Введение
Температура среды, подобно гравитации или освещенности, постоянно присутствует в жизни человека. Для неодетого человека термонейтральные условия составляют 28–29 ºС, а для легко одетого (офисный костюм, 1 CLO) 21–22 ºС (Bligh, 1973), однако человек редко пребывает в термонейтральной среде - на него в каждый данный момент действует либо охлаждение, либо согревание. За пределами термонейтральности активируются физиологические реакции, которые поддерживают тепловой баланс человека. Обычно человек получает холодовую нагрузку зимой, частично осенью и весной, вне дома и работы. Вместе с тем, развитие современной рекреационной индустрии позволяет человеку испытывать действие холода и летом на горнолыжных курортах, при плавании и нырянии. Холодовую экспозицию можно испытать даже при кондиционировании воздуха и при работе в холодильных камерах. Наиболее экстремальным видом действия холода считается зимнее плавание (холодовая иммерсия), когда человек погружается в воду при температуре, близкой к точке замерзания. Также, в последнее время получает популярность такой вид лечебно-косметической процедуры, как криосауна (WBC, whole body cryotherapy) (Smolander et al., 2004). Одним из наиболее мощных и частично управляемых механизмов терморегуляции теплокровного организма является двигательная система. Двигательная система способна производить тепло (теплопродукция) и снижать теплоотдачу через терморегуляционное поведение и теплозащитные позы. Двигательная система также является чутким индикатором длительных и острых сенсорных воздействий, таких как длительная гипоксия, невесомость, возраст, утомление, тренировка (Козловская. 2007; Gandevia, 2001). Двигательная система, попадая под влияние холода, неизбежно адаптируется к нему (Ткаченко, Якименко, 1983). Известно, что длительное или острое охлаждение вызывает снижение частоты импульсации двигательных единиц (ДЕ). В частности, у животных (крыс) адаптация к длительному содержанию при низкой температуре среды (экспозиция 4–5 недель при –1–15 ºС) приводила к снижению частоты импульсации ДЕ на 2–6 имп/с (Сорокина и др., 1984). У «зимних» голубей (исследованных зимой), частота импульсации ДЕ была на 1–3 имп/с меньше по сравнению с «летними» голубями (Сорокина, Медведев, 1986). Частота импульсации ДЕ при острой холодовой экспозиции снижается и у человека (Мейгал и др., 1997). В соответствии с недавно предложенной парадигмой об синергичности действия гравитации/невесомости и некоторых других сенсорных модальностей (холод/согревание, гипоксия/нормоксия) в онтогенезе человека (Мейгал, 2011; Мейгал, Ворошилов, 2009) было бы интересно исследовать изменения нейромышечного статуса в ответ на экстремально сильное острое и хроническое действие холода на организм человека. Это могло бы стать частью профилактических мероприятий в практике космических полетов (Meigal, 2011). В последнее время для описания биосигнала, в том числе электромиографического, используются нелинейные параметры (энтропия, детерминизм, размерность) (Meigal et al., 2009; Rissanen et al., 2008). В этой связи, цель настоящего исследования заключалась в том, чтобы на основе электромиографии дать описание нейромышечного статуса у любителей зимнего плавания в начале и конце сезона зимнего плавания, а также при остром погружении в ледяную воду.
Материалы
Общий дизайн исследования
Проведено 3 серии исследований с двумя группами испытуемых: 1) любителей зимнего плавания (далее – «моржей») и 2) «не-моржей». В первом исследовании проведено сравнение параметров интерференционной электромиограммы (иЭМГ) и двигательных единиц в группах «моржей» (М1) и «не-моржей» (М0) до начала сезона зимнего плавания в лабораторных условиях (октябрь-декабрь 2010 г). Во втором исследовании проведено сравнение группы «моржей» до начала сезона зимнего плавания (М1) и при его окончании в марте-апреле 2011 г. (М2). Третье исследование заключалась в сравнении параметров иЭМГ в конце сезона зимнего плавания до погружения в ледяную воду (М2) и сразу после выхода из нее (М3).
Испытуемые и условия среды
Исследовано 13 здоровых любителей спортивного зимнего плавания (КРО общероссийской общественной организации «Федерация закаливания и спортивного зименего плавания» (клуб «Виктория», г. Петрозаводск, наб. Варкауса, председатель И.Н.Жолудева, 7 мужчин и 6 женщин). Антропометрические данные приведены в табл. 1. Средний стаж занятий зимним плаванием составил 4/4 года (1–12 лет), среднее время экспозиции в воде в неделю ~5 мин (2–15 мин). Среди испытуемых 2 мастера спорта, чемпион России по зимнему плаванию, 2 разрядника по разным видам спорта. Все испытуемые некурящие, не страдают неврологическими заболеваниями.
Таблица 1. Антропометрические данные о группах «моржей» (М1) и «не-моржей» (М0)
| Группа | Группа М1 | Группа М0 |
| Возраст (годы) | ||
| вся группа мужчины женщины | 51.8±14.5 (27–85) n=13 40.42±10.19 n=7 62.83±16.03 ** n=13 | 47.7±12.3 (29–81) n=13 44.29±9.4 (29–49) n=5 50±13.7 (43–81) n=9 * |
| Рост (см) | ||
| вся группа мужчины женщины | 168.00±13.31 (146–195) 174.33±10.45 153.75±5.18 * | 169.08±9.05 (148–182) 177.44±4.45 (175–182) 163.87±6.98 (148–170) * |
| Вес (кг) | ||
| вся группа мужчины женщины | 75.23±15.67 (56–96) 82.11±13.93 59.75±1.71 ** | 72.00±14.81 (55–100) 86.00±9.19 (77–100) 62.00±8.10 (55–73) ** |
| BMI | ||
| вся группа мужчины женщины | 26.31±2.93 (22.4–32.4) 26.75±3.38 25.32±1.41 | 25.13±3.74 (18.7–32.3) 27.94±2.59 (26.0–32.3)* 23.13±3.15 (18.7–26.8) * # |
| Стаж занятий зимним плаванием (годы) | ||
| вся группа мужчины женщины | 4.53±3.80 4.38±3.5 4.92±2.36 | – – – |
Примечание: * – p< 0.05; ** – p < 0.01 между группами мужчин и женщин.
В контрольную группу отобрано 14 человек («не-моржи», 5 мужчин и 9 женщин, все некурящие). Обе группы примерно одинаковы по возрасту, полу и антропометрическим данным (табл. 1), хотя в группе «моржей» женщины имели больший средний возраст. У испытуемых собиралось информированное согласие на участие в исследовании. Исследование групп М1 и М0 проведено примерно в одно время года (с 21 октября по 21 декабря 2010 г.), в условиях лаборатории (Твозд=25–26 ºС, влажность 60–70%) на базе кафедры физиологии человека и животных ПетрГУ (комнатные условия).
Группа «моржей» также была обследована на берегу Онежского озера, в обогреваемом здании клуба «Виктория» (М2, комнатные условия, наб. Варкауса, г. Петрозаводск) в марте-апреле 2011 года. Температура воздуха в здании клуба составляла 24–25ºС. Группу М3 сформировали те же испытуемые сразу после иммерсии в холодной воде. Температура воды составила 1–4 ºС. Температура воздуха в марте 2011 г. составила –6–2ºС, в апреле от –1 до +10ºС. Время иммерсии (погружения) – 60–80 секунд. Испытуемые также получали дополнительную холодовую экспозицию примерно 2–3 минуты при подходе к проруби и выходе из нее. Запись ЭМГ после погружения происходила также в здании клуба «Виктория». Измеряли средневзвешенную температуру кожи (СВТК) по методу Раманатана (Ramanathan, 1964) до и после погружения в холодную воду:
СВТК = 0.3Т1 + 0.2Т2 + 0.3Т3 + 0.2Т4,
где Т1 – температура кожи под ключицей, Т2 – передней поверхности плеча, Т3 – передней поверхности бедра, Т4 – задней поверхности голени.
Методы
Регистрация и анализ электромиограммы.
Поверхностную иЭМГ регистрировали с двуглавой м. плеча (m. biceps br.) справа, в позе стоя, плечо было опущено вниз, предплечье удерживалось в положении локтевого сгибания. Запись иЭМГ делали при нагрузках 0 (без нагрузки), 1, 2 и 3 кг. Использовали электромиограф Нейро-МВП-8 c программной средой «Нейрософт» (ООО «Нейрософт», г. Иваново, Россия). Отводящие электроды укрепляли лейкопластырем над основной массой мышцы. Кожу предварительно обрабатывали абразивной пастой и 70%-м этанолом, на электрод наносили электродный гель. Полоса пропускания ЭМГ составила 2–500 Гц. Регистрировали отрезки ЭМГ длительностью 1 с. Аппарат Нейро-МВП-8 позволяет получать такие линейные параметры как средняя амплитуда (А, мкВ) и средняя частота (MNF, Гц) иЭМГ. Нами также применена программа FRACTAN 4.4 © для характеристики аттрактора иЭМГ, который описывается несколькими нелинейными параметрами: фрактальной размерностью (D), корреляционной размерностью (Dc) и корреляционной энтропией (К2) и [4].
Также регистрировали параметры импульсации двигательных единиц (ДЕ) трехглавой мышцы плеча (m. triceps br.) билатерально по методу примененному нами ранее (Мейгал и др., 2009). Испытуемых просили напрягать мышцу до появления спонтанно импульсирующих ДЕ. Анализировали до 70–100 межимпульсных интервалов, рассчитывали средний межимпульсный интервал (МИИ, мс), среднюю частоту импульсации (f, имп/с), вариабельность (среднеквадратическое отклонение от среднего межимпульсного интервала, σ, мс.
Таким образом, всего для характеристики нейромышечного статуса учитывалось 8 электромиографических параметров.
Статистический анализ.
Статистический анализ проведен при помощи программы SPSS 12.0 ™. Корреляционный анализ между параметрами производили с помощью критериев Спирмена и Пирсона, сравнение средних значений производили с помощью t-теста Стьюдента. Нормальность распределения данных определяли по методу Шапиро-Уилка.
Результаты
1. Сравнение нейромышечного статуса «моржей» и «не-моржей».
Значения параметров иЭМГ групп «моржей» (М1) и «не-моржей» (М0) приведены в табл. 2. Достоверные различия были характерны только для средней частоты иЭМГ и фрактальной размерности. Средняя частота иЭМГ была меньше, а фрактальная размерность больше в группе «не-моржей». Это может свидетельствовать о наличии большей предопределенности в сигнале ЭМГ, что характерно для более низких частот импульсации ДЕ. Действительно, наблюдалась отчетливая тенденция к увеличению межимпульсного интервала ДЕ в группе «моржей», характерная как для мужчин, так и для женщин. В целом, частота импульсации ДЕ была на ~0,5 имп/с больше в группе «не-моржей», однако это различие не достигло уровня достоверности (p = 0.099). При снижении частоты импульсации ДЕ процент детерминизма в их активности должен расти (Vaillancourtetal., 2002), поэтому меньшая сложность (низкая фрактальная размерность) иЭМГ «не-моржей» вполне объяснима через сниженную частоту импульсации ДЕ. Частота импульсации ДЕ была больше на 0.5–1.0 имп/с у мужчин в обеих группах.
Таблица 2. Электромиографические параметры в группах «моржей» и «не-моржей»
| Параметр ЭМГ | Группа М1 («моржи») | Группа М0 («не-моржи») |
| Средняя амплитуда иЭМГ (мкВ) | ||
| без нагрузки 1 кг 2 кг 3 кг | 90.05±38.76 121.58±33.38 131.64±40.64 152.31±35.11 | 76.98±37.05 112.81±30.10 127.51±35.58 151.11±40.84 |
| Средняя частота иЭМГ(Гц) | 135.90±14.33 | 127.81±18.25 * |
| Фрактальная размерность (D) | 1.7512±0.041 | 1.7629±0.046 * |
| Корреляционная размерность (Dc) | 4.380±0.366 | 4.253±0.336 |
| Корреляционная энтропия (K2) | 5.921±2.906 | 5.397±2.72 |
| Средний межимпульсный интервал ДЕ (мс) | ||
| вся группа < 60 лет > 60 лет мужчины женщины | 111.37±18.13 (n=39) 106.86±16.00 (n=27) 121.52±19.20 (n=12) 108.02±17.54 (n=20) 114.89±18.54 (n=19) | 106.88±21.75 (n=43) 103.38±20.61 (n=36) 131.68±23.34 (n=8) 101.25±24.78 (n=17) 110.56±19.33 (n=26) |
| Средняя частота (имп/с). | ||
| вся группа < 60 лет > 60 лет мужчины женщины | 9.25±1.59 (n=39) 9.58±1.56 (n=27) 8.53±1.45 (n=12) 9.52±1.72 (n=20) 8.98±1.44 (n=19) | 9.75±1.99 (n=43) 10.04±1.99 (n=36) 7.89±1.46 (n=8) 10.43±2.47 (n=17) 9.31±1.50 (n=26) |
Примечание: * – p < 0.05 между группами М1 и М0.
Характерной особенностью группы «не-моржей» было то, что внутри группы проявилось влияние возраста. Это выражалось в достоверной корреляции между возрастом и средним межимпульсным интервалом ДЕ (R = 0.324, p = 0.034) и фрактальной размерностью иЭМГ (R= 0.326, p = 0.014). В группе «моржей» подобной корреляции между возрастом и параметрами иЭМГ обнаружено не было. Внутригрупповые различия в группе «не-моржей» вполне объяснимы. Известно, что частота импульсации ДЕ снижена у лиц пожилого возраста за счет увеличения пропорции медленных ДЕ в процессе возрастного ремоделирования двигательной системы (Dohertyetal., 1993). Так как возраст не оказал достоверного влияния на активность ДЕ и параметры иЭМГв группе «моржей», это можно считать специфическим влиянием занятий зимним плаванием на нейромышечный статус.
2. Влияние 4-месячного сезона зимнего плавания и острой холодовой иммерсии на параметры ЭМГ.
Повторное исследование, проведенное в комнатных условиях на той же группе «моржей» спустя 3,5–4 месяца занятий зимним плаванием (М2, иммерсия в среднем 5 минут в неделю) показало, что исследованные параметры иЭМГ и параметры активности ДЕ практически не изменились (табл. 3).
Таблица 3. Электромиографические параметры в группе «моржей» до (М2) и после (М3) погружения в холодную воду в конце сезона зимнего плавания
| Параметр ЭМГ | Группа М2 | Группа М3 |
| Средняя амплитуда иЭМГ(мкВ) | ||
| без нагрузки 1 кг 2 кг 3 кг | 65.92±38.90 97.26±49.21 126.61±56.05 142.63±55.14 | 74.59±41.43 99.81±44.50 130.07±57.79 144.00±54.16 |
| Средняя частота иЭМГ(Гц) | 134.96±25.13 | 132.46±24.09 |
| Фрактальная размерность (D) | 1.7511±0.038 | 1.7412±0.059 * |
| Корреляционная размерность (Dc) | 4.464±0.570 | 4.355±0.436 * |
| Корреляционная энтропия (K2) | 4.752±1.63 | 4.610±1.746 * |
| Средний межимпульсный интервал ДЕ (мс) | ||
| вся группа < 60 лет > 60 лет мужчины женщины | 113.06±30.37 (n=35) 113.46±27.29 (n=24) 112.17±37.69 (n=11) 117.44±26.62 (n=20) 107.21±34.84 (n=15) | 128.69±22.26 * (n=28) 127.05±23.37 (n=19) 132.18±20.59 (n=9) 129.66±25.72 (n=13) 127.85±19.67 (n=15) |
| Средняя частота (имп/с) | ||
| вся группа < 60 лет > 60 лет мужчины женщины | 9.46±2.52 (n=35) 9.31±2.30 (n=24) 9.80±3.04 (n=11) 8.90±1.85 (n=20) 10.21±3.12 (n=15) | 7.99±1.35 (n=28) ** 8.11±1.40 (n=19) 7.74±1.29 (n=9) 7.98±1.51 (n=13) 7.99±1.29 (n=15) |
Примечание: * – p < 0.05; **– p < 0.01 между группами М2 и М3.
Сразу после 60–80 секундного погружения в ледяную воду (М3) СВТК снижалась с 30.9±2,1 до 14.6±1,5 °С, частота импульсации ДЕ достоверно снижалась как у мужчин, так и у женщин, увеличивался межимпульсный интервал, а также снижались все нелинейные параметры иЭМГ (табл. 3), что можно считать специфическим влиянием острого охлаждения организма.
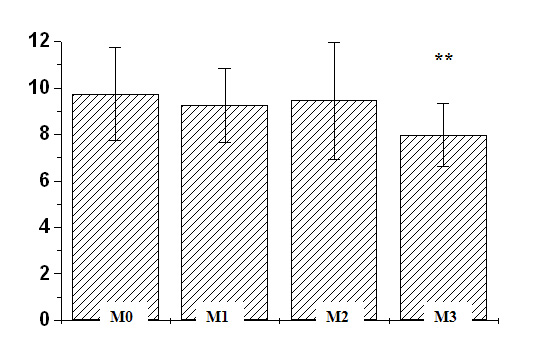
Рис. 1. Средняя частота импульсации (имп/с) двигательных единиц в четырех исследованных состояниях. М0 – «не-моржи»; М1 – «моржи» до сезона зимнего плавания; М2 – «моржи» после сезона зимнего плавания до погружения; М3 – «моржи» после сезона зимнего плавания, сразу после погружения в ледяную воду; ** – p < 0.05 между группами М0 и М3.
Таким образом, почти 4-месячный сезон зимнего плавания практически не изменил электромиографические параметры нейромышечного статуса в группе «моржей». Можно сделать вывод о том, что у человека, в отличие от лабораторных и свободно живущих в природе видов, длительное и сильное температурное влияние оказывают лишь минимальное воздействие на нейромышечный статус. Это может быть связано с тем, что, несмотря на длительность сезона зимнего плавания, это воздействие является все-таки кратковременными (всего 4–5 минут в неделю). Все остальное время любители зимнего плавания проводили в термонейтральных комфортных температурных условиях, в отличие от лабораторных животных, которые находились в более жестких температурных условиях (Сокрокина, Медведев, 1986; Сорокина и др., 1984). Можно также предположить, что в группе «моржей» 4-месячное воздействие холодной иммерсии «камуфлируется» уже имеющейся «аккумулированной» адаптацией скелетных мышц к холоду, поскольку у большинства любителей зимнего плавания стаж погружений в ледяную воду составляет более 2 лет.Рис. 1. Средняя частота импульсации (имп/с) двигательных единиц в четырех исследованных состояниях. М0 – «не-моржи»; М1 – «моржи» до сезона зимнего плавания; М2 – «моржи» после сезона зимнего плавания до погружения; М3 – «моржи» после сезона зимнего плавания, сразу после погружения в ледяную воду; ** – p < 0.05 между группами М0 и М3.
Таким образом, наиболее сильное влияние на нейромышечный статус оказало острое охлаждение в ледяной воде, на фоне более чем 2-кратного снижения кожной температуры. Погружение в ледяную воду (иммерсия) оказало достоверное и предсказуемое влияние на ДЕ, снижая их частоту, что совпадает с ранее полученными данными о влиянии умеренного воздушного охлаждения (экспозиции) на ДЕ человека (Мейгал и др., 1997). Таким образом, в континууме состояний М0-М1-М2-М3 два крайних состояния – М0 («не моржи») и М3 («моржи» после иммерсии) – оказались наиболее различными с точки зрения нейромышечного статуса (рис. 1). Физиологический смысл этих изменений заключается в т.н. «интерполяции» скорости сокращения мышечных волокон и частоты импульсации ДЕ для того, чтобы поддерживался примерно одинаковый режим зубчатого тетануса (Успенский, Данилова 1990, Merton, 1954). Снижение скорости сокращения при охлаждении требует снижения частоты импульсации ДЕ. Также, снижение частоты импульсации имеет калоригенный эффект (Гурфинкель и др., 1981).
Обсуждение
Новые нелинейные параметры иЭМГ, характеризующие нейромышечный статус, оказались достаточно стабильными в разных состояниях. Тем не менее, после иммерсии в ледяной воде фрактальная размерность и корреляционная размерность были достоверно ниже по сравнению с группой «не-моржей». Снижение размерности свидетельствует об уменьшении сложности биосигнала и, соответственно, о повышении его предсказуемости. Это, в свою очередь, является признаком повышенного количества одинаковых фрагментов сигнала, то есть появления ритмичности (Meigaletal., 2009; Rissanenetal., 2008). Поэтому, снижение нелинейных параметров после иммерсии в ледяной воде может быть признаком холодовой дрожи, которая визуально имела место у двоих из 13 испытуемых.
Заключение
Таким образом, занятия зимним плаванием оказывают лишь минимальный адаптационный эффект на нейромышечный статус «моржей». Вероятно, это связано с небольшой суммарной длительностью (5–10 минут в неделю) этого экстремального холодового воздействия. Наибольшее влияние у любителей зимнего плавания оказывает однократное острое сильное охлаждение – погружение в ледяную воду (иммерсия). При холодовой иммерсии изменения наблюдаются на уровне активности отдельных двигательных единиц, что связано с прямым охлаждением тканей организма и интерполяцией частоты импульсации двигательных единиц с уменьшенной скоростью сокращения мышечных волокон. Снижение значений нелинейных параметров отражает усиление синхронизации активности двигательных единиц, что свидетельствует о появлении явной или скрытой холодовой дрожи.
Библиография
Гурфинкель В.С., Левик Ю.С., Полещук Н.К., Коровин Ю.В. Зависимость теплопродукции скелетной мышцы от режима ее сокращения // Физиология человека. 1981. Т. 7. № 1. С. 46–54.
Козловская И.Б. Гравитационные механизмы в двигательной системе // Современный курс классической физиологии / Под ред. Ю. В. Наточина и В. А. Ткачука. М.: Геотар-Медиа, 2007. С. 115–134.
Мейгал А.Ю. Онтогенетическая модель гравитации и невесомости: теоретические и практические аспекты // Физиология человека. 2011. Т. 37. №6. С. 130–138.
Мейгал А.Ю., Ворошилов А.С. Перинатальная модель перехода от гипогравитации к земной гравитации на основе нелинейных характеристик электромиограммы // Авиакосм. Экологич. Медицина. 2009. Т. 43. № 6. С. 14–18.
Мейгал А.Ю., Герасимова Л.И., Золотова Е.В., Лупандин Ю.В. Произвольное рекрутирование двигательных единиц в условиях холодовой дрожи // Физиология человека. 1997. Т. 23. № 5. С. 64–68.
Мейгал А.Ю., Кузьмина Г.И., Шигуева Т.А., Закирова А.З. Способ селективного отведения потенциалов действия двигательных единиц человека накожными электродами // Физиология человека. 2009. Т. 35. № 5. С. 134–138.
Сорокина Л.В., Лупандин Ю.В., Власова Л.П. Терморегуляционная активность мотонейронного пула у крыс, адаптированных к холоду и гипоксии // Физиол. Журн. СССР. 1984. Т. 70. С. 75–80.
Сорокина Л.В., Медведев Н.В. Терморегуляционная активность двигательных единиц скелетных мышц голубя // Физиол. журн. СССР. 1986. Т. 72. № 11. С. 1571–1574.
Ткаченко Е.Я., Якименко М.А. исследование эффективности работы мышцы у белых крыс при адаптации к холоду // Физиол. журн. СССР. 1985. Т. 71. № 3. С. 337–341.
Успенский А.Н., Данилова Л.И. Влияние охлаждения на характеристику одиночного сокращения скелетной мышцы у адаптированных к холоду крыс // Физиол. Журн. СССР. 1990. Т. 76. № 3. С. 414–417.
Bligh J. Temperature regulation in mammals and other vertebrates // Frontiers of Biology. V. 30. 1973. 436 p.
Doherty T.J., Vandervoort A.A., Brown W.F. Effects of ageing on the motor unit: a brief review // Can. J. Appl. Physiol. 1993. V. 18. P. 331–358.
Gandevia S.C. Spinal and supraspinal factors in human muscle fatigue // Physiol. Rev. 2001. V. 811. P. 725–1789.
Мeigal A. Yu. Interplanetary spaceflight compared with fetal and neonatal strategy at microgravitation: theoretical and practical implications // Pathophysiology. 2012. V. 19. P. 269–276.
Meigal A., Rissanen S., Kankaanpää M., Tarvainen M., Nuutinen J., Tarkka I., Airaksinen O., Kajalainen P.A. Novel parameters of surface EMG in patients with Parkinson's disease and healthy young and old controls // J. Electromyogr. Kinesiol. 2009. V. 19. № 3. P. e206–213.
Merton P.A. Voluntary strength and fatigue // J. Physiol. 1954. V. 123. P.553–564.
Mulder E.R., Gerrits K.H., Rittweger J., Felsenberg D., Stegeman D.F., de Haan A., Characteristics of fast voluntary and electrically evoked isometric knee extensions during 56 days of bed rest with and without exercise countermeasure // Eur. J. Appl. Physiol. 2008. V. 103. P. 431–440.
Ramanathan N.L. A new weighting system for mean surface temperature of the human body // J. Appl. Physiol. 1964. V.19. P.531–533.
Rissanen S., Kankaanpää M., Meigal A., Tarvainen M., Nuutinen J., Tarkka I., Airaksinen O.Kajalainen P.A. Surface EMG and acceleration signals in Parkinson’s disease: feature extraction and cluster analysis // Med. Biol. Eng. Comp. 2008. V. 46. P. 849–858.
Smolander J., Mikkelsson M., Oksa J., Westerlund T., Leppäluoto J., Huttunen P. Thermal sensation and comfort in women exposed repeatedly to whole-body cryotherapy and winter swimming in ice-cold water // Physiol. Behav. 2004. V. 82. P. 691–695.
Vaillancourt D.E., Larsson L., Newell K.M. Time-dependent structure in the discharge rate of human motor units. .Clin. Neurophysiol. 2002. V. 113. P. 1325–1338.






 © 2011 - 2026
© 2011 - 2026