Введение
Водяная полевка (Arvicola amphibius) заселяет разнообразные ландшафты, в том числе и антропогенные, и имеет большое биоценотическое и эпидемиологическое значение (Водяная полевка, 2001; Проскурняк, Назарова, 2017; Stewart et al., 2017). Демографическая структура популяции тесно связана с интенсивностью размножения и уровнем смертности, зависящими от климатических факторов и ландшафтно-экологических особенностей местообитаний (Рогов, 1999; Рогов и др., 1999; Potapov et al., 2004; Проскурняк, Назарова, 2017). В настоящее время недостаточно исследован возрастной состав взрослого населения популяций грызунов и остаются невыясненными этолого-физиологические особенности сенильных особей и их роль в жизнедеятельности популяций, распространении инфекций, что связано с отсутствием достоверных признаков и критериев определения возраста. По данным индивидуального мечения и повторных отловов, проведенных в Северной Барабе, установлено, что около 7 % особей живут не менее 2 лет (Пантелеев, 1966; Водяная полевка, 2001). В многолетнем популяционном исследования, проведенном во Франции, выяснено, что максимальная продолжительность жизни водяных полевок в природе превышает 2 года (Saucy, 1988). В литературе есть сведения, что особи старше 2 лет встречаются в популяциях Microtus duodecimcostatus. У других представителей семейства: Microtus agrestis, Microtus arvalis, Microtus pennsylvanicus, Microtus townsendii, Microtus californicus, Microtus montanus, Myodes glareolus, – максимальная продолжительность жизни не более 20 месяцев (Paradis, Guedon, 1993). Мы предполагаем, что долгоживущие особи играют значимую роль в поддержании численности и генетического разнообразия популяций водяной полевки (Назарова, Проскурняк, 2017). В неволе водяные полевки живут до 3.5 года, сохраняя способность к размножению на протяжении всей жизни (Назарова, 2011). Эколого-эволюционная ценность долгоживущих особей может существенно повышаться в пессимальных экологических условиях, когда участие в размножении молодых особей ограничено. Снижение вклада в воспроизводство сеголеток характерно для спада численности, когда сокращается продолжительность репродуктивного периода и тормозится половое созревание молодых животных (Водяная полевка, 2001). Ограничено участие в размножении сеголеток и в популяциях, заселяющих антропогенные ландшафты (Проскурняк, Назарова, 2017) или обитающих на периферии ареала (Музыка, 1988), что связано с дефицитом пригодных для размножения территорий.
Ранее нами был разработан метод определения возраста водяных полевок с точностью до года, по промерам костей тазовых конечностей с использованием дискриминантного анализа (Zudova et al., 2017). Однако он не учитывает календарные сроки смерти животных, что может влиять на точность определения возраста, поскольку у водяных полевок сезонные ритмы роста – его весеннего ускорения и осенней регрессии – ярко выражены (Водяная полевка, 2001).
Задачи данного исследования: 1) разработать метод определения возраста водяных полевок по морфометрическим признакам тазовых конечностей с учетом календарных сроков сбора полевого материала (поздняя весна – начало осени); 2) выяснить возрастной состав перезимовавших особей в двух популяциях водяных полевок, обитающих на садово-огородных участках.
Детальное изучение демографического состава взрослого населения грызунов важно для выяснения механизмов поддержания жизнеспособности популяций и эволюции долголетия.
Материалы
Материал для исследования собран на двух участках в Новосибирской области. В августе – сентябре 2017 г. отловы проводили на территории садово-огородного товарищества «Сибсельмашевец», находящегося в 1 км от железнодорожной станции Оёш (55º03'58'' с. ш., 81º47'05'' в. д.). Место отлова представляет собой остепененный луг, расположенный между заболоченными березово-осиновыми колками. Всего было отловлено 14 зимовавших полевок (5 самцов и 9 самок) и 19 сеголеток (9 самцов и 10 самок).
Вблизи Новосибирского научного центра (ННЦ – Академгородок) зверьки отлавливалась в апреле – сентябре 2014–2018 гг. на территории садово-огородного общества «Надежда-2» (54º49'17'' с. ш., 83º09'48'' в. д.), в 100 метрах от осиново-березового леса. В оврагах и понижениях находятся заиленные пруды, соединенные ручьями. Всего здесь отловлено 22 перезимовавших особи (14 самцов и 8 самок) и 31 сеголеток (19 самцов и 12 самок). Максимальное количество животных, 30 особей, отловлено в 2018 г. Зимовавшие особи были отловлены преимущественно весной (апрель – май). После 10 июля они в отловах не встречались.
Биологическая особенность садово-огородных участков в том, что водяная полевка размножается у водоемов, а огороды использует как кормовые и зимовочные стации. До ближайших водоемов в ННЦ около 1.5 км, в Оёше – от 500 м до 1 км.
Для разработки метода определения возраста использовали водяных полевок виварного разведения (n = 139) и водяных полевок, отловленных в 2014–2017 гг. в окрестностях с. Лисьи Норки Убинского района Новосибирской области (55º52' 09'' с. ш., 80º05'03'' в. д.) и помещенных в виварий, где они содержались до конца жизни (n = 14). Выбор места отлова объясняется тем, что лабораторная колония основана особями из этой популяции.
В виварии водяные полевки содержались в индивидуальных клетках, снабженных сеном, в условиях естественного светового периода, свободного доступа к воде и корму (зерновая смесь, морковь, проростки овса).
Методы
В Оёше водяных полевок отлавливали в цилиндры (35 х 15 см), вкопанные вдоль грядок с овощными культурами. Расстояние между цилиндрами составляло в среднем около 3 м. Для получения сведений о многолетней динамике численности использовали широко применяемый в экологических исследованиях метод анкетного опроса населения (Максимов, 1967; Методические указания…, 1974; Карасева, Телицына, 1996). Опрашивали только тех владельцев садово-огородных участков, которые в 2014–2018 гг. отлавливали вредителя самостоятельно и хорошо знали этот вид. Респонденты оценивали численность зверьков в условных единицах: 5 – очень много; 4 – много; 3 – мало; 2 – единично; 1 – отсутствуют (Проскурняк, Назарова, 2017). Всего опрошено 11 человек.
Вблизи Академгородка полевок отлавливали с помощью канавки (50 метров с 5 цилиндрами), которая располагалась вдоль границ огородного участка, находившегося около границ общества.
В качестве дополнительной информации, подтверждающей характер изменения численности, использовали интенсивность размножения прибылых зверьков (Рогов, 1999; Cerqueira et al., 2006). К размножавшимся самкам относили особей с эмбрионами или плацентарными пятнами в матке. К способным к размножению самцам – особей, имевших зрелые сперматозоиды в придатках семенников.
К перезимовавшим относили полевок, у которых длина общего медиального гребня на черепе, образованного слившимися продольными саггитальными гребнями, превышала или было равна 3 мм (Пантелеев, 1966). В качестве дополнительного критерия учитывали общую структурированность черепа: крыша черепа старых полевок «как бы утоплена среди окантовочных гребней» (Водяная полевка, 2001).
Для разделения перезимовавших животных на возрастные классы (пережившие одну зиму; более двух зим) по промерам костей тазовых конечностей применяли дискриминантный анализ. Для нахождения дискриминантных функций была использована контрольная выборка (42 самки и 41 самец), представленная полевками известного возраста – родившимися в виварии и умершими в те же месяцы, что и отловленные в природе (в апреле – сентябре). Все они прожили в виварии не менее одного года.
Поскольку по скелетным признакам имеется половой диморфизм (Somoano et al., 2017; Zudova et al., 2017), дискриминантный анализ проводили отдельно для самцов и самок, используя промеры:
- a) Тазовая кость. Isl – длина седалищной кости, измеренная от края вертлужной впадины до седалищного бугра; ISW – максимальная ширина тела седалищной кости; PBL – наибольшая длинна лобка, измеренная от края вертлужной впадины; PH – высота таза вдоль линии, направленной перпендикулярно от седалищного бугра до линии длины лобка, измеряемой по внешнему краю; OFW – ширина запирательного отверстия.
- b) Бедренная кость, дорсальная плоскость. CFW – ширина шейки бедренной кости; FLp – длина проксимальной части бедренной кости, включающая третий вертел; FWp – ширина проксимальной части бедренной кости в области третьего вертела; FWd – ширина дистальной части бедренной кости; FWCd – ширина дистальной части бедренной кости, измеряемая по наибольшим выступам латерального и медиального надмыщелков.
- c) Бедренная кость, латеральная плоскость. FWpl – ширина проксимальной части бедренной кости; FWdl – ширина дистальной части бедренной кости.
- d) Голень. TWp – ширина проксимальной части голени.
Каждое измерение выполняли с помощью электронного штангенциркуля (точность 0.01 мм) на левой тазовой конечности в трех повторах, затем рассчитывали среднее.
Уравнения классификационной функции имели вид:
y = Ci + ki · xi + … + kn · xn,
где Ci – константа, k1-n – коэффициенты классификационной функции -го признака, xi – значение признака у определяемого экземпляра.
Для проверки точности определения возраста с использованием классификационных функций использовали проверочную выборку – 29 самцов и 27 самок, родившихся в виварии. Проверочные и контрольные выборки были сбалансированы по доле животных разного возраста (Клевезаль и др., 2005). Особи проверочной выборки не входили в состав контрольной. Кроме этого, корректность определения возраста была проверена на другой выборке – 7 самцах и 7 самках, отловленных в популяции, обитающей в окрестностях с. Лисьи Норки Новосибирской области, и до конца жизни содержавшихся в виварии. Относительный возраст животных этой группы устанавливали при отлове (зимовавшие, сеголетки). Возраст определяли по календарным срокам отлова, размерам тела, состоянию шерстного покрова, репродуктивному состоянию (Водяная полевка, 2001; Карасева и др., 2008).
Для установления возраста особей проверочных выборок с учетом их пола (1 год, 2 или более лет) вычисляли значения двух классификационных функций, используя коэффициенты, рассчитанные отдельно для самцов и самок. Наблюдение относили к той группе, для которой классификационная функция имела наибольшее значение. Тот же алгоритм использовали и для определения возраста водяных полевок из природных популяций.
Для выяснения связи с возрастом краниометрических признаков были взяты следующие промеры:
CBL – кондилобазальная длина черепа – расстояние от наиболее выступающей вперед точки межчелюстной кости до наиболее выступающей назад точки затылочных мыщелков; CHTB – высота черепа от барабанных камер – расстояние от наиболее низкой точки обеих барабанных камер до наиболее высокой точки крыши черепа; ICL – длина сросшейся части межглазничных гребней; NL – длина носовых костей – расстояние между наиболее выступающими вперед и назад точками носовых костей; NW – ширина носовых костей – расстояние между наиболее выступающими точками носовых костей; UMS – длина верхнего ряда коренных зубов – от заднего края альвеол коренных зубов до переднего края альвеол первых коренных зубов; ZW – скуловая ширина черепа – наибольшее расстояние между наружными краями скуловых дуг.
Статистическую обработку данных выполняли с помощью пакета программ Statistica 6.1 (SAS Institut, USA). Распределение морфометрических скелетных признаков соответствовало закону нормального распределения. Однородность дисперсии в различных группах оценивалась по критерию Левена, и статистически значимых отличий не выявлено. Для нахождения коэффициентов линейных классификационных функций использовали пошаговый дискриминантный анализ с последовательным включением переменных. Для выяснения влияния конкретных факторов на изменчивость морфометрических признаков применяли одно- и двухфакторный дисперсионный анализ. Множественные сравнения средних проводили по критерию Шеффе, парные – по t-критерию Стьюдента. Различия между долями оценивали по методу хи-квадрат. В тексте и таблицах приведены средние значения признаков (X), стандартная ошибка (± SE) и объем выборок (n). Уровень статистической значимости принят p < 0.05.
Результаты
Численность
На рис. 1 показана среднегодовая динамика численности водяных полевок, обитающих на участках. В 2016–2018 гг. численность оёшинской популяции снижалась, а популяции из Академгородка увеличивалась.
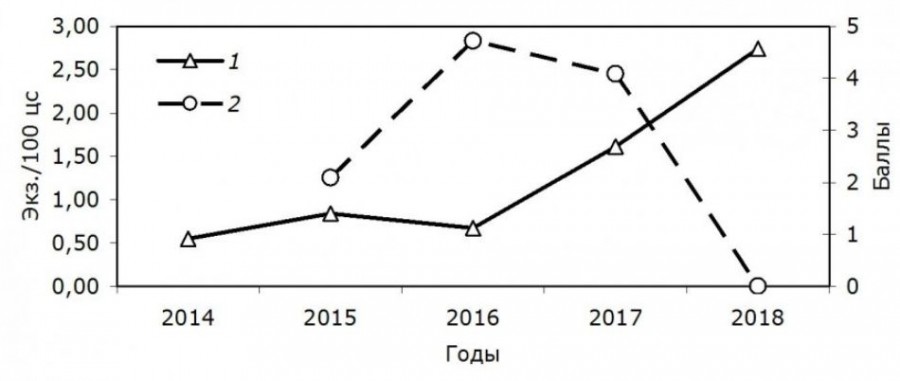 Рис. 1. Среднегодовая динамика численности двух популяций водяных полевок. 1 – Академгородок, 2 – Оёш. Оёш – балльная оценка; Академгородк – экз./100 ц. с.
Рис. 1. Среднегодовая динамика численности двух популяций водяных полевок. 1 – Академгородок, 2 – Оёш. Оёш – балльная оценка; Академгородк – экз./100 ц. с.
Fig. 1. The average annual dynamics of the number of two populations of water voles. 1 – Academgorodok, 2 – Oyosh. Оyosh – scoring; Akademgorodok - ind./100 trap days
Размеры тела зимовавших особей
В литературе отсутствует информация об экстерьерных характеристиках водяных полевок, обитающих на садово-огородных участках. Данные о массе, длине тела и упитанности (отношение массы тела к длине) зимовавших особей исследуемых популяций приведены в табл. 1. Как показали результаты двухфакторного дисперсионного анализа, масса тела зависит от места отлова (F1.32 = 17.30, p < 0.001) и пола животных (F1.32 = 5.56, p < 0.05), а длина тела и упитанность – только от места отлова (F1.32 = 35.67, p < 0.001 и F1.32 = 4.39, p < 0.05 соответственно). Однако результаты сравнения групповых средних с использованием критерия Шеффе показали, что достоверные отличия между животными одного пола, но разных мест отлова отсутствуют.
Таблица 1. Размеры тела зимовавших особей из двух популяций, обитающих на садово-огородных участках
| Место отлова | Пол | Масса тела, г | Длина тела, мм | Упитанность | n |
| Академгородок | самка | 131.1 ± 4.3 | 173.5 ± 1.9 | 0.76 ± 0.04 | 8 |
| самец | 143.0 ± 4.5 | 173.7 ± 2.4 | 0.82 ± 0.03 | 14 | |
| Оёш | самка | 156.4 ± 10.2 | 188.3 ± 2.6 | 0.83 ± 0.04 | 9 |
| самец | 179.3 ± 11.5 | 196.4 ± 5.7 | 0.91 ± 0.05 | 5 |
В табл. 2 приведена масса, длина тела и упитанность разводимых в виварии животных для сопоставления экстерьерных характеристик диких и виварных особей и анализа возрастных изменений. Полученные результаты свидетельствуют, что, достигнув взрослого состояния, водяные полевки продолжают расти. Влияние возраста (1, 2 или 3 года) на массу и, особенно, длину тела статистически достоверно. Самки: масса тела – F2,68 =3.93, p < 0.05, длина тела – F2,68 = 22.02, p < 0.001, упитанность – F2,68 = 1.89, p > 0.05. Самцы: масса тела – F2,67 = 6.48, p < 0.01, длина тела – F2,67 = 98.73, p < 0.001, упитанность – F2,67 = 5.46, p < 0.05. Следовательно, промеры посткраниального скелета могут быть использованы для определения возраста взрослых животных.
Таблица 2. Экстерьерные характеристики виварных водяных полевок в разном возрасте
| Пол | Возраст, годы | Масса тела, г | Длина тела, мм | Упитанность | n |
| Самка | 1 | 143.2 ± 5.3 | 177.4 ± 1.6 | 0.80 ± 0.02 | 37 |
| 2 | 169.2 ± 9.4 | 188.8 ± 2.0 | 0.89 ± 0.04 | 24 | |
| 3 | 168.5 ±13.2 | 197.7 ± 2.3 | 0.85 ± 0.06 | 10 | |
| Самец | 1 | 180.0 ± 5.8 | 185.3 ± 1.5 | 0.97 ± 0.02 | 36 |
| 2 | 219.6 ± 9.7 | 197.8 ± 2.0 | 1.10 ± 0.04 | 27 | |
| 3 | 186.0 ± 22.4 | 205.7 ± 4.7 | 0.89 ± 0.09 | 7 |
Дискриминантые функции для определения возраста самцов и самок
Результаты дискриминантного анализа, проведенного на контрольной выборке, были высоко достоверны: самки – λ = 0.16, F8.32 = 20.55, p < 0.001; самцы – λ = 0.15, F10.30 = 17.06, p < 0.001. Коэффициенты линейной классификационной функции приведены в табл. 3.
Таблица 3. Коэффициенты линейных классификационных функций для определения возраста
| Признаки | Самки | Самцы | ||
| возраст, годы | возраст, годы | |||
| 1 | ≥ 2 | 1 | ≥ 2 | |
| Тазовая кость | ||||
| ISW | -3.867 | -5.661 | 45.232 | 56.180 |
| PH | -10.766 | -15.557 | ||
| PBL | 20.047 | 23.750 | ||
| Isl | 5.544 | 8.904 | 23.993 | 28.571 |
| OFW | 65.906 | 73.252 | ||
| Бедренная кость | ||||
| FLp | 29.413 | 33.426 | ||
| CFW | 1.948 | -16.875 | 187.312 | 201.959 |
| FWp | -82.320 | -96.654 | ||
| FWpl | 28.325 | 52.741 | -81.488 | -67.683 |
| FWd | -5.827 | -10.556 | 64.477 | 79.721 |
| FWdl | 2.124 | -17.036 | ||
| FWCd | 144.265 | 151.284 | ||
| Голень | ||||
| TWp | -35.424 | -47.156 | ||
| Константа | -339.303 | -444.253 | -745.375 | -878.396 |
| Корректность определения, % | 100 | 100 | 100 | 100 |
Точность классификации особей контрольной выборки – 100 %. Точность классификации особей проверочной выборки – 89.7 % для самцов и 81.5 % для самок. Точность классификации особей животных, отловленных в природе, а умерших в виварии – 100 % для самок и 71.4 % для самцов.
Результаты определения возраста перезимовавших водяных полевок из двух природных популяций, обитающих на садово-огородных участках, представлены в табл. 4.
Таблица 4. Возрастной состав перезимовавших водяных полевок
| Возраст, годы | Академгородок | Оёш | ||
| самки | самцы | самки | самцы | |
| 1 | 8 | 10 | 7 | 3 |
| ≥ 2 | 0 | 4 | 2 | 2 |
| % проживших более 2 зим | 0 | 28.6 ± 12.1 | 22.2 ± 13.8 | 40.0 ± 21.9 |
В целом в оёшинской популяции 33.3 % перезимовавших особей прожили более двух зим, а в популяции из окрестностей Академгородка – 18.8 %. В обеих популяциях доля долгоживущих особей у самок ниже, чем у самцов. Суммируя данные по двум популяциям, 11.8 % самок и 31.6 % перезимовавших самцов имеют возраст более 2 лет. Различия возрастного состава самцов и самок статистически незначимы (χ2 = 2.04, p > 0.05).
Краниометрические характеристики зимовавших особей разных возрастных классов
Самцы разного возраста (группы: 1 год, 2 года и старше) из популяции Академгородка достоверно различались по краниометрическим признакам – ширине носовых костей и высоте черепа (табл. 5), признакам, имеющим сильную корреляционную связь с возрастом (Назарова и др., 2015). В оёшинской популяции не обнаружено достоверных половозрастных различий по краниометрическим признакам.
Таблица 5. Краниометрические характеристики самцов разного возраста
| Признаки | Возраст | P | |
| 1 год | 2 года и старше | ||
| Число животных | 10 | 4 | |
| Ширина носовых костей | 4.32 ± 0.05 | 4.55 ± 0.07 | < 0.05 |
| Высота черепа | 12.57 ± 0.14 | 13.13 ± 0.22 | 0.05 |
Участие в размножении
У сеголеток, отловленных в окрестностях Академгородка, репродуктивное состояние оценено у 25 особей. Из них 40 % самцов были половозрелыми (имели зрелые сперматозоиды в придатках семенников), а 50 % самок (n = 10) участвовали в размножении (имели эмбрионы или плацентарные пятна в матке), что свидетельствует о высоком репродуктивном потенциале этой популяции, находящейся в фазе подъема численности.
В оёшинской популяции не было половозрелых прибылых самцов (n = 9) и только 30 % молодых самок (n = 10) принимали участие в размножении. Сходный уровень репродуктивной активности характерен для популяций в фазе спада – депрессии численности (Водяная полевка, 2001).
В группе перезимовавших репродуктивные показатели оценены у 9 самок 5 самцов из оёшинской популяции и 7 самок и 13 самцов из популяции Академгородка. Все зимовавшие самки принимали участие в размножении.
В оёшинской популяции суммарная масса семенников у двухлетних самцов была существенно выше, чем у однолетних: 2.09 ± 0.01 и 0.36 ± 0.14 г соответственно (F1.3 = 95.46, p < 0.01). У однолетних самцов семенники имели признаки регрессии, связанные с окончанием сезона размножения (Проскурняк, Назарова, 2017). В популяции Академгородка зависящих от возраста отличий размеров семенников у перезимовавших самцов не обнаружено.
Обсуждение
Разработанный нами метод определения возраста водяных полевок по промерам костей тазовых конечностей был использован для оценки возрастной структуры двух популяций. Выяснено, что в среднем около 25 % особей переживают две или более зим. Отмечена тенденция к увеличению доли дважды зимоваших животных в популяции со снижающейся численностью, что подтверждает предсказания гипотезы старения Бунстра (Boonstra, 1994). Согласно этой гипотезе, увеличение возраста животных на спаде численности связано с торможением полового созревания сеголеток и укорочением сезона размножения. В свою очередь, увеличение возраста размножающихся животных может быть сопряжено со снижением гомеостаза физиологических функций, ослаблением устойчивости к стрессу, репродуктивным старением и снижением численности популяции. Увеличение в популяции доли животных старших возрастных классов в период спада численности водяной полевки отмечали и другие авторы (Cerqueira et al., 2006).
Обнаружены межпопуляционные отличия экстерьерных характеристик водяных полевок, населяющих садово-огородные участки. Особи из оёшинской популяции крупнее, чем из популяции Академгородка, что может быть обусловлено противофазной динамикой численности сравниваемых популяций и отличиями возрастной структуры популяций (Рогов, 1999; Рогов и др., 1999).
Результаты выполненных ранее исследований возрастных изменений репродуктивных показателей водяных полевок в условиях вивария показали, что у самок второго года жизни вероятность наступления эструса и спариваний при ссаживании с самцом выше, чем у самок первого и третьего года жизни. Признаки репродуктивного старения у водяных полевок проявляются только на третий год жизни (Назарова, Проскурняк, 2017). В исследованиях на других млекопитающих установлено, что успех размножения имеет квадратичную зависимость от возраста. Особи среднего возрастного класса обладают лучшими репродуктивными качествами (Beauplet et al., 2006).
Большую роль в возрастно-зависимой реализации репродуктивного потенциала играют ольфакторные сигналы. У Microtus pennsylvanicus обонятельные сигналы более взрослых самцов привлекательнее для самок, чем обонятельные сигналы половозрелых молодых самцов, при этом долгоживущие самцы проявляют больший интерес к обонятельным стимулам самок, чем молодые (Ferkin, 1999). Мы предполагаем, что в фазы пика и спада численности, когда сокращаются пригодные для размножения территории и усиливается конкуренция самцов за доступ к самкам, долгоживущие особи могут иметь селективное преимущество. В популяционных исследованиях, проведенных в Северной Барабе, показано, что в период спада более крупные самцы располагаются ближе к репродуктивно-активным самкам (Водяная полевка, 2001). Водяные полевки, согласно результатам выполненного исследования, растут на протяжении всей жизни, поэтому репродуктивный успех самцов может повышаться с возрастом. У двухлетних самцов оёшинской популяции, зимующих на садово-огородных участках (Проскурняк, Назарова, 2017), масса семенников достоверно выше, чем у однолетних. Двухлетние самцы, обитающие вблизи Академгородка, превосходят однолетних по некоторым краниометрическим характеристикам.
Заключение
Установлен возрастной состав перезимовавших водяных полевок двух популяций, различающихся по динамике численности. Отмечена тенденция к увеличению возраста перезимовавших зверьков, отловленных в популяции, находящейся в период снижения численности, что согласуются с предсказанием гипотезы Р. Бунстра о старении популяции в период спада. Долгоживущие особи играют важную роль в поддержании жизнеспособности популяций в пессимальных экологических условиях. Результаты работы важны для понимания экологических механизмов эволюции долголетия и мониторинга состояния популяций водяной полевки в антропогенных ландшафтах.
Библиография
Водяная полевка: Образ вида . М.: Наука, 2001. 527 с. (Серия «Виды фауны России и сопредельных территорий).
Карасева Е. В., Телицына А. Ю. Методы изучения грызунов в полевых условиях . М.: Наука, 1996. 227 с.
Карасева Е. В., Телицына А. Ю., Жигальский О. А. Методы изучения грызунов в полевых условиях . М.: Изд-во ЛКИ, 2008. 416 с.
Клевезаль Г. А., Мина М. В., Крушинская Н. Л. Использование методов многомерного статистического анализа при определении возраста млекопитающих (на примере лесной мышовки, Sicista betulina, и лесной куницы, Martes martes) // Зоологический журнал. 2005. Т. 84. № 11. С. 1389–1401.
Максимов А. А. Зона вредности водяной крысы в Западной Сибири, методы учета численности и прогноз . Новосибирск: Наука, 1967. 58 с.
Методические указания по учету численности и прогнозу вспышек масового размножения водяной крысы в Западной Сибири / Минсельхоз РСФСР. Гл. упр. защиты растений. БИ СО РАН. Куйбышев (НСО): П–о Простор., 1974. 29 с.
Музыка В. Ю. Структура локальной популяции водяной полевки // Экология популяций. Ч. 1: Тезисы докладов Всесоюзного совещания (4–6 октября 1988 г., Новосибирск). Новосибирск, 1988. С. 53–55.
Назарова Г. Г., Зудова Г. А., Проскурняк Л. П. Возрастная изменчивость и половой диморфизм краниометрических признаков у водяной полевки (Arvicola amphibius, Rodentia, Arvicolinae) // Зоологический журнал. Т. 94. № 8. С. 955–962.
Назарова Г. Г., Проскурняк Л. П. Возрастная изменчивость репродуктивных показателей у водяной полевки (Arvicola amphibius L., 1758) // Вестник ИрГСХА. 2017. № 83. С. 141–145.
Пантелеев П. А. Опыт определения возраста водяных полевок в осенней популяции // Бюлл. МОИП. Отд. Биол. 1966. Т. 71. Вып. 4. С. 20–25.
Проскурняк Л. П., Назарова Г. Г. Численность, популяционная структура и вредоносная деятельность водяной полевки (Arvicola amphibius L.), обитающей на садово-огородных участках // Пест-Менеджмент. 2017. № 4 (104). С. 23–29.
Рогов В. Г. Динамика численности и демографические параметры популяции водяной полевки (Arvicola terrestris) в подтаежной зоне Западной Сибири: Автореф. дис. ... канд. биол. наук . Новосибирск: ИСиЭЖ СО РАН, 1999. 19 с.
Рогов В. Г., Потапов М. А., Евсиков В. И. Половая структура популяций водяной полевки Arvicola terrestris (Rodentia, Cricetidae) в Западной Сибири // Зоологический журнал. 1999. Т. 78. № 8. С. 979–986.
Boonstra R. Population hypothesis cycles in microtines: the senescence hypothesis // Evolutionary Ecology. Vol. 8. P. 196–219.
Beauplet G., Barbraud C., Dabin W., Kűssener C., Guinet C. Age-specific survival and reproductive performances in fur seals: evidence of senescence and individual quality // Oikos. 2006. Vol. 112. P. 430–441.
Gelling M., Macdonald D. W., Telfer S., Jones T., Bown K., Birtles R., Mathews F. Parasites and pathogens in wild populations of water voles (Arvicola amphibius) in the UK // European Journal of Wildlife Research. 2012. Vol. 58. No 3. P. 615–619.
Cerqueira D., de Sousa B., Gabrion C., Giraudoux P., Quéré J. P., Delattre P. Cyclic changes in the population structure and reproductive pattern of the water vole, Arvicola terrestris Linnaeus, 1758 // Mamm. Biol. 2006. Vol. 71. P. 193–202.
Ferkin M. H. Attractiveness of opposite-sex odor and responses to it vary with age and sex in meadow voles (Microtus pennsylvanicus) // Journal of Chemical Ecology. 1999. Vol. 25. No 4. P. 757–769.
Nazarova G. G. Effects of seasonal, ontogenetic, and genetic factors on lifespan of male and female progeny of Arvicola amphibius // Frontiers in genetics. Т. 4. № JUN. С. Article 100.
Paradis E., Guedon G. Long lifespan in a population of Microtus (Pitymys) duodecimcostatus // Mammalia, De Gruyter. 1993. Vol. 57. No 1. P. 142–144.
Potapov M. A., Rogov V. G., Ovchinnikova L. E., Muzyka V. Yu., Potapova O. F., Bragin A. V., Evsikov V. I. The effect of winter food stores on body mass and winter survival of water voles, Arvicola terrestris, in Western Siberia: the implications for population dynamics // Folia Zoologica. 2004. Т. 53. № 1. P. 37–46.
Somoano A., Ventura J., Miñarro M. Continuous breeding of fossorial water voles innorthwestern Spain: potential impact on apple orchards // Folia Zool. 2017. Vol. 66. № 1. P. 37–49.
Saucy F. Dynamique de population, dispersion et organisation sociale de la forme fouisseuse du campagnol terrestre, (Arvicola terrestris scherman (Shaw), Mammalia, Rodentia). These Universite de Neuchatel. 1988. 366 p.
Stewart R. A., Clark T. J., Shelton J., Stringfellow M., Scott C., White S. A., McCafferty, D. J. Urban grasslands support threatened water voles // Journal of Urban Ecology. 2017. No 3. P. 1–7.
Zudova G. A., Proskurnyak L. P., Nazarova G. G. Age and sex determination in the water vole (Arvicola amphibius, Rodentia, Arvicolinae) based on measurements of the pelvic limb bones // Biology Bulletin. 2017. Vol. 44. No 9. P. 1115–1122.
Благодарности
Работа выполнена по Программе ФНИ государственных академий наук на 2013–2020 гг. (проект № VI.51.1.8.).






 © 2011 - 2026
© 2011 - 2026