Введение
Пресноводные высшие раки часто используются в качестве индикаторных организмов устойчивого функционирования водной экосистемы, в которой они обитают, и в мониторинге качества воды (Kholodkevich et al., 2008; Мельник и др. 2013; Сладкова и др., 2016; Kozák, Kuklina, 2016). Австралийские красноклешневые раки Cherax quadricarinatus (von Martens, 1868), получившие широкую известность в мире как объект тепловодной аквакультуры, могут служить в качестве индикаторных организмов качества воды теплых эвтрофных водоемов (Reynolds, Souty-Grosset, 2012). Их толерантность к колебаниям кислорода и биогенов в воде (Ghanawi and Saoud, 2012; Carreño-León et al., 2014), а также высокая чувствительность к загрязнению воды, например, тяжелыми металлами (Nakayama et al., 2010) делает их практически оптимальными животными для использования в качестве биоиндикаторов в биологических системах раннего предупреждения (БСРП). В настоящее время биологические методы оценки качества воды, в которых используются разные виды животных в качестве тест-организмов, а биомаркерами служат физиологические и поведенческие показатели их жизнедеятельности, получили достаточно широкое распространение. Среди них достаточно эффективными являются методы, основанные на неинвазивной регистрации и анализе в реальном времени кардиоактивности беспозвоночных животных с жестким наружным покровом (раков, крабов, раковинных моллюсков) (Depledge, 1984; Bamber, Depledge, 1997; Холодкевич, 2006, 2007; Kholodkevich et al., 2008). Очевидно, что при отборе тест-организмов, пригодных для использования в системах биоиндикации, необходимо учитывать адаптационные возможности вида, способность приспосабливаться к экспериментальной среде и условиям, зачастую весьма отличающимся от естественных. В ряде работ (Федотов и др., 2002; Сладкова и др., 2016) исследовалась кардиоактивность пресноводных раков вида Astacus leptodactylus в различных функциональных состояниях и показана возможность использования ее характеристик для оценки качества воды. В одной из таких работ (Удалова и др., 2009) по частоте сердечных сокращений (ЧСС) были определены критерии возникновения и стабилизации ночной, активной фазы поведения узкопалых раков и выявлены существенные изменения динамики ЧСС, предшествующие началу линьки, что позволило корректно использовать этот вид раков в системах биологического мониторинга качества воды на водозаборных станциях Санкт-Петербурга (Иванов и др., 2012). Несмотря на большое количество работ по выращиванию и культивированию австралийских красноклешневых раков, данные о кардиоактивности этого вида в литературе практически отсутствуют.
Цель настоящей работы состояла в изучении динамики ЧСС раков C. quadricarinatus в различных физиологических состояниях, важных с точки зрения их практического использования в качестве тест-организмов в биологических системах раннего предупреждения: в состоянии покоя, спонтанной ночной активности, состоянии стресса, а также на разных стадиях линочного цикла.
Аналитический обзор
Материалы и методы
Исследование проведено на культивируемых в лабораторных условиях австралийских красноклешневых раках Cherax quadricarinatus. Раки содержались в рыбоводческих лотках с пластиковыми убежищами. Основные параметры содержания: pH – 6.5–7.5, температура воды – 26–28 ºС, содержание кислорода – не менее 70 % насыщения (7 мг/л), режим освещенности – 12/12.
В эксперимент отбирали 6 недавно перелинявших половозрелых раков-самцов без признаков заболеваний общей длиной 10.0 ± 0.9 см и длиной карапакса 4.5 ± 0.4 см. Об удовлетворительном функциональном состоянии животных судили по их подвижности, поеданию корма и хорошо выраженной реакции опистотонуса (оборонительное приподнимание клешней). Отобранным животным на карапакс приклеивали миниатюрный держатель для волоконно-оптического датчика, необходимого для регистрации кардиоактивности (рис. 1), и по одному помещали в 6 аквариумов с проточной водой, в которых обеспечивалась циркуляция воды на постоянном уровне с помощью помпы, находящейся в специальной резервной емкости.

Рис. 1. Красноклешневой рак Cherax quadricarinatus с прикрепленным датчиком для регистрации ЧСС
Fig. 1. Red-claw crayfish Cherax quadricarinatus with a fixed sensor
for heart rate registration
Каждый аквариум был снабжен искусственным убежищем, в котором рак мог прятаться в светлое время суток. Толщина слоя воды в аквариуме поддерживалась на уровне 10 см. Использовалась отстоянная водопроводная вода. Качество воды обеспечивалось циркуляцией ее через биофильтр фирмы Eheim. Температуру воды в экспериментальной установке поддерживали на постоянном уровне 27.0 ± 0.5 ºС с помощью нагревателей, находящихся в резервной емкости. Режим освещенности 12/12 обеспечивался лампами дневного света. Свет включался с 8 утра до 8 вечера. Животных кормили 1 раз в 3 дня личинками хирономид (в пересчете на суточный рацион – 2 % от веса тела). На следующий день осуществлялась частичная смена воды через резервную емкость. Ежедневно контролировались рН воды и содержание нитратов в ней. Величина рН в течение всего эксперимента оставалась в пределах 6.5–7.4. Содержание нитратов не превышало 40 мг/л. Длительность исследования составила 6 месяцев. После линьки, по мере затвердения карапакса (в среднем через 5 суток), раку снова прикрепляли оптоволоконный датчик и продолжали регистрацию кардиоактивности. Для оценки функционального состояния раков в процессе исследования применяли физический стимул, в качестве которого использовали хэндлинг при наклейке датчиков и метод функциональной (физической) нагрузки – стресс-тест на подвес: рака в течение часа фиксировали в толще воды за закрепленный на карапаксе оптоволоконный кабель. Лишенный контакта с дном аквариума рак совершает вынужденные движения ходильными ногами и клешнями, пытаясь найти опору, и периодически совершает удары хвостом, пытаясь освободиться. Этот тест проводили через 20 дней от начала исследования и повторно в конце него. В течение всего исследования, за исключением момента линьки и постлиночной стадии линочного цикла (5 суток), осуществлялась непрерывная регистрация кардиоактивности раков с помощью оригинальной волоконно-оптической системы неинвазивной регистрации фотоплетизмограмм беспозвоночных с твердым наружным скелетом (Kholodkevich et al., 2008). На рис. 2 представлен используемый измерительный комплекс, который снабжен оригинальным программным обеспечением, позволяющим в реальном времени регистрировать ряд характеристик кардиоритма животных (Холодкевич, 2007; Kholodkevich et al., 2008). При математической обработке фотоплетизмограмм в реальном времени определяли частоту сердечных сокращений (ЧСС) в ударах в минуту с усреднением по 100 кардиоинтервалам, среднее квадратичное отклонение длительности кардиоинтервалов (СКО) в секундах. Программа обработки позволяла выводить и архивировать числовые данные, а также строить в реальном времени графики зависимости указанных характеристик кардиоактивности от времени суток. При дальнейшей обработке массива данных ЧСС выделяли два временных периода: ночной – с 20 ч до 8 ч утра и дневной – остальное время суток. Полученный числовой материал обрабатывали статистическими методами с применением парного критерия Стьюдента t для зависимых выборок при оценке влияния различных факторов на кардиоактивность каждого рака и двухвыборочного критерия t для независимых величин. Значимыми считали различия сравниваемых величин при р <0.05.

Рис. 2. Установка для многоканальной регистрации кардиоактивности одновременно до 7 животных и интерфейс оригинальной программы «VarPulse»
Fig. 2. Installation for multi-channel registration of cardiac activity of up to 7 animals simultaneously and the interface of the original computer program «VarPulse»
Использованный способ неинвазивной регистрации кардиоактивности не влияет на поведение раков и не вызывает у них состояния стресса (Kholodkevich et al., 2008). Длина волоконно-оптического кабеля позволяла животному свободно передвигаться по аквариуму. Для регистрации кардиоактивности при нахождении рака в убежище на его верхней поверхности имелась продольная щель. Кардиоактивность регистрировали одновременно у шести раков.
Результаты исследования
На рис. 3 на примере рака №1 представлена типичная динамика хронотропных характеристик кардиоактивности красноклешневых раков сразу после прикрепления волоконно-оптического датчика и помещения их в аквариумы экспериментальной лабораторной установки для регистрации кардиоактивности в течение 2-недельного периода времени.

Рис. 3. Типичная динамика (рак № 1) ЧСС и СКО длительности кардиоинтервалов раков в течение 14 суток.
3А – запись в первые сутки эксперимента, 3Б – запись со 2-х по 9-е сутки, 2В – запись с 10-х по 14-е сутки. Верхняя кривая – ЧСС, нижняя – СКО длительности кардиоинтервалов. Стрелками показано время подачи корма. Вертикальными отрезками обозначены границы суток. Темные участки на временной шкале – продолжительность темнового периода
Fig. 3. Typical dynamics (crayfish №1) of heart rate and mean-square deviation of crayfish cardiac interval duration for 14 days.
3A – record in the first day of the experiment, 3Б – record from 2d to 9th day, 2B – record from 10th to 14th day. The upper curve is the heart rate, the lower one is the mean-square deviation of the cardiac interval duration. Arrows indicate the feed time. Vertical segments represent the bordelines between days. Dark areas on the timeline are the duration of the dark period
На этой записи можно выделить несколько характерных участков. После помещения раков в экспериментальные аквариумы высокое значение ЧСС, равное 186 ± 14 уд./мин, сохранявшееся после хэндлинга, сохранялось почти час (53.3 ± 5.8 мин, n = 6). В дальнейшем ЧСС несколько снижалась и держалась в среднем на уровне 150 уд./мин независимо от освещенности. При этом СКО длительности кардиоинтервалов варьировало от 3 мс до 20 мс около среднего уровня 7–10 мс. Такие высокие значения ЧСС в сочетании с минимальными значениями СКО свидетельствуют о высокой степени напряжения регуляторных систем (Баевский, Берсенева, 1997). Стоит отметить, что такая первичная реакция со стороны кардиосистемы рака наблюдалась как на начальном этапе исследования, так и при повторном прикреплении оптоволоконного датчика на карапакс рака после линьки (рис. 3А). В последующие 2–3 суток наблюдались неритмичные колебания высоких значений ЧСС, что указывает на состояние возбуждения животных. Средний уровень СКО кардиоинтервалов при этом постепенно возрастал с 10 мс до 35 мс, что, в свою очередь, свидетельствует о том, что это возбуждение неуклонно спадает. С увеличением длительности нахождения раков в экспериментальной установке ЧСС постепенно снижается, и на 7-е сутки в кардиоактивности раков начинается проявление некоторой суточной периодичности, однако эта периодичность еще нестабильная. В это же время увеличивается диапазон колебаний СКО около все возрастающего среднего уровня, а в ночное время появляются значительные участки со средним значением СКО 7–10 мс, свидетельствующие о высокой ритмичности ЧСС в это время. На рис. 3В показан типичный пример суточного кардиоритма у раков Cherax quadricarinatus, адаптированных к условиям содержания (запись в течение 5 суток), который у всех особей стабилизировался на 10–11-е сутки после помещения раков в аквариумы. Четко прослеживаются регулярно повторяющиеся (с 24-часовым периодом) изменения кардиоактивности – высокие значения ЧСС в темное время и более низкие – в светлый период. Значения СКО кардиоинтервалов имеют аналогичную периодичность с минимальными значениями в ночное время и высокими – в дневное. Активизация кардиоактивности начинается с момента выключения освещения, ЧСС резко возрастает, а СКО резко падает. ЧСС в ночной период носила индивидуальные черты: продолжительность стадии стабильно высокого значения ЧСС, наличие нескольких фаз в периоде общей ночной активности и, наконец, продолжительность всего ночного периода активности. Однако имелись общие для разных особей закономерности. Значения ЧСС в течение почти всего темного периода сохраняются выше дневных значений. Почти все раки демонстрировали стабильно высокие значения ЧСС в промежутке от 22 до 4–6 часов утра. На включение света у всех исследованных животных наблюдается кратковременное повышение ЧСС до максимальных значений, характерных для ночного времени, и быстрый (от 10 до 30 минут) спад до низких дневных значений в покое. При этом СКО длительности кардиоинтервалов резко возрастает сразу после достижения максимальных значений ЧСС и падает до значений, характерных для дневного уровня. Такой пик, как правило, свидетельствует о процессе смены доминирующего звена регуляции, в частности, об ослаблении центральной регуляции кардиоактивности и возрастании влияния автономного контура (Баевский, Берсенева, 1997). Повышение СКО длительности кардиоинтервалов в дневное время сопровождается его постоянными колебаниями (разбросом) около средней линии (рис. 3В), что, возможно, свидетельствует о непостоянстве ритма ЧСС в дневное время, о возможных ультрадианных ритмах в ЧСС в состоянии покоя. Но способ обработки сигнала с усреднением по 100 кардиоинтервалам не позволяет их выявлять. Это задача требует применения всего арсенала метода вариационной пульсометрии для анализа кардиосигналов. На рис. 3 также видно, что процесс кормления раков всегда вызывает повышение ЧСС до максимальных значений, характерных для состояния стресса, но когда суточный ритм еще не выработался, длительность такой реакции разная и часто приводит к длительному периоду активации кардиоактивности. На стадии стабильного суточного ритма процесс кормления, как правило, приводит к повышению ЧСС на 30–60 минут, причем это не оказывает существенного влияния на динамику ЧСС животного в последующие сутки. Таким образом, реакция на включение света и подачу корма состоит в превышении ЧСС покоя на 100 % и более, которая в дневное время в среднем по выборке составляет 52.8 ± 2.160 уд./мин. В ночной период ЧСС в среднем по выборке возрастала на 130 % и составляла 124.4 ± 2.0 (табл. 1).
Таблица 1. Амплитудные характеристики суточного ритма кардиоактивности раков в режиме искусственной освещенности
| № рака | ЧСС в дневной период (уд./мин) | ЧСС в ночной период (22.00–6.00) (уд./мин) | Реакция ЧСС на включение света (уд./мин) | Длительность реакции на включение света (мин) |
| 1 | 55.9 ± 4.8 | 127.2 ± 10.2 | 135.3 ± 10.5 | 17 ± 3 |
| 2 | 54.3 ± 4.2 | 124.8 ± 9.3 | 148.3 ± 15.7 | 19 ± 4 |
| 3 | 50.8 ± 2.0 | 123.5 ± 10.6 | 132.4 ± 11.2 | 15 ± 4 |
| 4 | 50.3 ± 2.5 | 121.3 ± 10.3 | 128.2 ± 12.8 | 18 ± 5 |
| 5 | 53.5 ± 4.1 | 124.3 ± 10.3 | 130.3 ± 10.4 | 20 ± 3 |
| 6 | 52.1 ± 4.3 | 125.6 ± 9.8 | 126.2 ± 11.7 | 21 ± 5 |
| Среднее | 52.8 ± 2.1 | 124.4 ± 2.0 | 133.5 ± 7.4 | 18 ± 2 |
Такой характер кардиоактивности с выраженным суточным ритмом, период и фазы которого жестко определялись режимом освещенности, раки демонстрировали в течение 3–4 месяцев. За 9–10 дней до наступления линьки характер кардиоактивности раков менялся. Линька всех раков происходила не одномоментно, но в пределах 3 недель. Первый рак полинял на 115-й день от начала регистрации кардиоактивности, а два последних – на 134-й. Как видно из рис. 4, за 10 дней до момента сбрасывания старого панциря значения характеристик суточного ритма ЧСС начинают изменяться в основном за счет повышения ЧСС покоя в дневное время. Повышение ЧСС в дневное время в дальнейшем продолжает нарастать, и за 5 дней до непосредственного момента линьки значения ЧСС достигают значений, характерных для ночной фазы, что приводит к полному нивелированию суточного ритма. При этом разброс значений СКО длительности кардиоинтервалов постепенно уменьшается, и на 5-е сутки средний уровень СКО соответствует 25 мс, а далее снижается до 10 мс и в последние 3 дня перед линькой до 7 мс с минимальным разбросом, что свидетельствует о нарастающей ритмичности ЧСС и напряженности регуляторных систем. Также видно, что по мере приближения к моменту линьки рак перестает адекватно реагировать на предъявляемые стимулы, а именно: подачу корма, включение и выключение света. В последние 3 дня, непосредственно перед экдизисом, сердце рака работает как часы, а рак сидит в убежище и вылезает из него только перед самой линькой. На рис. 4 видно, что в 16.00 имеется пик СКО и его последующая большая нерегулярная вариация, что обычно связано с движением животного. Замена панциря, как правило, занимает всего около 5–30 минут. К сожалению, методические возможности не позволяют регистрировать ЧСС сразу после линьки из-за мягкого панциря, и любое прикосновению к раку в это время может нанести ему непоправимый вред. Затем рак на время затвердевания панциря забивается в убежище. В это время, как показывают наши наблюдения, он не питается. Через 5 дней панцирь становится достаточно жестким, что позволяет в очередной раз прикрепить датчик и продолжить регистрацию ЧСС. Наблюдается аналогичная первичная реакция и последующее возбуждение в день наклеивания датчика, но уже на следующие сутки раки демонстрируют характерный для них светозависимый суточный ритм кардиоактивности (рис. 3В, табл. 1).

Рис. 4. Типичная динамика (рак № 2) ЧСС и СКО кардиоинтервалов раков в течение 10 суток до линьки. Верхняя кривая – ЧСС, нижняя – СКО. Светлыми стрелками показано время подачи корма. Темная стрелка – момент сбрасывания старого панциря. Вертикальными отрезками обозначены границы суток. Темные участки на временной шкале – продолжительность темнового периода
Fig. 4. Typical dynamics (crayfish №2) of heart rate and cardiac interval mean-square deviation of crayfish within 10 days before molting. The upper curve is the heart rate, the lower one is the mean-square deviation. The light arrows indicate the feed time. The dark arrow is the moment of dropping the old carapace. Vertical segments denote the bordelines between days. Dark areas on the timeline are the duration of the dark period
Реакция сердечно-сосудистой системы раков в тесте на подвес представлена на рис. 5 на примере рака №3. Эта реакция заключается в быстром повышении ЧСС примерно в 3 раза по сравнению с ЧСС покоя и поддержании этого уровня в пределах 10 % разброса во время подвеса. При этом значение СКО длительности кардиоинтервалов во время подвеса в 10 раз меньше СКО в покое и в среднем составляет 8 мс против 80–100 мс, что свидетельствует о том, что вариабельность сердечного ритма во время подвеса значительно меньше, чем в покое.
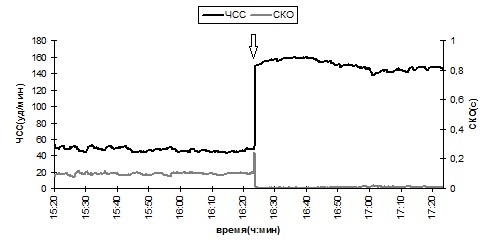
Рис. 5. Динамика ЧСС рака № 3 в фоне и в тесте на подвес. Стрелками указано начало подвеса. Черный цвет – среднее значение ЧСС, серый цвет – СКО кардиоинтервалов
Fig. 5. The dynamics of heart rate of crayfish №3 in the background mode and in the lifting test. The arrows indicate the beginning of lifting. The mean value of heart rate is marked black, the mean-square deviation of cardiac intervals is marked grey.
Такую реакцию все раки демонстрировали как в начале эксперимента до линьки, так и после линьки в конце эксперимента (табл. 2).
Таблица 2. Хронотропные характеристики кардиоактивности раков в тесте на подвес
| № рака | ЧСС в подвесе до линьки (уд./мин) | ΔЧСС =
(ЧССтест - ЧССпокой) до линьки, % |
ЧСС в подвесе после линьки (уд./мин) | ΔЧСС
(ЧССтест-ЧССпокой) после линьки, % |
| 1 | 172.4 ± 5.6 | 207 | 170.3 ± 9.7 | 201 |
| 2 | 156.3 ± 9.7 | 188 | 155.7 ± 9.8 | 198 |
| 3 | 151.2 ± 8.1 | 196 | 155.5 ± 9.2 | 194 |
| 4 | 158.8 ± 9.3 | 216 | 169.3 ± 8.4 | 218 |
| 5 | 160.7 ± 8.1 | 196 | 165.2 ± 8.3 | 201 |
| 6 | 155.1 ± 8.8 | 198 | 157.2 ± 10.2 | 198 |
| Среднее | 158.8 ± 7.6 | 200.2 ± 9.8 | 162.5 ± 7.4 | 201.7 ± 8.4 |
Обсуждение
Многомесячная регистрация хронотропных характеристик кардиоактивности австралийских красноклешневых раков позволила проследить изменения в динамике их сердечной деятельности, обусловленные долговременным пребыванием в экспериментальных условиях, отличающихся по ряду факторов от естественных сезонных, влияющих на процессы репродукции и линьки. Наблюдаемые изменения кардиоактивности связаны с различными физиологическими состояниями животных, поскольку сердечно-сосудистая система с ее многоуровневой регуляцией представляет собой систему, конечным результатом деятельности которой является обеспечение заданного уровня функционирования целостного организма. В процессе акклимации организм проходит ряд стадий, на которых пытается приспособиться к новым для него условиям среды. По изменениям характеристик кардиоактивности раков Cherax guadricarinatus в процессе их акклимации к экспериментальным условиям, а именно к существенному ограничению жизненного пространства и одиночному содержанию, можно выявить три этапа. Первичным стрессовым воздействием на раков является хэндлинг. Реакция на хэндлинг – генерализованная реакция возбуждения, проявляющаяся в возникновении отчетливого двигательно-оборонительного поведения, сопровождающегося быстрым повышением ЧСС до максимальных значений, приблизительно в 3 раза больших по сравнению с ЧСС в покое. В ответ на новые условия среды или стрессовое воздействие наблюдались выраженные поведенческие реакции и изменения хронотропных характеристик кардиоактивности с постепенным восстановлением их до исходного состояния в процессе акклимации. Анализ кардиоактивности раков в течение 9 дней после помещения в аквариумы лабораторной установки показал, что после первичной реакции с максимально возможными значениями ЧСС состояние возбуждения сохраняется еще 2–3 суток, о чем свидетельствует, в частности, повышенный на 20–30 % уровень ЧСС оперативного покоя в дневное время, по сравнению с ЧСС, характерной для раков этого вида, размера и возраста. Затем ЧСС покоя снижается до 50–60 уд./мин в зависимости от индивидуальных особенностей раков, при этом характерный для данного вида суточный кардиоритм еще не выявляется. По-видимому, за этапом возбуждения следует этап оптимизации поведенческих и физиологических процессов и соответствующих им характеристик кардиоактивности раков и установления оптимального суточного ритма (рис. 2Б). Длительность этого этапа в нашем исследовании составила 6–7 дней. Стабилизация типичной для данного вида раков циркадианной ритмики с чередованием дневного периода покоя и ночной активности является показателем торможения оборонительного поведения и закрепления естественного суточного цикла, т. е. акклимации к новым для животного условиям среды. Известно, что раки, адаптированные к условиям обитания, как в естественных условиях, так и при длительном содержании в лабораторных условиях, демонстрируют характерный для каждого вида циркадианный кардиоритм, даже если все параметры, которые могли бы повлиять на частоту сердечных сокращений, стандартизированы (Styrishave et al., 1995; Bojsen et al., 1998; Styrishave et al., 2007; Удалова и др., 2009). Нами впервые показано, что у акклимированных раков вида C. quadricarinatus устанавливается отчетливо выраженный суточный ритм кардиоактивности, характерный для высших раков, заключающийся в чередовании высоких значений ЧСС в ночное время и низких – в дневное. Указанные сдвиги количественных характеристик кардиоактивности отражают изменения в поведении раков, соответствующие переходу при наступлении темноты из состояния покоя в активное состояние. Такой переход отражает особенности поведения раков, связанные с их сумеречной активностью, особенностями организации их пищедобывательного поведения. Суточный ритм ЧСС, наблюдаемый нами у тропических красноклешневых раков, без сомнения, является проявлением характерного для Decapoda циркадианного ритма, синхронизированного с режимом искусственного освещения «день – ночь» (12С:12Т). Четко прослеживается его бимодальный характер, заключающийся в наличии двух пиков активности. Впервые модальность суточного ритма кардиоактивности раков была обнаружена и описана у красных болотных раков Procambarus clarkii (Pollard, Larimer, 1977). Кратковременный пик ЧСС, возникающий сразу после включения света, является рефлекторным ответом на свет, как и индуцированная локомоторная активность, связанная с попыткой спрятаться в убежище (Fingerman, Lago, 1957). Пик на выключение света считается циркадианным, так как он наблюдается и при свободно бегущем ритме с периодом, отличным от 24 часов (Pollard, Larimer, 1977). Такой суточный ритм раки демонстрировали на межлиночной стадии линочного цикла. С наступлением предлиночной стадии амплитудные показатели суточного ритма начинали изменяться, ЧСС покоя, неуклонно возрастая, достигала значений, характерных для состояния активности или стресса, и суточный ритм нивелировался полностью. При этом вариабельность ритма ЧСС существенно уменьшалась. Применение для анализа показателя метода вариационной пульсометрии СКО длительности кардиоинтервалов повышало надежность определения изменений в сердечном ритме (рис. 3). Линька у раков, как и у всех ракообразных, – доминирующий процесс в течение всей их жизни, прямо или косвенно влияющий на обмен, поведение, размножение и сенсорное восприятие (Passano, 1960). Процессу сбрасывания старого панциря предшествует длительная физиологическая подготовка, которая осуществляется на предлиночной стадии линочного цикла. Как известно (Drach, 1939), данная стадия делится на 4 этапа, на которых последовательно происходит частичная деградация экзоскелета и формирование новой кутикулы. Это осуществляется за счет процессов реабсорбции кальция от старой кутикулы, кальций переносится гемолимфой от экзоскелета к желудку, где происходит аккумулирование его в гастролитах (Ahearn et al., 2004). Стимулируя линьку у раков C. guadricarinatus удалением глазных стебельков, Шехтер с соавторами показали, что через два дня после активации начинали образовываться гастролиты в желудке и увеличивались с линейной скоростью в последующие 8 дней вплоть до момента самой линьки. Одновременно с этим плотность кутикулы оставалась почти постоянной на протяжении большей части предлиночной стадии, снижение плотности кутикулы было обнаружено за 3 дня до линьки (Shechter et al., 2008). Для осуществления транспорта кальция требуется большое количество энергии, которое обеспечивается за счет увеличения потребления кислорода, ЧСС и содержания гемоцианина в гемолимфе (Цукерсис, 1970; Черкашина, 2002; Сладкова, Холодкевич, 2011). Полученные нами данные по кардиоактивности раков указанного вида на предлиночной стадии хорошо согласуются с данными, полученными Шехтером с соавторами. За 8 дней до линьки заметно увеличивается ЧСС покоя, что обеспечивает процесс образования и роста гастролитов. А за 2.5–3 дня до линьки значения ЧСС держатся на максимальном уровне с высокой степенью ритмичности, что свидетельствует о высокой степени напряжения регуляторных систем и регуляции сердечного ритма животного центральным контуром, представляющим собой сложную многоуровневую систему нейрогуморальной регуляции физиологических функций. Известно, что линочный цикл речных раков контролируется гормонально и зависит от ряда внутренних и внешних факторов (Aiken, Waddy, 1992). Температура и фотопериод являются двумя основными экологическими факторами, лежащими в основе периодичности репродуктивных и линочных циклов у ракообразных. Влияние этих факторов на линьки, воспроизводство и связанные с ними процессы обмена веществ у речных раков хорошо изучены, а также показано, что изменение температуры и светового периода являются факторами, стимулирующими линьку (Armitage et al., 1973; Rice, Armitage, 1974; Westin, Gydemo, 1986; Aiken, Waddy, 1990; Dube, Portelance, 1992). В настоящем исследовании и температура, и фотопериод были стабилизированы. Линочный цикл, по-видимому, контролировался в основном эндогенными факторами. Поскольку линька наблюдалась у всех раков в относительно близкий временной интервал, можно предположить наличие внутренней программы роста и развития животных, выработанной в процессе эволюции. В естественных условиях эта программа синхронизируется с сезонными изменениями абиотических факторов и имеет важное адаптационное значение. В литературе имеются данные о периодических линьках красноклешневых раков как в условиях естественной освещенности, так и в условиях постоянства температуры и фотопериода (Barki et al., 1997).
Заключение
Проводимый в начале исследования (сразу после акклимации) и в конце его тест на подвес показал, что функциональное состояние раков не изменилось в процессе длительного эксперимента, а характеристики кардиоактивности в тесте на подвес свидетельствуют о нормальном энергетическом статусе животного (Bamber, Depledge, 1997). Поэтому можно считать, что все полученные закономерности в кардиоактивности красноклешневых раков имеют физиологический характер. В естественных условиях обитания суточная ритмика с выраженным усилением кардиоактивности и локомоций в «ночное» время у всех изученных видов Decapoda является выработанной в ходе эволюции адаптацией к циклическим изменениям в течение суток освещенности и температуры окружающей среды, способствующей избеганию дневных хищников и снижению межвидовой конкуренции. На наш взгляд, как и для раков вида Astacus leptodactylus (Удалова и др., 2009; Кузнецова и др., 2010; Иванов и др., 2012), наличие суточного ритма кардиоактивности C. guadricarinatus может служить важным индикатором нормального физиологического состояния, здоровья этих животных и использоваться в качестве автоматического самоконтроля работоспособности БСРП, в которых они используются в качестве тест-организмов. В заключение отметим, что автоматическая индикация этого показателя в реальном времени для всех раков C. guadricarinatus является принципиально важной, так как в качестве тест-организмов во всех системах БСРП, в том числе системах биомониторинга качества биологически очищенных сточных вод, целесообразно использовать только здоровых животных.
Работа была выполнена с использованием оборудования Ресурсного центра «Обсерватория экологической безопасности» Научного парка СПбГУ.
Библиография
Баевский Р. М., Берсенева А. П. Оценка адаптационных возможностей организма и риска развития заболеваний . М.: Медицина, 1997. 235 с.
Иванов А. В., Холодкевич С. В., Куракин A. С. Самодиагностика биоэлектронных систем мониторинга окружающей среды в реальном времени // Системы контроля окружающей среды. 2012. № 17. С. 26–31.
Кузнецова Т. В., Сладкова С. В., Холодкевич С. В. Оценка функционального состояния раков в нормальной и токсической среде по их кардиоактивности и биохимическим показателям гемолимфы // Журн. эвол. биохим. и физиол. 2010. Т. 46. № 3. С. 203–210.
Мельник Е. А., Рублевская О. Н., Панкова Г. А., Холодкевич С. В., Иванов А. В., Корниенко Е. Л., Сладкова С. В., Любимцев В. А., Куракин А. С. Биоэлектронная система контроля токсикологической безопасности биологически очищенных сточных вод // Водоснабжение и санитарная техника. 2013. № 1. C. 7–12.
Сладкова C. В., Сафронова Д. В., Холодкевич С. В. Изучение влияния изменений режимов освещенности, температуры и процесса кормления на кардиоактивность раков-биоиндикаторов в биоэлектронных системах мониторинга качества поверхностных вод // Вестник Санкт-Петербургского университета. Серия 3. Биология. 2016. № 1. С. 137–149.
Сладкова С. В., Холодкевич С. В. Общий белок в гемолимфе раков Pontastacus leptodactylus как показатель функционального состояния животных и биомаркер качества среды обитания // Журн. эвол. биохим. и физиол. 2011. Т. 47. № 2. С. 136–141.
Удалова Г. П., Холодкевич С. В., Сладкова С. В., Иванов А. В., Рымша В. А. Исследование циркадианной активности раков Pontastacus leptodactylus при их многомесячном содержании в протоке речной воды // Журн. эволюц. биохим. и физиол. 2009. T. 45. № 3. С. 304–312.
Федотов В. П., Холодкевич С. В., Строчило А. Г. Особенности активности сердца рака Astacus astacus в различных функциональных состояниях // Журн. эволюц. биохим. и физиол. 2002. Т. 38. № 1. С. 36–44.
Холодкевич С. В. Волоконно-оптические дистанционные биосенсорные системы непрерывного биологического мониторинга качества поверхностных вод и донных отложений в реальном времени // Нефть и газ арктического шельфа – 2006: Материалы международной конференции, Мурманск, 15–17 ноября. Мурманск: ММБИ КНЦ РАН, 2006. С. 287–296.
Холодкевич С. В. Биоэлектронный мониторинг уровня токсичности природных и сточных вод в реальном времени // Экологическая химия. 2007. Т. 16. № 4. С. 223–232.
Цукерсис Я. М. Биология широкопалого рака . Вильнюс: Милятис, 1970. 204 с.
Черкашина Н. Я. Динамика популяций раков родов Pontastacus и Caspiastacus (Crustacea, Decapoda, Astacidae) и пути их увеличения . М.: Нацрыбресурс, 2002. 256 с.
Ahearn G. A., Mandal P. K., Mandal A. Calcium regulation in crustaceans during the molt cycle: a review and update // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 2004. Vol. 137. P. 247–257.
Aiken D. E., Waddy S. L. Winter temperature and spring photoperiod requirements for spawning in the American lobster (Homarus americanus) // J. Shellfish Res. 1990. Vol. 9. P. 41–43.
Aiken D. E., Waddy S. L. The growth-process in crayfish // Rev. Aquat. Sci. 1992. Vol. 6. P. 335–381.
Armitage K. B., Buikema A. L., Willems N. J. The effect of photoperiod on organic constituents and molting of the crayfish Orconectes nais (Faxon) // Comp. Biochem. Physiol. 1973. Vol. 44(A). P. 431–456.
Bamber S. D., Depledge M. H. Responses of shore crabs to physiological challenges following exposure to selected environmental contaminants // Aquatic Toxicology. 1997. Vol. 40. P. 79–92.
Barki A., Levi T., Hulata G., Karplus I. Annual cycle of spawning and molting in the red-claw crayfish, Cherax quadricarinatus, under laboratory conditions // Aquaculture. 1997. Vol. 157. P. 239–249.
Bojsen B. Н., Witthofft H., Styrishave B. In situ studies on heart rate and locomotor activity in the noble freshwater crayfish, Astacus astacus (L.) in relation tо natural fluctuation in temperature and light intensity // Freshwater Biology. 1998. Vol. 39. P. 455–465.
Carreño-León D., Racotta-Dimitrov I., Casillas-Hernández R., Monge-Quevedo A., Ocampo-Victoria L., Naranjo-Páramo J., Villarreal H. Growth, metabolic and physiological response of juvenile Cherax quadricarinatus fed different available nutritional substrates // J. Aquac. Res. Development. 2014. Vol. 5. № 2. Doi:10.4172/2155-9546.1000220.
Depledge M. H. Disruption of circulatory and respiratory action in shore crabs Carcinus maenas (L.) exposed to heavy metal pollution // Comp. Biochem. Physiol. 1984. Vol. 78. P. 445–459.
Drach P. Mue et cycle d’intermue chez les Crustacés décapodes. Ann. Inst. Océanogr. Paris (Monaco), 1939. 19. pp. 103–391.
Dubé P., Portelance B. Temperature and photoperiod effects on ovarian maturation and egg laying of the crayfish Orconectes limosus // Aquaculture. 1992. Vol. 102. P. 161–168.
Fingerman M., Lago A. D. Endogenous twenty four hour rhythms of locomotor activity and oxygen consumption in the crayfi sh Orconectes clypeatus // The American Midland Naturalist. 1957. Vol. 58. P. 383–393.
Ghanawi J., Saoud I. P. Molting, reproductive biology, and hatchery management of red claw crayfish Cherax quadricarinatus (von Martens 1868) // Aquaculture. 2012. Vol. 358–359. P. 183–195.
Kholodkevich S. V., Ivanov A. V., Kurakin A. S., Kornienko E. L., Fedotov V. P. Real time biomonitoring of surface water toxicity level at water supply stations // J. Environmental Bioindicators. 2008. Vol. 3. № 1. P. 23–34.
Kozák P., Kuklina I. Crayfish as tools of water quality monitoring // Freshwater Crayfish: A Global Overview / CRS Press, eds. T. Kawai, Z. Faulkes, G. Scholtz. Boca Raton, 2016. P. 275–298.
Nakayama S. M., Ikenaka Y., Muzandu K,. Choongo K., Oroszlany B., Teraoka H., Mizuno N., Ishizuka M. Heavy metal accumulation in lake sediments, fish (Oreochromis niloticus and Serranochromis thumbergi), and crayfish (Cherax quadricarinatus) in Lake Itezhi-tezhi and Lake Kariba, Zambia // Arch. Environ. Contam. Toxicol. 2010. Vol. 59. № 2. P. 291–300.
Passano L. M. Molting and its control // Physiology of Crustacea. 1960. Vol. 1. P. 473–536.
Pollard T. G., Larimer J. L. Circadian rhythmicity of heart rate in the crayfish, Procambarus clarcii // Comp. Biochem. Physiol. 1977. Vol. 57(A). P. 221–226.
Reynolds J., Souty-Grosset C. Management of Freshwater Biodiversity. Cambridge: University press, 2012. 374 p.
Rice P. R., Armitage K. B. The effect of photoperiods on oxygen consumption of the crayfish Orconectes nais (Faxon) // Comp. Biochem. Physiol. 1974. Vol. 47(A). P. 261–270.
Shechter A., Berman A., Singer A., Freiman A., Grinstein M., Erez J., Aflalo E. D., Sagi A. Reciprocal Changes in Calcification of the Gastrolith and Cuticle During the Molt Cycle of the Red Claw Crayfish Cherax quadricarinatus // Biol. Bull. 2008. Vol. 214. P. 122–134.
Styrishave B., Rasmussen A. D., Depledge M. H. The influence of bulk and trace metals on the circzdian rhythm of heart rates in freshwater crayfish Astacus astacus // Marine Pollution Bulleten. 1995. Vol. 31. № 1–3. P. 87–92.
Styrishave B., Bojsen B. Н., Witthofft H., Andersen O. Diurnal variations in physiology and behaviour of the noble crayfish Astacus astacus and the signal crayfish Pacifastacus leniusculus // Marine and Freshwater Behaviour and Physiology. 2007. Vol. 40. № 1. P. 63–77.
Westin L., Gydemo R. Influence of light and temperature on reproduction and moulting frequency of the crayfish, Astacus astacus L. // Aquaculture. 1986. Vol. 52. P. 43–50.






 © 2011 - 2025
© 2011 - 2025