Введение
Реакция кардиосистемы может рассматриваться как интегральный ответ организма на изменение факторов среды обитания (Depledge et al., 1996). Частота сердечных сокращений (ЧСС) отражает интенсивность физиологических процессов, а также во многих случаях позволяет судить о функциональном состоянии организма в целом. В результате развития в последние годы неинвазивных методов регистрации кардиоактивности (Depledge, Andersen, 1990; Depledge et al., 1996; Kholodkevich et al., 2008; Nicholas et al., 2013) появились достаточно удобные инструменты измерения сердечного ритма ракообразных и моллюсков в природных и лабораторных условиях.
Настоящая работа посвящена изучению некоторых особенностей использования пресноводных двустворчатых моллюсков Unio pictorum, Anodonta anatina и Dreissena polymorpha в экотоксикологических исследованиях в качестве тест-организмов на основе мониторинга их кардиоритма волоконно-оптическим методом.
Материалы
Отбор и содержание моллюсков. Двустворчатые моллюски отбирались из среды обитания для проведения тестов в лабораторных условиях, после чего все животные возвращались в природную среду. В 2011–2014 гг. были проведены эксперименты на двустворчатых пресноводных моллюсках Anodonta anatina (L., 1758), Unio pictorum (L., 1758) и Dreissena polymorpha Pallas, 1771, отобранных летом в прибрежной зоне северного побережья восточной части Финского залива (60.089618° с. ш., 29.918753° в. д.). Природные условия обитания используемых в экспериментах моллюсков характеризуются общей минерализацией воды 100–300 мкг/л. В течение 1–3 часов после отлова моллюски доставлялись в лабораторию в пластиковых изотермических контейнерах объемом 10 л. В лаборатории на створки моллюсков в область сердца наклеивались миниатюрные датчики (D = 3 мм) с гибким оптическим волокном (рис. 1).
Во всех экспериментах непрерывная регистрация ЧСС производилась одновременно на группах из восьми или шестнадцати моллюсков. При этом в реальном времени для каждого животного с помощью программы VarPulse проводился расчет средних значений ЧСС и их среднего квадратичного отклонения (СКО) по выборке 50 интервалов сердечного ритма с шагом 10 интервалов. В процессе эксперимента данные о кардиоактивности моллюсков непрерывно записываются и сохраняются посуточно в виде файлов для последующего анализа. Визуализация данных по динамике параметров кардиоактивности осуществлялась при помощи MS Excel.
До проведения экспериментов моллюски были акклимированы к лабораторным условиям в течение 1 недели в 150-литровом аквариуме с внешним биологическим фильтром (EHEIM Ecco Pro 200) и постоянной аэрацией. Дважды в неделю производилась частичная замена воды. При длительном содержании проводили кормление сбалансированным препаратом TROPIC MARIN Pro-Coral Phyton. ЧСС моллюсков регистрировали при плавном повышении температуры воды (0.5 °С/час) в интервале от 5 до 20 °С в течение 24 часов, а также у нескольких групп моллюсков при постоянной температуре (5, 7, 10, 15, 20, 25 °С).

Рис. 1. Моллюски в аквариуме с прикрепленными датчиками и оптическими волокнами
Fig. 1. Mussel in an aquarium with attached sensors and optical fibers
Традиционные методы исследований
Фотоэлектрический метод измерения частоты сердечных сокращений (ЧСС) ракообразных и моллюсков, предложенный М. Деплиджем, основан на использовании инфракрасного излучения фотодиода для измерений движения сердечной мышцы макробентосных животных (Depledge, Andersen, 1990). Для этого используется оптический сенсор CNY70, совмещающий источник и приемник оптического излучения, который необходимо тщательно герметизировать и приклеить на поверхность раковины в районе расположения сердца. При этом его оригинальный размер (7 х 7 мм) становится около 10 мм в диаметре, что может вызывать у животных небольшого размера состояние стресса, связанное с ограничением их подвижности в результате наличия на их раковине значительного по массе и габаритам инородного тела.
Оригинальные методы исследований
В 1999 году С. В. Холодкевичем для неинвазивного измерения сердечного ритма макробентосных беспозвоночных животных с жестким наружным покровом с целью оценки состояния водных экосистем был предложен оригинальный волоконно-оптический метод (Холодкевич и др., 1999; 2007; Kholodkevich et al., 2008; 2013; Федотов и др., 2000). Принципиальное отличие этого метода заключается в использовании оптического волокна для приема/передачи отраженного от сердца сигнала полупроводникового лазера мощностью 3–10 мВт и оригинального программного обеспечения VarPulse. Использование тонкого оптического волокна позволило минимизировать размер сенсора, приклеиваемого на створку раковины, до 3 мм и вес менее 1 г, что позволяет проводить длительные непрерывные наблюдения кардиоактивности моллюсков с минимальным размером 4–5 мм. Кроме того, такой датчик, в отличие от оптического сенсора, используемого в системе М. Деплиджа, не требует его герметизации. Вся электронная часть: источник, приемник и усилитель оптического излучения, – располагается в едином малогабаритном корпусе на лабораторном столе, а сигналы из воды на сушу передаются по оптическому волокну. При этом длина волоконно-оптического кабеля может составлять многие сотни метров без существенной потери качества передаваемого сигнала о ритме сердечных сокращений.
Результаты апробации метода. ЧСС пресноводных моллюсков в ходе наших экспериментов изменялась от 5 до 45 уд./мин. Средняя ЧСС U. pictorum составляла 12 ± 3 и 31 ± 7 уд./мин, A. anatina – 8 ± 2 и 22 ± 5 уд./мин при температуре воды 16 °С и 26 °С соответственно. Средняя ЧСС дрейссены была 15 ± 1 уд./мин при 20 °С. Наблюдалась положительная логарифмическая зависимость кардиоактивности моллюсков от температуры воды (рис. 2).
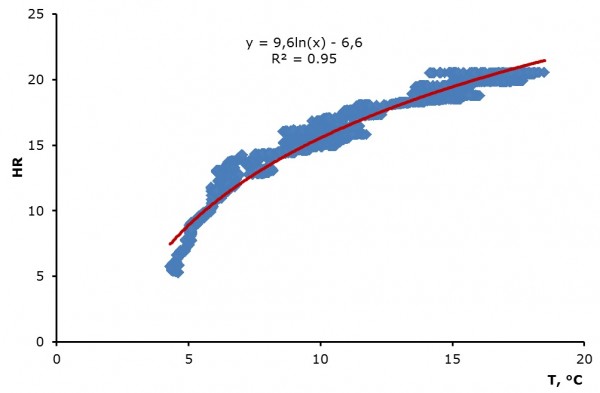
Рис. 2. Зависимость ЧСС беззубки от температуры воды в диапазоне от 5 до 20 °С
Fig. 2. Mussel heart rate dependence on the water temperature in the range 5 to 20 °C
Непрерывный анализ ЧСС моллюсков в течение 10 суток не выявил каких-либо достоверно проявляющихся биоритмов: циркадианных или ультрадианных. У исследуемых моллюсков отсутствовали достоверные изменения ЧСС при изменении освещенности и уровня воды в аквариуме.
Дрейссена реагировала снижением ЧСС при постукивании по стенке аквариума. Кроме того, у нее, в отличие от унионид, наблюдался ярко выраженный «теневой рефлекс» – кратковременное закрывание створок при резком снижении интенсивности света.
Было обнаружено снижение средней ЧСС моллюсков в среднем на 24 % после продолжительного (> 1 месяца) содержания в аквариуме.
При осушении в течение 1 часа на воздухе ЧСС моллюсков снижается, но после возвращения их в воду быстро (в течение 1–5 мин) восстанавливается. Униониды (перловицы и беззубки), в отличие от дрейссен, находясь вне водной среды, закрывают свои створки не плотно, иногда полностью открывают.
Для моллюсков наблюдалась достоверная зависимость ЧСС от размеров раковины (рис. 3): с увеличением размеров и, соответственно, возраста моллюска снижается ЧСС. У крупных (> 10 см) унионид иногда наблюдалась аритмия и замедление сердцебиения на несколько минут.
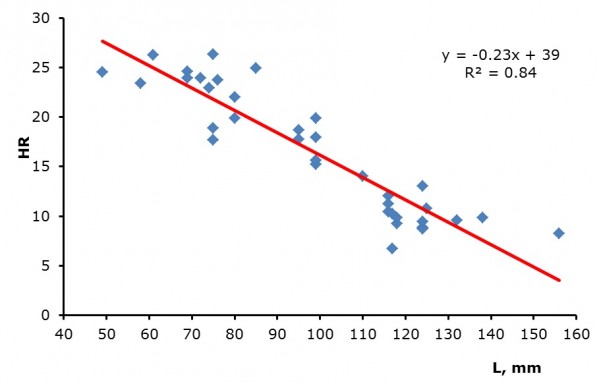
Рис. 3. Зависимость ЧСС беззубки от длины раковины (Т 23 ºС)
Fig. 3. Heart rate dependence on the length of Anodonta
Изменение химического состава воды может по-разному отражаться на ЧСС пресноводных моллюсков. Например, быстрое (1–2 мин) повышение содержания соли NaCl в воде до 3 г/л сопровождалось повышением ЧСС (тахикардия) моллюсков, а более высокие концентрации (5–8 г/л) всегда приводили к снижению ЧСС (брадикардия). При температуре воды 20 ºС достоверное изменение ЧСС на 40 ± 5 % наблюдалось через 1–2 мин. Низкая температура воды приводила к существенному понижению чувствительность моллюсков к изменению ее солености. Так, при температурах ниже 7 ºС достоверные изменения ЧСС после повышения концентрации NaCl до 3–8 г/л не наблюдались.
Обсуждение
Повышение сердечного ритма свидетельствует об увеличении энергетических затрат организма и усилении физиологической активности. Снижение ЧСС происходит при уменьшении физиологической активности и переходе на стратегию экономии энергии. Оценка сердечного ритма пресноводных двустворчатых моллюсков относительно нормы должна происходить с учетом возраста моллюсков, температуры окружающей среды и физиологического состояния моллюсков.
Температурный фактор оказывает большое влияние на процессы жизнедеятельности моллюсков и ЧСС соответственно (см. рис. 2). Температурный интервал, в котором пресноводные двустворчатые моллюски могут нормально функционировать, составляет 4–25 °С. Для моллюсков семейства Unionidae оптимальная температура воды 18–20 °С (Шкорбатов, Старобогатов, 1990). При этом наблюдается значительное потребление кислорода, которое достигает 23 мл О2/кг в час. В то время как при 10 °С потребление кислорода этими же животными может составлять всего 2 мл О2/кг в час, а при 0,5 °С почти прекращается (Константинов, 1986). Морские двустворчатые моллюски могут активно функционировать при температурах 0 °С (Braby, Somero, 2006) и даже 1.5 °С ниже нуля (Bakhmet, Zdorovenov, 2010).
Снижение ЧСС при длительном содержании в лабораторных условиях, возможно, связано с их недостаточным питанием. Подобный эффект отмечали ранее на морских двустворчатых моллюсках (Сlausen, Riisgard, 1996; Бахмет и др., 2005).
Известно, что у моллюсков, как и у большинства видов животных, уровень интенсивности дыхания снижается по мере старения, увеличения размеров раковин и массы мягких тканей (Зотин, Владимирова, 2001). Нашими исследованиями показано, что средние значения ЧСС моллюсков снижаются (см. рис. 3) в зависимости от увеличения длины раковины. Крупные моллюски семейства Unionidae размером больше 100 мм редко встречаются в природных условиях, несмотря на довольно широкое распространение этих видов (Шкорбатов, Старобогатов, 1990). Кроме того, крупные животные требуют много места в экспериментальных аквариумах, и их сердечный ритм плохо поддается анализу из-за часто наблюдаемой аритмии. Основываясь на нашем опыте, изучение динамики ЧСС унионид удобнее проводить на экземплярах длиной до 60–80 мм.
Повышение концентрации NaCl в воде приводит к снижению осмотического градиента между организмом моллюсков и средой, что сопровождается ухудшением условий диффузии воды в организм. При приближении концентрации натрия в воде к таковой гемолимфы пресноводные моллюски начинают повышать соленость внутренней среды (Мартемьянов, 2011), что сопровождается повышением энергетического обмена и ЧСС. Повышение концентрации натрия в гемолимфе моллюсков происходит в пределах физиологических особенностей конкретного вида. Превышение этого предела создает токсичные условия и приводит к защитно-оборонительной реакции моллюска, его изоляции от окружающей среды путем плотного закрывания створок и переходу на анаэробный обмен, что сопровождается снижением ЧСС.
Заключение или выводы
Использование неинвазивного волоконно-оптического метода измерения ЧСС позволяет оценивать в реальном времени функциональное состояние моллюсков размером от 1 см и более и может использоваться в целях мониторинга в системах раннего биологического предупреждения. Кроме того, данный метод может дополнять существующие подходы к биоиндикации качества поверхностных и сточных вод как среды обитания гидробионтов.
ЧСС моллюсков зависит от их физиологической активности и потребления кислорода. Основываясь на проведенных экспериментальных исследованиях ЧСС, можно рекомендовать проводить лабораторное тестирование ответных реакций кардиосистемы рассмотренных видов моллюсков на стрессорные факторы различной природы при температуре воды около 20 ºС. При этом средняя ЧСС беззубки A. anatina составляет 14 ± 1 уд./мин, перловицы U. pictorum – 13 ± 2 уд./мин. У дрейссены D. polymorpha при 20 ºС ЧСС составляет 15 ± 1 уд./мин.
Библиография
Бахмет И. Н., Бергер В. Я., Халаман В. В. Сердечный ритм у мидии Mytilus edulis (Bivalvia) при изменении солености . Биология моря. 2005. №31(5). С. 363–366.
Зотин А. А., Владимирова И. Г. Интенсивность дыхания и видовая продолжительность жизни пресноводных двустворчатых моллюсков семейств Margaritiferidae и Unionidae // Известия РАН. Серия биологическая. 2001. № 3. С. 331–338.
Константинов А. С. Общая гидробиология . М.: Высш. шк., 1986. 472 с.
Мартемьянов В. И. Влияние минерального состава внешней среды на показатели водно-солевого обмена вселившейся в Рыбинское водохранилище дрейссены Dreissena polymorpha Pallas // Российский журнал биологических инвазий. 2011. Т. 4. № 2. С. 120–134.
Федотов В. П., Холодкевич С. В., Строчило А. Г. Изучение сократительной активности сердца раков с помощью нового неинвазивного метода // Журнал эволюционной биохимии и физиологии. 2000. Т. 36, № 3. С. 219–222.
Холодкевич С. В., Шумилова Т. Е., Федотов В. П., Сладкова С. В. Экспресс-метод оценки функционального состояния речных раков как инструмент тестирования устойчивости экосистем малых водоемов // Труды IV Всероссийской научно-практической конференции с международным участием «Новое в экологии и безопасности жизнедеятельности» 16–18 июня 1999 года. СПб., 1999. Т. 3. С. 451.
Холодкевич С. В., Иванов А. В., Корниенко Е. Л., Куракин А. С. Способ биологического мониторинга окружающей среды (варианты) и система для его осуществления // Бюл. изобр. 2007. № 29. Патент РФ № 2308720 C1, МПК G01N 33/18 (2006.01); G01N 21/17 (2006.01).
Шкорбатов Г. Л., Старобогатов Я. И. Методы изучения двустворчатых моллюсков // Труды Зоологического института АН СССР. Т. 219. Л., 1990. 208 с.
Bakhmet I. N., Zdorovenov P. E. Variability in cardiac activity of the bivalves Mytilus edulis and Modiolus modiolus // Russian Journal of Marine Biology. 2010. Vol. 36, № 3. P. 223–225.
Braby C. E., Somero G. N. Following the heart: temperature and salinity effects on heart rate in native and invasive species of blue mussels (genus Mytilus) // J. Exp. Biol. 2006. Vol. 20. Р. 2554–2566.
Burnett N. P., Seabra R., Pirro M., Wethey D. S., Woodin S. A., Helmuth B., Zippay M. L., Sarà G., Monaco C., Lima F. P. An improved noninvasive method for measuring heartbeat of intertidal animals // Limnol. Oceanogr. Methods. 2013. № 11. P. 91–100.
Clausen I., Riisgard H. U. Growth, filtration and respiration in the mussel Mytilus edulis: no evidence for physiological regulation of the filter-pump to nutritional needs // Mar. Ecol. Progr. Ser. 1996. Vol. 141. P. 37–45.
Depledge M. H., Andersen B. B. A computer-aided physiological monitoring system for continuous, long-term recording of cardiac activity in selected invertebrates // Comp. Biochem. Physiol. 1990. Vol. 96. Р. 474–477.
Depledge M. H., Lundebye A. K., Curtis T., Aagaard A., Andersen B. B. Automated interpulse-duration assessment (AIDA): a new technique for detecting disturbances in cardiac activity in selected invertebrates // Mar. Biol. 1996. Vol. 126, № 2. P. 313–319.
Kholodkevich S. V., Ivanov A. V., Kurakin A. S., Kornienko E. L., Fedotov V. P. Real time biomonitoring of surface water toxicity level at water supply stations // Journal of Environmental Bioindicators. 2008. Vol. 3, № 1. P. 23–34.
Kholodkevich S. V., Ivanov A. V., Kornienko E. L., Kurakin A. S. Method of biological environment monitoring (versions) and a system for realization thereof. 05.14.2013. US Patent NO. 8442809.
Burnett N. P. , Seabra R. , de Pirro M., Wethey D. S., Woodin S. A., Helmuth B., Zippay M. L. , Sarà G. , Monaco C., Lima F. P. An improved noninvasive method for measuring heartbeat of intertidal animals. // Limnol. Oceanogr. Methods. 2013. Vol. 11. P. 91-100.
Благодарности
Работа была выполнена с использованием оборудования Ресурсного центра «Обсерватория экологической безопасности» Научного парка СПбГУ.






 © 2011 - 2026
© 2011 - 2026