Введение
Экологические исследования, затрагивающие изменения морфологии личинок хирономид, чаще всего освещают деформацию органов под влиянием токсических веществ (Arambourou et al., 2012; Grebenjuk, Tomilina, 2014; Montaño-Campaz et al., 2019) или сосредотачиваются на экологических признаках (так называемые «Эльтонианские признаки» – Eltonian traits) и проводятся на надвидовом уровне (Serra et al., 2017; Rossaro et al., 2022; Kamburska et al., 2023). Эти исследования выявляют важные экосистемные характеристики сообществ хирономид в целом, оставляя в стороне популяционные сдвиги морфологических признаков у видов, переживающих изменения внешних факторов. Тем не менее морфометрические исследования личинок комаров-звонцов на уровне вида также проводились, однако значимые исследования относятся лишь к 80-м гг. XX в. Одна из немногочисленных примечательных работ принадлежит Атчли и Хилбурну (Atchley, Hilburn, 1979), в которой была выявлена достоверная взаимосвязь между такими признаками личинок, как ширина лба, длина и ширина первого сегмента антенн, и такими характеристиками среды, как широта, долгота, количество органики и pH.
Поскольку на размеры личинок из разных районов может влиять сложный комплекс факторов и межпопуляционные различия, эффект определенных условий наиболее легко отследить в пределах одного водоема. В данном случае для морфометрических исследований был выбран вид Einfeldia pagana (Meigen, 1838), обитающий в оз. Комсомольском г. Казани на различных глубинах. Данный вид хорошо идентифицируется на стадии личинки и может служить модельным объектом для определения морфометрических различий в разных экологических условиях. E. pagana – бивольтинный вид, в условиях недостатка кислорода – унивольтинный (Learner, Potter, 1974), вылет происходит в середине июля и конце августа (Демина и др., 2013). Вид характерен для стоячих и медленно текучих водоемов, толерантен к небольшой солености, пелофил, фитодетритофаг, фильтратор-грунтоед-собиратель (Wiederholm, 1983; Moubayed, Langton, 2025).
Цель исследования – выявить наличие и характер морфометрических различий между выборками личинок E. pagana из двух разных биотопов одного озера с различной глубиной (2 и 4 м) и, как следствие, различными условиями обитания. Поставленные задачи: 1) выявить наиболее подходящие для морфометрических исследований признаки личинок хирономид; 2) оценить морфометрические различия между двумя выборками и их достоверность.
Согласно общей теории стресса (Sibly, Calow, 1989), в стрессовых условиях организм тратит дополнительные ресурсы для поддержания биохимического равновесия, вследствие чего на постройку тела расходуется меньшее количество ресурсов и организм вырастает, имея меньшие размеры. В связи с этим сформулирована нулевая гипотеза: в биотопах на разных глубинах личинки не будут отличаться по размерам органов и уровню стресса.
Материалы
Озеро Комсомольское (N55.8573, E49.2271), расположенное в микрорайоне Дербышки г. Казани, имеет искусственное происхождение (1950 г.), площадь зеркала 1.76 га, длина около 340 м, максимальная ширина 85 м, глубина достигает 4.5 м. По химическому составу вода относится к сульфатно-кальциевому классу с высоким уровнем минерализации 0.88–0.95 г/дм3 и жесткостью 15–20 °Ж (Токинова и др., 2019), что создает условия, благоприятные для обитания личинок E. pagana.
Пробы были отобраны дночерпателем Петерсена (два черпания на пробу) на двух станциях:
1) Глубина 2–2.5 м. 24.10.2019. Грунт: глинистый ил, на дне присутствуют редкие харовые водоросли. Количество растворенного кислорода: 6.8 ± 0.7 мг/дм3, химическое потребление кислорода: 6.9 ± 2.1 мг/дм3, 1 проба;
2) Глубина 4 м. 16.10.2020. Грунт: глинисто-песчаный ил, макрофитов нет. Количество растворенного кислорода: 4.9 ± 0.2 мг/дм3, химическое потребление кислорода: 11.8 ± 2.8 мг/дм3, 1 проба.
Методы
После отбора, в 2019 и 2020 гг., пробы были зафиксированы в 70 % спирте. В январе 2025 г. из проб были отобраны и промерены по 35 экземпляров личинок 4-го возраста, всего 70 личинок.
Возраст личинок определялся исходя из данных о размерах личинок 4-го возраста (McCauley, 1974; Wiederholm, 1983) и экстраполирования описанных закономерностей возрастных изменений личинок комаров-звонцов с учетом длины личинки, ширины головной капсулы и индекса усика (Панкратова, 1977). В пробах также присутствовали личинки более ранних (2–3-го) возрастов, позволявшие удостовериться в правильности определения возраста.
Промеры (табл. 1, рис. 1) проводились по двум группам параметров: относящиеся к головной капсуле и относящиеся к сегментам тела, так как для насекомых характерны более стабильные размеры у сильно хитинизированных частей тела, которые изменяются только после линьки, в то время как слабее хитинизированные части тела могут изменяться и между линьками под влиянием внешних факторов, в частности, для анальных жабр отмечены различия в росте в условиях различного уровня солености (Clarke, 1957; Nguyen, Donini, 2010). Терминология по Панкратовой (1977) и Кикнадзе с соавторами (1991).
Таблица 1. Перечень использованных в работе промеров личинок E. pagana
| Голова | Длина* и ширина* |
| Ментум | Длина срединного зуба, ширина срединного зуба, длина первого бокового зуба, длина второго бокового зуба |
| Вентроментальные пластинки | Высота, ширина |
| Мандибулы | Длина, ширина, длина апикального зуба, ширина внутренних зубов |
| Ротовые органы | Длина щупика максиллы, расстояние между щетинками SII (как аппроксимация ширины клипеуса)* |
| Антенны | Длина жгутика (2–5-й членики), длина сенсиллы, длина лаутерборновых органов**, диаметр кольцевого органа |
| Тело | Длина* |
| Задняя часть тела | Длина задних подталкивателей, длина и ширина вентральных отростков, длина и ширина первых анальных жабр, длина и ширина вторых анальных жабр. |
Примечание. * – признак, не являющийся билатеральным, ** – билатеральный орган на каждой антенне: 4 промера на личинку.
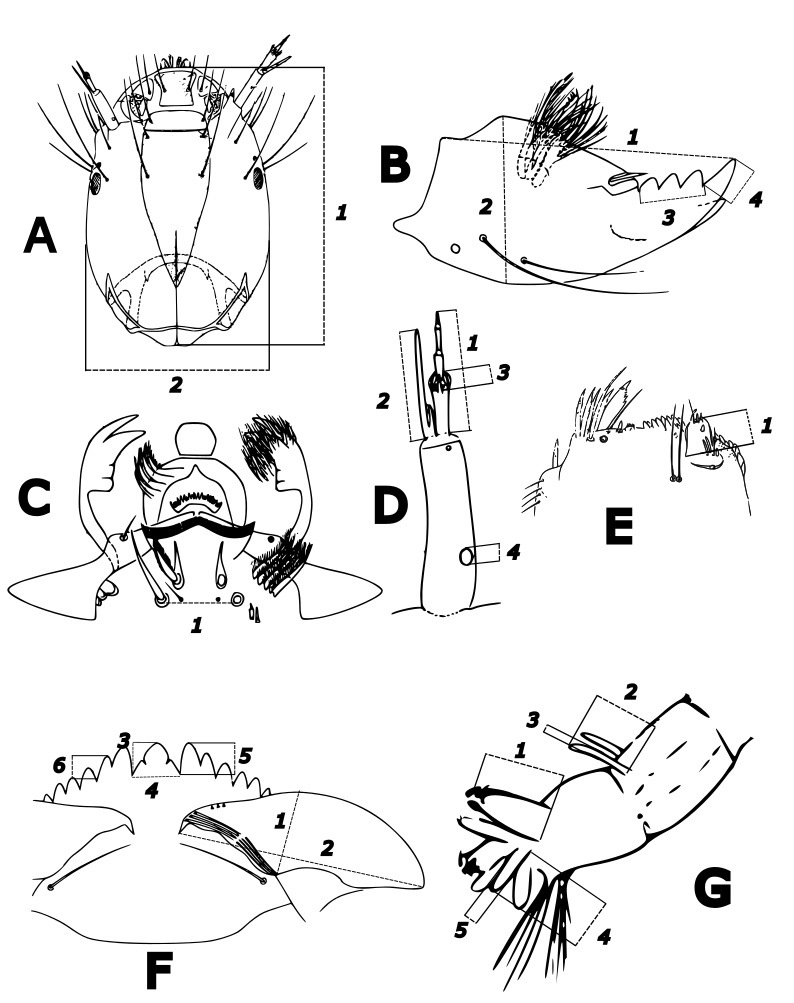
Рис. 1. Схематическая иллюстрация промеров органов личинок комаров-звонцов (рис. по: Wiederholm, 1983). A. Головная капсула. 1 – длина, 2 – ширина. B. Мандибула. 1 – длина, 2 – ширина, 3 – ширина внутренних зубов мандибулы, 4 – длина апикального зуба. C. Верхняя губа. 1 – расстояние между щетинками SII. D. Антенна. 1 – длина жгутика (2–5 членик), 2 – длина сенсиллы, 3 – длина лаутерборновых органов, 4 – диаметр кольцевого органа. E. Максилла. 1 – длина щупика максиллы. F. Ментум. 1 – высота вентроментальной пластинки, 2 – ширина вентроментальной пластинки, 3 – длина срединного зуба, 4 – ширина срединного зуба, 5 – длина первого бокового зуба, 6 – длина второго бокового зуба. G. Задняя часть тела личинки. 1 – длина задних подталкивателей, 2 – длина вентральных отростков, 3 – ширина (диаметр) вентральных отростков, 4 – длина анальных жабр, 5 – ширина (диаметр) анальных жабр
Fig. 1. Scematic illustration of organ measurements of larvae Chironomidae (based on Wiederholm, 1983). A. The head Capsule : 1 – length, 2 – width. B. Mandible : 1 – length, 2 – width, 3 – the width of the internal teeth of the mandible, 4 – the length of the apical tooth. C. Labrum : 1 – the distance between SII setae. D. Antenna : 1 – the length of the flagellum (segments 2–5), 2 – the length of the sensilla, 3 – the length of the Lauterborn organs, 4 – the diameter of the ring organ. E. Maxilla : 1 – the length of the maxillary palp . F. Mentum : 1 – the height of the ventromental plate, 2 – the width of the ventromental plate, 3 – the length of the median tooth, 4 – the width of the median tooth, 5 – the length of the first lateral tooth, 6 – the length of the second lateral tooth. G. Posterior Larval Body : 1 – the length of the posterior parapods, 2 – the length of the ventral processes, 3 – the width (diameter) of the ventral processes, 4 – the length of the anal gills, 5 – the width (diameter) of the anal gills
Суммарно измерялось 18 признаков головной капсулы, промеров – 33; задней части тела: 8 признаков, промеров – 14. Также были вычислены производные признаки: площадь и объем вентральных отростков, площадь и объем анальных жабр, квадратные и кубические корни из этих значений соответственно, а также суммы корней из объемов или площадей органов по отдельности. Поскольку целью работы не было вычислить абсолютные значения размеров, степени искажения в размерах органов в результате фиксации и приготовления препаратов принимались одинаковыми для всех экземпляров и игнорировались в расчетах.
Промеры проводились под бинокуляром и на временных глицериновых препаратах, накрытых покровным стеклом, под световым микроскопом с помощью окуляр-микрометра. Головные капсулы выдерживались в 10 % растворе едкого калия (KOH) для осветления.
Проводились измерения высоты ментума, длины и ширины передних подталкивателей, но полученные значения имели слишком большой разброс в связи с особенностями формы и расположения этих органов, поэтому они не участвовали в анализе.
Для проверки нормальности распределения проводился тест Шапиро – Уилка. Для проверки гомогенности дисперсий сравниваемых выборок использовался тест Левена. В случае нормального распределения и равенства дисперсий для оценки достоверности отличий использовался стандартный критерий Стьюдента, при неравенстве дисперсий – критерий Стьюдента с поправкой Уэлча. В случае отклонения от нормального распределения для оценки достоверности отличий между выборками использовались U-критерий Манна – Уитни – Уилкоксона и бутстрэп-анализ (1000 итераций). В связи с тем, что размер выборки небольшой, допустимый p-level для оценки достоверности различий принят < 0.01. Для определения достоверности суммарных различий между морфометрическими признаками личинок использовался однофакторный многомерный дисперсионный анализ (MANOVA), для оценки направления различий – апостериорный тест Тьюки. Для нормализации данных перед дисперсионным анализом была применена z-стандартизация, при которой математическое ожидание переменной приравнивается к 0, а каждое значение выражается в единицах стандартных отклонений от среднего (Мелник, 1983).
Вычисления производились в среде программирования R (R Core Team, 2025) с использованием библиотек «car» (Fox, Weisberg, 2019), «boot» (Canty, Ripley, 2022), «tidyverse» (Wickham et al., 2019), «emmeans» (Lenth, 2025).
Флуктуирующая асимметрия (ФА) билатеральных признаков и коэффициент вариации использовались для оценки уровня стресса организмов в популяции (напр.: Алиева и др., 2013; Ахметкиреева и др., 2014). Флуктуирующая асимметрия вычислялась по формуле ФА = ∑ |l – r| / n, где l и r – величина значения левого и правого признаков соответственно, n – количество особей (Захаров, 1987). Коэффициент вариации (CV) вычислялся по формуле µ / σ · 100 %, где µ – среднее арифметическое, σ – стандартное отклонение.
Для вычислений использовались следующие признаки: ширина и высота вентроментальных пластинок, длина и ширина мандибул, ширина внутренних зубов мандибул. Данные признаки были выбраны потому, что они билатерально-симметричные, достаточно крупные для фиксации тонкой вариабельности и слабо подвержены прижизненному деформирующему и модифицирующему влиянию среды вроде стачивания зубов ментума.
Результаты
Средние значения, стандартное отклонение и коэффициент вариации признаков приведены в табл. 2. Коэффициент вариации (CV) большинства признаков находится в пределах 4–12 %. Наибольшая вариабельность наблюдается у лаутерборновых органов (CV до 20.48 %), кольцевого органа (CV до 13.6 %), вентральных отростков (CV до 19.43 %).
Таблица 2. Основные параметры исследованных признаков личинок E. pagana
| Признак (сокращения) | 2 м | 4 м | |||||
| Среднее (мкм) | σ (мкм) | CV (%) | Среднее (мкм) | σ (мкм) | CV (%) | ||
| Длина тела | 8581.43 ± 122.37 | 723.97 | 8.44 | 8356.94 ± 160.82 | 964.89 | 11.55 | |
| Ширина головы (Hw) | 456.07 ± 3.71 | 21.94 | 4.81 | 436.5 ± 3.46 | 20.47 | 4.69 | |
| Длина головы | 725.86 ± 10.05 | 59.44 | 8.19 | 666.67 ± 7.28 | 43.67 | 6.55 | |
| Ширина вентроментальных пластинок (VPw) | 190.92 ± 0.81 | 6.76 | 3.54 | 183.8 ± 1.84 | 15.28 | 8.31 | |
| Высота вентроментальных пластинок | 80.71 ± 0.43 | 3.6 | 4.46 | 80.16 ± 0.57 | 4.75 | 5.92 | |
| Длина срединного зуба ментума | 25.34 ± 0.36 | 2.12 | 8.36 | 25.13 ± 0.43 | 2.58 | 10.26 | |
| Ширина срединного зуба ментума | 38.52 ± 0.44 | 2.63 | 6.83 | 38.51 ± 0.47 | 2.84 | 7.37 | |
| Длина первого бокового зуба ментума | 24.46 ± 0.3 | 2.5 | 10.2 | 24.22 ± 0.31 | 2.64 | 10.89 | |
| Длина второго бокового зуба ментума | 19.55 ± 0.27 | 2.23 | 11.39 | 20.01 ± 0.21 | 1.75 | 8.77 | |
| Длина щупика максиллы (MP) | 38.35 ± 0.33 | 2.79 | 7.28 | 36.71 ± 0.44 | 3.71 | 10.09 | |
| Длина мандибулы (Ml) | 225.15 ± 1.32 | 10.86 | 4.82 | 213.82 ± 2.27 | 18.61 | 8.7 | |
| Ширина мандибулы | 93.31 ± 1.1 | 8.84 | 9.47 | 96.01 ± 1.39 | 10.91 | 11.36 | |
| Длина апикального зуба мандибулы (AT) | 33 ± 0.38 | 2.84 | 8.62 | 30.95 ± 0.32 | 2.46 | 7.95 | |
| Ширина внутрених зубов мандибулы | 42.57 ± 0.37 | 3.08 | 7.24 | 41.68 ± 0.41 | 3.19 | 7.64 | |
| Расстояние между щетинками SII | 61.36 ± 0.78 | 4.59 | 7.48 | 60.74 ± 0.62 | 3.74 | 6.16 | |
| Длина жгутика антенны: 2–5-й членики (AF) | 76.64 ± 0.5 | 3.95 | 5.16 | 73.52 ± 0.7 | 5.49 | 7.47 | |
| Длина сенсиллы | 66.73 ± 0.59 | 4.59 | 6.87 | 65.29 ± 0.74 | 5.32 | 8.15 | |
| Длина лаутерборновых органов (LO) | 8.98 ± 0.14 | 1.49 | 16.6 | 7.92 ± 0.14 | 1.62 | 20.48 | |
| Диаметр кольцевого органа | 10.01 ± 0.19 | 1.36 | 13.6 | 10.65 ± 0.14 | 1 | 9.39 | |
| Длина задних подталкивателей (PPl) | 365.59 ± 5.03 | 41.44 | 11.34 | 390.98 ± 7.34 | 58.22 | 14.89 | |
| Длина вентральных отростков | 727.39 ± 11.77 | 97.73 | 13.44 | 703.81 ± 16.34 | 136.75 | 19.43 | |
| Ширина вентральных отростков | 83.12 ± 1.76 | 14.63 | 17.6 | 87.4 ± 1.9 | 15.56 | 17.81 | |
| Длина первых анальных жабр | 290.03 ± 4.92 | 39.98 | 13.79 | 281.89 ± 4.4 | 36.8 | 13.06 | |
| Длина вторых анальных жабр (2AGl) | 272.4 ± 3.78 | 31.16 | 11.44 | 232.82 ± 4.15 | 30.76 | 13.21 | |
| Ширина первых анальных жабр (1AGw) | 89 ± 2.57 | 21.18 | 23.8 | 80.93 ± 1.41 | 11.78 | 14.56 | |
| Ширина вторых анальных жабр (2AGw) | 100.01 ± 1.87 | 15.45 | 15.45 | 87.95 ± 1.49 | 11.72 | 13.33 | |
Примечание. σ – стандартное отклонение, CV – коэффициент вариации.
У личинок выявлено 12 признаков с достоверными отличиями (рис. 2, 3). Для промеров головной капсулы все достоверно отличающиеся признаки больше у личинок на глубине 2 м. Для промеров задней части тела задние подталкиватели длиннее у личинок на глубине 4 м, а анальные жабры – на глубине 2 м. Ширина вентральных отростков имела большие значения у личинок на глубине 4 м, однако с уровнем достоверности только 0.05 для бутстрэп-анализа и 0.157 для U-теста.
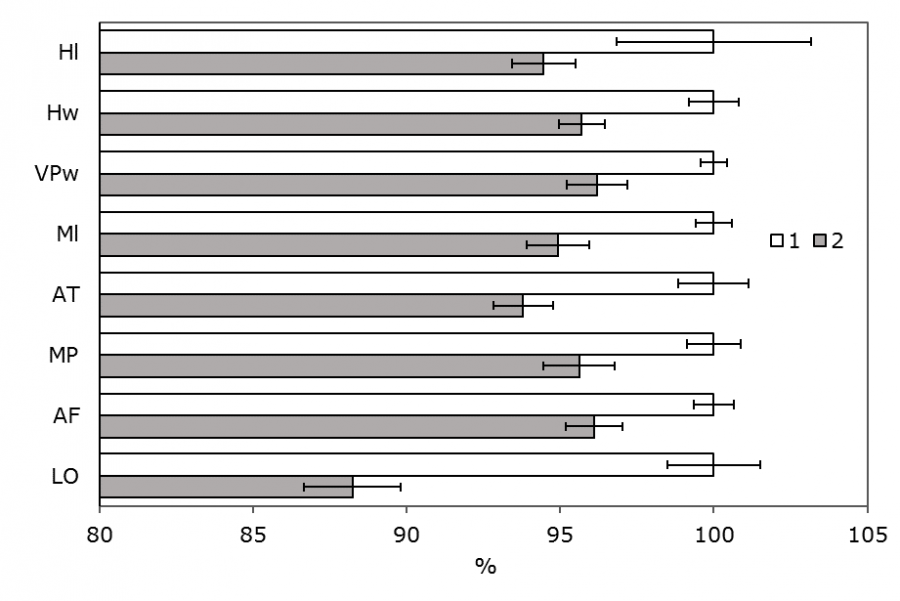
Рис. 2. Сравнение размеров органов головной капсулы личинок E. pagana на глубине 2 и 4 м (% от размера измеряемого органа у личинки с глубины 2 м, p < 0.01) и ошибка среднего значения: 1 – глубина 2 м, 2 – глубина 4 м. Hl – длина головы; Hw – ширина головы; VPw – ширина вентроментальной пластинки; Ml – длина мандибулы; AT – длина апикального зуба мандибулы; MP – длина щупика максиллы; AF – длина жгутика антенны; LO – длина лаутерборнового органа
Fig. 2. Comparison of the sizes of the organs of the head capsule of larvae E. pagana at a depth of 2 and 4 m (% of the size of the measured organ in larvae at a depth of 2 m, p < 0.01) and average value error : 1 is a depth of 2 m, 2 is a depth of 4 m. Hl - the length of the head; Hw - the width of the head; VPw - the width of the ventromental plate; Ml - the length of the -mandible; AT - the length of the apical tooth of the mandible; MP - the length of the maxilla tentacle; AF - the length of the antenna flagellum; LO - the length of the Lauterborn organ.
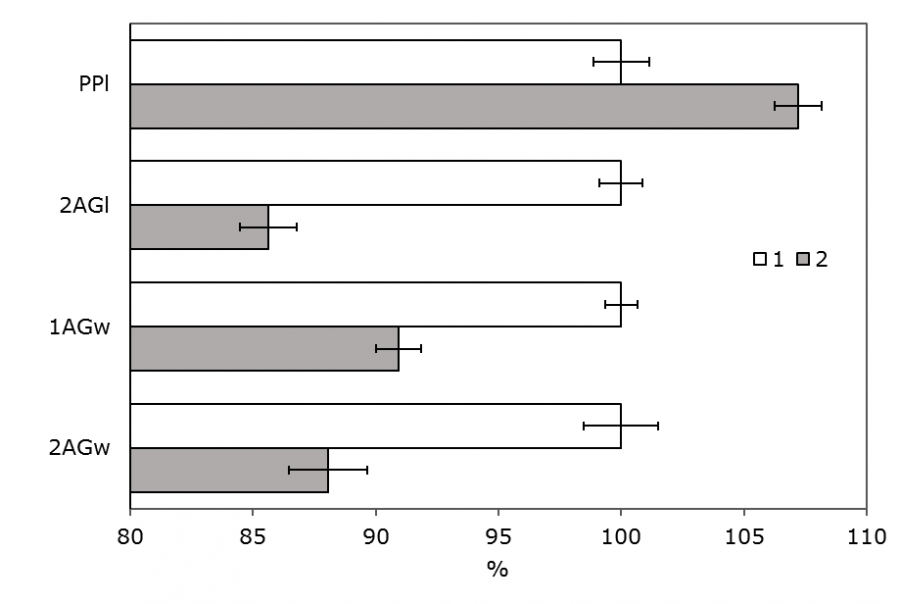
Рис. 3. Сравнение размеров органов задней части тела личинок E. pagana на глубине 2 и 4 м (% от размера измеряемого органа у личинки с глубины 2 м, p < 0.01) и ошибка среднего значения: 1 – глубина 2 м, 2 – глубина 4 м. PPl – длина заднего подталкивателя; 2AGl – длина вторых анальных жабр; 1AGw – ширина первых анальных жабр; 2AGw – ширина вторых анальных жабр
Fig. 3. Comparison of the sizes of the organs of the posterior part of the body of E. pagana larvae at a depth of 2 and 4 m (% of the size of the measured organ in the larva from a depth of 2 m, p < 0.01) and the error of the average value: 1 – a depth of 2 m, 2 – a depth of 4 m. PPl – the length of the posterior pusher; 2AGl –the length of the second anal gills; 1AGw – the width of the first anal gills; 2AGw – the width of the second anal gills.
Для суммарной оценки достоверности различий между двумя выборками был проведен однофакторный многомерный дисперсионный анализ (MANOVA) нормально распределенных признаков по фактору «глубина». В дисперсионном анализе использовались следующие признаки: длина личинки, длина головы, ширина срединного зуба ментума, длина сенсиллы и кубический корень из суммарного объема вентральных отростков и анальных жабр как нормально распределенный интегральный признак, характеризующий размеры дыхательных органов. Коэффициенты корреляции признаков не превышали 0.57. Результаты MANOVA и апостериорного теста Тьюки по z-стандартизованным данным представлены в табл. 3.
Таблица 3. Результаты однофакторного многомерного дисперсионного анализа и апостериорного теста Тьюки по фактору «глубина»
| Однофакторный многомерный дисперсионный анализ (MANOVA) | |||
| Тест Пиллаи (Pillai's Trace) | F-статистика | Уровень значимости p | Уровень значимости (p) теста Шапиро – Уилка для остатков |
| 0.22 | 3.20 | 0.013 | 0.65 |
| Апостериорный Тест Тьюки для MANOVA | |||
| Оценка (estimate) | Стандартная ошибка (SE) | t-статистика | Уровень значимости p |
| 0.377 | 0.136 | 2.777 | 0.007 |
Дисперсионный анализ показал достоверные морфометрические различия между двумя выборками. Согласно тесту Тьюки, разница между группами составляет 0.3 стандартных отклонения в нормализованном пространстве с более высокими значениями в выборке с глубины 2 м. Этот эффект можно классифицировать как умеренный по величине (Gallardo‐Gómez, 2024).
Наибольшие значения коэффициентов вариации и флуктуирующей асимметрии у органов, выбранных для оценки стресса, принадлежат ширине мандибул у личинок с 4 м: 11.36 % и 0.039 соответственно. Кроме ширины мандибул, значения CV и ФА находятся в пределах небольших значений (2.9–7.24 для CV и 0.01–0.023 для ФА) и варьируют слабо, однако во всех случаях большие значения относятся к личинкам с глубины 4 м.
Обсуждение
Сравнение морфометрических признаков личинок E. pagana из двух биотопов с разными глубинами показало достоверные отличия по 12 признакам из 26. Признаки имеют меньшие значения на глубине 4 м за исключением задних подталкивателей. Ширина вентроментальных пластинок, по-видимому, отражает ширину головной капсулы. Дисперсионный анализ, даже с использованием признаков, не имевших достоверных различий, выявил умеренное значимое влияние фактора на размеры личинок.
Функционально отличающиеся органы головной капсулы связаны в первую очередь с размерами мандибул и лаутербороновых органов, что могло бы говорить о проявлении небольших различий в способе питания и ориентации в пространстве, дающих небольшие преимущества в соответствующих биотопах: на фоне меньших размеров головной капсулы и антенн на 4 м такие органы, как ментум, сенсилла и кольцевой орган, оказываются относительно крупнее, а различия только в ширине вентроментальных пластинок можно трактовать как небольшую разницу в форме: на меньшей глубине они несколько более вытянуты в ширину.
Известно (Nguyen, Donini, 2010; Kefford et al., 2011; Hildebrandt et al., 2018), что анальные жабры хирономид и другие мягкие органы пресноводных беспозвоночных могут менять свой размер под влиянием внешних факторов среды как у сформировавшихся личинок, так и в процессе онтогенеза, показывая различные скорости роста органа. В данном случае уменьшение размеров анальных жабр и увеличение вентральных отростков на большей глубине может объясняться меньшими уровнями кислорода, однако конкретные механизмы изменений требуют дальнейших исследований.
Коэффициент вариации и флуктуирующая асимметрия как индикаторы уровня стресса в целом не показали высоких значений на обоих глубинах, тем не менее значения на глубине 4 м в большинстве случаев несколько выше, особенно для промеров мандибул. Таким образом, нулевая гипотеза о меньших размерах личинок на большей глубине в связи с большим уровнем стресса опровергается, но частично: различия имеются, но не по всем признакам, а влияние стресса слабо. Тем не менее исследованный градиент в 2 м глубины не отражает сильного перепада условий. На основе полученных данных можно предполагать континуальное распределение размерных характеристик организмов в популяциях личинок хирономид в пределах одного водоема внутри вида.
Заключение
Исследование показало, что локальные выборки личинок комаров-звонцов из разных биотопов могут иметь достоверные морфометрические отличия в органах головной капсулы и задней части тела и статистически значимо различаться по комплексу признаков. В данном случае личинки с большей глубины имеют меньшие размеры по следующим признакам: размеры головной капсулы, ширина вентроментальных пластинок, длина мандибул и апикального зуба, длина щупика максиллы, длина жгутика и лаутерборновых органов антенны, размеры анальных жабр. Предположительно, это связано с менее благоприятными условиями обитания, включая меньшее количество кислорода и больший уровень органического загрязнения. Ожидается, что аналогичная закономерность будет отмечена и для других лимно-пелофильных представителей комаров-звонцов.
Данная работа носит исследовательский характер: объект исследования имеет небольшую выборку, а в процессе исследования были выявлены признаки более и менее подходящие для анализа. В частности, такие органы, как ментум, передние подталкиватели, кольцевой орган, менее подходят для сравнения, в то время как размеры головной капсулы, мандибул и дыхательные органы являются более показательными.
Полученные данные могут быть использованы для продолжения исследований E. pagana, а также других лимно-пелофильных видов семейства Chironomidae. Методика может быть экстраполирована для других экологических градиентов и служить основой для биомониторинга по ключевым морфометрическим признакам и более детального анализа ископаемых остатков головных капсул хирономид.
В дальнейшем данный алгоритм будет использован на выборках большего размера и других видах, чтобы осветить закономерности, характерные для семейства в целом. Так, исследование представителей подсемейства Tanypodinae, которые не имеют вентральных отростков и у которых другая форма анальных жабр, может представлять интерес для сравнения.
Библиография
Алиева З. М., Самедова Н. Х., Юсуфов А. Г. Реакция растений на стрессы на начальных этапах онтогенеза // Аридные экосистемы. 2013. Т. 1, № 1. C. 59–66.
Ахметкиреева Т. Т., Беньковская Г. В., Китаев К. А., Долматова И. Ю. Комнатная муха как объект экологической генетики: структура лабораторной популяции и устойчивость к стрессовым воздействиям // Вестник Башкирского государственного аграрного университета. 2014. № 3 (31). С. 34–37.
Демина И. В., Ермохин М. В., Полуконова Н. В. Фенология вылета и соотношение полов в популяциях гетеротопных насекомых пойменных озер долины реки Волги // Известия Саратовского университета. Новая серия. Сер. Химия. Биология. Экология. 2013. Т. 13, вып. 2. С. 89–95.
Захаров В. М. Асимметрия животных (популяционно-феногенетический подход) . М.: Наука, 1987. 216 с.
Кикнадзе И. И., Шилова А. И., Керкис И. Е., Шобанов Н. А., Зеленцов Н. И., Гребенюк Л. П., Истомина А. Г., Прасолов В. А. Кариотипы и морфология личинок хирономид трибы Chironomini: Атлас . Новосибирск: Наука. Сиб. отд-ние, 1991. 114 с.
Мелник М. Основы прикладной статистики . М.: Энергоатомиздат, 1983. 416 с.
Панкратова В. Я. Личинки и куколки комаров подсемейств Podonominae и Tanypodinae фауны СССР (Diptera, Chironomidae Tendipedidae) . Л.: Наука. Ленингр. отд-ние, 1977. 154 с.
Токинова Р. П., Любарский Д. С., Буторова Л. Е. Особенности населения макрофитов и фитофильной фауны в озере Комсомольское (г. Казань) в зимний период // Озера Евразии: проблемы и пути их решения: Материалы II Междунар. конф. / Под ред. Р. Р. Шагидуллина, Н. Н. Филатова, Ш. Р. Позднякова, Д. В. Иванова. Казань: Изд-во АН РТ, 2019. Ч. 2. С. 341–345.
Arambourou H., Beisel J. N., Branchu P., Debat V. Patterns of fluctuating asymmetry and shape variation in Chironomus riparius (Diptera, Chironomidae) exposed to nonylphenol or lead // PloS one. 2012. Vol. 7, No 11. e48844. DOI: 1371/journal.pone.0048844
Atchley W. R., Hilburn L. R. Morphometric variability in larvae of the Antarctic fly, Belgica antarctica (Diptera: Chironomidae) // Canadian Journal of Zoology. 1979. Vol. 57, No 12. P. 2311–2318. DOI: 10.1139/z79-300
URL: https://www.scirp.org/reference/referencespapers?referenceid=3500252
Clarke K. U. On the increase in linear size during growth in Locusta migratoria L. // Proceedings of the Royal Entomological Society of London. 1957. Vol. 32, No 1–3. P. 35–39.
Gallardo‐Gómez D., Richardson R., Dwan K. Standardized mean differences in meta‐analysis: A tutorial // Cochrane Evidence Synthesis and Methods. 2024. Vol. 2, No 3. e12047. DOI: 10.1002/cesm.12047
Fox J., Weisberg S. An R Companion to Applied Regression. Third edition. Sage, Thousand Oaks CA, 2019. URL: https://www.john-fox.ca/Companion/
Grebenjuk L. P., Tomilina I. I. Morphological deformations of hard-chitinized mouthpart structures in larvae of the genus Chironomus (Diptera, Chironomidae) as the index of organic pollution in freshwater ecosystems // Inland water biology. 2014. Vol. 7. 273. DOI: 10.1134/S1995082914030092
Hildebrandt J. P., Wiesenthal A. A., Müller C. Phenotypic plasticity in animals exposed to osmotic stress–is it always adaptive? // BioEssays. 2018. Vol. 40, No 11. 1800069. DOI: 10.1002/bies.201800069
Kamburska L., Zaupa S., Boggero A. Size-pattern and larval-length–mass relationships for the most common Chironomid taxa in the deep subalpine Lake Maggiore // Water. 2023. Vol. 15, No 15. 2730. DOI: 3390/w15152730
Kefford B. J., Reddy-Lopata K., Clay C., Hagen T., Parkanyi O., Nugegoda D. Size of anal papillae in chironomids: Does it indicate their salinity stress? // Limnologica. 2011. Vol. 41, No 2. P. 96–106. DOI: 10.1016/j.limno.2010.09.004
Learner M. A., Potter D. W. B. The seasonal periodicity of emergence of insects from two ponds in Hertfordshire, England, with special reference to the Chironomidae (Diptera: Nematocera) // Hydrobiologia. 1974. Vol. 44. P. 495–510.
Lenth R. _emmeans: Estimated Marginal Means, aka Least-Squares Means. 2025. DOI: 10.32614/CRAN.package.emmeans, R package version 1.11.2-8. URL: https://CRAN.R-project.org/package=emmeans
McCauley V. J. E. Instar differentiation in larval Chironomidae (Diptera) // The Canadian Entomologist. 1974. Vol. 106, No 2. P. 179–200. DOI: 10.4039/Ent106179-2
Montaño-Campaz M. L., Gomes-Dias L., Toro Restrepo B. E., García-Merchán V. H. Incidence of deformities and variation in shape of mentum and wing of Chironomus columbiensis (Diptera, Chironomidae) as tools to assess aquatic contamination // PloS one. 2019. Vol. 14, No 1. e0210348. DOI: 1371/journal.pone.0210348
Moubayed J., Langton P. H. On the genus Einfeldia Kieffer from France. Description of aberlencii sp. n. from French Guiana with emendation of four recently described species from continental France (Diptera, Chironomidae) // Ephemera. 2025. Vol. 26. P. 1–9.
Nguyen H., Donini A. Larvae of the midge Chironomus riparius possess two distinct mechanisms for ionoregulation in response to ion-poor conditions // American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2010. Vol. 299, No 3. P. R762–773. DOI: 10.1152/ajpregu.00745.2009
R Core Team. _R: A Language and Environment for Statistical Computing_. R. Foundation for Statistical Computing. Vienna, Austria, 2025. URL: https://www.R-project.org/
Rossaro B., Marziali L., Boggero A. Response of chironomids to key environmental factors: perspective for biomonitoring // Insects. 2022. Vol. 13, No 10. 911. DOI: 3390/insects13100911
Serra S. R., Graca M. A., Doledec S., Feio M. J. Discriminating permanent from temporary rivers with traits of chironomid genera // Annales de Limnologie-International Journal of Limnology. 2017. Vol. 53. P. 161–174.
Sibly R. M., Calow P. A life-cycle theory of responses to stress // Biological Journal of the Linnean Society. 1989. Vol. 37, No 1-2. P. 101–116. DOI: 10.1111/j.1095-8312.1989.tb02007.x
Wickham H., Averick M., Bryan J., Chang W., McGowan L. D., François R., Grolemund G., Hayes A., Henry L., Hester J., Kuhn M., Pedersen T. L., Miller E., Bache S. M., Müller K., Ooms J., Robinson D., Seidel D. P., Spinu V., Takahashi K., Vaughan D., Wilke C., Woo K., Yutani H. Welcome to the tidyverse // Journal of Open Source Software. 2019. Vol. 4, No 43. 1686. DOI: 10.21105/joss.01686.
Wiederholm T. Chironomidae of the Holarctic Region. Part 1. Larvae // Entomologica Scandinavica Supplement. 1983. Vol. 19. P. 149–291.
Благодарности
Автор выражает благодарность Л. Е. Буторовой за предоставление бентосных проб, использованных в данном исследовании.






 © 2011 - 2026
© 2011 - 2026