Введение
Работая над данным материалом и не претендуя на полноту и всеобщность формулировок, мы были вынуждены четко определиться с употреблением некоторых часто используемых и принципиально важных для данного обсуждения понятий.
Термины «животные» и «организм» мы определим не для всеобщего применения в любых случаях, а для использования в том объеме и с такой стороны, которые важны именно при рассмотрении темы данной статьи.
Живое существо – относительно обособленная сложная функциональная система, противодействующая росту энтропии, живая элементарная единица биологического вида, осуществляющая упорядоченный, внутренне скоординированный энергетический, вещественный и информационный обмен с внешней средой как некое единое целое, способная различными путями в большей или меньшей мере поддерживать параметры внутреннего гомеостаза за счет поведения, физиологических и других внутренних компенсаторных и регуляторных реакций, размножаться с передачей наследственной информации, обеспечивать и защищать индивидуальную жизнеспособность, видовую и другую групповую идентичность. Живыми существами являются и животные, и растения.
Животное – живое существо, способное питаться только готовыми органическими соединениями.
Организм – 1) аналог понятия «живое существо»; 2) «морфофизиологическое ядро» живого существа, т.е. его тело, реагирующее на изменения окружающей среды как единое целое поддерживанием в более или менее узких границах параметров гомеостаза биохимическими и физиологическими способами. Оба эти определения будут использоваться нами в том или ином смысле, применительно к контексту.
Адаптация (приспособление) организма к определенным условиям внешней среды – это процесс оптимизации необходимых и достаточных, энергетических и вещественных затрат, который благодаря комплексу поведенческих, биохимических, физиологических и морфологических регуляторных реакций обеспечивает поддержание необходимых параметров гомеостаза, благополучную и конкурентоспособную жизнедеятельность особей и популяций, процветание вида в различных условиях внешней среды (по: Черлин, 2015).
Регуляторные реакции – биохимические, физиологические, поведенческие или реакции организма, направленные на сохранение оптимальных параметров гомеостаза, режимов метаболизма и других его функций в меняющихся условиях внешней среды.
Компенсаторные реакции (приспособления) – реакции организмов на повреждения, при которых органы и системы, непосредственно не пострадавшие от действия повреждающего фактора, выполняют функции поврежденных структур путем заместительной гиперфункции или качественно измененной функции (по: Ветеринарный…, 1981).
В последнее время очень популярным направлением биологических исследований стало изучение возможностей и перспектив адаптации различных животных к условиям глобально меняющегося климата Земли. Особенно остро эта тема касается температурных условий внешней среды, которые непосредственно и опосредованно (Wild et al., 2025), жестко и безоговорочно влияют на все стороны жизнедеятельности любого организма. Принимая во внимание такие концепции, как глобальное потепление климата, которое в ряде случаев и мест на Земле по прогнозам некоторых ученых может в перспективе привести к глобальному и фатальному похолоданию (Wood, 2008; Kerr, 2008; Сапунов, 2010; Кароль, Киселев, 2013; Серхенов и др., 2024; и др.), такие исследования приобретают большу́ю значимость и прогностическую важность.
Терминология, касающаяся общих направлений адаптации животных к тепловому фактору (животные холодно- и теплокровные, экто-, экзо- и эндотермные, пойкило- и гомойотермные, бради- и тахиметаболические, псилотермные и хамилотермные), достаточно подробно рассмотрена нами в недавней публикации (Черлин, 2025).
Аналитический обзор
Общие направления адаптации животных к изменениям климата
Обратимся к проблеме адаптации животных к изменениям климата. Познакомившись с публикациями на темы, связанные с глобальными изменениями климата, и учитывая то, что мы сами уже много десятилетий занимались изучением термобиологии, принципов регуляции температуры тела у пресмыкающихся, а также проделав анализ имеющихся в научной литературе данных на эти темы у других групп животных, нам стало очевидно, что проблемы адаптации разных групп животных к глобальным изменениям климата в подавляющем большинстве страдают по крайней мере одной важной некорректностью: в этих исследованиях смешиваются два контрастно различающихся механизма реагирования на климатические изменения.
- Биохимические и физиологические реакции, которые позволяют организму приспосабливаться к изменениям внешних климатических параметров, компенсируя их эффекты и позволяя таким образом сохранять необходимые параметры гомеостаза.
Этот тип реакций на изменения температурных условий в основном присущ и является ведущим у большого количества беспозвоночных или низших хордовых. Членистоногие – в подавляющем большинстве достаточно подвижные животные. Они могут и часто регулируют поведенческим путем температуру своего тела. Так, с помощью современных технических средств удалось получить графики динамики температуры тела у перелетной саранчи Locusta migratoria (рис. 1).
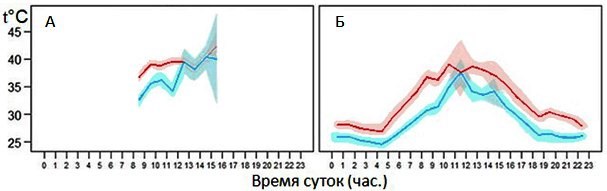
Рис. 1. Суточный ход температуры тела саранчи (красный график) и температуры поверхности почвы (голубой график) (Li et al., 2023). А – местность Даган (Dagang), Б – местность Дунъин (Dongying). Закрашенные голубым и розовым цветом области – доверительный интервал (стандартная ошибка). Сходство формы графиков температуры тела и поверхности почвы говорит не о зависимости температуры тела от температуры почвы (насекомые не так много времени проводят на почве и к тому же их туловище приподнято над почвой на лапках), а то, что и на насекомых, и на почву одинаково действуют солнечное излучение и температура воздуха
Fig. 1. Diurnal variation of locust body temperature (red graph) and soil surface temperature (blue graph) (Li et al., 2023). А – Dagang locality, Б – Dongying locality. Blue and pink shaded areas are confidence intervals (standard error). The similarity in the shape of the graphs of body and soil surface temperatures does not indicate the dependence of body temperature on soil temperature (locusts do not spend much time on the soil and, moreover, their body is raised above the soil on their paws), but the fact that both – insects and soil – are equally affected by solar radiation and air temperature
Эти материалы подтверждают данные И. Д. Стрельникова, который еще в первой половине ХХ в. показал, что перелетная саранча Locusta migratoria осуществляет эффективную поведенческую регуляцию температуры тела, поднимаясь утром на верхушки травянистых растений и согреваясь на солнце примерно до 40°, обеспечивая таким образом реализацию важнейших физиологических функций – активного питания и переваривания большого количества корма, быстрого роста и развития, интенсивной двигательной активности, сбора в кулиги и перелетов на большие расстояния и т.п. (Стрельников, 1934, 1935). Также им была описана эффективная поведенческая терморегуляция у жука-чернотелки Stenodes caspius (Стрельников, 1934) и у некоторых других насекомых. На шести видах жуков-навозников (Heliocopris dilloni, Scarabaeus laevistriatus, Kheper aegyptiorum, K. platynotus, Scarabaeus catenatus, Gymnopleurus laevicollis) было показано, что скорость скатывания и перекатывания навозных шариков повышается при повышении температуры их груди (Bartholomew, Bernd, 1978). И жуки этим свойством пользуются. Есть много и других подобных примеров.
Среди других беспозвоночных – кишечнополостных, разных червей, иглокожих, моллюсков, а также низших хордовых, есть и подвижные, но в большинстве они медленно двигающиеся или вообще сидячие формы. Такие животные не способны активно и точно регулировать температуру тела. Они вынуждены вырабатывать и применять целый комплекс компенсаторных биохимических и физиологических реакций, позволяющий поддерживать параметры внутренней среды, зависящие от параметров внешней среды, в допустимых для нормальной жизнедеятельности рамках. Диапазоны температур, в которых они оказываются, достаточно широки (если это не паразитические животные, живущие внутри теплокровных). Здесь большое значение имеет избегание (если это возможно) опасных термальных границ – прежде всего верхних, но также и нижних.
В связи с такими условиями у этих животных температурные диапазоны их жизнедеятельности оказываются достаточно широкими, но различается температурная выносливость. Например, если данный вид, или популяция, или лабораторная линия адаптированы в течение некоторого времени к более высоким температурам, чем другие, то и тепловая выносливость у них оказывается выше.
Особенно ярко эта зависимость проявляется у сидячих форм, таких как, например, усоногие рачки баланусы Chthamalus stellatus, двустворчатые моллюски черноморские мидии Mytilus galloprovincialis, и другие животные, которые никаким образом неспособны поменять место прикрепления или положение туловища, чтобы хоть как-то изменить тепловой баланс тела. При этом, поскольку они часто живут в литоральной зоне, оказываясь то в прохладной воде, то под действием жаркого солнца, температура их тела может в летний период колебаться примерно от 24 до 38° (Стрельников, 1945). Также показано, что съедобные мидии Mytilus edulis из холодного Баренцова моря имеют верхний температурный предел выносливости между 15 и 20°, в то время как представители того же вида из более теплого Балтийского моря обладают более высоким температурным пределом – выше 20° (Беляев, 1954).
Познакомимся с суточной динамикой температуры тела ребристой атлантической мидии Geukensia demissa (рис. 2; Jost, Brian, 2007).
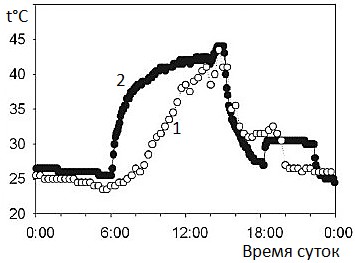
Рис. 2. Суточная динамика температура тела ребристой атлантической мидии в естественной среде в литоральной зоне (1) и в условиях лаборатории с искусственным обогревом (2) (Jost, Brian, 2007)
Fig. 2. Daily dynamics of body temperature of Atlantic ribbed mussel in natural environment in the littoral zone (1) and in laboratory conditions with artificial heating (2) (Jost, Brian, 2007)
Несмотря на то, что температура тела имеет максимум в середине дня (примерно 42–43°), эту ситуацию, видимо, неправомочно рассматривать как проявление терморегуляции. Находясь в литоральной зоне, моллюски оказываются то в прохладной воде, то нагреваются на солнце. Сменить местоположение они не в состоянии, поэтому они имеют ту температуру, которая получается у них сама собой в имеющихся безальтернативных условиях.
И. Д. Стрельников указывал для черноморской мидии в периоды отсутствия воды температуру тела до 40° (Стрельников, 1945), т.е. такую же, как и у ребристой атлантической мидии (Jost, Brian, 2007). Но при этом черноморские мидии живут не только в литоральной зоне. Бо́льшая их часть как раз населяет более глубокие места – примерно от 1 до 20 м, хотя могут встречаться и на глубине до 80 м. На глубине около 12 м температура воды в Черном море за сутки колеблется в январе примерно от 9.26 до 9.28°, а в августе примерно от 23.5 до 24.5° (Рубакина и др., 2019). Другими словами, черноморские мидии живут в очень различных температурных условиях и подъем их температуры тела на литорали до 40°, видимо, не является для них обязательным. Регуляции температуры тела у них не наблюдается.
Таким образом, основная нагрузка при приспособлении сидячих или малоподвижных беспозвоночных и низших хордовых животных к климатическим изменениям температуры среды ложится на реакции на уровне организма (в том смысле слова «организм», который определен в самом начале статьи).
2. Прежде всего поведенческие реакции, которые направленно меняют структуру теплового баланса тела и таким образом регулируют количество теплоты, поступающей к телу животного, а значит, и температуру тела.
Такой активной поведенческой терморегуляцией пользуются в первую очередь позвоночные животные, у которых достаточно развита центральная нервная система.
Организация и деятельность нервной системы у беспозвоночных и позвоночных животных существенно различаются. Нервная система появилась впервые в эволюции у кишечнополостных. Она обеспечивала возможность связи организма с окружающей средой (восприятие, передача раздражения и ответная реакция на раздражение), связь всех органов и систем органов в единое целое. Несмотря на то, что у беспозвоночных центральной нервной системы как таковой практически нет, тем не менее многие из них, особенно такие группы, как насекомые, пауки и головоногие моллюски, способны достаточно оперативно и адекватно реагировать на изменения параметров окружающей среды, формировать целые комплексы безусловно рефлекторных регуляторных поведенческих реакций.
Относительная значимость этих двух механизмов – внутренних регуляторных и компенсаторных реакций организма с одной стороны и поведенческих регуляторных реакций животных с другой стороны – связана прежде всего с развитием и деятельностью центральной нервной системы. Она впервые появилась и начала активно развиваться у хордовых, а затем у позвоночных животных. Именно центральная нервная система обеспечивала проявления разнообразных поведенческих термо- и других регуляторных реакций (Мышкин, 2016). Таким образом, основная нагрузка при приспособлении позвоночных животных к климатическим изменениям температуры среды ложится на реакции на уровне животного.
Примерно об этом писал еще в середине ХХ в. известный советский физиолог Борис Петрович Ушаков: «При исследовании адаптации животных к различным экологическим факторам следует различать два типа приспособлений: приспособление клеточного типа, которое обусловлено прямым приспособлением всех клеток животного к данному фактору, и приспособление системного типа, при котором адаптация достигается изменением организма как целостной системы (приспособительное изменение поведения, биологического цикла и т.д.).» (Ушаков, 1956; с. 962). К сожалению, он не развил эту важную мысль и не акцентировал на ней внимания читателей. В результате она не стала предупреждением от ошибок для последующих исследователей.
Само по себе изучение терморезистентности клеток, тканей, органов и животных в целом – тема интересная и важная. Но главное здесь – правильно интерпретировать и применять полученные результаты. А вот в этой части дело не всегда обстоит гладко… Во всяком случае очевидно, что закономерности терморезистентности клеток и тканей организма у животных, слабо регулирующих или вообще не регулирующих поведенческим путем температуру своего тела, нельзя прямо переносить на тех животных, которые с помощью поведенческих реакций активно и эффективно регулируют температуру тела, сохраняя ее либо на одном высоком уровне, либо в узком высоком диапазоне.
Температура тела холоднокровных позвоночных животных с недостаточно хорошо развитой регуляцией температуры тела
Рыбы – одни из тех позвоночных, у которых терморегуляция хоть и есть, но она развита не очень отчетливо. В экспериментальных условиях они показывают, что могут за какое-то более или менее продолжительное время выбрать относительно подходящую, т.е. по каким-то причинам желательную для себя, температуру (Голованов, 2012, 2013 и др.).
В природных условиях температура тела рыб может быть подвержена динамике определенной направленности. Так, рис. 3 иллюстрирует суточный ход температуры тела у голубого тунца (Thunnus thynnus) в Средиземном море. Температура тела этих рыб примерно на 2–5° выше, чем температура воды, в которой они живут. Это, скорее всего, связано с подвижностью рыб, т.е. с тем, что при активном движении температура их красных аэробных мышц, располагающихся около позвоночника, выше, чем в остальном теле. При этом график показывает, что в ночное время температура тела тунцов примерно на 2–3° выше, чем днем (Teo et al., 2007). Это, видимо, также имеет свое объяснение: активная охота тунцов за мезопелагической фауной происходит в поверхностных, более теплых слоях воды (Battaglia et al., 2013); днем же они опускаются на бо́льшую глубину, в более прохладную воду. Но даже при этом их высокая подвижность не позволяет температуре тела опускать ниже 26–27°. Вряд ли эта ситуация может быть признана проявлением направленной и эффективной терморегуляции.
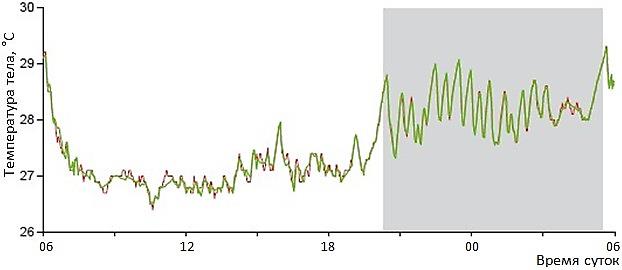
Рис. 3. Суточный ход температуры тела у голубых тунцов Thunnus thynnus (17–18 июня 1999 г.) в фазе размножения. Смоделированная (зеленая) и измеренная (красная) температуры тела. Серое пространство обозначает ночное время, белое – дневное (Teo et al., 2007)
Fig. 3 The daily course of body temperature in bluefin tuna Thunnus thynnus (June 17–18, 1999) in the breeding phase. Simulated (green) and measured (red) body temperatures. The gray space indicates night time, and the white space indicates daytime (Teo et al., 2007)
Рис. 4 иллюстрирует относительную стабильность температуры тела тунца Thunnus dews (Holland, Sibert, 1994), несмотря на меняющуюся температуру воды, в которой эти рыбы плавают; при этом температура тела рыб может быть на 10–14° выше, чем температура воды. Эту ситуацию можно было бы частично признать физиологической терморегуляцией. «Частично» – потому что изученные в данном исследовании рыбы имели достаточно большую массу (7–12 кг) и, следовательно, значительную температурную инерцию.
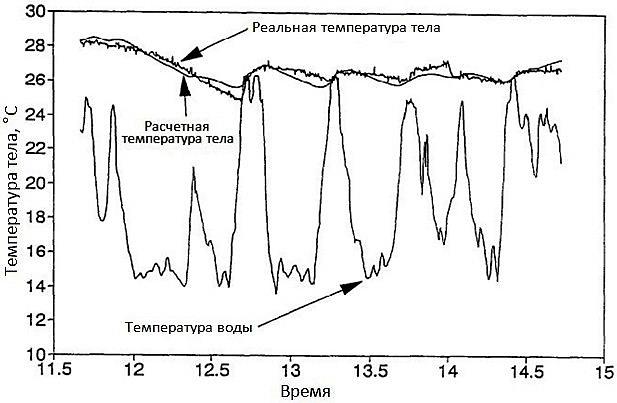
Рис. 4. Температура воды, расчетная и реальная температура тела у взрослого тунца Thunnus dews (по: Holland, Sibert, 1994) в связи с его охотой и погружением в воды с разной температурой
Fig. 4. Water temperature, estimated and actual body temperature in adult tuna Thunnus dews (Holland, Sibert, 1994) in connection with their hunting and immersion in waters with different temperatures
В этой связи специальное исследование скорости изменения температуры тела у рыб большой массы в связи с изменениями температуры воды показало, что коэффициент теплопередачи при охлаждении у различных видов рыб, как с большой, так и с меньшей мышечной теплопродукцией, весом примерно 10–100 кг и более, была пропорциональна массе тела в степени − 0.63. Таким образом, крупным рыбам легче сохранять стабильность высокой температуры тела, чем мелким, причем без затраты на это дополнительной энергии (Nakamura et al., 2020). Такая же ситуация отмечается и у акул: так, белые акулы, Carcharodon carcharias, длиной примерно 4–5 м и массой около 200 кг сохраняли почти постоянную температуру тела 24.8–26.5°, плавая в воде с температурой около 13–15°, т.е. температура тела могла превышать температуру окружающей воды на 14–15° (Carey et al., 1982; Tricas, McCosker, 1984; McCosker, 1987; Goldman et al., 1996; Goldman, 1997).
Частично этот эффект достигается определенными физиологическими реакциями эффективного перераспределения тепла внутри тела. В значительно степени это происходит благодаря сложному переплетению прилегающих друг к другу подкожных вен и артерий («чудесная сеть») (Cech et al., 1984; Compagno, 2002). Она помогает тунцам и акулам удерживать внутри тела тепло, вырабатываемое при интенсивной работе красных аэробных мышц вокруг позвоночника, и подогревать за счет этого мозг, глаза и другое внутренние органы (Cech et al., 1984; Sepulveda et al., 2008; Compagno, 2002), экономить энергию, активно двигаться и выживать в водах с очень широким спектром температур.
У амфибий могут наблюдаться различные варианты терморегуляционного поведения. Так, у мраморной лягушки, Nannophrys marmorata, на Шри-Ланка во все сезоны года, с высокой и низкой температурой, температура их тела никогда не поднимается выше примерно 25°. Все теплое время суток они проводят в щелях между камней, не позволяя телу нагреваться даже тогда, когда это принципиально возможно (рис. 5). Это тоже своего рода проявление терморегуляции, но только лягушки в основном стремятся не повышать температуру тела, а наоборот, не давать ей подниматься. Так же ведут себя и травяные лягушки в Карелии (Кутенков, 2009; Кутенков, Целлариус, 1998). У лягушек, у которых кожа всегда влажная, это, видимо, принципиально важно, поскольку подъем температуры тела проведет к быстрой и критической потере организмом воды, к нарушению поступления кислорода, энергии и к другим чрезвычайно опасным для их жизни последствиям.
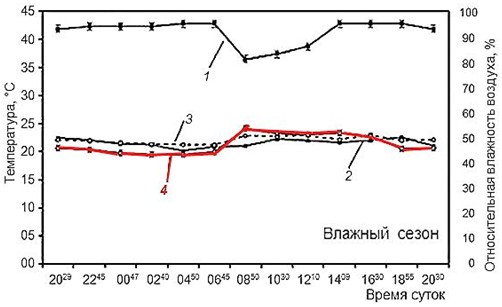
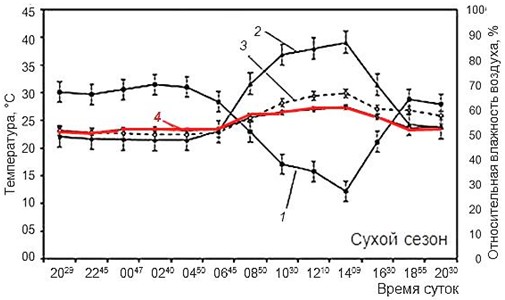
Рис. 5. Иллюстрация хамилотермического статуса. Активность мраморной лягушки в связи с условиями внешней среды в Шри-Ланка. А – влажный сезон, Б – сухой сезон (Senanayake et al., 2019). 1 – относительная влажность воздуха, 2 – температура воздуха, 3 – температура убежища, 4 – температура тела (красная линия)
Fig. 5. Illustration of the hamilothermiс status. The activity of the marbled streamlined frog in connection with environmental conditions in Sri Lanka (Senanayake et al., 2019). A – wet season, Б – dry season. 1 – relative humidity, 2 – air temperature, 3 – shelter temperature, 4 – body temperature (red line)
А вот у некоторых видов жаб, у которых кожа сухая, показано наличие неплохо развитой терморегуляции. Так, шиповатые жабы, Bufo spinulosus, обитающие в неотропических регионах Мексики, Центральной и Южной Америки на высотах 3–4 тысячи метров над у.м. и даже несколько выше, выбирают во внешней среде такие условия, которые позволяют им поддерживать температуру тела выше 15°, но по возможности не поднимать ее выше 22–24°, находясь на солнце или, наоборот, уходя в тень или убежища (рис. 6, 7; Sinsch, 1989; Lambrinos, Kleier, 2003).
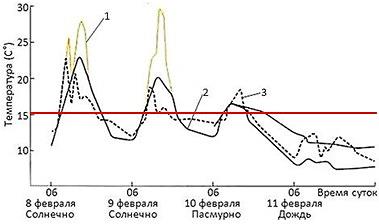
Рис. 6. Регулирование температуры взрослой шиповатой жабой (Bufo spinulosus) на высоте 3200 м. В этих условиях взрослые жабы сочетают гелиотермию и тигмотермию. 1 – температура почвы, 2 – температура воздуха, 3 – температура тела жаб. Красная линия – температура 15°, выше которой жабы позволяют температуре тела подниматься не всегда, но при возможности стараются поднимать ее примерно к этому уровню, если в среде холоднее. В солнечные дни жабы выбирались на солнце между 7:30 и 8:30 утра и грелись в течение нескольких часов. Максимальной температуры тела они достигали к полудню, а затем отступали в тень. При полном облачном покрове температура их тела была равна температуре воздуха или немного превышала ее (по материалам Sinsch, 1989)
Fig. 6. Temperature regulation of an adult Andean toad (Bufo spinulosus) at an altitude of 3200 m. Under these conditions adult toads combine heliothermy and thigmothermy. 1 – soil temperature, 2 – air temperature, 3 – body temperature of toads. The red line is a temperature of 15°, above which toads do not always allow body temperature to rise, but if possible, they try to raise it to about this level if the environment is colder. On sunny days, the toads went out into the sun between 7:30 a.m. and 8:30 a.m. and basked for several hours. They reached their maximum body temperature by noon, and then retreated into the shade. With full cloud cover, their body temperature was equal to or slightly higher than the air temperature (according to Sinsch, 1989)
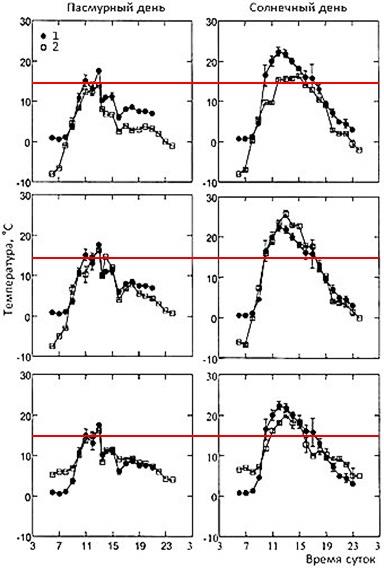
Рис. 7. Почасовое изменение средней температуры тела и средней температуры окружающей среды свободно перемещающихся шиповатых жаб Bufo spinulosus в течение пасмурного и солнечного дня. Значения приведены в среднем за 71 день (по: Lambrinos, Kleier, 2003). 1 – температура тела жаб, 2 – температура воздуха. Три горизонтальных ряда по два графика – данные по трем жабам, за которыми велись наблюдения. Красная линия – температура 15°, выше которой жабы позволяют температуре тела подниматься не всегда, но при возможности стараются поднимать ее примерно к этому уровню, если в среде холоднее
Fig. 7. Hourly change in mean environmental temperatures and mean body temperature of free ranging toads, Bufo spinulosus, during one cloudy and one sunny day. Values are means 71 days (according to Lambrinos, Kleier, 2003). 1 – body temperature of toads, 2 – air temperature. Three horizontal rows of two graphs represent data on three toads that were monitored. The red line is a temperature of 15°, above which toads do not always allow body temperature to rise, but if possible, they try to raise it to about this level if the environment is colder
На рис. 8 приведена еще одна иллюстрация того, что шиповатая жаба Bufo spinulosus регулирует в течение дня температуру своего тела, стараясь в утренний период активности даже в весьма прохладных климатических условиях высокогорья поднимать ее хотя бы ближе к 20º.
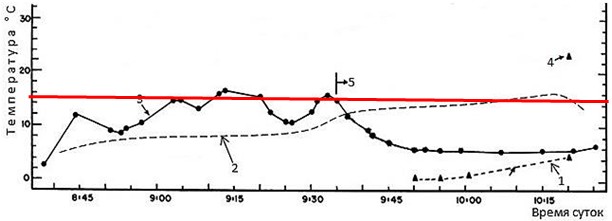
Рис. 8. Динамика температуры тела шиповатой жабы Bufo spinulosus на голой земле в вольере, где ей доступны как солнце, так и тень. 17 марта; 4300 м над у.м. (по: Pearson, Brandford, 1976). 1 – температура почвы в тени, 2 – температура воздуха, 3 – температура тела жабы 19.9 г, 4 – температура почвы на солнце, 5 – жаба находится в тени. Красная линия – температура 15°, выше которой жабы позволяют температуре тела подниматься не всегда, но при возможности стараются поднимать ее примерно к этому уровню, если в среде холоднее
Fig. 8. Dynamics of body temperature of Bufo spinulosus on bare ground in an enclosure with both sun and shade available to them. 17 March; 4,300 m (Pearson, Brandford, 1976). 1 – the soil temperature in the shade, 2 – the air temperature, 3 – the body temperature of the toad 19.9 g, 4 – the soil temperature in the sun, 5 – the toad is in the shade. The red line is a temperature of 15°, above which toads do not always allow body temperature to rise, but if possible, they try to raise it to about this level if the environment is colder
Таким образом, материалы исследований демонстрируют, что у низших позвоночных животных терморегуляция уже отмечается, но ее реализация и возможности достаточно ограничены, да и направленность на повышение температуры тела проявляется слабо. В значительно большей степени регулирование температуры тела этих животных связано, наоборот, с недопущением повышения температуры тела выше 25–28° (далеко не всегда даже до 30°). Важно напомнить, что это в значительной степени связано с тем, что рыбы и подавляющая часть амфибий – хамилотермные животные, т.е. у них нет терморегуляционной реакции псилотермии, заставляющей температуру их тела подниматься.
Температура тела «холоднокровных» («потенциально теплокровных») животных с развитой поведенческой терморегуляцией
Подавляющая часть ученых, к сожалению, оценивает возможности адаптации к повышенным климатическим температурам исключительно так, как будто бы они имеют дело исключительно с животными, у которых нет терморегуляции, т.е. с беспозвоночными или в крайнем случае с малоподвижными или вообще с сидячими низшими хордовыми. В этом случае у всех животных, вне зависимости от уровня их развития, изучают тепловую выносливость, делая вывод о возможности их адаптации к изменению климата. Ошибочность такого подхода удобно показать на примере рептилий, поскольку у нас есть для иллюстрации этого подходящий материал.
Так, у среднеазиатской эфы, Echis multisquamatus, в разные сезоны года, когда температурные условия внешней среды существенно различаются (максимальная температура поверхности почвы ранней весной доходит до 40, а летом – до 70°, приземный слой воздуха ранней весной прогревается до 27, а летом – до 42°), температура тела во время их пребывания на поверхности, благодаря хорошо развитым поведенческим регуляторным реакциям, находится в узком диапазоне 30–32° (рис. 9; Черлин, Целлариус, 1981).
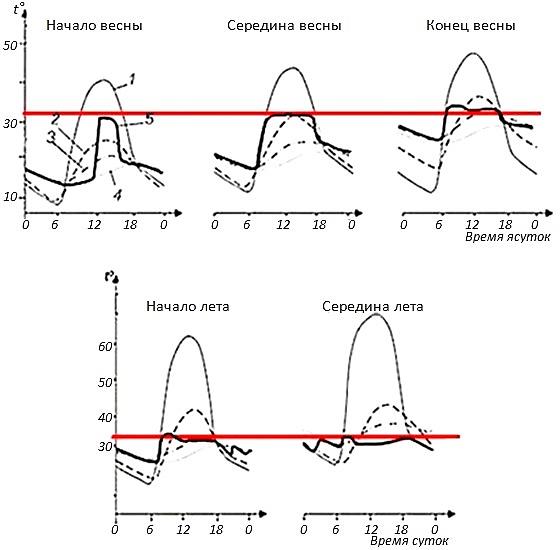
Рис. 9. Динамика температуры тела среднеазиатской эфы, Echis multisquamatus, и внешней среды в разные сезоны года (по: Черлин, Целлариус, 1981). 1 – температура поверхности почвы, 2 – температура воздуха на высоте 2 см, 3 – температура почвы на глубине 20 см, 4 – температура почвы на глубине 30 см, 5 – температура тела. Красная линия показывает уровень температуры примерно 32°
Fig. 9. Dynamics of body temperature of the saw-scaled viper, Echis multisquamatus, and the external environment in different seasons (according to Cherlin and Tsellarius, 1981). 1 – the soil surface temperature, 2 – the air temperature at a height of 2 cm, 3 – the soil temperature at a depth of 20 cm, 4 – the soil temperature at a depth of 30 cm, 5 – the body temperature. The red line shows a temperature level of approximately 32°
Точно такая же ситуация характерна и для сугубо ночного среднеазиатского вида ящериц – сцинкового геккона, Teratoscincus scincus (рис. 10) и практически для всех современных рептилий, поскольку это псилотермические животные, стремящиеся периодически поднимать температуру тела и удерживать ее некоторое время на достаточно высоком уровне (чаще всего в диапазоне примерно 30–40° в зависимости от вида).
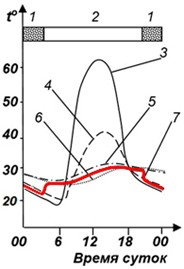
Рис. 10. Связь температуры тела сугубо ночного сцинкового геккона с температурными условиями среды в летний период (по данным: Черлин и др., 1983; Черлин, 2013). t° – температура; формы активности: 1 – активность на поверхности в темное время суток, 2 – сон / отдых (дневной); температуры: 3 – поверхности почвы; 4 – воздуха на высоте 3 см, 5 – почвы на глубине 20 см, 6 – почвы на глубине 30 см, 7 – (красная линия) тела гекконов
Fig. 10. Relationship of body temperature of a purely nocturnal Turkestan plate-tailed gecko with ambient temperature conditions in summer (according to Cherlin et al., 1983; Cherlin, 2013). t° is temperature; forms of activity: 1 – activity on the surface at night, 2 – sleep / rest (daytime); temperatures: 3 – surface soil; 4 – air at a height of 3 cm, 5 – soil at a depth of 20 cm, 6 – soil at a depth of 30 cm, 7 – (red line) bodies of geckos
Рис. 11 демонстрирует, что даже в жестких условиях высокогорья ящерицы способны поддерживать относительно постоянную и высокую температуру своего тела.
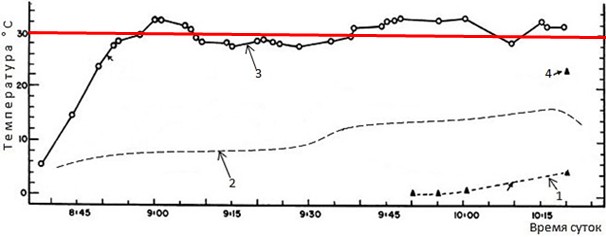
Рис. 11. Температура тела перуанской изменчивой игуаны, Liolaemus multiformis, на голой земле в вольере, где ей доступны как солнце, так и тень. 17 марта; 4300 м над у.м. (Pearson, Brandford, 1976). 1 – температура почвы в тени, 2 – температура воздуха, 3 – температура тела ящерицы длиной 75 мм, 4 – температура почвы на солнце. Красная линия – температура 30°, т.е. примерно тот уровень температуры тела, который ящерицы стараются у себя поддерживать
Fig. 11. Body temperature of a Liolaemus multiformis on bare ground in an enclosure with both sun and shade available to them. March 17; 4300 m above see level (Pearson, Brandford, 1976). 1 – the soil temperature in the shade, 2 – the air temperature, 3 – the body temperature of the lizard 75 mm long, 4 – the soil temperature in the sun. The red line is a temperature of 30°, which is near the body temperature level that lizards try to maintain
Наиболее показательны данные, полученные нами при подробном слежении за температурами тела ушастых круглоголовок, Phrynocephalus mystaceus, с помощью температурных логгеров, регистрировавших температуру их тела раз в минуту, и логгеров температуры внешней среды (рис. 12–14).
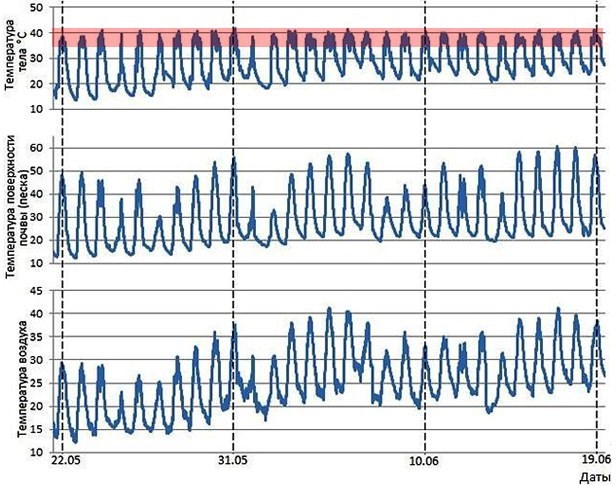
Рис. 12. Динамика температуры тела ушастой круглоголовки, Phrynocephalus mystaceus, с 22 мая по 19 июня 2024 г., полученная с помощью внедренного интраперитонеально логгера на бархане Сарыкум (Республика Дагестан, РФ), и динамика температур внешней среды там же. Серая полоса выделяет примерный температурный диапазон полной активности у круглоголовок
Fig. 12. Dynamics of the body temperature of the Toad-headed agama, Phrynocephalus mystaceus, from May 22 to June 19, 2024, obtained using an intraperitoneally embedded logger on the Sarykum dune (Republic of Dagestan, Russian Federation) and the dynamics of ambient temperatures in the same place. The gray stripe highlights the approximate full activity temperature range in the Toad-headed agama
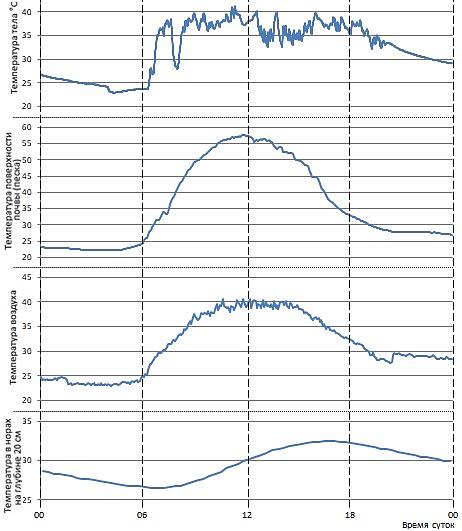
Рис 13. Суточная динамика температуры тела ушастой круглоголовки и параметров окружающей среды. 6 июня 2024 г.
Fig. 13. Daily dynamics of body temperature of the Toad-headed agama and environmental parameters. June 6, 2024
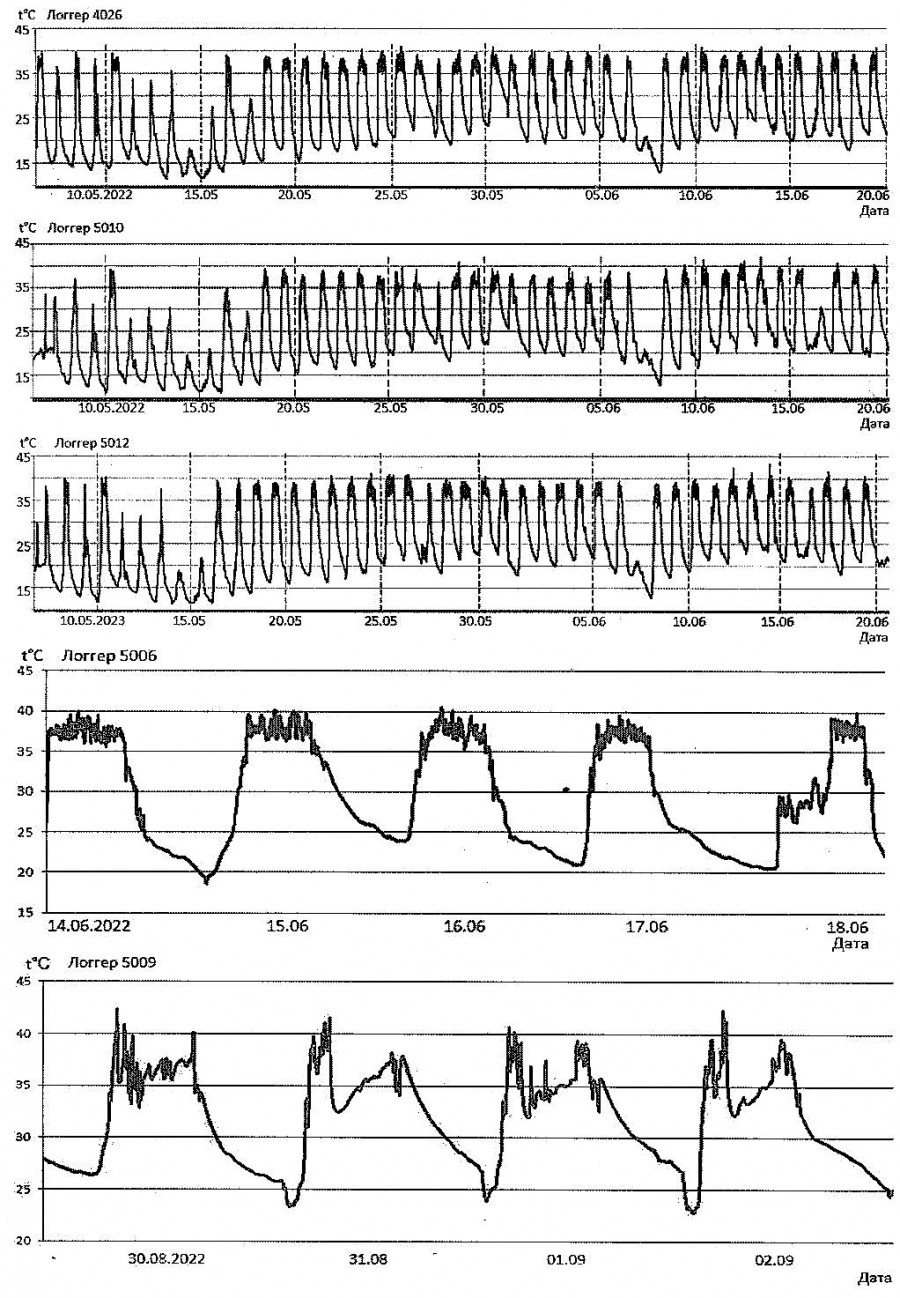
Рис. 14. Динамика температуры тела ушаcтой круглоголовки, Phrynocephalus mystaceus, полученная с помощью интраперитонеально внедренных логгеров на бархане Сарыкум (Республика Дагестан, РФ) в разные сезоны года
Fig. 14. Dynamics of the body temperature of the Toad-headed agama, Phrynocephalus mystaceus, obtained using an intraperitoneally embedded loggers on the Sarykum dune (Republic of Dagestan, Russian Federation) during different seasons
Рис. 12–14 отчетливо показывают, что происходит в том случае, когда даже пойкилотермное (т.е. эктотермное, холоднокровное) животное использует активную поведенческую терморегуляцию. Так, хотя погода в мае – июне 2024 г. на бархане Сарыкум была изменчивая, с периодически наступающими более прохладными периодами, температура тела круглоголовок все время держалась примерно в границах 35–41° (см. рис. 12). Сходная ситуация отмечалась и для мая – июня 2022 г. (четыре верхних графика на рис. 14). Рис. 13 показывает, что в самую жаркую середину дня, когда температура поверхности песка приближается к 60°, ящерицы покидают поверхность, закапываются в песок или уходят в норы, где температуры ниже (см. рис. 13). Такая же ситуация, только еще более ярко, проявляется в самый жаркий период наблюдений – в конце августа – начале сентября 2022 г. (последний график на рис. 14). Другими словами, даже широкие вариации микроклиматических условий не способны изменить параметры температуры тела рептилий, которые они направленно поддерживают приемами прежде всего поведенческой терморегуляции. То есть при изменениях внешних условий у рептилий меняются не преимущественные параметры температуры их тела, а режим пространственно-временной активности, обеспечивающий термальный гомеостаз.
Таким образом, не чисто теоретические рассуждения, а данные конкретных научных исследований экологии и термобиологии рептилий (см. рис. 9–14) отчетливо показывают, что у животных, у которых хорошо развита поведенческая регуляция температуры тела, в частности у рептилий, при изменениях климата даже в широких пределах температура тела сохраняется в достаточно узком диапазоне, при котором эти животные в основном и живут. При серьезных изменениях климата животные могут менять биотопическое распределение и режимы суточной и сезонной активности (пространственно-временную структуру активности), сохраняя в видоспецифичных рамках температуру тела. Заметное влияние изменений климата на жизнедеятельность таких животных может произойти вследствие изменений в количестве получаемой животными теплоты за год. Но это, в свою очередь, никак не связано с тепловой выносливостью. Следовательно, в этих условиях сомнительно возможное действие отбора на изменение терморезистентности и на клеточном уровне, и на уровне организма.
Терморезистентность клеток, тканей и организма в целом у холоднокровных животных
Вполне логично ожидать, что животные, которые живут в более теплых условиях внешней среды и к ним адаптированы, должны иметь более высокие температурные уровни тепловой резистентности, как на уровне клеток, тканей и органов, так и целого организма.
Ученые, занимающиеся исследованиями в связи с глобальным потеплением, чаще всего изучают две стороны этой проблемы.
- Влияние повышенной температуры на морфологию, физиологические процессы и экологические проявления (Cabezas-Cartes et al., 2019; Kubisch et al., 2019; Prokosch et al., 2019 и др.).
- Влияние повышенной температуры на тепловую выносливость животных (Колсанова и др., 2014; Калинникова и др., 2014 и др.). Основной смысловой посыл таких исследований сводится к тому, что при постепенном потеплении климата выжить должны животные, у которых тепловая выносливость выше. Но это утверждение очень сильно упрощает реальное положение дел в данной сфере. Оно однозначно справедливо только для тех животных, которые вследствие сидячего образа жизни, неразвитости или слабой развитости центральной нервной системы не могут поведенческими способами регулировать температуру своего тела. На самом деле отношения термобиологии активно терморегулирующихся животных с климатическими условиями намного сложнее. Да и соотношения показателей терморезистентности клеток, тканей и органов у нетерморегулирующихся и терморегулирующихся с помощью поведенческих реакций животных тоже неоднозначны.
«…Теплоустойчивость мускулатуры земноводных одного и того же вида относительно постоянна и является физиологической характеристикой вида…
Теплоустойчивость мускулатуры различных видов земноводных неодинакова и находится в соответствии с температурой среды обитания вида. Это различие является специфическим по отношению к тепловому воздействию…
…обнаруженные закономерности имеют общебиологическое значение. Они, с одной стороны, показывают, что организм нельзя рассматривать как простую сумму составляющих его клеток, и, с другой стороны, обнаруживают наличие прямого приспособления клеток к условиям существования организма. Последнее мы объясняем адаптивными изменениями белковой структуры различных тканей» (Ушаков, 1955; с. 587–588).
«Теплоустойчивость мускулатуры пойкилотермных животных, принадлежащих к одному виду, в значительной мере не зависит от микроклиматических условий, в которых обитает данное животное, и является его видовым признаком, обусловленным видовой специфичностью клеточных белков. В пределах одного вида адаптация к различным условиям обитания осуществляется благодаря системному приспособлению организма…
Теплоустойчивость мускулатуры близких видов холоднокровных животных различна и находится в явном соответствии с микроклиматическими условиями жизни вида и его филогенетическим происхождением. Эти данные показывают, что в процессе видообразования холоднокровных значительную роль играет адаптация именно к температурным условиям существования, причем эта адаптация принадлежит к клеточному типу и связана с адаптивным приспособлением белкового субстрата организма» (Ушаков, 1956; с. 962–963)».
«…теплоустойчивость тканей пойкилотермных животных является удобным цитофизиологическим критерием вида, который можно использовать в систематике с диагностическими целями...
Работа Ю. И. Полянского, доказавшая большую зависимость теплоустойчивости одноклеточных от температуры окружающей среды, и ряд косвенных соображений приводят к предположению, согласно которому у низших типов животных (губки, кишечнополостные и, возможно, черви) теплоустойчивость клеток не может являться критерием вида» (Ушаков, 1959; с. 1301–1302).
Б. П. Ушаков совместно с И. С. Даревским провели исследование терморезистентности мышечной ткани у двух видов ящурок (Eremias), различающихся по экологии и биотопическому распределению (табл. 1).
Таблица 1. Сравнение теплоустойчивости мышечных волокон и отношения к температуре ящурок Штрауха и закавказских ящурок (Ушаков, Даревский, 1959)
| Характеристики | Ящурка Штрауха, Eremias strauchii | Закавказская ящурка, Eremias pleski |
| Северная граница ареала | 40°25′ с. ш. | 40°10′ с. ш. |
| Высота проникновения в горы, м | 3500 | 1800 |
| Наиболее ранние сроки пробуждения весной (долина Аракса) | Середина марта | Начало апреля |
| Наиболее поздние сроки ухода на зимовку (долина Аракса) | Конец октября | Конец сентября |
| Температура тела в активный период в природе, °С | 36–36.6 | 39–41.5 |
| Теплоустойчивость мышечных волокон (потеря возбудимости мышц через 5 мин), °С | 47.4 | 48.5 |
| Наступление теплового паралича при насильственном помещении на яркое солнце: – температура тела в момент наступления теплового паралича, °С
Время до наступления теплового паралича, мин |
48.4–49.6
1.2–4 |
49.3–49.8
6–12 |
Авторы сделали важные выводы из своих исследований.
«Обнаруженное различие в теплоустойчивости мышечных волокон изученных ящурок говорит о том, что в процессе образования этих видов произошла адаптивная перестройка их клеточных белков, которая имеет решающее значение в процессе дивергенции и образования видов.
Рассмотренные в этой работе системные приспособления и являются тем механизмом, который обеспечивает представителям систематически близких видов, обитающих в одном биотопе, различный, специфический для вида и оптимальный для жизнедеятельности организмов и их клеток микроклимат» (Ушаков, Даревский, 1959; с. 835).
То, что «перестройка… клеточных белков… имеет решающее значение в процессе дивергенции и образования видов», скорее всего, не вызывает сомнений. Но главный для нас вопрос заключается в другом: насколько эта перестройка клеточных белков была адаптивной, насколько она была связана и инициирована различиями в их терморезистентности? Или, другими словами, а) являлись ли различия в терморезистентности клеток и тканей животных следствием отбора, направленного на формирование различий в термобиологических характеристиках и, следовательно, на экологическое расхождение внутривидовых групп, приводящее к появлению новых видов, или б) биохимические перестройки, происходящие по каким-то чисто внутренним (биохимическим, биофизическим и др.) причинам, приводят к появлению новых групп с новыми термобиологическими характеристиками температурных предпочтений и тепловой резистентности, а уже видоспецифичный комплекс поведенческих регуляторных реакций и отбор осуществляют «подгонку» получившихся подобным «не адаптивным» способом групп к конкретным климатическим условиям, формируя таким образом новые виды с новыми термобиологическими характеристиками и отличными от изначальных пространственно-временными структурами активности, хорошо адаптированными к условиям внешней среды?
Так, сами результаты работы Ушакова и Даревского (1959) не вызывают сомнений. Некоторое удивление связано лишь с попытками осмысления и интерпретации результатов. То, что закавказская ящурка более термофильна, чем ящурка Штрауха, очевидно. Проблема осмысления состоит в том, что температуры тела у обоих видов ящурок различаются, но сам уровень этих температур существенно ниже того уровня, который представляет для них реальную опасность. В природных условиях их температура тела никогда не приближается к опасному пределу. В чем тогда биологический смысл того, что тепловая выносливость клеток и тканей закавказских ящурок выше, чем у ящурок Штрауха (хотя на самом деле, на наш взгляд, они очень близки)? И можно ли тогда по уровню тепловой резистентности клеток, тканей и даже животного в целом делать вывод о том, что при потеплении климата один вид окажется более приспособленным к новым условиям, чем другой? Ведь в природе они часто населяют одни и те же биотопы. По нашему мнению, уровни тепловой выносливости животных лишь опосредованно, коррелятивно связаны с их адаптивными свойствами. Другими словами, бо́льшая тепловая выносливость клеток и тканей какого-либо вида рептилий может не говорить о том, что при потеплении климата он будет иметь какие-то адаптивные преимущества по сравнению с менее температурно выносливыми видами. Просто менее температурно выносливые виды изменят свои пространственно-временные структуры активности и, таким образом, останутся в рамках своих термальных ниш со своими видоспецифичными параметрами гомеостаза.
Связь температуры тела при активности и терморезистентности организма в целом у холоднокровных животных
Табл. 2. демонстрирует результаты наших исследований по термобиологии некоторых среднеазиатских аридных ящериц. Ранее мы выделили важный, на наш взгляд, показатель, имеющий большое адаптивное значение. «Запас температурной прочности вида» – диапазон температур тела между максимальной температурой полной активности и критическим максимумом (Черлин, 2012). Этот показатель важен, поскольку в ряде случаев может оказаться критичным.
Таблица 2. Термобиологические показатели активности и выносливости некоторых среднеазиатских аридных ящериц в Каракумах (Туркменистан) и Кызылкумах (Узбекистан) (по: Черлин, 1988, 2013а; Черлин, Музыченко, 1984)
| Виды животных | Диапазон температур полной активности (°С) | Диапазон термостабилиза- ции (°С) | Критический максимум (наступление теплового шока) (°С) | Запас темпера- турной прочности вида (°С) |
| Ушастая круглоголовка,
Phrynocephalus mystaceus |
36.0–44.2 | 38.8–39.8 | 49.0–49.5 | ~5.0-7.0 |
| Песчаная круглоголовка,
Ph. interscapularis |
37.5–45.0 | 40.5–41.5 | 48.5–49.5 | ~3.0-4.5 |
| Сетчатая ящурка,
Eremias grammica |
34.0–42.5 | 38.6–39.5 | 44.0–45.0 | ~1.5–3.0 |
| Полосатая ящурка,
E. scripta |
39.0–43.0 | 40.0–41.0 | 47.0–48.0 | ~4.0–5.0 |
| Сцинковый геккон,
Teratoscincus scincus |
16.0–33.0 | 27.5–33.0 | 41.0–43.8 | ~8.0–11.0 |
Данные табл. 2 показывают, что рептилии, экологически приуроченные к дневным условиям жарких среднеазиатских пустынь, имеют чаще всего высокие уровни температурных характеристик активности. Им же свойственны и высокие температуры критического максимума. При этом изученные нами дневные агамиды имеют явно более высокие критические максимумы по сравнению с дневными же лацертидами.
Также из табл. 2 видно, что в Каракумах у ушастой круглоголовки Phrynocephalus mystaceus максимальная температура полной активности около 42–43°, а критический максимум около 49°, т.е. запас температурной прочности может достигать примерно 7°. У обитающей в том же месте сетчатой ящурки максимальная температура полной активности около 40–41.5°, а критический максимум около 43–44°, т.е. запас температурной прочности не более 1.5–3°. Получается, что сетчатая ящурка живет практически на верхней границе своей температурной выносливости, т.е. периодически буквально «ходит по лезвию бритвы» (Черлин, 2012). Но при этом она живет в этих условиях вполне успешно.
Таким образом, запас температурной прочности вида показывает неоднозначность связи между температурными предпочтениями ящериц при активности и их температурной выносливостью. Это явно связано с различными морфофизиологическими механизмами, устанавливающими эти показатели. Скорее всего, характеристики активности связаны в основном с установочной температурой в центре терморегуляции центральной нервной системы, а температурная выносливость – с тепловым повреждением клеток или с тепловой дезинтеграцией клеточных функций в центральной нервной системе (Калинникова и др., 2018; об этом далее). Не исключено, что параметры тепловой выносливости клеток и тканей (а следовательно, и организма в целом) не прямо, а лишь опосредованно связаны с группоспецифичным (например, со специфичным для родов) составом белков и некими их биохимическими свойствами.
Связь температуры тела, терморезистентности клеток, тканей и организма в целом с климатическими условиями обитания у холоднокровных животных
У холоднокровных животных, не способных по объективным, прежде всего внутренним, причинам более или менее точно регулировать температуру своего тела, связь термобиологических характеристик и климатических условий обитания отчетливо более тесная. Так, исследования теплоустойчивости, проведенные на свободноживущей почвенной нематоде Caenorhabditis elegans, показали, что причиной повреждающего, негативного влияния тепла на организм этих животных является тепловая дезинтеграция клеточных функций. Тепловые нарушения интеграции функций клеток в теле животного, в свою очередь, являются следствием нарушения интегративных функций нервной системы, которые проявляются при интенсивности и продолжительности теплового стресса, подпорогового для теплового повреждения нейронов (Калинникова и др., 2018).
Организмы малоподвижных или сидячих пойкилотермных (эктотермных) животных из-за слабой системы терморегуляции настроены в процессе эволюции на температурные условия их экологических ниш, которые варьируют в широких пределах (Пианка, 1981; Проссер, 1977; Шмидт-Ниельсен, 1982).
«В целом анализ многочисленных исследований негативного влияния превышения физиологического оптимума температуры на поведение и выживаемость организмов пойкилотермных животных различных таксономических групп (низшие беспозвоночные, высшие беспозвоночные и пойкилотермные позвоночные) и на клетки, выделенные из этих организмов, позволил сделать следующие выводы:
- Прогрессивное усложнение организмов в ходе эволюции Metazoa уже на ранней стадии (низшие беспозвоночные с простой нервной системой) привело к качественному изменению механизмов негативного влияния тепла на функции и выживаемость организмов Metazoa. Если причиной негативного влияния гипертермии на функции и выживаемость организмов Protozoa и простых организмов Metazoa без нервной системы (губки) является тепловое повреждение клеток, то у низших беспозвоночных (нематоды), высших беспозвоночных и пойкилотермных позвоночных причиной негативного влияния тепла на организм животного является тепловая дезинтеграция клеточных функций. В свою очередь, тепловые нарушения интеграции функций клеток в теле животного являются следствием нарушения интегративных функций нервной системы, которые проявляются при интенсивности и продолжительности теплового стресса, подпорогового для теплового повреждения нейронов.
- Свободноживущая почвенная нематода C. elegans является удобным модельным организмом для изучения как молекулярных механизмов тепловой дезинтеграции нейронов в их ансамблях, так и для моделирования процессов эволюции термотолерантности с использованием лабораторных популяций пойкилотермных животных» (Калинникова и др., 2018; с. 49).
В пустынях Каракумы и Кызылкумы, в других регионах и природных зонах мы долгое время изучали термобиологию и экологию обитающих там рептилий, их тепловую выносливость. В качестве примера можно рассмотреть герпетофауну западных Кызылкумов. Даже беглого взгляда на табл. 3 достаточно, чтобы заметить значительные различия в термобиологических показателях у обитающих там видов пресмыкающихся. Исходя из этого можно сделать первый вывод: в одном и том же месте даже в достаточно экстремальных аридных условиях вполне благополучно живут рептилии с очень разными температурными характеристиками активности.
Таблица 3. Температурные характеристики активности некоторых видов рептилий западных Кызылкумов
| Виды | Min t° полной актив-ности* | Max t° полной актив-ности | Диапазон термоста-билиза- ции ** | Источник |
| Круглоголовка песчаная, Phrynocephalus interscapularis | 37.5 | 45.0 | 40.5–41.5 | Черлин, Музыченко, 1983, 1988 |
| Круглоголовка ушастая, Ph. mystaceus | 36.0 | 44.2 | 38.8–39.8 | Черлин, Музыченко, 1983, 1988 |
| Агама степная Trapelus sanguinolentus | 37.0 | 44.5 | 38.0–42.0 | Черлин, 1988 |
| Варан серый, Varanus griseus | 34.0 | 40.6 | 36.0–39.0 | Целлариус и др., 1991 |
| Ящурка сетчатая, Eremias grammica | 34.0 | 42.5 | 38.6–39.5 | Черлин, Музыченко, 1983, 1988 |
| Ящурка быстрая, E. velox | 36.0 | 41.0 | 39.5 | Черлин, Чикин, 1991 |
| Ящурка линейчатая, E. lineolata | 34.0 | 41.0 | 35.0–37.5 | Черлин, 2019 |
| Стрела-змея, Psammophis lineolatus | 32.0 | 40.4 | 34.0–40.0 | Черлин, 2013б |
| Геккон серый, Mediodactylus russowii | 11.0 | 42.5 | 37.0–40.0 | Черлин, 1988 |
| Ящурка средняя, E. intermedia | 32.0 | 39.0 | 32.5–37.5 | Черлин, 2019 |
| Черепаха среднеазиатская, Agrionemys horsfieldi | 27.0 | 36.5 | 32.0–34.0 | Черлин, 2012 |
| Полоз чешуелобый, Spalerosophis diadema | 28.0 | 34.5 | 28.8–32.4 | Черлин, 2013б |
| Эфа среднеазиатская, Echis multisquamatus | 25.0 | 34.0 | 30.0–32.0 | Черлин, 2013б |
| Гологлаз пустынный, Ablepharus deserti | 25.0 | 33.0 | 27.0–31.0 | Черлин, 2012а |
| Геккон каспийский, Cyrtopodion caspius | 23.0 | 36.0 | 26.0–32.0 | Черлин, 2012а |
| Геккон сцинковый, Teratoscincus scincus | 16.0 | 33.0 | 27.5–33.0 | Черлин, 2013а; Черлин и др., 1983 |
| Геккон гребнепалый, Crossobamon eversmanni | 18.0 | 32.0 | 28.0–32.0 | Черлин, 2013а |
| Гюрза Чернова, Macrovipera lebetina černovi | 17.0 | 34.0 | 27.0–30.0 | Черлин, Шепилов, 2014 |
Примечание. * Полная активность – животные находятся в физиологическом состоянии, в
полной мере обеспечивающем эффективное протекание всех основных поведенческих
актов (локомоции, терморегуляция, питание, сексуальность, территориальность,
защита, коммуникации и т.п.). В этом состоянии движения рептилий активны, быстры
(адекватно видовым особенностям) и точны (Черлин, 2014).
** Диапазон термостабилизации – довольно узкий диапазон высоких температур
тела, который рептилии, находясь в состоянии полной активности, направленно и
оперативно поддерживают.
Необходимо обратить внимание на ряд важных обстоятельств. Во-первых, на одной и той же площади, например в Кызылкумах, существует значительное разнообразие основных биотопов: дневная пустыня с ячеистыми песками; ночная пустыня; обрывы коренного берега Амударьи днем; то же ночью; тугайный лес днем; то же ночью и т.п. Все эти биотопы обладают специфическими микроклиматическими условиями по всем показателям: температурно-влажностному режиму, освещенности и т.п. Во-вторых, между разными видами рептилий существуют порой весьма значительные различия в массе тела (от 1 до 3 порядков) и других особенностях, очень сильно отражающихся на процессах теплообмена со средой. В-третьих, огромное нивелирующее влияние на связь температур тела и среды оказывают терморегуляционное и другие формы поведения (способность или неспособность залезать на ветки, активность использования нор и т.п.). В-четвертых, сами термобиологические показатели активности, как выяснилось, не всегда напрямую связаны с климатом района обитания (Черлин, 1989б). Так, в одних и тех же биотопах в одно и то же время в Каракумах и Кызылкумах живут ушастая и песчаная круглоголовки, которые имеют немного различные диапазоны термостабилизации: соответственно 38.8–39.8° и 40.5–41.5° (Черлин, Музыченко, 1988). Критические максимумы температуры тела при этом у данных видов примерно одинаковые (48.0–50.0°). У серого геккона, живущего на стволах деревьев и не уходящего в убежища даже в самое жаркое время суток, критический максимум 43.5–44.0°, а у сцинкового геккона, обитающего там же, но встречающегося на поверхности только ночью, этот показатель 41.0–44.,0° (Черлин, Музыченко, 1984), т.е. эти цифры вполне сопоставимы. Но диапазоны термостабилизации двух этих видов равны соответственно 36–40° (Черлин, 1983) и 27.5–33° (Черлин и др., 1983), т.е. значительно различаются. При сравнении ушастых круглоголовок и сетчатых ящурок видно, что их модальные диапазоны термостабилизации очень сходны (38.8–39.8°), а критические максимумы различны (соответственно 49.0–49.5° и 44.0–45.0°) (Черлин, Музыченко, 1983б, 1988). Все это приводит к тому, что в одном и том же месте могут обитать виды как очень высокотемпературные, так и типичные мезофилы. И действительно, почти половина видов (кроме, очевидно, группы наиболее термофильных), обладая своими показателями активности, могли бы обитать и в значительно более северных районах с более холодным и мягким климатом, включая степи и даже широколиственные леса. Но их там нет. Нетрудно такую же ситуацию экстраполировать и на другие районы, и на другой набор видов рептилий.
Принадлежность к группам термонейтрально или термостабильно активных рептилий (Черлин, 1983, 2012 и др.) также мало помогает в понимании специфики адаптации к разным климатическим зонам. Рептилии той или другой группы вполне успешно приспосабливаются к самому широкому спектру природно-климатических условий. Так, даже в жарких пустынях можно встретить представителей тех или других пресмыкающихся. В приведенном выше примере с герпетофауной Кызылкумов все агамиды, лацертиды и сцинциды относятся к термостабильно активным, а геккониды и змеи – к термонейтрально активным рептилиям. В таежной зоне, где климат холодный, также обитают, с одной стороны, прыткие и живородящие ящерицы, а с другой – обыкновенная гадюка и обыкновенный уж. И в пустыне, и в тайге обе группы пресмыкающихся вполне успешно приспосабливаются к природно-климатическим условиям, используя микробиотопическую и микроклиматическую мозаичность, разнообразие и формируя различные пространственно-временные структуры активности. Следовательно, и эти достаточно глубокие физиологические различия также не являются определяющими ни в адаптации к различным условиям среды, ни в географическом распространении пресмыкающихся.
Таким образом, можно сделать второй вывод: сами по себе термобиологические и другие показатели активности не являются специфическими адаптациями к климату данного региона.
Закономерности формирования пространственно-временной структуры активности, в свою очередь, базируются и на видоспецифичных физиологических, морфологических, поведенческих и других генетически фиксированных характеристиках. У близкородственных групп эти закономерности и многие характеристики часто бывают сходными (Черлин, 1989б и др.). Значит, если сравнивать близкородственные виды со сходными закономерностями, но с несколько различающимися абсолютными значениями указанных характеристик, то можно понять и объяснить разницу в их пространственно-временном, а также частично – биотопическом распределении и географическом размещении (Черлин, 1989б). Так, на адырах Нуратинского хребта (Узбекистан) в полосе шириной всего около 1 км встречаются совместно степная и туркестанская агамы. Температуры полной активности и модальные диапазоны термостабилизации у степных агам существенно выше, чем у туркестанских (табл. 4). В соответствии с этим степная агама населяет более жаркие остепненные открытые пространства низин около хребта, а туркестанская поднимается по ущельям и склонам в горы, где температуры среды более изменчивы, контрастны, к тому же их основной фон заметно ниже (Черлин, Чикин, 1991; Cherlin, 1989).
Подобное сравнение возможно и для туркестанской агамы и агамы Чернова, с которыми мы работали на хребте Кугитанг в Туркмении. Агамы Чернова выбирают заметно более низкие температуры тела и поэтому поднимаются намного выше в горы (более 2000 м над у.м.), чем туркестанские агамы (ниже 2000 м над у.м.). Агамы Чернова оказываются способны выдерживать большие перепады температур, для них характерно псевдо ТСП, когда они подолгу находятся на поверхности без солнца при достаточно низких температурах, располагаются на гребнях каменных выходов, чтобы лучше использовать ненадолго появляющееся солнце, и ожидают коротких периодов солнечной погоды для нагрева тела до температуры полной активности. Ниже по склонам, где живут туркестанские агамы, им будет явно жарко; при постоянно высокой температуре воздуха и горячих камнях им грозит там регулярный перегрев (Черлин, 2021).
Таблица 4. Термобиологические показатели двух видов горных агам (Черлин, 2021)
| Виды | Температуры полной активности, °С | Диапазон термостабилизации, °C | |
| min | max | ||
| Агама туркестанская, Laudakia lehmanni | 35.0 | 39.0 | 35.0–37.5;
Mo = 37.3 |
| Агама Чернова, Laudakia chernovi | 32.0 | 37.0 | 32.0–34.0;
Mo = 33.6 |
В Кызылкумах симпатрично, на одних и тех же участках, совместно обитают два вида ящурок – линейчатая (Eremias lineolate) и средняя (E. intermedia), которые существенно различаются по температурным характеристикам активности (табл. 5).
Таблица 5. Температурные характеристики активности двух видов ящурок западных Кызылкумов (Черлин, 2019)
| Виды | Минимальная температура полной активности | Максимальная температура полной активности | Диапазон термостаби- лизации |
| Ящурка линейчатая, Eremias lineolata | 34.0 | 41.0 | 35.0–37.5 |
| Ящурка средняя, E. intermedia | 32.0 | 39.0 | 32.5–37.5 |
Поддерживать видоспецифичные, различающиеся характеристики термального гомеостаза в одних и тех же биотопах помогает им поведенческая регуляция. Средние ящурки выбирают более затененные участки биотопов и часто используют для регуляции температуры тела норы, тогда как линейчатые, наоборот, чаще активны на достаточно открытых участках. Кроме того, они по-разному распределяют свою активность по температурам поверхности почвы и, следовательно, по времени суток (рис. 15).
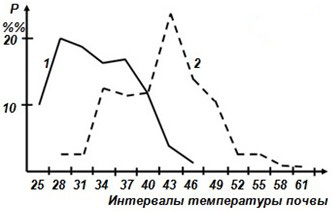
Рис. 15. Частота встреч двух видов ящурок при полной активности. Р – частота встреч в %%. 1 – средняя ящурка, 2 – линейчатая ящурка
Fig. 15. Frequency of occurrence of two species of racerunners (Eremias) at full activity. P – the frequency of meetings in %%. 1 – Eremias intermedia, 2 – E. lineolata
Можно рассматривать целые герпетокомплексы на одной территории, внутри которых у разных видов различны терморегуляторные стратегии и разнообразны пространственно-временные структуры активности. Один пример такого рода герпетофауна Кызылкумов уже приведен (табл. 3).
Другой пример – герпетофауна горных ущелий Нуратинского хребта, где можно встретить набор фоновых видов: степная (Trapelus sanguinolentus) и туркестанская агамы (Laudakia lehmanni), быстрая ящурка (Eremias velox), туркестанский геккон (Cyrtopodion fedtschenkoi) и желтопузик (Pseudopus apodus) (Черлин, Чикин, 1991; Cherlin, 1989). Их термобиологические показатели приведены в табл. 6.
Хорошо прогреваемые участки дна ущелий занимали в основном быстрые ящурки и степные агамы, имеющие самые высокие температуры полной активности и модальные диапазоны термостабилизации. Туркестанские агамы, способные свободно лазать по скалам и вертикальным поверхностям и имеющие немного более низкие температурные показатели активности, занимали в основном вертикальные склоны и отвесные поверхности камней и скал, тянущиеся намного выше в горы, которые хорошо прогревались солнцем, но не так длительно и регулярно, как дно ущелий внизу. А еще менее теплолюбивые туркестанские гекконы, которые мельче и легче агам, способные свободно передвигаться по вертикальным каменным поверхностям и потолку небольших пещер и пустот в скалах, ограниченно использовали открытые солнечные участки скал, в основном получая тепло от разогретых камней на склонах (как снаружи, так и внутри полостей, пустот и пещер). Желтопузики же, крупные, не умеющие лазать и ограниченно подвижные, с низким температурным предпочтением, могли населять только поймы саев и пологие глинисто-щебнистые поросшие травой склоны. Часто они держались недалеко от густых зарослей мяты и другой травы, растущей около родников. В качестве убежищ желтопузики использовали густые заросли травы, трещины скал и пустоты под камнями. Таким образом, распределение пресмыкающихся по стациям вполне соответствовало их термобиологическим показателям.
Таблица 6. Термобиологические показатели некоторых рептилий хребта Нуратау, Узбекистан (по: Черлин, 2012)
| Виды | Температура полной активности, °С | Диапазон термостабили- зации, °C | Температуры ночного покоя, °С | ||
| min | max | Весна | Лето | ||
| Агама степная, Trapelus sanguinolentus | 37.0 | 44.5 | 38.0–42.0 | ||
| Агама туркестанская, Laudakia lehmanni | 35.0 | 39.0 | 35.5–37.5
Mo = 37.3 |
18.0–20.0 | 25.0–27.0 |
| Геккон туркестанский, Cyrtopodion fedtshenkoi | 25.0 | 36.0 | 32.0–34.5
Mo = 33.3 |
18.0–20.0 | 25.0–27.0 |
| Ящурка быстрая,
Eremias velox |
36.0 | 41.0 | 39.0–41.0
Mo = 39.5 |
17.0–19.0 | 25.0–27.0 |
| Желтопузик, Pseudopus apodus | 25.0 | 30.0 | 27.0–30.0
Mo = 28.0 |
17.0–19.0 | 20.0–22.0 |
В результате оказывается, что в одних и тех же местах могут жить рептилии с очень разными термобиологическими характеристиками.
Теперь сравним термобиологические характеристики активности у нескольких видов змей, обитающих в очень различных по климатическим условиям регионах, – обыкновенной гадюки из Карелии, среднеазиатской гюрзы из горных районов Узбекистана и среднеазиатской эфы из южных среднеазиатских пустынь (табл. 7).
Таблица 7. Термобиологические показатели (°С) некоторых рептилий Средней Азии и севера Российской Федерации
| Виды | Температура полной активности, °С | Диапазон термоста- билизации, °С | Температуры ночного покоя, °С | Источники | |
| min | max | ||||
| Средняя Азия | |||||
| Гюрза Чернова, Macrovipera lebetina cernovi | 17.0 | 34.0 | 27.0–30.0 | 10.0–32.0 | Черлин, Шепилов, 2014 |
| Эфа среднеазиатская, Echis multisquamatus | 25.0 | 34.0 | 30.0–32.0 | 10.0–32.0 | Черлин, Целлариус, 1981 |
| Полоз чешуелобый, Spalerosophis diadema | 28.0 | 34.5 | 28.8–32.4 | 10.0–32.0 | Черлин, 2013б |
| Гологлаз пустынный, Ablepharus deserti | 25.0 | 33.0 | 27.0–31.0 | 15.0–25.0 | Черлин, 2012 |
| Геккон сцинковый, Teratoscincus scincus | 16.0 | 33.0 | 27.0–33.0 | 10.0–32.0 | Черлин и др., 1983 |
| Геккон гребнепалый, Crossobamon eversmanni | 18.0 | 32.0 | 28.0–32.0 | 10.0–32.0 | Черлин, 2013а |
| Север Российской Федерации | |||||
| Гадюка обыкновенная, Vipera berus | 28.0 | 37.0 | 32.0–35.0 | 10.0–20.0 | Коросов, 2010; Коросов, Ганюшина, 2020 |
| Ящерица живородящая, Lacerta vivipara | 26.8 | 33.0 | 28.8–32.5 | 10.0–15.0 | Черлин, 2012 |
| Ящерица прыткая, Lacerta agilis | 25.0 | 40.0 | 29.0–33.0 | 10.0–15.0 | Либерман, Покровская, 1943 |
Из сказанного выше можно сделать третий вывод: если ориентироваться только на термобиологические характеристики рептилий, описывающие показатели их активности, то невозможно объяснить закономерности их приуроченности к различным природно-климатическим зонам. Градиентные свойства среды и возможности модификации пространственно-временной структуры активности позволяли бы конкретным видам рептилий занимать значительно более широкий спектр природно-климатических условий, чем тот, который они реально занимают. Другими словами, эти характеристики не являются специфическими адаптивными к условиям данных природно-климатических зон.
Все отмеченное выше говорит о том, что связь между термобиологическими показателями рептилий и показателями природных условий среды не всегда однозначна. Между ними существует важный посредник, который и определяет возможность адаптации – это системы терморегуляции. Благодаря системам прежде всего поведенческой терморегуляции и некоторым физиологическим адаптациям рептилии как группа, имея потребность в нагреве тела хотя бы на недолгое время до уровней примерно от 28 до 42°, могут обитать как в экстремально жарких пустынях, так и в не менее экстремальных для их физиологии приполярных районах и высокогорьях.
Количество теплоты, полученное животным за сезон или год
Большое значение в адаптациях рептилий к условиям среды имеют не только прямые температурные воздействия, но и такой показатель, как «сумма эффективных температур», точнее – суммарное количество теплоты, которое получают рептилии, например, за год (табл. 8). Точное суммарное количество теплоты, выраженное в калориях, определить, конечно, чрезвычайно сложно, но можно рассчитать сравнительный показатель количества теплоты, которое получает животные за год, т.е. можно вычислить характеристику, которую возможно будет сравнивать у разных видов, – это сумма чисел, каждое из которых представляет собой произведение температуры тела (°С) на время, которое животное при этой температуре провело (час).
Подробная методика расчета этого показателя была разработана нами (Черлин, 2014). Например, ящерица провела 12 часов в норе при температуре тела примерно 25° (12 х 25 = 300), 6 часов при температуре тела 32° (6 х 32 = 192) (пока грелась, находилась в тени и т.п.) и 6 часов при температуре тела 37° в период полной активности на поверхности на солнце (6 х 37 = 222). Тогда сравнительный показатель количества теплоты за день будет 300 + 192 + 222 = 714. Упрощаем ситуацию и считаем, что весь год у ящерицы именно такой. Сравнительный показатель количества теплоты за год будет 714 х 365 = 260610. На самом же деле так не бывает: в году в данной географической локации бывает столько-то дней пасмурных, столько-то солнечных, бывает столько-то месяцев (т.е. часов), когда ящерицы могут поддерживать у себя такую температуру, а столько-то, когда их температура будет ниже, а сколько-то месяцев (часов) ящерицы вообще будут находиться в зимнем убежище при температуре тела около примерно 5 или 10°. Зная климатические характеристики региона, зная поведение ящериц, их экологию, режим их суточной и сезонной активности, можно рассчитать эти показатели для каждого такого отрезка времени, когда температура тела ящерицы примерно одинакова, и сложить их. Тогда мы получим близкий к реальному сравнительный показатель количества теплоты, полученной ящерицей за год. И такой расчет можно произвести по каждому виду, в каждой географической точке, за день, месяц или год.
Таблица 8. Сравнительный показатель количества теплоты (в град. х час.), полученной рептилиями данного вида за год (средние по нескольким регионам)
| Виды | Примерные границы диапазона температур полной активности | Сравнительный показатель количества теплоты (в тысячах) | %% | Источники | ||
| Min | Max | |||||
| За весь год | ||||||
| Гадюка обыкновенная (Vipera berus) | 13–40 | 46 | 85 | 69 | 100 | Saint-Grons, 1980; Юмашев, 1995; Коросов, 2010; Коросов, Ганюшина, 2020; Черлин, 2014 |
| Гюрза среднеазиатская (Macrovipera lebetina černovi) | 17–34 | – | – | 159 | 285 | Черлин, Шепилов, 2014; Черлин, 2014 |
| Гадюка армянская (Montivipera raddei) | 17–34 | – | – | 160 | 288 | Черлин, 2014 |
| Эфа среднеазиатская (Echis multisquamatus) | 25–34 | 180 | 181 | 180 | 324 | Черлин, Целлариус, 1981; Черлин, 2014 |
| Тропические удавы | 25–32 | – | – | 241 | 347 | Черлин, 2014 |
| Только за период активности (без зимовки) | ||||||
| Гадюка обыкновенная | – | 34 | 71 | 56 | 100 | Черлин, 2014 |
| Гюрза среднеазиатская | – | – | – | 119 | 215 | Черлин, 2014 |
| Гадюка армянская | – | – | – | 128 | 231 | Черлин, 2014 |
| Эфа среднеазиатская | – | 148 | 156 | 151 | 272 | Черлин, 2014 |
| Тропические удавы | – | – | – | 241 | 433 | Черлин, 2014 |
Табл. 8 показывает, что, несмотря на слабо различающиеся термобиологические характеристики активности у всех четырех приведенных в таблице видов гадюковых змей, обитателей северных лесов и болот вплоть до полярного круга (обыкновенная гадюка), горных областей Кавказа и Средней Азии (гюрза и армянская гадюка) и равнинных южных пустынь средней Азии (среднеазиатская эфа), безусловные различия в климатических условиях обитания приводят к тому, что получаемое ими годовое количество теплоты может различаться более чем в 4 раза. А это серьезно отражается на возможностях их годичных физиологических циклов, например питания и размножения, что, в свою очередь, самым непосредственным образом влияет не столько на возможность выживания этих змей в таких условиях как отдельных животных (отдельные животные могут выжить и в намного более широком спектре климатических условий), сколько на возможности поддерживать жизнеспособность их популяций (прежде всего возможность при беременности полностью созреть яйцам или эмбрионам), т.е. на выживание в таких условиях данного вида.
Какие характеристики и реакции животных могут считаться адаптивными к условиям изменения климата?
Изучая в свое время организацию термобиологической сферы у рептилий, мы предположили, что по крайней мере некоторые термофизиологические характеристики (верхняя и нижняя границы диапазона температур полной активности, предпочитаемые и критические температуры) являются у этих животных стабильно видоспецифичными и не различаются в разных географических регионах и климатических зонах, в разных популяциях (Черлин, Музыченко, 1988; Черлин, 1989а, б, 2012, 2014, 2015). Но серьезные экспериментальные работы в этой области с применением современной исследовательской техники и программного компьютерного обеспечения, проведенные проф. А.В.Коросовым, показали неоднозначность этого нашего утверждения (Коросов и др., 2021 и др.). По нашим современным представлениям, важнейшее значение имеет, видимо, корректная интерпретация результатов исследований. Являются ли популяционные и прочие различия между одними и теми же характеристиками в 0.5–2.0° чисто математическими, статистическими или они имеют серьезное функциональное, адаптивное значение? Пока этот важнейший вопрос остается без ответа…
Наши данные показывают, что, с одной стороны, в одних и тех же регионах могут обитать рептилии с очень различающимися термобиологическими характеристиками. С другой стороны, в регионах с сильно различающимися климатическими условиями могут обитать рептилии с очень сходными термобиологическими характеристиками (Черлин, 2014, 2015). Причиной этого являются прекрасно развитые комплексы физиологической и особенно поведенческой терморегуляции, которые нивелируют жесткость связи между термобиологией и климатом места обитания у рептилий. Это обстоятельство говорит о том, что чисто числовое выражение термобиологических характеристик может иметь весьма неоднозначное адаптивное значение. В таких условиях совершенно очевидно, что данная проблема является важной и сложной и требует дальнейшего изучения.
Заключение
Выводы о возможном влиянии изменений климата на термобиологические показатели при активности и терморезистентности у холоднокровных животных
Приведенные материалы демонстрируют, что один и тот же вид животных, у которых хорошо развита поведенческая терморегуляция (в данном случае это рептилии), может успешно жить в более теплых или более прохладных условиях, поскольку животные могут эффективно регулировать температуру тела, которая остается у них в одном и том же желательном диапазоне даже при достаточно широких колебаниях климатических температур. Это их свойство позволяет некоторым из них населять территории с очень различающимся климатом. Например, живородящая ящерица (Zootoca vivipara) и обыкновенная гадюка (Vipera berus) успешно обитают в России почти от полярного круга до средних и даже некоторых южных регионов страны.
К сожалению, эти важные обстоятельства часто исследователями не учитываются. Так, например, в одной из недавно опубликованных статей обсуждается толерантность организмов пойкилотермных животных к высокой температуре среды (Калинникова и др., 2018). Эта тема обсуждалась в связи с возможностями адаптации к потеплению климата. При этом возможности регуляции температуры тела у разных групп животных авторами вообще не учитывались: «Организмы пойкилотермных животных из-за отсутствия системы терморегуляции в ходе эволюции настроены на температурные параметры их экологических ниш, и эта настройка проявляется не только в наличии у организма физиологического оптимума температуры, но и в способности переносить неблагоприятное снижение и повышение температуры окружающей среды, обусловленное изменениями сезона и климата» (Калинникова и др., 2018; с. 38). Но в этом обобщающем по смыслу утверждении имеется важное ошибочное допущение, предполагающее, что у пойкилотермных (эктотермных, холоднокровных) животных отсутствует система терморегуляции. Да, у сидячих, например, мидий, она, видимо, отсутствует, хотя не исключено, что даже у них могут присутствовать некоторые биохимические и физиологические реакции, способствующие их приспособлению к меняющимся температурам (к сожалению, подобных работ мы пока не встречали). Действительно, у почвенных нематод, которых, собственно, и изучали авторы упомянутой нами статьи, система терморегуляции, по всей видимости, развита слабо (но это авторы как раз не исследовали). Но у многих пойкилотермных (эктотермных, холоднокровных) животных, таких как, например, многие насекомые или некоторые рыбы и амфибии (в частности, ряд групп жаб), или тем более у рептилий системы поведенческой терморегуляции вполне хорошо развиты и очень эффективно работают. Отсюда, к сожалению, возникают многочисленные заблуждения и ошибки в общебиологических выводах из подобных работ.
В упомянутой нами статье изучаются механизмы теплового поражения, которые отождествляются с проблемой воздействия потепления климата. Но для слабо терморегулирующихся животных и для тех, кто активно и эффективно регулирует температуру тела с помощью поведенческих реакций, – это две разные проблемы. Поэтому экстраполировать данные о механизмах тепловой смерти, полученные на нематодах, на проблему приспособления позвоночных животных к потеплению климата, по нашему мнению, вообще некорректно. Решать проблему адаптации животных к потеплению климата нужно совершенно другими способами.
У животных, которые по ряду причин слабо или вообще не регулируют температуру тела (многие беспозвоночные, особенно малоподвижные и сидячие, и низшие хордовые), термобиологические характеристики активности (подвижности, если она есть) и показатели терморезистентности (клеток, тканей или организма в целом) очень тесно связаны с температурными условиями внешней среды. Такие животные безальтернативно оказываются в условиях с меняющимися температурами и, чтобы выжить, они безусловно должны к ним адаптироваться прежде всего биохимическими или физиологическими способами.
Но у свободно передвигающихся животных (многих насекомых, позвоночных, прежде всего некоторых амфибий, всех рептилий и теплокровных), которые с помощью поведенческих реакций активно регулируют температура тела, более или менее успешно удерживая ее в физиологически необходимых границах, термобиологические характеристики активности должны быть связаны с тепловыми характеристиками внешней среды намного слабее, потому что поведенческие регуляторные механизмы нивелируют взаимодействие между ними. За счет разнообразных механизмов модификации пространственно-временной структуры активности эти животные могут эффективно сохранять параметры гомеостаза в очень широком спектре внешних температурных условий.
Эта ситуация очень логична и очевидна. Однако в действительности все происходит не совсем так, как можно было бы ожидать. В частности, материалы, приведенные в нашем обзоре, с одной стороны, показывают, что именно поведенческая терморегуляция позволяет животным с очень различающимися физиологическими требованиями к температуре успешно жить в одних и тех же, порой жестких климатических условиях. Так, например, симпатрично живут высокотемпературная линейчатая ящурка и намного более мезофильная средняя ящурка. Но, с другой стороны, та же поведенческая терморегуляция допускает обитание животных со сходными требованиями к температуре при активности в сильно различающихся климатических зонах (среднеазиатская эфа в южных пустынях Средней Азии и обыкновенная гадюка в приполярных зонах).
Кроме того, даже сама связь между термобиологическими характеристиками активности и показателями тепловой резистентности часто оказывается неоднозначной. Мы показывали это на конкретных примерах, приведенных в данной нашей статье, когда в жаркой пустыне могут симпатрично обитать ящерицы с высокими верхними границами температуры тела при активности (ушастая круглоголовка и сетчатая ящурка), но у круглоголовки тепловая резистентность заметно выше, чем у ящурки.
Однако, с другой стороны, можно отметить и иные закономерности, которые пока мы однозначно объяснить не можем. Так, при сравнении более термофильной закавказской ящурки и менее термофильной ящурки Штрауха получается, что, несмотря на хорошо развитую систему поведенческой терморегуляции, у более термофильной при активности закавказской ящурки температурная выносливость также оказывается немного выше, чему у более мезофильной ящурки Штрауха (Ушаков, Даревский, 1959). Как это может сформироваться при такой системе терморегуляции – пока не понятно. И в чем тогда биологический смысл того, что тепловая выносливость клеток и тканей закавказских ящурок выше, чем у ящурок Штрауха, если с критическими температурами в природе они никогда не сталкиваются?
Подобная ситуация в природе далеко не уникальна. И единственное логичное объяснение, которое нам представляется реальным, сводится к тому, что диапазон температур полной активности и тепловая резистентность устанавливаются разными механизмами, которые тем не менее каким-то образом биохимически, физиологически или генетически увязаны между собой. Их сопряженность в данном случае не результат отбора по каждому из признаков отдельно, а просто действует он на оба показателя одновременно. Недавние специальные исследования показали, что поведение и физиологическая пластичность по отношению к высоким температурам определенным образом связаны, что может повлиять на то, как организмы реагируют на повышение температуры (Domínguez–Guerrero et al., 2019). Но при этом повышение тепловой резистентности само по себе не всегда может оказываться адаптивно обусловленным.
Приведенные примеры, таким образом, демонстрируют странную ситуацию: в некоторых случаях у рептилий температурные показатели их активности и резистентности могут быть связаны между собой, а в некоторых случаях – нет. В некоторых случаях климатические условия обитания жестко связаны с термобиологическими характеристиками ящериц, а в некоторых – нет. Следовательно, можно предполагать, что в некоторых случаях глобальное потепление может сильно повлиять на возможность обитания ящериц в данном регионе, а в некоторых – нет… Тогда каким образом при потеплении климата отбор может отсеять менее термофильные виды рептилий, если они разнообразными поведенческими приемами нивелируют влияние температурных условий на организм, эффективно сохраняя в относительном постоянстве характеристики термального гомеостаза в широком спектре внешних условий? И вообще – имеет ли какое-то значение в адаптации к потеплению климата такая вроде бы важная характеристика, как тепловая резистентность, для животных с хорошо развитой поведенческой терморегуляцией? А если это для них важно, то по каким причинам и как это может действовать?
Удовлетворительный ответ на эти вопросы мы сами пока дать не можем и в литературе мы пока не нашли на них ответов. Тем не менее, по нашему представлению, то, что эти вопросы наконец сформулированы в такой отчетливой форме, дает направление дальнейшим исследованиям и внушает надежду на возможность решения в перспективе этих и многих сопряженных экологических и эволюционных проблем.
Библиография
Андроников В. Б. Пороговая температура теплового повреждения мускулатуры у лягушек и видоспецифичность клеточно-тканевой терморезистентности // Зоологический журнал. 1988. Т. 67, вып. 8. С. 1205–1213.
Беляев Г. М. Физиологические различия между представителями одних и тех же видов водных беспозвоночных в экологически различных водоемах // III экологическая конференция: Тезисы докладов. Ч. 2. Киев, 1954.
Ветеринарный энциклопедический словарь / Гл. ред. В. П. Шишков. М.: Советская энциклопедия, 1981. 640 с.
Голованов В. К. Поведенческая терморегуляция пресноводных рыб. Эколого-физиологические и биохимические механизмы // Физиологические, биохимические и молекулярно-генетические механизмы адаптаций гидробионтов: Материалы Всероссийской конференции с международным участием (Борок, 22–27 сентября 2012 г.). Кострома: Костромской печатный дом, 2012. С. 95–97.
Голованов В. К. Эколого-физиологические закономерности распределения и поведения пресноводных рыб в термоградиентных условиях // Вопросы ихтиологии. 2013. Т. 53, № 3. С. 286–314.
Калинникова Т. Б., Шагидуллин Р. Р., Колсанова Р. Р., Белова Е. Б., Гайнутдинов Т. М., Гайнутдинов М. Х. Эволюция толерантности организмов пойкилотермных животных к высокой температуре среды // Российский журнал прикладной экологии. 2018. № 3. С. 38–52.
Кароль И. Л., Киселев А. А. Парадоксы климата: Ледниковый период или обжигающий зной? . М.: АСТ-Пресс, 2013. 282 с.
Колсанова Р. Р., Калинникова Т. Б., Белова Е. Б., Гайнутдинов Т. М., Гайнутдинов М. Х. О роли холинергических синапсов в термотолерантности почвенных нематод Caenorhabditis elegans и Caenorhabditis briggsae // Вестник ОГУ. 2014. № 9 (170). С. 135–139.
Коросов А. В. Экология обыкновенной гадюки (Vipera berus L.) на Севере . Петрозаводск: Изд-во ПетрГУ, 2010. 264 с.
Коросов А. В., Ганюшина Н. Д. Методы оценки параметров терморегуляции рептилий (на примере обыкновенной гадюки, Vipera berus L.) // Принципы экологии. 2020. № 4. С. 88–103.
Коросов А. В., Литвинов Н. А., Ганюшина Н. Д., Четанов Н. А. Параметры терморегуляции обыкновенной гадюки (Vipera berus L.) в разных частях ареала // Принципы экологии. 2021. № 3. С. 54–63.
Кутенков А. П. Экология травяной лягушки (Rana temporaria L., 1758) на Северо-западе России . Петрозаводск: Изд-во ПетрГУ, 2009. 140 с.
Кутенков А. П., Целлариус Н. Б. Особенности активности травяной лягушки (Rana temporaria) в Карелии // Зоологический журнал. 1988, Т. 67, вып. 7. С. 1038–1045.
Либерман С. С., Покровская И. В. Материалы по экологии прыткой ящерицы // Зоологический журнал. 1943. Т. 22, № 2. С. 247–256.
Мышкин И. Ю. Механизмы регуляции процессов жизнедеятельности . Ярославль: ЯрГУ, 2016. 48 с.
Пианка Э. Эволюционная экология . М.: Мир, 1981. 400 c.
Проссер Л. Температура // Сравнительная физиология животных / Под ред. Л. Проссера. М.: Мир, 1977. Т. 2. С. 84–209.
Рубакина В. А., Кубряков А. А., Станичный С. В. Сезонный и суточный ход температуры вод Черного моря по данным термопрофилирующих дрейфующих буев // Современные проблемы дистанционного зондирования Земли из космоса. 2019. Т. 16, № 5. С. 268–281.
Сапунов В. Б. Грядет глобальное похолодание . СПб.: АСТ, Астрель. 2010. 248 с.
Серхенов М. Э., Мурадова А. О., Кичикулова М. Т. Глобальное похолодание: вызовы и возможности. Будущее глобального потепления // Вестник науки. 2024. Т. 4, № 5 (74). С. 2004–2007.
Стрельников И. Д. Действие солнечной радиации и микроклимата на температуру тела и поведение личинок азиатской саранчи Locusta migratoria L. // Труды ЗИН АН СССР. 1935. Т. 2, № 4. С. 637–734.
Стрельников И. Д. Действие солнечной радиации на температуру тела некоторых литоральных животных // Доклады Академии наук СССР. 1945. Т. 47, № 8. C. 626–628.
Ушаков Б. П. Теплоустойчивость мускулатуры мидий и пиявок в связи с условиями существования вида // Зоологический журнал. 1955. Т. 34, вып. 3. С. 578–588.
Ушаков Б. П. Теплоустойчивость соматической мускулатуры земноводных в связи с условиями существования вида // Зоологический журнал. 1956. Т. 35, вып. 7. С. 953–964.
Ушаков Б. П. Теплоустойчивость тканей – видовой признак пойкилотермных животных // Зоологический журнал. 1959. Т. 38, вып. 9. С. 1292–1302.
Ушаков Б. П., Даревский И. С. Сравнение теплоустойчивости мышечных волокон и отношения к температуре у двух симпатрических видов полупустынных ящериц // Доклады Академии наук СССР. 1959. Т. 128, № 4. С. 833–835.
Целлариус А. Ю., Черлин В. А., Меньшиков Ю. Г. Предварительное сообщение о работах по изучению биологии Varanus griseus (Reptilia, Varanidae) в Средней Азии // Герпетологические исследования. Л.: ЛИСС, 1991. № 1. С. 61–103.
Черлин В. А. Способы адаптации пресмыкающихся к температурным условиям среды // Журнал общей биологии. 1983. Т. 44, № 6. С. 753–764.
Черлин В. А. К термобиологии серого геккона (Cyrtopodion russowi), полосатой ящурки (Eremias scripta) и степной агамы (Trapelus sanguinolentus) в Восточных Каракумах // Известия Академии наук Туркменской ССР. Серия биологических наук. 1988. № 5. С. 36–43.
Черлин В. А. Популяционные аспекты термальных адаптаций у пресмыкающихся // Проблемы популяционной экологии земноводных и пресмыкающихся. М., 1989. С. 135–172 (Итоги науки и техники. ВИНИТИ. Серия Зоология позвоночных, т. 17.)
Черлин В. А. Возрастная изменчивость термобиологических показателей у некоторых ящериц // Известия Академии наук Туркменской ССР. Серия биологических наук. 1989. № 1. С. 35–38.
Черлин В. А. Термобиология рептилий. Общая концепция СПб.: Русско-Балтийский информационный центр «БЛИЦ», 2012. 362 с.
Черлин В. А. Сравнение термобиологии сцинкового (Teratoscincus scincus scincus) и гребнепалого (Crossobamon eversmanni) гекконов // Вестник Тамбовского университета. Сер. Естественные и технические науки. 2013. Т. 18, вып. 6. С. 3110–3112.
Черлин В. А. Сравнение термобиологии трех видов змей Средней Азии (Echis multisquamatus, Spalerosophis diadema, Psammophis lineolatum) // Працi Украïнського герпетологiчного товариства. 2013. № 4. С. 184–189.
Черлин В. А. Рептилии: температура и экология . Saarbrücken: Lambert Academic Publishing, 2014. 442 с.
Черлин В. А. Тепловые адаптации рептилий и механизмы их формирования // Принципы экологии. 2015. T. 4, № 1. С. 17–76.
Черлин В. А. Термобиологический механизм пространственно-временного разобщения активности средней, Eremias intermedia, и линейчатой, E. lineolata, ящурок (Reptilia, Lacertidae) в Кызылкумах // Известия высших учебных заведений. Поволжский регион. Естественные науки. 2019. № 1. С. 162–174.
Черлин В. А. Термобиология и экология четырех видов агамовых ящериц в Средней Азии и на Северном Кавказе // Горные экосистемы и их компоненты: Материалы VIII Всероссийской конференции с международным участием, посвященной Году науки и технологий в Российской Федерации. 10–25 сентября 2021. Нальчик, 2021. С. 124–125.
Черлин В. А. Преадаптивность несократительного термогенеза в эволюции теплокровности у позвоночных // Успехи современной биологии. 2023. Т. 143, № 4. С. 375–392.
Черлин В. А. Феномен псилотермии и его значение в биологии позвоночных животных // Принципы экологии. 2025. (в печати).
Черлин В. А., Музыченко И. В. Термобиология и экология сетчатой ящурки (Eremias grammica), ушастой (Phrynocephalus mystaceus) и песчаной (Ph. interscapularis) круглоголовок летом в Каракумах // Зоологический журнал. 1983. Т. 62, № 6. С. 897–908.
Черлин В. А., Музыченко И. В. К методике определения критического максимума температуры тела некоторых среднеазиатских ящериц // Известия Академии наук Туркменской ССР. Серия биологических наук. 1984. № 5. С. 73–76.
Черлин В. А., Музыченко И. В. Сезонная изменчивость термобиологических показателей некоторых аридных ящериц // Зоологический журнал. 1988. Т. 67, № 3. С. 406–416.
Черлин В. А., Целлариус А. Ю. Зависимость поведения песчаной эфы, Echis multisquamatus Cherlin 1981 от температурных условий в Южной Туркмении // Фауна и экология амфибий и рептилий палеарктической Азии. Л.: Наука, 1981. С. 96–108. (Труды Зоологического института АН СССР, т. 101.)
Черлин В. А., Целлариус А. Ю., Громов А. В. К температурной биологии сцинкового геккона (Teratoscincus scincus) в Каракумах // Экология. 1983. № 2. С. 84–87.
Черлин В. А., Чикин Ю. А. К термобиологии ящериц горных районов Узбекистана // Герпетологические исследования. Л.: ЛИСС, 1991. № 1. С. 119–129.
Черлин В. А., Шепилов С. А. Термобиология среднеазиатской гюрзы (Macrovipera lebetina turanica) хребта Нуратау и гюрзы Чернова (Macrovipera lebetina černovi) западных Кызылкумов // Зоологический журнал. 2014. Т. 93, № 2. С. 242–247.
Шмидт-Ниельсен К. Физиология животных. Приспособление и среда . М.: Мир, 1982. Т. 1. 416 с.
Юмашев И. Ю. Термобиологические показатели обыкновенной гадюки в бассейне Верхней Волги // Первая конференция герпетологов Поволжья: Тез. докл. Тольятти, 1995. С. 63–65.
Bartholomew G. F., Bernd H. Endothermy in African Dung Beetles During Flight, Ball Making, and Ball Rolling // J. Exp. Biol. 1978. Vol. 73, Iss. 1. P. 65–83.
Battaglia P., Andaloro F., Consoli P., Esposito V., Malara D., Musolino S., Peda C., Romeo T. Feeding habits of the Atlantic bluefin tuna, Thunnus thynnus (L. 1758), in the central Mediterranean Sea (Strait of Messina) // Helgol. Mar. Res. 2013. Vol. 67. P. 97–107.
Cabezas-Cartes F., Fernández J. B., Duran F., Kubisch E. L. Potential benefits from global warming to the thermal biology and locomotor performance of an endangered Patagonian lizard // PeerJ. 2019. No:7:e7437.
Carey F. G., Kanwisher J. W., Brazier O., Gabrielson G., Casey J. G., Pratt H. L. Jr. Temperature and activities of a white shark, Carcharodon carcharias // Copeia. 1982. No 2. P. 254–260.
Compagno L. J. V. Bullhead, mackerel and carpet sharks (Heterodontiformes, Lamniformes and Orectolobiformes). Vol. 2. Food and Agriculture Organization of the United Nations. Rome, 2002. P. 109–115.
Cech J. J., Laurs R. M., Graham J. B. Temperature-induced changes in blood gas equilibria in the albacore, Thunnus alalunga, a warm-bodied tuna // J. exp. biol. 1984. Vol. 109, No 1. P. 21–34.
Domínguez–Guerrero S. F., Muñoz M. M., Pasten–Téllez D.de J., Arenas–Moreno D. M., Rodríguez–Miranda L. A., Manríquez–Morán N. L., Méndez–de la Cruz F. R. Interactions between thermoregulatory behavior and physiological acclimatization in a wild lizard population // J. Therm. Biol. 2019. Vol. 79. P. 135–143.
Goldman K. J. Regulation of body temperature in the white shark, Carcharodon carcharias // J. Comp. Physiol. B. 1997. Vol. 167. P. 423–429.
Goldman K. J., Anderson S. D., McCosker J. E., Klimley A. P. Temperature, swimming depth, and movements of a whiteshark at the South Farallon Islands, California // Klimley A. P., Ainley D. G. (eds.). Great white sharks: ecology and behavior. San Diego, CA: Academic Press, 1996. P. 111–120.
Holland K. N., Sibert J. R. Physiological thermoregulation in bigeye tuna, Thunnus dews // Environmental Biology of Fishes. 1994. Vol. 40. P. 319–327.
Kerr R. A. Mother Nature cools the greenhouse, but hotter times still lie ahead // Science. 2008. Vol. 230. P. 595.
Kubisch E. L., Fernández J. B., Ibargüengoytía N. R. Vulnerability to climate warming of Liolaemus pictus (Squamata, Liolaemidae), a lizard from the cold temperate climate in Patagonia, Argentina // J. Comp. Physiol. B. 2016. Vol. 186, No 2. P. 243–253.
Lambrinos J. G., Kleier C. C. Thermoregulation of juvenile Andean toads (Bufo spinulosus) at 4300 m // Journal of Thermal Biology. 2003. Vol. 28, No 1. P. 15–19.
Li H, Zhu J, Cheng Y, Zhuo F, Liu Y, Huang J, Taylor B, Luke B, Wang M, González-Moreno P. Daily activity patterns and body temperature of the Oriental migratory locust, Locusta migratoria manilensis (Meyen), in natural habitat // Front. Physiol. 2023. 14:1110998. DOI: 10.3389/fphys.2023.1110998
McCosker J. E. The white shark, Carcharodon carcharias, has a warm stomach // Copeia. 1987. No 1. P. 195–197.
Nakamura I., Matsumoto R., Sato K. Body temperature stability in the whale shark, the world's largest fish // J. Exp. Biol. 2020. Vol. 223, No 11: jeb210286.
Pearson O. P., Brandford D. F. Thermoregulation of lizards and toad at high altitudes in Peru // Copeia. 1976. № 1. P. 155–170.
Prokosch, J., Bernitz, Z., Bernitz, H., et al. Are animals shrinking due to climate change? Temperature-mediated selection on body mass in mountain wagtails // Oecologia. 2019. No 189. P. 841–849.
Saint-Girons H. Thermoregulation in reptiles with special reference to the tuatara and its ecophysiology // Tuatara. 1980. Vol. 24. No 2. P. 59–80.
Senanayake U. I., Siriwardana S., Weerakoon D. K., Wijesinghe M. R. Combating Extreme Tropical Seasonality: Use of Rock Crevices by the Critically Endangered Frog Nannophrys marmorata in Sri Lanka // Herpetological Conservation and Biology. 2019. Vol. 14, No 1. P. 261–268.
Sepulveda C. A., Dickson K. A., Bernal D., Graham J. B. Elevated red myotomal muscle temperatures in the most basal tuna species, Allothunnus fallai // J. Fish Biol. 2008. Vol. 73, Iss. 1. P. 241–249.
Sinsch U. Behavioural thermoregulation of the Andean toad (Bufo spinulosus) at high altitudes // Oecologia. 1989. Vol. 80, No 1. P. 32–38.
Teo S. L. H., Boustany A., Dewar H., Stokesbury M. J. W., Weng K. C., Beemer S., Seitz A. C., Farwell C. J., Prince E. D., Block B. A. Annual migrations, diving behavior, and thermal biology of Atlantic bluefin tuna, Thunnus thynnus, on their Gulf of Mexico breeding grounds // Mar. Biol. 2007. Vol. 151. P. 1–18.
Tricas T. C., McCosker J. E. Predatory behavior of the whiteshark (Carcharodon carcharias), with notes on its biology // Proc. Calif. Acad. Sci. 1984. Vol. 43. P. 221–238.
Wild K. H., Huey R. B., Pianka E. R., Clusella-Trullas S., Gilbert A. L., Miles D. B., Kearney M. R. Climate change and the cost-of-living squeeze in desert lizards // Science. 2025. Vol. 387, Iss. 6731. P. 303–309.
Wood R. Natural ups and downs // Nature. 2008. Vol. 453. P. 43–44.
Благодарности
Сердечно благодарю моих друзей И. Ю. Барсукова и И. Л. Окштейна за то, что нашли время и согласились обсуждать со мной темы, затронутые в этой статье.






 © 2011 - 2026
© 2011 - 2026