Введение
Закономерности формирования разнообразия многих групп организмов до сих пор остаются плохо исследованными (Decaens, 2010), т. к. определяются большим числом факторов, каждый из которых действует в своем пространственном масштабе. Факторами, определяющими разнообразие на низших уровнях иерархии (микромасштаб), могут быть способность к расселению, межвидовые взаимодействия, приводящие к разделению нишевого пространства, на уровне биогеоценоза (мезомасштаб) – физико-химические свойства почвы, тип растительности, а на более высоких уровнях иерархии (макромасштаб) – геологические, исторические и климатические (Ettema, Wardle, 2002; Coulson et al., 2003; Покаржевский и др., 2007). Одним из способов количественного оценивания вклада таких факторов в формирование общего видового разнообразия (γ) на какой-либо территории является сравнение относительной роли его компонентов, а именно инвентаризационного, т. е. внутри местообитания (α), и дифференцирующего, т. е. между местообитаниями (β), в различных масштабах исследования (Crist, Veech, 2006; Crist et al., 2003). Если α-компонента вносит наибольший вклад, то предполагается, что роль локальных факторов незначительна по сравнению с крупномасштабными процессами и количество видов в отдельном локусе является предсказуемой частью разнообразия. Напротив, в тех случаях, когда выше доля β-компоненты, это свидетельствует о том (в рамках модели), что локальные факторы вносят определяющий вклад в формирование разнообразия на низших уровнях иерархии масштабов. Ранее такой подход был успешно применен для определения закономерностей формирования видового разнообразия животных в водных и наземных экосистемах (Gering et al., 2003; Ribeiro et al., 2008; Bolger et al., 2014; Tsyganov et al., 2015; Kuznetsova, Saraeva, 2018; da Silva Lima et al., 2022; Vasenkova, Kuznetsova, 2022). Однако все они касаются тропических и бореальных лесов. Вместе с тем закономерности распределения организмов в тундровых ландшафтах могут отличаться от таковых лесных экосистем.
Коллемболы, или ногохвостки, являясь одной из самых многочисленных групп почвенных беспозвоночных от экватора до полярных пустынь, послужили модельной группой для анализа видового разнообразия в разных масштабах исследования. Их разнообразие интенсивно изучалось во многих регионах европейской части России, включая таежную и тундровую зоны (Бызова и др., 1986; Кузнецова, 2005; Taskaeva, 2009; Babenko, 2012; Babenko et al., 2017 и др.). В последнее время они часто используются в качестве объектов для изучения пространственных закономерностей распределения разнообразия (Kuznetsova, Saraeva, 2018; Kuznetsova et al., 2019; Vasenkova, Kuznetsova, 2022). Однако следует отметить, что эти исследования были проведены на территории таежной зоны и они показали, что наибольший вклад в видовое разнообразие коллембол вносит фактор региональной специфики, а также тип леса со свойственными ему особенностями подстилки. В то же время работ, касающихся иерархического подхода к изучению видового разнообразия коллембол тундровых экосистем, нами не обнаружено. Тундры являются важным резервуаром биоразнообразия и поддержания экосистем, содержащих большие запасы углерода (Crowther et al., 2019), характеризуются высоким видовым богатством ногохвосток (Potapov et al., 2023) и мозаичностью растительного покрова, обусловленного чередованием куртин мхов с лишайниками и/или травами (Тихомиров, 1956). Поэтому важно понимать, каким образом это разнообразие формируется и поддерживается.
Цель нашего исследования состояла в изучении разнообразия ногохвосток в тундрах в соответствии с разномасштабной (иерархической) гетерогенностью биотопа.
Материалы
Исследования проведены в пределах Печорской низменности в нижнем течении рек Уса и Адьзва, ландшафтно представляющую собой тундровую и лесотундровую равнину. Географически эта территория относится к Большеземельской тундре. В административном отношении ее образуют Ненецкий автономный округ и Республика Коми. Согласно геоботаническому районированию, исследуемая территория относится к подзоне южных гипоарктических (кустарниковых) тундр, зональным типом растительности которых являются кустарниковые сообщества, где господствует ерник и несколько видов ивы (филиколистная, лопарская, шерстистая, серо-голубая). В целом им свойственна флористическая бедность и постоянство видового состава. К возвышенным элементам рельефа (выпуклые участки водоразделов и склонов, бровки рек) и участкам с неблагоприятным гидротермическим режимом приурочены кустарничковые, кустарничково-травяно-лишайниково-моховые тундры (Растительность…, 1980). Район исследований относится к атлантико-арктической климатической области со значительной суровостью и континентальностью климата. Среднегодовая температура воздуха ‒ 5.5 °C, среднемесячная температура самого теплого месяца (июль) +13.4 ºC, самого холодного (январь) –20.3 °С. Среднегодовое количество осадков составляет 450‒500 мм. Исследуемая территория характеризуется распространением преимущественно сплошной многолетней мерзлоты, усиливающей суровость климатических условий.
Методы
В районе исследования нами было выделено четыре пробных площади, две из которых располагались в кустарниковых и две – в кустарничковых тундрах. Расстояние между кустарниковыми тундрами составило 11 км, между кустарничковыми – 15 км, а между кустарниковыми и кустарничковыми тундрами – 41 км. Растительный покров кустарниковых тундр образуют Betula nana L., Salix lanata L., Salix phylicifolia L., Salix glauca L., а кустарничковых – Vaccinium uliginosum L., Arctous alpina (L.) Niedz, V. vitis-idaea L., Empetrum hermaphroditum (Lange) Hagerup. На каждой пробной площади были выделены участки 20 х 20 м, в пределах которых было отобрано по 24 пробы размером 10 х 10 см. Для оценки влияния мозаичности растительного покрова на разнообразие коллембол внутри каждой пробной площади были выделены элементы микрогетерогенности растительности (моховые подушки, куртины лишайников и смешанные образцы, представленные травами, мхами, лишайниками, включая нижележащий органогенный горизонт на глубину до 5 см), которые рассматривались нами как внутренние однородные микробиотопы в пределах типа растительности. Из каждого микробиотопа было отобрано по 8 проб. Моховой покров, главным образом, состоял из Hylocomium splendens (Hedw.) Schimp и различных видов политрихума. Лишайники в основном были представлены родами Cetraria, Cladina и Cladonia и располагались рассеянно. Из трав наиболее обильными оказались Carex arctisibirica, Carex globularis L., Chamaenerion angustifoluim (L.) Scop, Eriophorum vaginatum L., E. scheuchzeri Hoppe, Calamagrostis neglecta (Ehrh.) Gaerth, Solidago virgaurea L., Euphrasia frigida Pugsl., Festuca ovina L., Veratrum lobelianum Bernh (Taskaeva et al., 2021). Все пробы были отобраны случайным образом, т. к. растительный покров тундр очень мозаичен. Так, если на долю лишайников в кустарниковых тундрах приходилось 10–15 %, то в кустарничковых – 30–50 %. Такое пятнистое распределение лишайников не позволило использовать регулярный метод отбора проб. Таким образом, было обработано 96 проб в четырех масштабах: ландшафт, тип растительности, тип микробиотопа, проба (табл. 1). Отбор почвенных образцов был произведен в конце августа 2015 г. в дождливую погоду при температуре воздуха 4‒6 °С.
Экстракция микроартропод была проведена в лаборатории Института биологии сразу же после прибытия с помощью воронок Тулльгрена до полного иссушения субстрата. Для идентификации коллембол были использованы определители (Fjellberg, 1998, 2007; Potapov, 2001).
Варьирование видового разнообразия коллембол оценивали с использованием показателей видового богатства (количество видов в образце, индекс Шеннона) и видовой структуры. В данной работе термины «видовое богатство» и «видовое разнообразие» (или просто разнообразие) используются как синонимы, несмотря на известное различие между ними (Vasenkova, Kuznetsova, 2022). Полноту выявления видового богатства оценивали с помощью кумулятивной кривой, которая показывает рост числа видов в зависимости от числа взятых проб. Матрицы числа видов по отдельным пробам анализировали с помощью индекса Chao2. Общее видовое богатство исследуемой территории (γ) было разделено на инвентаризационное – в пределах местообитания (α-разнообразие) и дифференцирующее – между местообитаниями (β-разнообразие) отдельно для каждого иерархического уровня (см. табл. 1) с использованием аддитивного подхода (Crist et al., 2003). Для каждого уровня α-разнообразие оценивали как среднее арифметическое количества видов (± ошибка среднего арифметического), обнаруженных в отдельных пробах (αsp), микробиотопах (αbt) или типе растительности (αvt). β-разнообразие также делили на три уровня: гетерогенность внутри проб (βsp = αbt – αsp), микробиотопов (βbt = αvt – αbt) и типов растительности (βvt = γ – αvt). Рассчитанные значения альфа- и бета-разнообразия проверялись на значимость отличий от аналогичных показателей для нуль-модели, предполагающей случайное распределение видов в пробах. Использовалась функция ‘adipart’ из пакета ‘vegan’ (Oksanen et al., 2012) с 999 повторениями и методом построения нуль- модели "r2dtable". Оценку различий между выборками проводили при помощи непараметрического критерия Манна – Уитни с пороговым уровнем значимости p < 0.05. Ординация сообществ коллембол исследуемых микробиотопов и типов растительности была проведена методом анализа главных компонент (PCA) на основе относительного обилия видов. Всего материал включает 23792 экземпляра из 96 проб. Все расчеты производили при помощи программ RStudio версия 4.2.2 (R Core Team, 2022) и PAST 4.0 (Hammer et al., 2001). Графики в среде R делали с использованием пакета ‘ggplot2’ (Wickham 2016).
Таблица 1. Иерархия местообитаний, изученных в Большеземельской тундре
| Уровень | Единицы измерения | Пространственный масштаб, м | Тип разнообразия |
| Ландшафт (n = 1) | Тундра | 105 | Общее богатство (γ) |
| Тип растительности (n = 2) | Кустарниковая кустарничковая |
103 | Между типами растительности (βvt) Внутри типов растительности (αvt) |
| Микробиотоп (n = 3) | Мхи Лишайники Смешанные образцы |
101 | Между типами микробиотопов (βbt) Внутри типов микробиотопов (αbt) |
| Проба (n = 96) | Пробы | 10-1 | Между пробами (βsp) Внутри проб (αsp) |
Результаты
Общая характеристика. В исследованных тундрах обнаружено 65 видов ногохвосток, большинство из которых широко распространены (приложение). Общая кривая накопления видов (рис. 1), полученная на основе всей выборки, показала, что видовой состав выявлен достаточно полно (93 % по оценке индекса Chao2). Наиболее многочисленными видами оказались Folsomia quadrioculata (Tullberg, 1871), Tetracanthella wahlgreni Axelson, 1907 и Protaphorura subarctica (Martynova, 1976), на долю которых приходится около 44 % всего населения. Эти таксоны также характеризовались высокой частотой встречаемости (> 68 % всей выборки). 14 видов были редкими и отмечены в одной-двух пробах. Количество таксонов в выборке варьировало от 2 до 23 при среднем значении 12.7 ± 0.3, а суммарная численность – от 0.5 до 90.0 тыс. экз./м2 при среднем значении 23.8 ± 1.9 (n = 96).
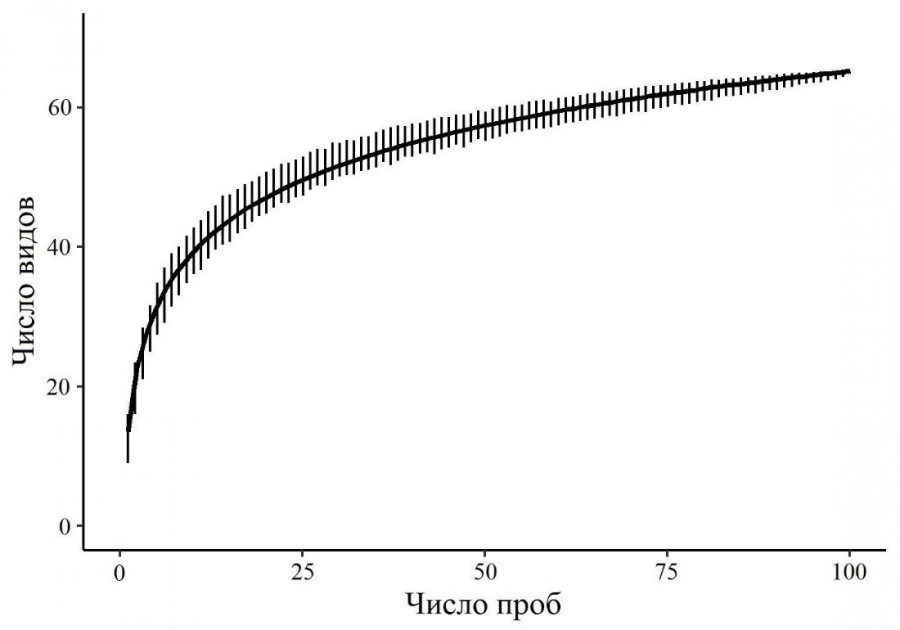
Рис. 1. Кривая накопления видов коллембол в зависимости от числа проб, отобранных в тундровых экосистемах. Cплошная линия – модельная кривая вида y = a + b * ln(x), где x – число проб, y – число видов, a = 13.63, b = 11.22
Fig. 1. The accumulation curve of the number of Collembola species in the sampling series depending on the number of sampless collected in tundra ecosystems. Solid line is the model curve of the form y = a + b * ln(x), where x is the number of samples, y is the number of species, a = 13.63, b = 11.22
Видовое разнообразие коллембол (иерархический подход). Анализ аддитивного распределения видового богатства свидетельствует о том, что общее (γ) разнообразие складывается на 80.5 % из β-разнообразия, причем 26.2 % обусловлены различиями на уровне типа растительности (βvt), на долю микробиотопических различий в пределах одного типа растительности (βbt) и различий между пробами в пределах одного типа биотопа (βsp) приходится около 25 и 30 % соответственно. Бета-разнообразие на всех уровнях иерархии (за исключением уровня проб) было значимо (p < 0.001) выше (рис. 2), чем это могло бы быть в случае случайного распределения видов. Альфа-разнообразие на уровне проб (αsp) оказалось ниже ожидаемого случайного (p < 0.001, см. рис. 2) и составило 19.5 % от общего видового богатства, наблюдаемого в ландшафтном масштабе (около 13 видов от общего гамма-разнообразия 65 видов).
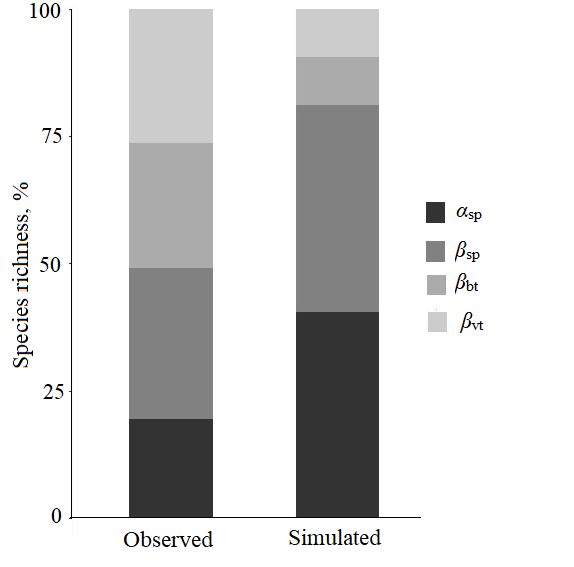
Рис. 2. Аддитивное парционирование разнообразия коллембол по пространственным масштабам в Большеземельской тундре. Вклад α-разнообразия и трех компонентов β-разнообразия, где αsp – среднее число видов на уровне проб, βsp – гетерогенность проб в пределах биотопа, βbt – различия биотопов внутри типов растительности, βvt – различия типов растительности в пределах ландшафта, observed – наблюдаемые данные, simulated – данные, ожидаемые при случайном распределении компонентов
Fig. 2. Additive partitioning of Сollembola diversity by spatial scales in the Bolshezemelskaya tundra. Contribution of the α-diversity and three β-diversity components: αsp– average species number at the sample level, βsp – heterogeneity of samples within biotope, βbt – differences of biotopes within vegetation types, βvt – differences of vegetation types within landscape, observed – observed data, simulated – data expected with a random distribution of components
На уровне типа растительности максимальное число видов зарегистрировано в кустарничковых (54), а наименьшее (42) – в кустарниковых тундрах. Вклад α-компоненты в общее γ-разнообразие варьировал в пределах 24‒29 % и был значимо (p < 0.001) ниже, чем при случайном распределении. При этом вклад β-компоненты (βsp + βbt) составил 38‒44 %. На уровне типа микробиотопа общее число видов коллембол не различалось и составило 47‒51 вид. Отдельный анализ распределения для каждого микробиотопа показал, что α-разнообразие варьировало от 23 до 34 %, при этом его минимальное значение отмечено в микробиотопе с преобладанием мхов (23 %), а β-компонента изменялась в пределах 38–49 % с максимальным показателем (49 %) в органогенном горизонте под моховыми подушками.
Таким образом, проведенный анализ иерархического разнообразия показал, что на всех уровнях вклад α-компоненты ниже, а β-компоненты выше, чем это было бы при случайном распределении видов, что позволяет рассматривать сообщества коллембол южных тундр как β-доминантные.
Структура населения. Видовое богатство и разнообразие, рассчитанное по индексу Шеннона, внутри различных типов тундр достоверно не изменялось. Однако средняя численность коллембол в кустарниковых тундрах оказалась значимо ниже, чем в кустарничковых (табл. 2). Кроме того, для ряда видов также отмечено влияние типа растительности. Так, численность D. neglecta, F. quadrioculata и T. wahlgreni достоверно снижалась в кустарниковых, а обилие D. tschernovi и I. minor, напротив, в кустарничковых тундрах (см. табл. 2). Распределение коллембол в микробиотопах также показало, что видовое богатство и разнообразие не изменялось. Однако значения численности значимо различались (табл. 3). Влияние микроместообитания оказалось достоверным только для трех видов. Так, численность F. quadrioculata, T. wahlgreni снижалась в моховой дернине, а D. tschernovi, напротив, увеличивалась (см. табл. 3).
Таблица 2. Характеристика сообществ коллембол в различных типах тундр
| Параметры | Тундры | |
| кустарниковые | кустарничковые | |
| Общее число видов | 42 | 54 |
| Видовое богатство, S | 12.2 ± 0.4a | 13.2 ± 0.5a |
| Видовое разнообразие, Н' | 1.8 ± 0.04a | 1.8 ± 0.05a |
| Средняя численность, экз./м2 | 17562 ± 1780a | 30022 ± 3110b |
| Desoria neglecta (Schäffer, 1900) | 94 ± 32a | 1118 ± 270b |
| Desoria tschernovi (Martynova, 1974) | 1342 ± 237a | 30 ± 19b |
| Folsomia amplissima Potapov et Babenko, 2000 | 906 ± 305a | 430 ± 132a |
| Folsomia quadrioculata (Tullberg, 1871) | 1968 ± 372a | 8664 ± 1770b |
| Isotomiella minor (Schäffer, 1896) | 1590 ± 411a | 638 ± 243b |
| Pachyotoma miserabilis Potapov, 2017 | 1254 ± 288a | 1170 ± 347a |
| Parisotoma notabilis (Schäffer, 1896) | 1006 ± 156a | 1076 ± 206a |
| Protaphorura boedvarssoni Pomorski, 1993 | 480 ± 121a | 370 ± 152a |
| Protaphorura subarctica (Martynova, 1976) | 3170 ± 613a | 2788 ± 599a |
| Tetracanthella wahlgreni Axelson, 1907 | 2182 ± 608a | 4254 ± 688b |
| Willemia anophthalma Börner, 1901 | 980 ± 460a | 1828 ± 414a |
Примечание. Разные буквы указывают на значимые различия между исследованными участками на основе теста Mann – Whitney при p < 0.05, одинаковые буквы – различия не выявлены.
Таблица 3. Характеристика сообществ коллембол в различных микроместообитаниях
| Параметры | Лишайники | Мхи | Смешанные образцы |
| Общее число видов | 50 | 51 | 47 |
| Видовое богатство | 12.5 ± 0.6a | 12.2 ± 0.5a | 13.6 ± 0.8a |
| Видовое разнообразие, Н' | 1.8 ± 0.1a | 1.8 ± 0.1a | 1.7 ± 0.1a |
| Общая численность, экз./
м2 |
25078 ± 3098a | 17742 ± 2154b | 31521 ± 4510a |
| Desoria neglecta | 528 ± 209a | 309 ± 149a | 1120 ± 388a |
| Desoria tschernovi | 154 ± 65a | 1014 ± 254b | 703 ± 248a |
| Folsomia amplissima | 868 ± 369a | 595 ± 378a | 583 ± 122a |
| Folsomia quadrioculata | 5400 ± 1613a | 2628 ± 584b | 9221 ± 2672a |
| Isotomiella minor | 989 ± 562a | 1128 ± 342a | 1214 ± 402a |
| Pachyotoma miserabilis | 1289± 452a | 930 ± 261a | 1555 ± 513a |
| Parisotoma notabilis | 925 ± 154a | 1167 ± 190a | 965 ± 313a |
| Protaphorura boedvarssoni | 146 ± 47a | 737 ± 207a | 231 ± 87a |
| Protaphorura subarctica | 2664 ± 701a | 2067 ± 610a | 4634 ± 891a |
| Tetracanthella wahlgreni | 4261 ± 824a | 1209 ± 306b | 5190 ± 1201a |
| Willemia anophthalma | 857 ± 302a | 1402 ± 562a | 1934 ± 610a |
Примечание. Разные буквы указывают на значимые различия между исследованными участками на основе теста Mann – Whitney при p < 0.05, одинаковые буквы – различия не выявлены.
Результаты анализа главных компонент, полученные для разных типов растительности, свидетельствуют о том, что первые две оси объясняют 36.5 % общей дисперсии видовой структуры сообществ коллембол, внутри которой выделилось три группы проб (рис. 3а). Первая из них, расположенная в левой части диаграммы ординации, наиболее гомогенная и включала пробы, отобранные исключительно в кустарничковых тундрах. Вторая и третья группы образованы локальными сообществами ногохвосток из кустарниковой тундры. Рис. 3б отражает изменения сообществ коллембол на уровне типа микробиотопа, где четко выделилось две группы проб: куртин лишайников и моховых подушек. Большие вариации в распределении точек для смешанных образцов свидетельствуют о том, что этот тип микробиотопа характеризуется существенной гетерогенностью видового состава и отсутствием индикаторных видов.
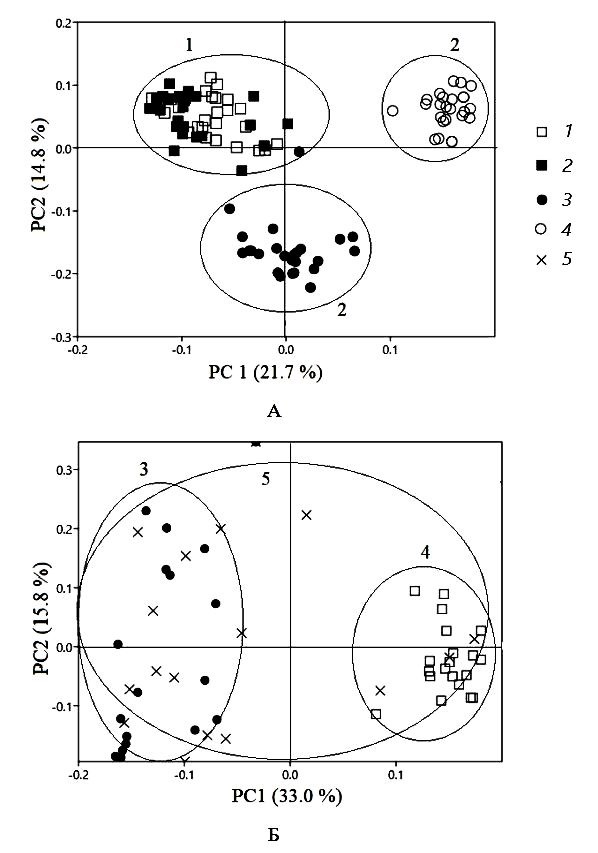
Рис. 3. Диаграмма анализа главных компонент (PCA), отражающая вариации локальных сообществ, формирующихся в разных типах растительности (А) и микробиотопах (Б), где 1 – кустарничковые (1 – участок 1, 2 – участок 2), 2 – кустарниковые тундры (3 – участок 3, 4 – участок 4), 3 – куртины лишайников (3), 4 – моховые подушки (1), 5 – смешанные образцы (5)
Fig. 3. PCA ordination diagrams reflecting variation of local communities formed in different types of vegetation (A) and microbiotopes (B), where 1 – low bush tundra (1 – plot 1, 2 – plot 2), 2 – shrubby tundra (3 – plot 3, 4 – plot 4), 3 – lichen beds (3), 4 – mosses (1), 5 – mixed samples (5)
Обсуждение
Видовое разнообразие (65 видов) коллембол изученного нами ландшафта является достаточно высоким и вполне сопоставимо с богатством локальных фаун восточно-европейских тундр. Предыдущие исследования, проведенные в материковой части востока Большеземельской тундры, свидетельствуют как о низких, так и высоких значениях видового разнообразия: 45‒72 вида (Таскаева и др., 2015, 2017; Taskaeva et al., 2019; Taskaeva, 2020). При этом это территории, заведомо отличающиеся разнообразными биогеоценозами. Такие различия могут быть обусловлены рядом причин, в т. ч. и количеством изученных почвенных образцов на одной пробной площади. Средние показатели видового богатства коллембол тундровых экосистем европейской части России варьируют в пределах 11‒49 видов в одном местообитании. Полученные нами результаты (27‒36 видов) укладываются в вышеуказанные данные.
Результаты аддитивного парционирования указывают на то, что на разных уровнях иерархии вклад α-компоненты меньше, а β-компоненты выше, чем это было бы при случайном распределении видов. Подобные закономерности позволяют рассматривать сообщества коллембол в пределах тундрового ландшафта как бета-доминантные, что в целом соответствует данным, полученным для таежных лесов (Kuznetsova, Saraeva, 2018; Vasenkova, Kuznetsova, 2022). Вклад типа растительности в общее разнообразие оказался выше, чем это могло бы быть в случае случайного распределения видов (см. рис. 2). Несмотря на большое сходство флоры пробных площадей внутри кустарниковых и кустарничковых тундр, сообщества коллембол кустарниковых тундр разделились на два кластера (см. рис. 3а). С одной стороны, это может быть обусловлено доминирующим видом кустарника. Если на первом участке господствует Betula nana L., содоминантами являются Salix lanata L., Salix phylicifolia L., Salix glauca L., то на втором участке вклад последних менее выражен. С другой стороны, рассмотренные участки различались мезорельефом, глубиной залегания вечной мерзлоты и влажностью (Taskaeva et al., 2021). Это лишь подтверждает предположение о том, что неоднородность микроклимата, порового пространства почвы и качества растительной подстилки, обусловленные видовым составом растений, являются важными детерминантами сообщества почвенных микроартропод (Hansen, 2000; Coulson et al., 2003; Mitchell et al., 2017). При этом влажность почвы, являющаяся для коллембол важным фактором, в восточно-европейских тундрах, судя по всему, не оказывает существенного влияния на их пространственное распределение (Taskaeva et al., 2021).
Вместе с тем нашими исследованиями установлено, что на уровне типа микробиотопа разнообразие коллембол может и не быть β-доминантным. Так, для микробиотопа, представленного лишайниками, вклад α- и β-компонент оказался сравнимым и составил 34 и 38 % соответственно. Это свидетельствует о том, что сообщества коллембол лишайниковых куртин в равной степени могут определяться популяционными, ценотическими и абиотическими факторами. На наш взгляд, это связано с тем, что лишайники сами по себе формируют достаточно однотипную среду вне зависимости от расположения в пространстве, что, соответственно, приводит к пространственной гомогенности сообществ коллембол. Аналогичные результаты были получены для коловраток, обитающих в эпилитных и эпифитных лишайниках (Fontaneto et al., 2011). Моховой покров, напротив, благодаря способности сглаживать колебания температуры (Soudzilovskaya et al., 2013) способствует созданию благоприятного микроклимата для коллембол. Поэтому любые изменения, вызванные, например, засухой или переизбытком осадков, приводят к изменению окружающей среды, которые в свою очередь оказывают влияние на разнообразие мхов и, в конечном итоге, на сообщества ногохвосток. Результаты анализа главных компонент (см. рис. 3б) подтверждают предположение о том, что функциональные группы и виды растений определяют структуру сообществ коллембол (Hansen, 2000; Coulson et al., 2003; Mitchell et al., 2017).
На уровне проб в среднем обнаружена пятая часть (12.7 вида) всего разнообразия коллембол рассмотренных тундровых экосистем. Это может быть обусловлено, с одной стороны, автокорреляцией распределения видов, а с другой, неоднородностью окружающей среды внутри однородных участков (биотопов), что было продемонстрировано предыдущими исследованиями (Tsyganov et al., 2015; Kuznetsova, Saraeva, 2018; Vasenkova, Kuznetsova, 2022). В целом результаты указывают на то, что условия окружающей среды играют важную роль в формировании разнообразия коллембол в разных пространственных масштабах ниже уровня ландшафта.
Заключение
Результаты использования мультимасштабного подхода для изучения структуры разнообразия коллембол тундрового ландшафта показали, что факторы, связанные с типом растительности, биотопа и неоднородностью распределения видов на уровне проб вносят одинаковый вклад. В то же время проведенное исследование подтверждает важность микробиотопов (особенно лишайниковых куртин) в тундрах в поддержании разнообразия коллембол. Оно показало, что вклад α- и β-разнообразия в общее видовое богатство (γ) может быть равнозначным, что служит дополнительным доказательством необходимости отбора проб под разными функциональными группами растений в различных пространственных масштабах. В целом полученные данные свидетельствуют о том, что разнообразие коллембол южных тундр характеризуется как β-доминантное на всех уровнях ландшафтной иерархии, что соответствует данным, полученным ранее для бореальных лесов.
Библиография
Бызова Ю. Б., Уваров А. В., Губина В. Г. и др. Почвенные беспозвоночные беломорских островов Кандалакшского заповедника . М.: Наука, 1986. 311 с.
Кузнецова Н. А. Организация сообществ почвообитающих коллембол . М.: ГНО Прометей, 2005. 244 с.
Покаржевский А. Д., Гонгальский К. Б., Зайцев А. С., Савин Ф. А. Пространственная экология почвенных животных.. М.: Товарищество науч. изд. КМК, 2007. 175 с.
Растительность европейской части СССР / Под ред. В. Д. Александрова, С. А. Грибова, Т. И. Исаченко, Е. М. Лавренко, Ю. Р. Шеляг-Сосонко. Л.: Наука, 1980. 429 с.
Таскаева А. А., Кудрин А. А., Конакова Т. Н., Колесникова А. А. Разнообразие почвенных беспозвоночных окрестностей Падимейских озер (Большеземельская тундра) // Евразиатский энтомологический журнал. 2015. № 14 (5). С. 480–488.
Таскаева А. А., Колесникова А. А., Конакова Т. Н., Кудрин А. А. Зооэдафон восточно-европейских тундр // Известия Коми научного центра УрО РАН. 2017. № 4 (32). С. 15–24.
Тихомиров Б. А. Некоторые вопросы структуры растительных сообществ Арктики // Академику В. Н. Сукачеву к 75-летию со дня рождения. М.: Изд-во АН СССР, 1956. С. 537–557.
Babenko A. B. Springtails (Hexapoda, Collembola) of Tundra Landscapes of the Kola Peninsula // Entomol Review. 2012. Vol. 92, № 5. P. 497–515. DOI: 10.1134/S0013873812050028
Babenko A. B., Potapov M. B., Taskaeva A. A. The Collembola fauna of the East-European tundra // Russian Entomological Journal. 2017. Vol. 26, № 1. P. 1–30. DOI: 10.15298/rusentj.26.1.01
Bardgett R. D., Wardle D. A. Above-belowground Linkages. Oxford: Oxford University Press, 2010. 320 p.
Bokhorst S., Wardle D. A., Nilsson M.-C., Gundale M. J. Impact of understory mosses and dwarf shrubs on soil micro-arthropods in a boreal forest chronosequence // Plant and Soil. 2014. Vol. 379. P. 121–133. DOI: 10.1007/s11104-014-2055-3
Bokhorst S., Asplund J., Kardol P., Wardle D. A. Lichen physiological traits and growth forms affect communities of associated invertebrates // Ecology. 2015. Vol. 96, № 9. P. 2394–2407. DOI: 10.1890/14-1030.1
Bolger T., Arroyo J., Kenny J., Caplice M. Hierarchical analysis of mite community structures in Irish forests – a study of the relative contribution of location, forest type and microhabitat // Applied Soil Ecology. 2014. Vol. 83. P. 39–43. DOI: 10.1016/j.apsoil.2013.06.004
Coulson S. I., Hodkinson I. D., Webb N. R. Microscale distribution patterns in high Arctic soil microarthropod communities: the influence of plant species within the vegetation mosaic // Ecography. 2003. Vol. 26. P. 801–809. DOI: 10.1111/j.0906-7590.2003.03646.x
Crist T. O., Veech J. A., Gering J. C., Summerville K. S. Partitioning species diversity across landscapes and regions: a hierarchical analysis of α-, β and γ-diversity // The American naturalist. 2003. Vol. 162, № 6. P. 734–743. DOI: 10.1086/378901
Crist T. O., Veech J. A. Additive partitioning of rarefaction curves and species–area relationships: unifying alpha, beta, and gamma diversity with sample size and habitat area // Ecology letters. 2006. Vol. 9. P. 923–932. DOI: 10.1111/j.1461-0248.2006.00941.x
Crowther T. W., van den Hoogen J., Wan J. et al. The global soil community and its influence on biogeochemistry // Science. 2019. Vol. 365 (6455). DOI: 10.1126/science.aav0550
da Silva Lima C. S., Maciel E. B., Clark F. J. K., Pessanha A. L. M. Does environmental heterogeneity explain βdiversity of estuarine fish assemblages? Example from a tropical estuary under the influence of a semiarid climate, Brazil // Plos One. 2022. Vol. 17, № 9. P. e0273765. DOI: 10.1371/journal.pone.0273765
Decaens T. Macroecological patterns in soil communities // Global Ecol. Biogeogr. 2010. Vol. 19. P. 287–302.
Eisenhauer N., Sabais A. C. W., Scheu S. Collembola species composition and diversity effects on ecosystem functioning vary with plant functional group identity // Soil Biol. Biochem. 2011. Vol. 43. P. 1697–1704. DOI: 10.1016/j.soilbio.2011.04.015
Ettema C. H., Wardle D. A. Spatial soil ecology // Trends in Ecology and Evolution. 2002. Vol. 17. P. 177‒183.
Fjellberg A. The Collembola of Fennoscandia and Denmark // Fauna Entomologica Scandinavica. Leiden: Brill, 1998. Vol. 35. 184 p.
Fjellberg A. The Collembola of Fennoscandia and Denmark. Part II: Entomobryomorpha and Symphypleona / Fauna Entomologica Scandinavica. Vol. 42. Leiden: Brill, 2007. 264 p.
Fontaneto D., Westberg M., Hortal J. Evidence of weakhabitat specialisation in microscopic animals // PLoS One. 2011. Vol. 6. P. e23969. DOI: 10.1371/journal.pone.0023969
Gering J. C., Crist T. O., Veech J. A. Additive partitioning of species diversity across multiple spatial scales: Implications for regional conservation of biodiversity // Conserv. Biol. 2003. Vol. 17. P. 488–499. DOI: 10.1046/j.1523-1739.2003.01465.x
Hammer Ø., Harper D. A., Ryan P. D. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia electronica. 2001. Vol. 4 (1). P. 1–9.
Hansen R. A. Effects of habitat complexity and composition on a diverse litter microarthropod assemblage // Ecology. 2000. Vol. 81. P. 1120–1132. DOI: 10.2307/177183
Hobbie S. E., Schimel J. P., Trumbore S. E., Randerson J. R. Controls over carbon storage and turnover in high latitude soils // Global. Change Biol. 2000. Vol. 6. P. 196–210. DOI: 10.1046/j.1365-2486.2000.06021.x
Kuznetsova N. A., Saraeva A. K. Beta-diversity partitioning approach in soil zoology: A case of Collembola in pine forests // Geoderma. 2018. Vol. 332. P. 142–152. DOI: 10.1016/j.geoderma.2017.09.030
Kuznetsova N. A., Bokova A. I., Saraeva A. K. et al. Structure of the Species Diversity of Soil Springtails (Hexapoda, Collembola) in Pine Forests of the Caucasus and the Russian Plain: a Multi-Scale Approach // Entmol. Rev. 2019. Vol. 99. P. 143–157. DOI: 10.1134/S0013873819020027
Leibold M. A., Holyoak M., Mouquet N. et al. The metacommunity concept: a framework for multi-scale community ecology // Ecology letters. 2004. Vol. 7 (7). P. 601–613. DOI: 10.1111/j.1461-0248.2004.00608.x
Mitchell R. J., Urpeth H. M., Britton A. J., Taylor A. R. Soil microarthropod-plant community relationships in alpine moss-sedge heath // Applies soil ecology. 2017. Vol. 111. P. 1–8. DOI: 10.1016/j.apsoil.2016.10.010
Potapov A. M., Guerra C. A., van den Hoogen J. et al. Globally invariant metabolism but density-diversity mismatch in springtails // Nature Communications. 2023. Vol. 14 (1). P. 674. DOI: 10.1038/s41467-023-36216-6
Potapov M. Synopses on Palaearctic Collembola. Vol. 3. Isotomidae. Görlitz, 2001. 601 p.
R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austri, 2022. URL: http://wwwR-project.org/
Ribeiro D. B., Prado P. I., Brown Jr. K. S., Freitas A. V. L. Additive partitioning of butterfly diversity in a fragmented landscape: importance of scale and implications for conservation // Diversity and Distributions. 2008. Vol. 14. P. 961–968. DOI: 10.1111/j.1472-4642.2008.00505.x
Soudzilovskaia N. A., van Bodegom P. M., Cornelissen J. H. Dominant bryophyte control over high-latitude soil temperature fluctuations predicted by heat transfer traits, field moisture regime and laws of thermal insulation // Functional Ecology. 2013. Vol. 27. P. 1442–1454. DOI: 10.1111/1365-2435.12127
Taskaeva A. A. Springtail (Collembola) assemblages in floodlands of the taiga zone of the Republic of Komi // Entomological review. 2009. Vol. 89, № 8. P. 965–974. DOI: 10.1134/S0013873809080119
Taskaeva A. Collembola of terrestrial ecosystems near Pymvashor stream (Subarctic Hydrothermal System) . 2020. Sampling event dataset. URL: https://www.gbif.org/dataset/d88c33a5-2534-4069-bdd2-a071029ef44c (дата обращения 25.03.2023). DOI: 10.15468/ty35e8
Taskaeva A. A., Konakova T. N., Kolesnikova A. A., Kudrin A. A., Panjukov A. N., Lapteva E. M. Spatial Distribution of Invertebrates in the Soils of the Southeastern Part of the Bolshezemelskaya Tundra // Biology Bulletin. 2021. Vol. 48, № 1. P. 94‒102. DOI: 10.1134/S1062359021010143
Taskaeva A. A., Mandrik E. A., Konakova T. N., Kudrin A. A. Characteristics of the Microarthropod Communities in Postagrogenic and Tundra Soils of the European Northeast of Russia // Eurasian soil science. 2019. Vol. 52, № 6. P. 661–670. DOI: 10.1134/S1064229319060127
Tsiafouli M. A., Kallimanis A. S., Katana E., Stamou G. P., Sgardelis S. P. Responses of soil microarthropods to experimental short-term manipulations of soil moisture // Applied Soil Ecology. 2005. Vol. 29. P. 17–26.
Tsyganov A. N., Komarov A. A., Mitchell E. A. et al. Additive partitioning of testate amoeba species diversity across habitat hierarchy within the pristine southern taiga landscape (Pechora-Ilych Biosphere Reserve, Russia) // European Journal of Protistology. 2015. Vol. 51 (1). P. 42–54. DOI: 10.1016/j.ejop.2014.11.003
Vasenkova N. V., Kuznetsova N. A. A multiscale approach to evaluate the structure of diversity of Collembola in boreo-nemoral forests of the Russian Plain // Nature Conservation Researche. Заповедная нука. 2022. Vol. 7 (Suppl. 1). P. 38–51. DOI: 10.24189/ncr.2022.019
Благодарности
Работа выполнена в рамках государственного задания ИБ ФИЦ Коми НЦ УрО РАН (регистрационный номер 122040600025-2).






 © 2011 - 2025
© 2011 - 2025