Введение
В процессе формирования экологического направления в паразитологии в научный оборот было введено понятие «паразитоценоз» (Павловский, 1934). Впоследствии для многовидового паразитарного населения отдельного хозяина было предложено много определений, но в литературе закрепились термины «сообщество» (community), «паразитоценоз» и «паразитофауна» (Балашов, 2000; Esch еt al., 1990). После длительного обсуждения процессов формирования сообществ выкристаллизовались две точки зрения. Взгляд на ассоциации паразитов в хозяине как на случайные скопления видов, не связанных межвидовой конкуренцией, характерен для изоляционистской концепции сообществ (Кеннеди, 1978; Rohde, 1993; Akani et al., 2011). Типичные характеристики изоляционистского сообщества установлены у гельминтов римского крота Talpa romana (Milazzo et al., 2002). Согласно концепции интерактивных сообществ, межвидовые взаимодействия регулируют численность видов и формирует структуру сообществ (Holmes, 1991; 2002). Отличия во взглядах на процессы образования компонентных сообществ сняты актуальной парадигмой, согласно которой реальные фауны паразитов располагаются между полностью изоляционистскими и всецело интерактивными сообществами (Janovy 2002; Poulin, Luque, 2003). Наибольшее внимание специалистов привлекают сообщества гельминтов рыб, птиц и млекопитающих (Пугачёв, 2000; Доровских и др., 2016; Иешко и др., 2019; Valtonen еt al., 2001; Randhawa, 2012; de Yamada et al., 2017, Spickett et al., 2017). Амфибии в этом отношении исследованы меньше (Буракова, 2010а; Тарасовская, 2013; Hamann et al., 2009; Langford et al., 2013; Vhora, Bolek, 2015; Kuzmin et al., 2020).
В предлагаемой работе продолжено изучение сообществ гельминтов, для которых R. arvalis в степной зоне Казахстана является окончательным хозяином. Цели исследования: 1) изучить структуру компонентных сообществ гельминтов R. arvalis из нативного (пойма р. Иртыш) и антропогенных биотопов (Большой Павлодар); 2) исследовать частоты формирования фактических сочетаний паразитических видов и сравнить их с ожидаемыми согласно нуль-гипотезе о случайном формировании; 3) сопоставить численность видов гельминтов в инфрасообществах.
Материалы
Материалом для работы послужили сборы половозрелых гельминтов R. arvalis из поймы р. Иртыш и антропогенных биотопов Большой Павлодар (Республика Казахстан). Два вида гельминтов – Opisthioglyphe ranaе (Froelich, 1791) (Plagiorchidae) и Oswaldocruzia filiformis (Goeze, 1782) (Trichostrongylidae) населяют тонкий отдел кишечника R. arvalis. Трематода Haplometra cylindracea (Zeder, 1800) (Plagiorchidae) и нематода Rhabdias bufonis (Schrank, 1788) (Rhabdiasidae) паразитируют в легких. Сосальщик Pleurogenes intermedius Issaitschikoff, 1926 (Pleurogenidae) обитает в полузакрытых капсулах в стенках нижних частей кишечника и мочевого пузыря хозяина. Данные по личиночным формам гельминтов – Strigia falkonis, Alaria alata, Tylodelphis excavata, Sphaerirostris teres и простейшим Opalina sp. исключили из анализа. Их рассматривали как единый фон, на котором формируются инфрасообщества половозрелых видов гельминтов. Наибольшее количество земноводных собрано в ходе гельминтологического мониторинга, который проводили в 1984–1997 гг. на правобережье р. Иртыш. Для этого на берегу протоки Усолка подобрали площадку (с тем же названием) длиной 500 и шириной 0.5–7.0 м. Данная часть нативного биотопа включает нерестовый водоем, заросший хвощем (Equisetum arvense L.), по берегам – тростником (Phragmites australis Cav. Trin. Ex Steud, 1840), расположен в 15 км выше г. Павлодар (52 12' 32.15'' СШ и 77 01' 05.70'' ВД). Нерестилище и экспериментальная площадка промываются родниками, изливающимися на неогеновых глинах ложа реки. Другое место сбора хозяев (Черноярка) расположено ниже по течению реки, в 50 км от пункта Усолка. Лягушек отлавливали у временного водоема, заполняющегося весной талыми и полыми водами и пересыхающего к концу июня. В зоне урбанизации (г. Павлодар) расположены три пункта. Три километра восточнее Усольского биотопа находится Яблонька. Здесь лягушек добывали возле неглубокого водоема, который образовался в понижении рельефа, оставшегося после строительства шоссе. Хозяев из биотопа под названием Карьер отлавливали на берегу озерца, возникшего в отработанном песчаном карьере. В пятой точке (АБС) амфибий собирали у котловины, ежегодно заполняющейся талыми и инфильтрационными водами из полей Черноярской агропромышленной фирмы. Пункт находится в 5 км на восток от Черноярки. Для сравнительного анализа компонентных сообществ гельминтов R. arvalis из нативного (Усолка) и урбанизированных биотопов данные по Карьеру, Яблоньке и АБС с учетом сходства в зараженности хозяина объединили в одну выборку под названием Большой Павлодар.
Методы
Хранение и вскрытие хозяев, сбор, окраску и просветление гельминтов проводили по общепринятым в гельминтологии методикам (Боев и др., 1962). Классификация сколецид соответствует системам, изложенным в работах К. М. Рыжикова с соавт. (1980), P. D. Olsson еt al. (2003), J. Kuzmin, V. Tkach, 2019. Теоретическую частоту инфрасообществ гельминтов рассчитывали по методике П. Грейг-Смита (Greig-Smith, 1967). Подсчет частоты, ожидаемой согласно нуль-гипотезе (Н0) о случайном образовании, показан в тексте. Теоретическую численность i-го вида гельминтов в j-м инфрасообществе подсчитывали по формуле: nij* = (ni/N) · Nj, где Nj – объем j-го ценоза, ni – число особей i-го вида в компонентном сообществе, N – количество инфрасообществ, · – знак умножения. Смещение обилия i-го вида к определенному паразитоценозу определяли с помощью показателя биотопической приуроченности вида Fij (Песенко, 1982). При обработке данных использовали индекс доминирования Ковнацкого (Баканов, 1987). Хозяев без гельминтов считали обладателями 0-ценозов, а инвазированных одним видом – одновидовыми инфрасообществами.
Результаты
Компонентные сообщества гельминтов остромордой лягушки
У 2319 вскрытых экземпляров R. arvalis в большинстве инфрасообществ отмечена доминантная (D = 30.0) нематода R. bufonis (76.1 ± 0.9 %). Ассоциации гельминтов с участием также обильной Os. filiformis (D = 15.1) обнаружены у 61.3 ± 1.0 % исследованных хозяев. Более половины R. arvalis (53.4 ± 1.0 %) обладают фаунами с доминантной O. ranae (D = 15.0). Ассоциации с P. intermedius найдены у 17.0 ± 0.8 % амфибий. Наименьшее количество остромордых лягушек содержат комплексы с участием H. cylindracea (11.9 ± 0.7 %). Два последних вида являются адоминантами, индекс доминирования равен соответственно 1.0 и 0.24. В компонентном сообществе из пяти видов гельминтов теоретически возможное число сочетаний равно 32, а каждый вид максимально участвует в образовании только 16 (Плохинский, 1970). У R. arvalis в пойме р. Иртыш найден 31 комплекс видов. Не установлен двухвидовой – H. cylindracea + P. intermedius. Интересно, что хотя отдельно его нет во всех наших сборах, он присутствует в семи более сложных фаунах у R. arvalis из Усолки и в одной из Большого Павлодара. Двухвидовые совокупности, образованные R. bufonis, Os. filiformis и O. ranae, вполне обычны.
Наименьшее количество комбинаций гельминтов отмечено у лягушек из АБС (9) и Карьера (11). В Черноярке и Яблоньке у R. arvalis установлено соответственно 17 и 19. В компонентных сообществах R. arvalis в пяти биотопах преобладают двухвидовые ценозы. Исключение составляют амфибии из Яблоньки, у которых процент одновидовых комплексов немного больше двухвидовых. Пониженное число сочетаний на Карьере связано с отсутствием у хозяина H. cylindracea. В пробах R. arvalis из Усолки, Карьера и Яблоньки наряду с двухвидовыми высока встречаемость трехвидовых комбинаций. На Усолке больше, чем в других биотопах, распространены четырехвидовые ассоциации. Пятивидовой гельминтоценоз отмечен только у амфибий из Усолки и Яблоньки. В пробах Черноярка и АБС частота одновидовых и нулевых ценозов повышена, низка доля трех- и четырехвидовых, отсутствуют пятивидовые. Такая структура паразитоценозов определяется тем, что совокупность хозяев в Черноярке и АБС ежегодно формируется из особей-мигрантов. Известно, что инфрасообщества с небольшим набором видов встречаются у хозяев чаще (Иешко и др., 2019; Poulin, 2006). Полученные нами данные еще раз подтверждают это положение.
По количеству видов в инфрасообществах условно выделили простые, состоящие из одного-двух, средние по сложности – из трех и сложные – из четырех-пяти видов. Так, в Усольском биотопе у 1073 экз. R. arvalis из возможных комбинаций гельминтов с участием R. bufonis найдены все 16 (рис. 1). Простые установлены у 477 экз., или у 44.5 % хозяев. Трехвидовые ценозы представлены у 36.2, а сложные – у 19.3 % амфибий. Отличие между долями простых и средних по сложности и между последними и сложными паразитофаунами достоверно. Критерии tφ равны соответственно 2.17 (α > 0.05) и 6.52 (α > 0.01). Число комплексов c Os. filiformis, состоящих из одного и двух видов, примерно такое же, как и из трех (рис. 1А). Количество четырех-пятивидовых сочетаний заметно меньше трехвидовых (tφ = 4.18, α > 0.01). Из всех сообществ R. arvalis, членом которых является O. ranae, самая большая доля принадлежит трехвидовым. Простые и сложные комбинации гельминтов отмечены у R. arvalis в почти в равной мере, по 28.2 и 27.9 % (рис. 1А). Разница между количеством средних по сложности и простых комплектов, с одной стороны, и сложных – с другой достоверны (tφ = 3.33 и 3.38, α > 0.05). Отсюда следует, что O. ranae причастна главным образом к образованию среднесложных инфрасообществ.
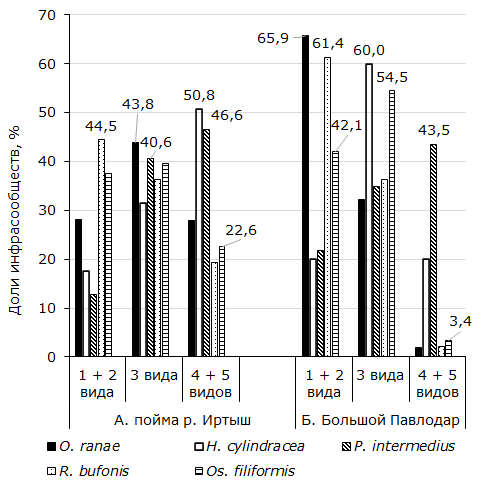
Рис. 1. Представительство видов гельминтов в инфрасообществах
Fig. 1. Representation of helminth species in the infra-communities
У лягушек из Усолки, зараженных P. intermedius, найдена заметная квота трехвидовых паразитоценозов. Их доля больше простых (tφ = 3.48, α > 0.05) и не отличается от количества сложных (tφ = 0.91, α < 0.05). Самая большая доля фаун, к которым сопричастна H. cylindracea, относится к сложным (рис. 1А). Их количество существенно больше, чем трехвидовых (tφ = 2.66, α > 0.05). У лягушек из антропогенных биотопов R. bufonis также в большей мере делает вклад в образовании простых сочетаний, чем трехвидовых (tφ = 5.37, α > 0.01). Освальдокрузия сравнительно с простыми, также как в пойменной популяции хозяев, немного больше, но достоверно, участвует в образовании сообществ из трех видов (tφ = 2.06, α > 0.05). В отличие от поймы р. Иртыш у амфибий из Большого Павлодара O. ranae в достоверно большей мере участвует в формировании простых ценозов (tφ = 7.57, α > 0.01).
Распределение инфрасообществ в компонентных сообществах гельминтов остромордой лягушки
Теоретическую встречаемость инфрасообщества R. bufonis + Os. filiformis у R. arvalis из Усолки получили умножением следующих показателей: 1) рrb и pof, 2) qor, qhc и qpi, 3) N, где рrb и pof – вероятности появления R. bufonis и Os. filiformis, qor, qhc и qpi – вероятности отсутствия O. ranae, H. cylindracea и P. intermedius в названной комбинации; N – объем выборки хозяина. Значение рrb равно 0.8455, pof – 0.7203, qor – 0.4949, qhc – 0.7951, qpi – 0.7360, N – 1269 экз. Частота паразитоценоза в соответствии с нуль-гипотезой о случайном формировании составляет: Ne = 0.8455 · 0.7203 · 0.4949 · 0.7951· 0.7360 · 1269 = 223.8 экз. (табл. 1). Отличия между найденным и подсчитанным числами достоверны. Величина критерия χ² больше критической. Следовательно, от нулевой гипотезы (Н0) следует отказаться и принять противоположную (Н1) о неслучайном возникновении названного сообщества.
Анализ встречаемости сообществ, состоящих из более чем трех видов, усложняется из-за образования так называемых хвостов, значений ≤ 5 экз. По правилам их надо объединять, пока сумма не будет ≥ 5 экз. (Лакин, 1990). Биологически оправданного принципа объединения нет. В пойменной выборке R. arvalis насчитывается шесть таких фаун, их разделили на две группы (см. табл. 1).
Таблица 1. Структура компонентного сообщества гельминтов у Rana arvalis (Усолка)
| № | A | Инфрасообщества | Ne | Nt | χ² | ||
| 1 | Ne 3.84 | Rb | 67 | 86.9 | 4.56 | ||
| Rb + Of + Hc | 33 | 57.7 | 10.6 | ||||
| Of + Or | 28 | 41.7 | 4.50 | ||||
| Of + Or + Pi | 5 | 15.0 | 6.67 | ||||
| 2 | Ne > Nt χ² >3.84 | Rb + Of | 260 | 223.8 | 5.86 | ||
| Rb + Or | 110 | 88.7 | 5.11 | ||||
| Rb + Of + Hc + Pi | 36 | 20.7 | 11.3 | ||||
| Or | 26 | 16.2 | 5.93 | ||||
| Of + Or + Hc | 19 | 10.8 | 6.23 | ||||
| 3 | Ne = Nt χ² <3,84 | Rb + Of + Or | 206 | 228.5 | 2.22 | ||
| Rb + Of + Pi | 97 | 80.3 | 3.47 | ||||
| Rb + Of + Or + Pi | 83 | 81.9 | 0.01 | ||||
| Rb + Of + Or + Hc | 59 | 58.9 | 0.00 | ||||
| Of | 34 | 40.9 | 1.16 | ||||
| Rb + Or + Pi | 27 | 31.8 | 0.72 | ||||
| Rb + Pi | 24 | 31.2 | 1.66 | ||||
| Нуль-ценозы | 23 | 15.9 | 3.17 | ||||
| Rb + Or + Hc | 23 | 22.9 | 0.00 | ||||
| Rb + Of + Or + Hc + Pi | 21 | 21.1 | 0.00 | ||||
| Rb + Hc | 16 | 22.4 | 1.83 | ||||
| Of + Pi | 11 | 14.7 | 0.93 | ||||
| Of + Hc | 11 | 10.5 | 0.02 | ||||
| Rb + Or + Hc + Pi | 8 | 8.2 | 0.00 | ||||
| Or + Pi | 4 | 5.8 | 0.56 | ||||
| Pi | 4 | 5.7 | 0.51 | ||||
| Rb + Hc + Pi | 3 | 8.0 | 3.13 | ||||
| 4 | Nt <5 | Or + Hc | 13 | 4.2 | |||
| Hc | 6 | 19 | 4.1 | 9.8 | 8.64 | ||
| Hc + Pi | 0 | 1.5 | |||||
| 5 | Nt <5 | Of + Hc + Pi | 3 | 3.8 | 9.2-0.2 | ||
| Or + Hc + Pi | 1 | 12 | 1.5 | = 9.0 | 1.00 | ||
| Of + Or + Hc + Pi | 8 | 3.9 | |||||
| Итого: | 1269 | 1269.2 | 89.8 | ||||
| ∑χ² = 89.8, df = 28 – 3 = 25, χ2 при α = 0.05 равен 46.9 | |||||||
| Примечание. № – номер группы; A – отношение между частотами; Ne – эмпирическая частота, Nt – теоретическая частота, χ² – критерий согласия, ∑ – знак суммы, df – число степеней свободы, Or – Opisthioglyphe ranae, Hc – Haplometra cylindracea, Pi – Pleurogenes intermedius, Rb – Rhabdias bufonis, Of – Oswaldocruzia filiformis. | |||||||
В группу № 4 поместили одно- и двухвидовые, в пятую – трех- и четырехвидовые. Значение критерия χ² для новых членов распределения подсчитали по суммам теоретических и, соответственно, фактических чисел. Остальные паразитоценозы по величине эмпирических и ожидаемых частот и значениям χ² распадаются на три группы (см. табл. 1). В первой и второй группах значение χ² в каждой паре показателей больше, а в третьей – меньше критического при α = 0.05 и df = 1. Для первого набора сообществ характерно достоверное преобладание рассчитанных величин над эмпирическими. Члены этой группы размещены у 10.5 % хозяев. Второй комплекс, найденный у 35.5 % лягушек, вмещает ценозы с эмпирической частотой, существенно больше ожидаемой. Очевидно, в популяции R. arvalis действуют механизмы, вызывающие неслучайное комплектование собраний паразитических видов. Третья, самая большая группа объединяет инфрасообщества, отмеченные у 54.0 % R. arvalis. Ожидаемая частота каждой комбинации видов гельминтов не отличается от установленной, т. к. значение χ² меньше критического. Это указывает на то, что третий комплекс фаун, в отличие от первых двух, формируется под действием случайных факторов.
Сумма членов теоретического ряда больше суммы фактического на 0.2 (см. табл. 1). Чтобы уравнять оба ряда, эту разницу отняли от последнего члена теоретического ряда. Затем подсчитали величину критерия χ² для него. Появление 4-й и 5-й групп уменьшило число членов распределения до 28. Из данных табл. 1 видно, что критическое значение критерия χ2 значительно меньше суммы хи-квадрат по всему распределению. Несмотря на присутствие случайно образующихся ассоциаций, нуль-гипотезу следует отвергнуть и принять противоположную о том, что в целом формирование инфрасообществ в компонентном сообществе R. arvalis в пойме р. Иртыш происходит неслучайно.
Компонентное сообщество остромордых лягушек из г. Павлодар недосчитывает 12 из 32 возможных сочетаний (табл. 2). В их составе порознь или вместе должны были бы находиться P. intermedius и H. cylindracea. Условия для развития в загрязненных, урбанизированных биотопах далеки от оптимума, видимо, поэтому здесь спорадично встречаются комплексы с участием названных трематод. Связь структуры сообществ с загрязненностью местообитаний хозяев изучена во многих работах. Так, сильным химическим загрязнением р. Дырнос вызвано упрощение компонентного сообщества паразитов гольяна (Голикова, 2005). У трех видов рыб рода Lepomis в дренажных водах, выкачиваемых из угольных шахт, число видов гельминтов снижено по сравнению с обитателями реки (Claxton, Laursen, 2015). Е. П. Иешко с соавторами (2019) установили, что сообщества паразитов ротана Perrccottus glenii в естественных водоемах гораздо богаче, чем у рыб, вселившихся в новые водоемы. Обеднение сообществ в результате антропогенного стресса показано у R. arvalis, P. ridibundus и Bufotes viridis (Файзулин, Зарипова, 2017; Чихляев и др., 2017; Vershinin et al., 2017).
У R. arvalis из Большого Павлодара насчитывается 23 сочетания видов с теоретическим числом меньше 5 экз. (см. табл. 2). Их разделили на две группы. В одну, под номером 4, поместили одно- и двухвидовые гельминтофауны. В другую, под номером 5, включили трех-, четырех- и пятивидовые. Так же как в пойме, инфрасообщества с вычисленными частотами больше 5 экз. и соответствующими найденными распадаются на три группы. Первая включает паразитоценозы с фактической встречаемостью, достоверно меньшей теоретической. Их число у R. arvalis составляет 13.1 %. Ко второй группе относятся паразитофауны с эмпирическими частотами, значимо большими ожидаемых. Данные комбинации размещены у 36.3 % хозяев. Третья выборка включает ценозы, у которых наблюдаемая и подсчитанная встречаемости статистически не отличаются, т. к. величина χ² в каждой паре сравниваемых значений меньше критической. Данный комплекс видов, возникающий по законам вероятности, обнаружен у 50.5 % амфибий. Доля третьей совокупности паразитоценозов не отличается от таковой у хозяев из поймы р. Иртыш (tφ = 1.04, df = 1075, α < 0.05).
| Таблица 2. Структура компонентного сообщества гельминтов у остромордой лягушки в антропогенных биотопах Большого Павлодара | |||||||
| № | А | Инфрасообщества | Ne | Nt | Nt | χ² | |
| 1 | Ne < Nt | Of + Or | 45 | 78.3 | 78.3 | 14.16 | |
| χ² > 3.84 | Of | 10 | 27.4 | 27.4 | 11.05 | ||
| Rb | 47 | 74 | 74 | 9.85 | |||
| 2 | Ne > Nt | Or | 145 | 109.8 | 109.8 | 11.28 | |
| χ² > 3.84 | Rb + Of | 78 | 52.8 | 52.8 | 12.03 | ||
| Нуль-ценозы | 59 | 38.4 | 38.4 | 11.05 | |||
| 3 | Ne = Nt | Rb + Or | 187 | 211.7 | 211.7 | 2.88 | |
| χ² < 3.84 | Rb + Of + Or | 173 | 151 | 151 | 3.21 | ||
| Rb + Or + Pi | 6 | 6.47 | 6.47 | 0.03 | |||
| 4 | Nt < 5 | Rb + Pi | 2 | 2.26 | |||
| Of + Pi | 2 | 0.84 | |||||
| Of + Hc | 1 | 0.36 | |||||
| Or + Pi | 1 | 3.35 | |||||
| Or + Hc | 1 | 7 | 1.43 | 10.9 | 1.40 | ||
| Hc | 0 | 0.5 | |||||
| Pi | 0 | 1.17 | |||||
| Rb + Hc | 0 | 0.97 | |||||
| Hc + Pi | 0 | 0.02 | |||||
| 5 | Nt < 5 | Rb + Of + Or + Pi | 9 | 4.61 | |||
| Rb + Or + Hc | 5 | 2.76 | |||||
| Rb + Of + Pi | 2 | 1.61 | |||||
| Of + Or + Hc | 1 | 1.02 | |||||
| Rb + Of + Or + Hc | 1 | 1.97 | |||||
| Rb + Of + Or + Hc + Pi | 1 | 0.06 | |||||
| Rb + Of + Hc | 0 | 0.69 | 15.3 - 0.1= | ||||
| Of + Or + Pi | 0 | 19 | 2.39 | 15.2 | 20.9 | ||
| Rb + Hc + Pi | 0 | 0.03 | |||||
| Of + Hc + Pi | 0 | 0.01 | |||||
| Or + Hc + Pi | 0 | 0.04 | |||||
| Rb + Of + Hc + Pi | 0 | 0.02 | |||||
| Rb + Or + Hc + Pi | 0 | 0.08 | |||||
| Of + Or + Hc + Pi | 0 | 0.03 | |||||
| Итого: | 776 | 776.1 | 97.9 | ||||
| Примечание. См. табл. 1. | |||||||
В табл. 2 сумма значений теоретического ряда превышает сумму фактического на 0.1. Чтобы уравнять оба ряда, эту разность отняли от значения последнего объединенного члена ряда и подсчитали χ². После процедур объединения сообществ в распределении насчитывается 11 членов. Исходя из этого число степеней свободы равно 8. Табличная величина критерия хи-квадрат при данном числе степеней свободы равна 21.96 (α > 0.05). Сумма χ² в распределении гораздо больше, поэтому от Н0 необходимо отказаться и принять Н1 о том, что в целом образование инфрасообществ в компонентном сообществе гельминтов в популяциях R. arvalis в урбанизированных условиях, так же как в нативных, происходит неслучайно. О неслучайном возникновении сообществ благодаря экологическим факторам сообщают T. Timi, А. Lanfranchi (2009).
Согласно полученным данным, одни инфрасообщества возникают чаще других. Например, R. bufonis + Os. filiformis констатировано у пятой части R. arvalis (20.5 %) из Усолки. В Большом Павлодаре наибольшее распространение установлено для R. bufonis + O. ranae (24.1 %). На р. Иртыш зарегистрировано шесть ценозов с встречаемостью у более чем 5 % амфибий, а в антропогенных пунктах – семь. Остальные отмечены от 0 до 2.8 % земноводных. Ценозы R. bufonis + Os. filiformis, R. bufonis + O. ranae, R. bufonis + Os. filiformis + O. ranae и R. bufonis констатированы в обеих биотопических пробах. Они установлены у 50.7 % лягушек из поймы и у 62.5 % из Большого Павлодара. Названные инфрасообщества мы отнесли к стабильно возникающим в пространстве. Они образуют не только группу стабильных, но наиболее распространенных. К относительно стабильным отнесли комбинации видов, частота которых только в одном из двух исследованных компонентных сообществ превышает 5 %. У амфибий из поймы к ним относятся R. bufonis + Os. filiformis + P. intermedius, R. bufonis + Os. filiformis + O. ranae + P. intermedius и R. bufonis + Os. filiformis + O. ranae + H. cylindracea. Эти гельминтофауны отмечены у 18.8 % R. arvalis и всего у 1.5 % хозяев из Большого Павлодара (см. табл. 1, 2). В последнем встречаемость 0-ценозов, O. ranae и Os. filiformis + O. ranae отмечена у более чем 5 % остромордых лягушек. Данные относительно стабильные паразитоценозы в антропогенных точках зарегистрированы у 32.1, а в пойменной у 6.1 % земноводных. Устойчивость образования сообществ во времени прослежена по данным мониторинга за 1984–1988 гг., когда были взяты полные сезонные выборки. Как следует из рис. 2, в компонентном сообществе R. arvalis из года в год образуются 13 фаун из 32 теоретически возможных. Следует подчеркнуть, что четыре из них по составу сходны со стабильными, а пять с относительно стабильными в пространстве.
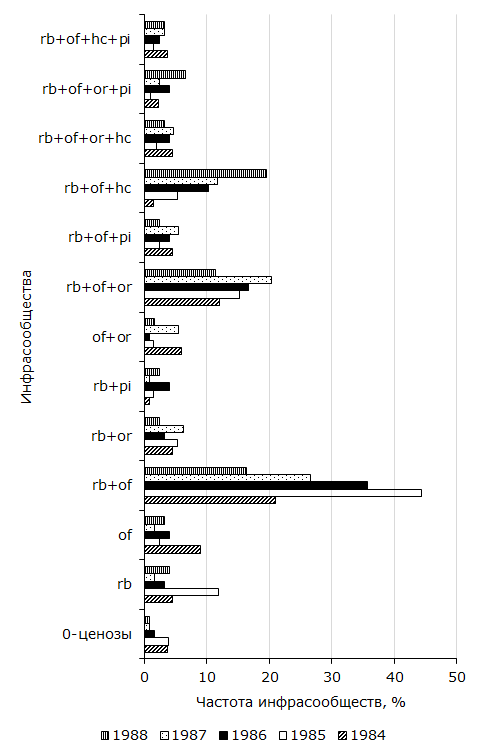
Рис. 2. Стабильные во времени инфрасообщества Rana arvalis из поймы р. Иртыш
Fig. 2. Time-stable infra-communities of Rana arvalis from the floodplain of the Irtysh River
Среди комбинаций гельминтов, стабильных во времени, довольно высокая встречаемость характерна для трех – R. bufonis + Os. filiformis, R. bufonis + Os. filiformis + O. ranae и R. bufonis + Os. filiformis + P. intermedius. Их частоты колеблются и отличие между минимальной и максимальной величинами каждого значимо. Значение критерия tφ у первого сочетания равно 5.37 (df = 331; α > 0.001), второго – 5.52 (df = 342; α > 0.001), третьего – 5.04 (df = 429; α > 0.001). Частоты других комплексов относительно небольшие. Наименьшие и наибольшие значения показателя отличаются только в одновидовых ценозах R. bufonis (tφ = 3.69; df = 336; α > 0.01) и Os. filiformis (tφ = 2.53; df = 260; α > 0.05). Три из повторяющихся во времени комбинаций (R. bufonis, Os. filiformis + O. ranae, R. bufonis + Os. filiformis + H. cylindracea) относятся к группе с фактической величиной, достоверно большей, чем теоретическая (см. табл. 1). Еще у трех ассоциаций (R. bufonis + Os. filiformis, R. bufonis + O. ranae, R. bufonis + Os. filiformis + H. cylindracea + P. intermedius) ожидаемая частота выше эмпирической. Семь комплексов формируются благодаря случайным процессам. Для стойко дублирующихся в пространстве и времени инфрасообществ характерно: 1) образование с высокой частотой; 2) ограничение состава наиболее обильными видами – R. bufonis, Os. filiformis и O. ranae; 3) возникновение благодаря действию не только случайных, но и закономерных процессов.
Наши данные о сходном механизме образования инфрасообществ из двух различающихся биотопических выборок R. arvalis согласуются с результатами изучения гельминтов угрей Anguilla anguilla, константно обнаруживаемых в реках Ирландии, на р. Тибр в Италии и в зарыбленном эвтрофном озере Нойзидлер-Зее в Австрии (Kennedy et al., 1998; Kennedy, Moriarty, 2002; Schabuss et al., 2005). Авторы исследований предполагают, что сообщества гельминтов угрей из р. Шеннон в Ирландии типичны и сопоставимы с таковыми в реках и водоемах Европы. Стабильное образование сообществ в течение десяти лет установлено у сколецид полевок из трех лесных биотопов на севере Польши (Grzybek et al., 2015). Воспроизводимость паразитических инфрасообществ в пространстве и времени играет важную роль при изучении взаимодействий между видами паразитов (Poulin, 2001).
Численность особей в инфрасообществах гельминтов Rana arvalis
В инфрасообществах компонентного сообщества R. arvalis из нативного биотопа численность гельминтов распределена неравномерно, в одних обилие одного и того же вида может быть гораздо выше, чем в других (табл. 3А). Так, в группе наиболее распространенных и стабильных в пространстве и времени паразитоценозов R. bufonis + Os. filiformis, R. bufonis + O. ranae R. bufonis + Os. filiformis + O. ranae и R. bufonis сосредоточено основное количество R. bufonis (55.3 %). Следует отметить, что в относительно устойчивых фаунах R. bufonis + Os. filiformis + O. ranae + P. intermedius, R. bufonis + Os. filiformis + P. intermedius размещено соответственно 12.6 и 10.8 % особей нематоды. В каждом из остальных ценозов находится особей данного вида меньше критической величины в 5.0 % (0.17–4.63 %). В четырех стабильных паразитофаунах распределено базовое количество (48.5 %) другого представителя круглых червей. В названных относительно устойчивых комплексах находится соразмерно 10.9 и 12.5 % трихостронгилид. Доля Os. filiformis в других ассоциациях гельминтов колеблется от 0.51 до 4.9 % от числа всех освальдокрузий. Больше половины O. ranae (52.2 %) собрано в стабильных ценозах. В двух относительно устойчивых размещено 13.1 % особей трематоды (табл. 3А). Частоты остальных сочетаний с участием O. ranae колеблются от 1.0 до 3.4 %. Исключением являются сообщества R. bufonis + Os. filiformis + O. ranae + H. cylindracea и O. ranae. В них разместилось больше 5 % особей O. ranae, соответственно 8.4 и 5.7 %. Асимметричное размещение особей в инфрасообществах присуще не только доминантным видам. Так, ключевое количество P. intermedius (88.3 %) распределено в шести инфрасообществах. От 0.12 до 3.46 % плейрогенесов приурочено к оставшимся комплексам. Стержневое количество H. cylindracea (84.6 %) накопилось в восьми сообществах. В ценозе R. bufonis + Os. filiformis + O. ranae + H. cylindracea, в частности, размещена пятая часть (20.9 %) всех особей адоминантной гаплометры. Доля ее марит в остальных фаунах равна 5.83–14.1 %. Для паразитоценозов компонентного сообщества лягушек из урбанизированных биотопов Большого Павлодара также характерно неравномерное распределение числа гельминтов (табл. 3Б). В четырех распространенных и стабильных в пространстве и времени инфрасообществах сосредоточено основное количество R. bufonis (89.8 %), Os. filiformis (92.8 %) и O. ranae (51.8) (табл. 3Б). Ни в одном из названных сообществ не отмечены H. cylindracea и P. intermedius, как известно, спорадически встречающиеся здесь у амфибий. Следовательно, большая часть особей R. bufonis Os. filiformis и O. ranae предпочитают небольшое число сообществ, в которых отсутствуют по отдельности или совместно мариты H. cylindracea и P. intermedius.
| Таблица 3. Численность особей в инфрасообществах гельминтов у Rana arvalis | ||||||||||
| Инфрасообщества | Численность особей в инфрасообществах гельминтов, экз. | |||||||||
| А. Усолка (р. Иртыш) | Б. Большой Павлодар | |||||||||
| Rb | Of | Or | Hc | Pi | Rb | Of | Or | Hc | Pi | |
| Or | 142 | 2278 | ||||||||
| Hc | 19 | |||||||||
| Pi | 26 | |||||||||
| Rb | 384 | 182 | ||||||||
| Of | 187 | 28 | ||||||||
| Rb + Of | 2109 | 1516 | 573 | 435 | ||||||
| Rb + Or | 511 | 530 | 765 | 1997 | ||||||
| Rb + Hc | 79 | 42 | ||||||||
| Rb + Pi | 193 | 110 | 20 | 2 | ||||||
| Of + Or | 75 | 84 | 158 | 341 | ||||||
| Of + Hc | 35 | 41 | 5 | 1 | ||||||
| Of + Pi | 60 | 57 | 11 | 2 | ||||||
| Or + Pi | 8 | 9 | 20 | 4 | ||||||
| Or + Hc | 74 | 36 | 24 | 1 | ||||||
| Hc + Pi | 0 | |||||||||
| Rb + Of + Or | 1580 | 972 | 770 | 1056 | 731 | 1289 | ||||
| Rb + Of + Hc | 315 | 218 | 72 | |||||||
| Rb + Of + Pi | 893 | 641 | 481 | 9 | 3 | 3 | ||||
| Rb + Or + Hc | 60 | 84 | 44 | 9 | 50 | 7 | ||||
| Rb + Or + Pi | 247 | 79 | 137 | 113 | 216 | 16 | ||||
| Rb + Hc + Pi | 14 | 3 | 13 | |||||||
| Of + Or + Hc | 63 | 79 | 87 | 5 | 1 | 1 | ||||
| Of + Or + Pi | 26 | 13 | 9 | |||||||
| Of + Hc + Pi | 21 | 7 | 4 | |||||||
| Or + Hc + Pi | 5 | 4 | 2 | |||||||
| Rb + Of + Or + Hc | 264 | 312 | 210 | 129 | 2 | 8 | 18 | 1 | ||
| Rb + Of + Or + Pi | 1043 | 561 | 250 | 369 | 140 | 42 | 103 | 19 | ||
| Rb + Of + Hc + Pi | 404 | 250 | 72 | 256 | ||||||
| Rb + Or + Hc + Pi | 43 | 55 | 18 | 28 | ||||||
| Of + Or + Hc + Pi | 60 | 24 | 20 | 45 | ||||||
| Rb + Of + Or + Hc + Pi | 148 | 136 | 82 | 24 | 102 | 1 | 1 | 3 | 1 | 1 |
| ni | 8287 | 5133 | 2489 | 618 | 1648 | 2870 | 1427 | 6340 | 12 | 47 |
| Примечание. ni – общая численность соответствующего вида гельминтов; Or – Opisthioglyphe ranae, Hc – Haplometra cylindracea, Pi – Pleurogenes intermedius, Rb – Rhabdias bufonis, Of – Oswaldocruzia filiformis. | ||||||||||
В четырех дублирующихся в пространстве и времени инфрасообществах в соотношении фактической и теоретической численности видов наблюдается сходство (рис. 3). В нативном и антропогенных биотопах в каждом из двух паразитоценозов – R. bufonis и R. bufonis + O. ranae ожидаемая численность рабдиаса достоверно (α > 0.01) превышает фактическую. Знак при показателе приуроченности обилия нематоды отрицателен. Наоборот, в ценозах R. bufonis + Os. filiformis и R. bufonis + Os. filiformis + O. ranae значение показателя Fij положительно и эмпирическое количество рабдиасов достоверно больше ожидаемого по Н0. В комбинации Os. filiformis + O. ranae рассчитанное число нематод в 1.9 раз и надежно (α > 0.01) превышает наблюдаемое, а значение показателя Fij отрицательно. В инфрасообществах Os. filiformis + R. bufonis + O. ranae и Os. filiformis + R. bufonis величины Fij отрицательны и практически равны. Но в паразитоценозе Os. filiformis + R. bufonis + O. ranae у лягушек из урбанизированной территории фактическая и теоретическая численность Os. filiformis отличаются недостоверно (α < 0.05).
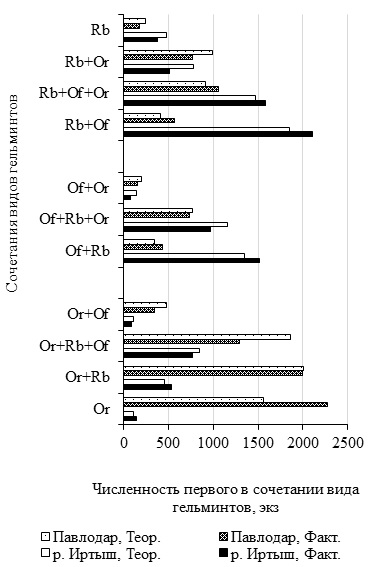
Рис. 3. Численность Rhabdias bufonis, Oswaldocruzia filiformis и Opisthioglyphe ranae в стабильных в пространстве и времени сообществах Rana arvalis (экз.)
Fig. 3. Аbundance of Rhabdias bufonis, Oswaldocruzia filiformis, and Opisthioglyphe ranae in Rana arvalis infra-communities stable in space and time (specimens)
В двух комбинациях O. ranae + Os. filiformis и O. ranae + Os. filiformis + R. bufonis подсчитанное значение численности O. ranae достоверно выше найденного (см. рис. 3). Знак при Fij в каждой паре величин отрицательный. Для ценоза O. ranae в обеих биотопических пробах R. arvalis характерно достоверное превышение фактического числа над теоретическим. Значение показателя Fij положительно. Несколько особняком стоит фауна O. ranae + R. bufonis. В пойменной выборке R. arvalis фактическое обилие трематоды достоверно (χ² = 12.8) превышает ожидаемое и знак при Fij положителен (+0.11). У амфибий из надпойменных антропогенных биотопов подсчитанное число марит O. ranae несущественно (χ² = 0.06) больше эмпирической, но значение показателя приуроченности обилия равно нулю.
Во всех сообществах лягушек из биотопа в пойме р. Иртыш, в которых врозь или вместе присутствуют H. cylindracea и P. intermedius, отмечается пониженное число R. bufonis, Os. filiformis и O. ranae (см. табл. 3). Например, в сочетаниях R. bufonis + Os. filiformis + P. intermedius, R. bufonis + Os. filiformis + O. ranae + P. intermedius и R. bufonis + Os. filiformis + H. cylindracea относительное число плейрогенеса и гаплометры при условном сравнении величин в 2–3 раза превышает таковые рабдиаса, освальдокрузии и опистиоглифы. Особенно заметное отрицательное воздействие гаплометра оказывает на численность рабдиасов, чуть меньше на опистиоглифу и еще слабее на освальдокрузию (рис. 4). Тем не менее доля последней в 2.4 раза ниже доли гаплометры.
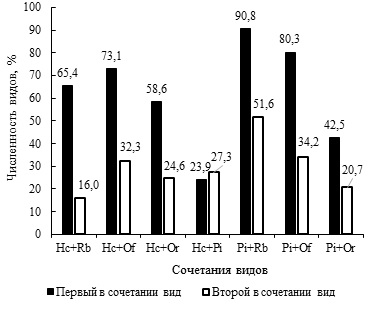
Рис. 4. Численность видов гельминтов (%) при совместном нахождении
Fig. 4. The number of helminths (%) when finding species together
Негативное воздействие H. cylindracea на численность R. bufonis, Os. filiformis и O. ranae явно имеет место. По сравнению с гаплометрой количественный ущерб рабдиасов и освальдокрузий от присутствия P. intermedius менее высок, но его доля выше в 1.8–2.3 раза таковых R. bufonis и Os. filiformis соответственно. Негативное влияние плейрогенесов на численность опистиоглиф заметно, доля последний в 2.0 раза меньше. Однако бросается в глаза относительно невысокая доля P. intermedius. Не исключено, что не только P. intermedius отрицательно влияет на численность O. ranae, но и последняя, хотя и в меньшей мере, воздействует на обилие первой. В трех фаунах амфибий из Усолки, в которых присутствует сочетание H. cylindracea + P. intermedius, плейрогенес численно преобладает над гаплометрой. В четырех инфрасообществах первенство по количеству особей переходит к H. cylindracea. В целом при совместном нахождении в паразитоценозах доли гаплометры и плейрогенеса близки (рис. 4). Видимо, влияние H. cylindracea и P. intermedius на численность друг друга приблизительно одинаково. Интересно, что единственным инфрасообществом, в котором находится равное количество особей, является сочетание из трех видов трематод: O. ranae + H. cylindracea + P. intermedius (см. табл. 3). В антропогенных биотопах разброс долей рабдиаса, освальдокрузии и опистиоглифы в присутствии P. intermedius и H. cylindracea статистически не адекватен.
В Среднем Прииртышье в популяциях R. arvalis в течение сезона происходит смена двух поколений R. bufonis и O. ranae и в среднем полтора у Os. filiformis – одно в сухие и два во влажные годы (Ваккер, 2018а, б, 2020). По литературным и нашим данным, одно поколение H. cylindracea сменяется другим в течение двух-трех лет (Ваккер и др., 1990; Гинецинская, Голубева, 1990; Буракова, 2010б; Joly et al., 2008). Одна генерация P. intermedius, по нашим наблюдениям, также замещается за 2–3 года. Итак, пока в популяции хозяина произойдет смена по одному поколению гаплометры или плейрогенеса, сменяется четыре-шесть рабдиаса и опистиоглифы и два-три освальдокрузии. По нашему предположению, это различие приводит в популяции R. arvalis к наложению потоков пяти видов гельминтов, что оказывает значительное влияние на процессы формирования инфрасообществ. Кроме того, хорошо известно, что в средах с непредсказуемыми свободными территориями судьба видов часто зависит от того, кто из них первым заселит незанятый участок (Бигон и др., 1989). В. Д. Гуляев (2005) показал, что цестода Paranoplocephala omphalodes подавляет развитие особей родственных видов гельминтов, проникающих в кишечник грызунов позже нее. Наши данные также позволяют считать, что если H. cylindracea или P. intermedius первыми случайно заражают R. arvalis, то они на 2–3 года получают преимущества «первопоселенцев» и сдерживают численность гельминтов, которые позже заселяют занятые «территории». Этим объясняется пониженное число R. bufonis, Os. filiformis и O. ranae во всех паразитофаунах, в которых присутствуют гаплометра или плейрогенес. С другой стороны, при более раннем заражении остромордых лягушек видами R. bufonis, Os. filiformis и O. ranae они становятся пионерами незанятой территории. Данные виды, сформировав разной сложности инфрасообщества, далее препятствуют, по нашему мнению, заражению R. arvalis гаплометрами или плейрогенесами. Этим мы объясняем невысокую встречаемость сообществ с участием H. cylindracea и P. intermedius, а также повышенную частоту и значительную численность особей в сочетаниях, состоящих только из R. bufonis, Os. filiformis и O. ranae.
Таким образом, часть инфрасообществ гельминтов R. arvalis возникает благодаря действию случайных процессов. Это согласуется с изоляционистской концепцией сообществ. Немного меньше сочетаний паразитических видов образуется за счет неслучайных причин, что соответствует концепции интерактивных сообществ. Мы считаем, что одними из важных экологических факторов, участвующих в регуляции частоты образующихся комбинаций гельминтов, являются: 1) наложение паразитических потоков, определяемое индивидуальным развитием и числом сменяющихся поколений гельминтов; 2) время заражения хозяев сколецидами. Наложение гельминтных потоков друг на друга связано с осуществлением одновременно пятью видами гельминтов циклов развития в течение активности одного и того же окончательного хозяина. Одним из результатов является случайное, хаотичное формирование части инфрасообществ. Время заражения хозяев, как мы полагаем, упорядочивающе влияет на распределение паразитических потоков. Действие этого фактора канализирует образование заметной части сочетаний видов сколецид в закономерное русло.
Заключение
Инфрасообщества в компонентных сообществах возникают с различной частотой, одни образуются чаще, другие реже. Наиболее распространенными и образующимися в нативном и антропогенных биотопах являются сочетания R. bufonis + Os. filiformis, R. bufonis + O. ranae, R. bufonis + Os. filiformis + O. ranae и R. bufonis. Они отмечены соответственно у 50.7 % R. arvalis из поймы р. Иртыш и у 62.5 % из Большого Павлодара. Для этих фаун характерно стабильное образование не только в пространстве двух проб хозяина, но и во времени. По соотношению величины фактических и ожидаемых, согласно нуль-гипотезе о случайном образовании, частот и значениям критерия χ² инфрасообщества в обеих биотопических выборках хозяина распадаются на три совокупности. В самую большую, встречающуюся немного больше, чем у половины хозяев, входят ценозы, которые образуются благодаря действию случайных причин. Две других возникают закономерно: в них значения фактических и теоретических частот отличаются достоверно. Следует отметить, что у более чем двух тысяч изученных R. arvalis не обнаружено двухвидовое сочетание H. cylindracea + P. intermedius. Не исключено, что на его образование существует экологический запрет.
В компонентных сообществах R. arvalis из нативного биотопа численность гельминтов распределена неравномерно, в одних инфрасообществах обилие одного и того же вида может быть гораздо выше, чем в других. Только в четырех дублирующихся в пространстве и времени комбинациях гельминтов у амфибий из поймы сосредоточено базовое число R. bufonis (55.3 %), O. ranae (52.2 %) и Os. filiformis (48.5 %). Неравномерно размещены особи не только доминантных видов гельминтов, но и адоминантных. Ключевая сумма P. intermedius (88.3 %) распределена в 6 из 16 инфрасообществ. Стержневое количество H. cylindracea (84.6 %) скопилось в 8 сообществах. В частности, в ценозе R. bufonis + Os. filiformis + O. ranae + H. cylindracea размещена пятая часть (20.9 %) всех особей адоминантной гаплометры. Для паразитоценозов компонентного сообщества лягушек из урбанизированных биотопов Большого Павлодара также характерно неравномерное распределение числа гельминтов. В четырех стабильных в пространстве и времени инфрасообществах обнаружено 89.8 % всех R. bufonis, 81.7 % Os. filiformis и 51.8 % O. ranae.
Различные темпы индивидуального развития и число сменяющихся поколений пяти видов гельминтов в течение активности одного и того же окончательного хозяина приводят, как мы полагаем, к наложению паразитических потоков друг на друга. В результате, с одной стороны, происходит случайное формирование части сочетаний паразитов. С другой стороны, время заражения хозяев накладывает ограничение на распределение видовых потоков сколецид. Если H. cylindracea или P. intermedius первыми заражают R. arvalis, то они сдерживают развитие гельминтов, которые заселяются позже. В пользу этого предположения говорит то, что во всех сообществах, в которых вместе с указанными сосальщиками паразитируют R. bufonis, Os. filiformis или O. ranae, у последних снижена численность. В случаях, когда у хозяев первыми формируются сообщества с участием рабдиаса, освальдокрузии или опистиоглифы, эти виды создают трудности для развития гаплометр и плейрогенесов при их более позднем заражении хозяина. Негативное влияние видов с быстрой сменой поколений на H. cylindracea и P. intermedius косвенно удостоверяется редкостью комплексов с участием последних. Об этом же свидетельствует высокая частота и нахождение ведущего числа особей R. bufonis, Os. filiformis и O. ranae в комбинациях, которые состоят только из последних видов.
Библиография
Баканов А. И. Количественная оценка доминирования в экологических сообществах / Институт биологии внутренних вод АН СССР. Борок, 1987. 64 с.
Балашов Ю. С. Термины и понятия, используемые при изучении популяций и сообществ паразитов // Паразитология. 2000. Т. 34, № 5. С. 361–370.
Бигон М., Харпер Дж., Таунсенд К. Экология. oсоби, популяции и сообщества: В 2 т. . М.: Мир, 1989 Т. 1. 667 с.
Боев С. Н., Соколова И. Б., Панин В. Я. Гельминты копытных животных Казахстана . Алма-Ата: Изд-во Акад. наук КазССР, 1962. Т. 1. 377 с.
Буракова А. В. Структура паразитофауны популяций остромордой лягушки (Rana arvalis Nilss.) в условиях антропогенного воздействия // Урбоэкосистемы: проблемы и перспективы развития: Материалы V Международной научно-практической конференции. Вып. 5, часть III: Животные в урбоэкосистеме, 25–26 марта. Ишим, 2010а. С. 135–138.
Буракова А. В. Эколого-генетические особенности и гельминтофауна остромордой лягушки (Rana arvalis Nilss.) в градиенте урбанизации : Автореф. дис. ... канд. биол. наук. Екатеринбург, 2010б. 23 с.
Ваккер В. Г. К экологии трематоды Opisthioglyphe ranae (Telorchidae) // Принципы экологии. 2018а. Т. 7, № 1. С. 38–59.
Ваккер В. Г. Паразитарная система нематоды Oswaldocruzia filiformis (Strongylida: Molineidae) в Казахстане // Принципы экологии. 2018б. Т. 7, № 4. С. 44–64.
Ваккер В. Г. Вопросы экологии нематоды Rhabdias bufonis (Nematoda: Rhabdiasidae) в степной зоне Республики Казахстан // Принципы экологии. 2020. № 1. С. 43–67.
Ваккер В. Г., Брушко З. К., Тарасовская Н. Е. К гельминтофауне амфибий Казахстана // Материалы Всесоюзного научно-методич. совещания зоологов пед. вузов СССР. (Ред. С. П. Наумов, А. Г. Юсуфов). Махачкала: ДГУ, 1990. С. 59–61.
Гинецинская Т. А., Голубева Е. Б. Изменение гельминтофауны Rana temporaria в Петергофском парке за 50 лет // Эволюция паразитов: Материалы Первого Всесоюзного симпозиума. Тольятти, 1991. С. 211–215.
Голикова Е. А. Экология паразитов гольяна обыкновенного и их сообществ в условиях малых рек бассейна Вычегды : Автореф. дис. ... канд. биол. наук. Сыктывкар, 2005. 24 с.
Грейг-Смит П. Количественная экология растений . М.: Мир, 1967. 360 с.
Гуляев В. Д. Эволюция форм гермафродитизма Cyclophyllidea (Cestoda). 2. Морфофункциональные причины возникновения цепней с протогиническим развитием полового аппарата // Паразитология. 2016. Т. 50, № 1. С. 58–68.
Ивантер Э. В., Коросов А. В. Основы биометрии: Введение в статистический анализ биологических явлений и процессов: Учебное пособие . Петрозаводск: ПГУ, 1992. 163 с.
Иешко Е. П., Коросов А. В., Соколов C. Г. Видовое богатство сообществ паразитов ротана Perccottus glenii (Actinopterygii, Odontobutidae) в нативной и приобретенной частях ареала хозяина // Паразитология. 2019. Т. 53, № 2. С. 145–158.
Кеннеди К. Экологическая паразитология . М.: Мир, 1978. 230 с.
Лакин Г. Ф. Биометрия : Учебное пособие для биол. спец. вузов. М.: Высшая школа, 1990. 352 с.
Павловский Е. Н. Организм как среда обитания // Природа. 1934. № 1. С. 80–91.
Песенко Ю. А. Принципы и методы в фаунистических исследованиях . М.: Наука, 1982. 288 с.
Плохинский Н. А. Биометрия . М.: Изд-во МГУ, 1970. 359 с.
Пугачёв О. Н. Паразитарные сообщества речного гольяна (Phoxinus phoxinus L.) // Паразитология. 2000. Т. 34, № 3. С. 196–209.
Рыжиков К. М., Шарпило В. П., Шевченко Н. Н. Гельминты амфибий фауны СССР . М.: Наука, 1980. 279 с.
Тарасовская Н. Е. Гельминтофауна наземных холоднокровных позвоночных Павлодарской области и сопредельных регионов // Матеріали Х Міжнародної науково-практичної інтернет-конференції «Проблеми та перспективи розвитку науки на початку третього тисячоліття у країнах СНД» («Проблемы и перспективы развития науки в начале третьего тысячелетия в странах СНГ»). Переяслав-Хмельницкий, 2013. С. 31–33.
Файзулин А. И., Зарипова Ф. Ф. Гельминты озерной лягушки Pelophylax ridibundus (Pallas, 1771) г. Салават (Республика Башкортостан) // Известия Самарского научного центра Российской академии наук. 2017. Т. 19, № 2. С. 75–79.
Чихляев И. В., Файзулин А. И., Кузовенко А. Е. Анализ гельминтофауны зеленой жабы Bufotes viridis (Laurenti, 1768) на урбанизированных территориях Самарской области // Известия Самарского научного центра Российской академии наук. 2017. Т. 19, № 5. С. 178–184.
Akani G. C., Luiselli L., Amuzie C. C., Wokem G. N. Helminth community structure and diet of three Afrotropical anuran species: a test of the interactive-versus-isolationist parasite communities’ hypothesis // Web Ecol. 2011. Vol. 11. P. 11–19. DOI: 10.5194/we-11-11-2011
Claxton A., Laursen J. Endoparasite Community Differences in Sunfish (Lepomis spp.) Above and Below Coal Mine Effluent in Southern Illinois // J Parasitol. 2015. Vol. 101 (3). P. 282–289. DOI: 10.1645/12-157.1
Esch G. W., Bush A. 0., and Aho J. M. Parasite communities: Patterns and processes. Chapman and Hall, London, U. K., 1990. 335 p.
Grabda-Kazubska B. Abbreviation of the life cycles in plagiorchid trematodes. General remarks // Acta Parasit. Pol. 1976. Vol. 26. Fasc. 3. P. 125–141.
Grzybek M., Bajer A., Bednarska M., Al-Sarraf M., Behnke-Borowczyk J., Harris P. D., Price S. J., Brown G. S., Osborne S.-J., Siński E., Behnke J. M. Long-term spatiotemporal stability and dynamic changes in helminth infracommunities of bank voles (Myodes glareolus) in NE Poland // Parasitology. 2015. Vol. 142 (14). P. 1722–1743. DOI: 10.1017/S0031182015001225
Hamann M. I., Kehr A. I. and Gonzalez C. E. Niche specificity of two glyphtelmins (Trematoda) congeners infecting Leptodactylus chaquensis (Anura: Leptodactylidae) from Argentina // Journal of Parasitology. 2009. Vol. 95. P. 817–822. DOI: 10.1645/GE-1860.1
Holmes J. C. Effects of concurrent infections on Hymenolepis diminuta (Cestoda) and Moniliformis dubius (Acanthocephala). I. General effects and comparison with crowding // J. Parasitol. 2002. Vol. 88 (3). P. 434–439.
Holmes J. C. Competition, contacts, and other factors restricting niches of parasitic helminths // Ann. Parasitol, Hum. Comp. 1991. Vol. 65, Suppl. 1. P. 69–72. DOI: 10.1139/z02-188
Janovy J. Jr. Concurrent infections and the community ecology of helminths parasites // J. Parasitol. 2002. Vol. 88 (3). P. 440–445.
Joly P., Guesdon V., Fromont E., Plenet S., Grolet O., Guegan J. F., Hurtrez-Bousses S., Thomas F. and Renaud F. Heterozygosity and parasite intensity: lung parasites in the water frog hybridization complex // Parasitology. 2008. Jan. Vol. 135 (Pt 1). P. 95–104. DOI: 10.1017/S0031182007003599
Kennedy C. R., Berrilli F., Cave D., De Liberto C. Orecchia P. Composition and diversity of helminth communities in eels Anguilla anguilla in the River Tiber: long-term changes and comparison with insular Europe // J. of Helminthology. 1998. Vol. 72, Issue 4. P. 301–306. DOI: 10.1017/S0022149X00016hology643
Kennedy C. R., Moriarty C. Long-term stability in the richness and structure of helminth communities in eels, Anguilla anguilla, in Lough Derg, River Shannon, Ireland // Journal of Helmintology. 2002. Vol. 76, Issue 4. P. 315–322. DOI: 10.1079/JOH2002140
Kuzmin J., Tkach V. Family Rhabdiasidae Railliet, 1915. 2019. URL: http://izan.kiev.ua/ppages/rhabdias/list.htm (03.08.2019).
Kuzmin Yuriy, Dmytrieva I., Marushchak O., Morozov-Leonov S., Oskyrko O., Nekrasova O. Helminth Species and Infracommunities in Frogs Pelophylax ridibundus and P. esculentus (Amphibia: Ranidae) in Northern Ukraine // Acta Parasitologica. 2020. Vol. 65. P. 341–353.
Langford G. J., Vhora M. S., Bolek M. G., Janovy J. Jr. Co-Occurrence of Haemotoloechus complexus and Rhabdias joaquinensis in the Plains Leopard Frog from Nebraska // J. Parasitol. 2013. Vol. 99 (3). P. 558–560.
Milazzo C., Casanova J., Aloise G., Ribas A., Cagnin M. The helminth community of Talpa romana (Thomas, 1902) (Insectivora, Talpidae) in southern Italy // Parasitology Research. 2002. Vol. 88. P. 979–983.
Olsson P. D., Gribb T. H., Tkach V. V., Bray R. A., Littlwood D. T. J. Phylogeny and classification of the Digenea (Platyhelminths: Trematoda) // Intern. J. for Parasitology. 2003. Vol. 33. P. 733–755.
Poulin R. Evolutionary Ecology of Parasites. Princeton, NY, USA: Princeton University Press, 2006. 360 p.
Poulin R. Interactions between species and the structure of helminth communities // Parasitology. 2001. 122 (Suppl.) S. 3–11. DOI: 10.1017/ S0031182000016991
Poulin R., Luque J. L. A general test of the interactive – isolationist continuum in gastrointestinal parasite communities of fish // International Journal of Parasitology. 2003. Vol. 33. P. 1623–1630.
De Yamada Priscilla Oliveira Fadel, Yamada Fabio Hideki, Silva Reinaldo José da & s dos Anjos Luciano Alve. Ecological implications of floods on the parasite communities of two freshwater catfishes in a Neotropical floodplain // Acta Parasitologica. 2017. Vol. 62, Issue 2. P. 312–318.
Randhawa H. S. Numerical and functional responses of intenstinal helminths in thee rajid skates: evidence for competition between parasites? // Parasitology. 2012. Vol. 139, Issue 13. P. 1784–1793.
Rohde K. Ecology of marine parasites. 2nd ed. Wallingford, U.K., 1993. 298 p.
Schabuss M., Kennedy C. R., Konecny R., Grillitsch B., Schiemer F., Herzig A. Long-term investigation of the composition and richness of intestinal helminth communities in the stocked population of eel, Anguilla anguilla, in Neusiedler See, Austria // Parasitology. 2005. Vol. 130, Issue 2. P. 185–194. DOI: 10.1017/S0031182004006444
Spickett A., Junker K., Krasnov B., Haukisalmi V., Matthee S. Intra- and interspecific similarity in species composition of helminth communities in two closely-related rodents from South Africa // Parasitology. 2017. Vol. 144 (9). P. 1211–1220. DOI: 10.1017/S003118201700049X
Timi J. T., Lanfranchi A. L. The importance of the compound community on the parasite infracommunity structure in a small benthic fish // Parasitology Research. 2009. Vol. 104, Issue 2. P. 295-302. DOI: 10.1007/s00436-008-1191-1
Valtonen E. T., Pullkinen K., Poulin R., Julkunen M. The structure of parasite component communities in brackfish water of the northeastern Baltic Sea // Parasitology. 2001. Vol. 122. P. 471–481. DOI: 10.1017/s0031182001007491
Vershinin V. L., Burakova A. V., Vershinina S. D. Comparative Analysis of the Parasitocenoses of Amphibians from the Family Ranidae (Anura) in the Urbanization Gradient // Russian journal of ecology. 2017. Vol. 48, No 5. P. 466–475.
Vhora M. S., Bolek M. G. Temporal occurrence and community structure of helminth parasites in southern leopard frogs, Rana sphenocephala, from north central Oklahoma // Parasitology Research. 2015. Vol. 114, Issue 3. P. 1197–1206. DOI: 10.1007/s00436-014-4303-0






 © 2011 - 2026
© 2011 - 2026