Введение
Многочисленные паразитологические исследования ихтиофауны северных морей указывают на высокий процент инвазии рыб личинками нематод семейства Anisakidae (Гаевская, 1984, 2004; Шукарова, Сальникова, 2013; Ткаченко и др., 2017). Анизакиды имеют широкое распространение в водах Баренцева, Балтийского и Белого морей, где установлена зараженность практически всех видов промысловых рыб гельминтами четырех родов: Anisakis, Contracaecum, Pseudoterranova и Hysterothylacium (Гаевская, 2005).
Высокая интенсивность заражения анизакидами объектов рыбного промысла ухудшает их товарное качество. При интенсивности инвазии путассу, сельди и хамсы – более 20, а минтая и мойвы – более 7 гельминтов на рыбу показатели питательной ценности их мяса значительно снижаются (Васильева, 2002; Дубинина, 2009). Несмотря на это, санитарная оценка допускает реализацию такой рыбы в торговой сети после глубокой заморозки, приводящей к гибели паразитов (Гаврюшенко, 2016).
Для здоровья людей опасность представляют паразитирующие у рыб личиночные стадии анизакид трех видов: Anisakis simplex, Pseudoterranova decipiens и Contracaecum osculatum. Они вызывают заболевание анизакидоз с поражением желудочно-кишечного тракта. Основной источник и хозяин-носитель данных гельминтов – морская рыба (Головина и др., 2007). Традиционное для жителей северных районов употребление в пищу сырой или слабосоленой морской рыбы, а также икры быстрого посола создает реальную опасность распространения данного заболевания. В последние годы на территории России уже были зафиксированы случаи заражения людей анизакидами на Дальнем Востоке (Микулич, 2010).
Одним из объектов промыслового рыболовства на Белом море является навага. Ежегодный объем ее добычи (~190 т/год) в среднем составляет 30–40 % от общего вылова (Государственный доклад..., 2019). В местах вылова рыба, как правило, замораживается для дальнейшей транспортировки и хранения. Определенное количество наваги поступает к потребителям практически «с моря на стол» без длительной заморозки или реализуется в свежем виде. Это повышает вероятность употребления населением в пищу рыбы с выжившими гельминтами. Нематоды вызывают и эстетическую проблему, негативно влияющую на рынок морепродуктов прибрежных районов Белого моря и на доход рыбаков-поморов.
До настоящего времени изучение зараженности беломорской наваги нематодами семейства Anisakidae на местах промысла не проводилось. Также необходим анализ профилактических мероприятий, направленных на предотвращение анизакидоза человека. Целью представленной работы является проведение ветеринарно-санитарной экспертизы свежевыловленной наваги и оценка интенсивности ее заражения личинками анизакид при разных условиях хранения.
Материалы
Изучение паразитов семейства Anisakidae проводилось на наваге (Eleginus navaga Pallas) – морской арктической рыбе из семейства тресковых Gadidae. Материал был собран в промысловый период в Сумской губе Онежского залива Белого моря. Общее количество выловленных особей составило 125 штук: 42 особи в январе 2016 г., 21 – в марте 2016 г. и 62 – в марте 2019 г.
Для количественной оценки зараженности наваги использованы следующие показатели:
- экстенсивность инвазии (ЭИ, %) – степень зараженности рыб в процентах,
- интенсивность инвазии (ИИ, экз.) – среднее число паразитов на одну зараженную рыбу.
Для анализа выживаемости личинок анизакид было проведено паразитологическое исследование рыбы: свежевыловленной (рыба-сырец), охлажденной после 24 часов хранения и дефростированной после 15 суток заморозки.
У всех рыб измерялась абсолютная длина тела при помощи мерной ленты и определялась половая принадлежность по первичным половым признакам – наличию молок или икры.
Для получения данных по зараженности отдельных органов рыб использовался показатель встречаемости личинок анизакид. Для оценки величины признаков рассчитывалась медиана, как наиболее представительная и устойчивая статистическая характеристика, на которую слабо влияют выскакивающие варианты и несоответствие выборок закону нормального распределения (Животовский, 1991; Коросов, 2007).
Методы
Анализ физических показателей и изучение зараженности наваги проводились по утвержденной методике (Методика…, 1989; ГОСТ..., 2011).
Личинки анизакид определялись методом визуального осмотра всех органов, полостей и тканей рыб. Отмечалось наличие (или отсутствие) паразитов в печени, пилорических придатках, кишечнике, мышцах, гонадах, анальном отверстии, под кожей, на серозной оболочке полости тела и в жабрах, видимых невооруженным глазом. Жизнеспособность обнаруженных личинок нематод определяли по морфологическим признакам и двигательной активности (Методика…, 1989).
При обработке данных использовались непараметрические показатели и методы вариационной статистики: критерий Уилкоксона – Манна – Уитни, тест Колмогорова – Смирнова, критерий Хи-квадрат Пирсона, коэффициент корреляции Спирмена rs (со статистической ошибкой mr = корень((1-rs ^ 2)/(n – 2)) (Коросов, 2007).
Оценка влияния условий хранения зараженных рыб была проведена с использованием кластерного анализа на основе метода Уорда (Ward’s method), в котором расчет расстояний между кластерами основан на дисперсионном анализе. В результате образуются группы приблизительно равных размеров с минимальной внутрикластерной вариацией. Для статистического подтверждения наличия кластеров на рисунках указан уровень бутстрэп-поддержки в точках ветвления дендрограмм при количестве итераций для бутстрэпинга, равном 10000 (Шитиков, Розенберг, 2013).
Статистическая обработка полученного материала выполнялась в программах Microsoft Excel 2010, STATGRAPHICS Plus 5.0, PAST версии v3.17.
Результаты
Ветеринарно-санитарная экспертиза 125 рыб установила зараженность их паразитами семейства Anisakidae, принадлежащих к нескольким родам, в том числе представляющих опасность для здоровья человека (СанПиН..., 2003).
При паразитологическом исследовании наваги выявили наличие в рыбе личинок анизакид на разных стадиях развития: второй, третьей и четвертой. Паразиты были локализованы в печени, пилорических придатках, на серозе кишечника и полости тела.
Доля зараженных рыб личинками анизакид (ЭИ) в 2016 г. составила 67 %, в 2019 – 87 %, однако достоверных отличий как по годам, так и по месяцам выявлено не было (критерий Пирсона, p = 0.10 и p = 0.34 соответственно). Не установлено достоверных отличий и по интенсивности инвазий (ИИ): 2016 г. – 2 экз. (от 1 до 20); 2019 г. – 4 экз. (от 1 до 20) (тест Колмогорова – Смирнова – p = 0.09; критерий Уилкоксона – p = 0.077). По половой принадлежности значимых различий также не выявлено (p = 0.37 и p = 0.06 соответственно).
Результаты сравнительного анализа позволили объединить данные обоих лет по самцам и самкам для проведения дальнейшего исследования, которое показало, что степень зараженности беломорской наваги личинками анизакид в среднем составляет 74 ± 5 % с интенсивностью инвазий – 5.5 ± 1.6 экз. (от 1 до 20 экз./рыбу). Установлена средняя зависимость между длиной тела рыбы и интенсивностью ее заражения: rs = 0.57 ± 0.10, p = 0.02 (рис. 1).
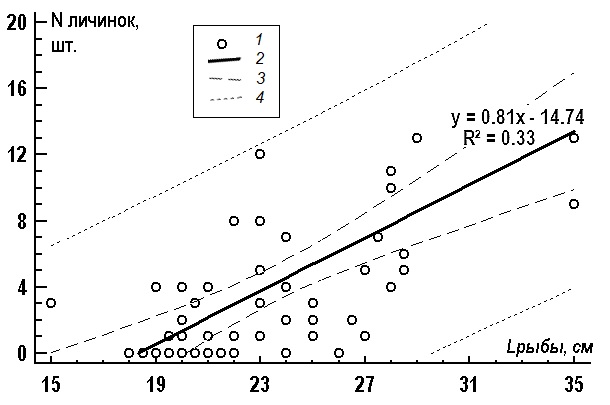
Рис. 1. Линейная зависимость интенсивности заражения (N личинок, шт.) Eleginus navaga от длины ее тела (L рыбы, см); 1 – исходные данные, 2 – линия тренда, 3 – доверительный интервал, 4 – интервал прогноза
Fig.1. Linear dependence of infection intensity (n larvae, PCs.) of Eleginus navaga on body length (L fish, cm); 1 – source data, 2- trend line, 3-confidence interval, 4- forecast interval
Уравнение регрессии достоверно согласуется с исходными данными, модель адекватна реальности (p = 0.03): чем крупнее рыба, тем больше интенсивность ее заражения. Широкий размах изменчивости исходных данных и средняя зависимость переменных объясняется разнообразием случайных факторов (особенностями жизнедеятельности рыб – питание, условия местообитания, миграции и т. д.).
Выявление органов-мишеней (основных мест локализации личинок паразитов) зараженных особей свежевыловленной наваги было проведено с помощью кластерного анализа на основе метода Уорда и евклидовой меры расстояния (рис. 2).
Рис. 2. Дендрограмма сходства внутренних органов свежевыловленных рыб по зараженности их личинками анизакид с нанесенными оценками бутстрэп-вероятностей ветвей. Пунктиром с римскими цифрами отмечены кластеры органов с доверительной вероятностью > 95 %
Fig. 2. Dendrogram of similarity of internal organs of raw fish by infestation with larvae of Anisacidae family, with estimates of bootstrap probability. Dotting with Romal numerals indicate clusters of organs with a confidence probability > 95 %
Основными органами локализации личинок анизакид у рыбы-сырца являются печень, желудочно-кишечный тракт и серозная оболочка; единичны случаи обнаружения паразитов под кожей, в жабрах и в области анального отверстия (на рис. 2, 3 – «анус»). Нахождение анизакид в пилорических придатках, мышцах и гонадах определяется, скорее всего, индивидуальными особенностями самих рыб и длительностью их заражения в естественной среде обитания (см. рис. 2).
Сравнительный анализ интенсивности инвазии наваги личинками анизакид в зависимости от сроков хранения показал, что у свежевыловленной рыбы зараженность составляет 48 %, после 24 часов хранения – 26 %, а после заморозки – 5 % (отличия по степени зараженности достоверны: критерий Пирсона, p = 0.02). Изменения связаны не только с эффективностью профилактических мероприятий (уменьшение количества паразитов), но и с переходом личинок из формы плоской свернутой спирали в свободную форму – червей (табл. 1; p < 0.01 по критерию Пирсона).
Таблица 1. Соотношение форм личинок нематод семейства Anisakidae в наваге при разных условиях хранения рыб после вылова (доля, %)
Table 1. Ratio of forms of nematode larvae of the Anisakidae family in navaga under different conditions of fish storage after catch (share, %)
| Условия | Форма спирали | Свободная форма (червь) |
| Рыба-сырец (1 час после вылова) | 65 | 23 |
| Рыба охлажденная (24 часа после вылова) | 7 | 57 |
| Дефростированная рыба (15 суток заморозки) | 0 | 31 |
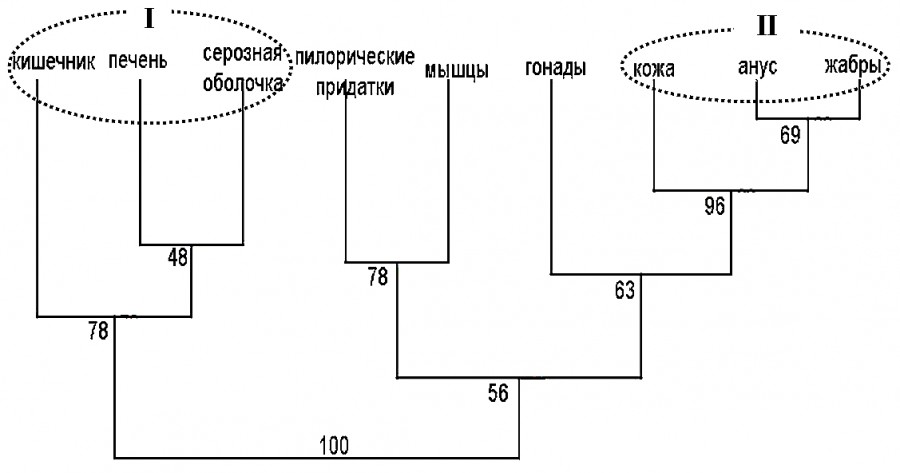
Для оценки эффективности профилактических мероприятий с помощью кластерного анализа выявили изменения в концентрации и локализации анизакид после 24 часов хранения рыб и их заморозки (рис. 3).
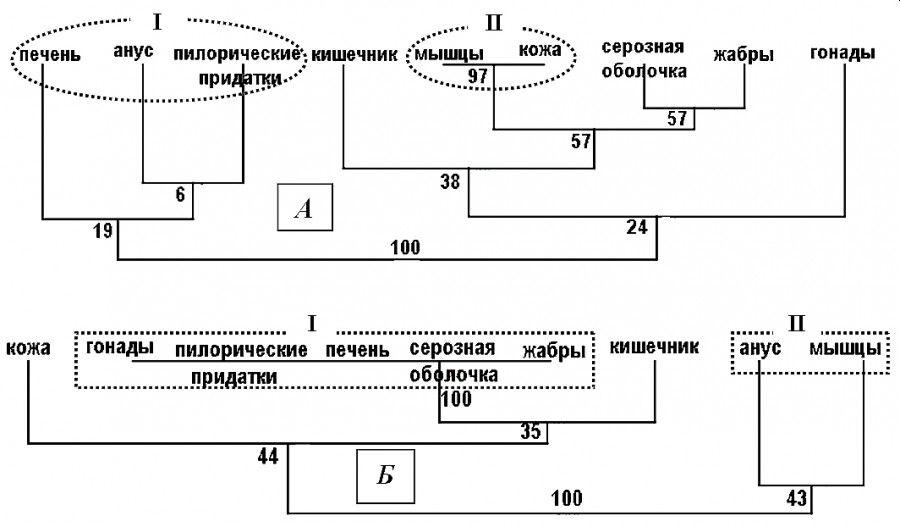
Рис. 3. Дендрограмма сходства внутренних органов рыб (А – после 24 часов хранения, Б – после их заморозки) по зараженности их анизакидами с нанесенными оценками бутстрэп-вероятностей ветвей. Пунктиром с римскими цифрами отмечены кластеры органов с доверительной вероятностью P > 95 %
Fig. 3. Dendrogram of similarity of internal organs of fish by their infestation with larvae of Anisacidae family (A – after 24 hours of storage and B – after freezing), with estimates of bootstrap probability. Dotting with Romal numerals indicate clusters of organs with a confidence probability P > 95 %
После 24 часов хранения рыбы анизакиды концентрируются в печени и пилорических придатках, их миграция в анальное отверстие объясняет формирование первого кластера органов (I, А, рис. 3). Отсутствие анизакид в мышцах и под кожными покровами формирует второй кластер. Обнаружение паразитов в других органах может быть связано с разной степенью повреждения и началом разложения внутренних органов рыб при хранении без специальной обработки.
У рыбы после интенсивной заморозки наблюдается существенное уменьшение количества органов, пораженных личинками анизакид (p < 0.001 по критерию Уилкоксона и Колмогорова – Смирнова при сравнении с выборками свежих рыб и после 24 часов их хранения). В первый кластер объединены органы, в которых не удалось обнаружить анизакид (I, Б, рис. 3). Обнаружение паразитов больше чем в одном органе (в анальном отверстии и в мышцах, кластер II) можно объяснить нарушением процесса заморозки (человеческий фактор) или редкой выносливостью вида при понижении температуры.
Результаты кластерного анализа подтверждают эффективность профилактических мероприятий в виде заморозки рыбы с целью элиминации личинок анизакид. Однако 24-часовое хранение рыб также приводит к достоверному уменьшению концентрации паразитов (p < 0.03 по критерию Пирсона при сравнении с выборками свежих рыб) и их локализации в органах (пилорические придатки, анальное отверстие), не используемых человеком в пищу. К основному органу-мишени следует отнести печень, где наблюдается скопление анизакидных нематод как у свежевыловленных рыб, так и у особей после 24 часов хранения. Употребление печени наваги в пищу рекомендуется только после заморозки рыб.
Таблица 2. Локализация гельминтов семейства Anisakilae в органах и тканях наваги (2019 г.)
Table 2. Location of helminthes of the Anisakidae family in the organs of navaga (2019)
| Место локализации | Количество обнаруженных нематод, шт. | ||
| рыба-сырец | охлажденная рыба | дефростированная рыба | |
| Печень | 6 | 43 | 0 |
| Пилорические придатки | 75 | 29 | 0 |
| На кишечнике | 29 | 11 | 1 |
| В мышцах | 4 | 0 | 2 |
| В гонадах | 19 | 11 | 0 |
| В области анального отверстия | 1 | 8 | 2 |
| На серозе | 4 | 0 | 1 |
Нами установлена зараженность беломорской наваги личинками нематод семейства Anisakidae. В задачи исследований не входило определение паразитов до вида, однако по фенотипическим особенностям и морфометрическим признакам отмечена принадлежность паразитов не менее чем к трем родам, которые являются наиболее опасными для здоровья человека: Anisakis, Pseudoterranova и Hysterothylacium.
При вскрытии рыбы-сырца наибольшее количество обнаруженных нематод было в форме спирали диаметром 4–6 мм и незрелые цисты до 2 мм. Размер личиок, извлеченных из капсул, от 14 до 22 мм. Основным местом локализации личинок была печень, серозная оболочка кишечника, пилорических придатков, гонады, область анального отверстия, мышечная ткань хозяина. Единичны случаи обнаружения личинок свободной от капсулы формы в виде взрослых червей (19–28 мм), находившихся в печени и гонадах наваги.
При вскрытии охлажденной рыбы через 24 часа после вылова в полости тела наваги обнаружены только нематоды в свободной от капсулы форме размером от 14 до 28 мм. Основным местом локализации анизакид была печень наваги, пилорические придатки, гонады. Некоторые личинки выползали наружу (торчали из анального отверстия) или находились на поверхности тела рыб.
В наваге после длительного замораживания (15 суток, -18 ˚С) и последующей дефростации личинки в форме спирали не обнаружены, количество личинок в свободной форме значительно меньше, размер нематод 15–18 мм.
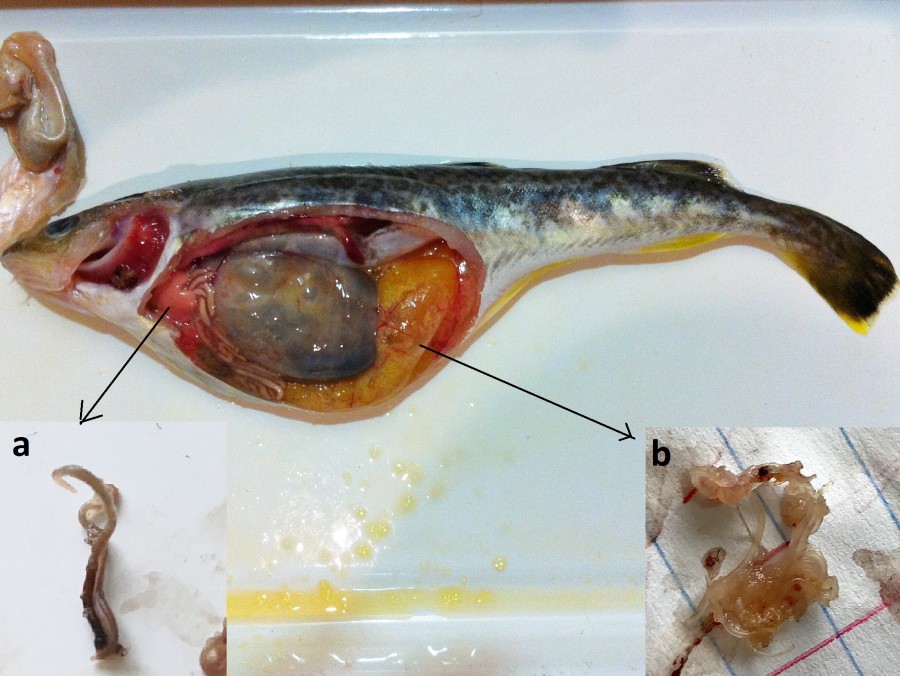
У нескольких рыб в печени и гонадах вместе с личинками были обнаружены живые, взрослые формы анизакид в процессе спаривания (рис. 4). Это позволяет сделать вывод, что навага может являться окончательным хозяином для представителей нематод семейства Anisakidae. Среди анизакид в рыбах во взрослом состоянии паразитирует Hysterothylacium aduncum (Гаевская, 2005).
Рис. 4. Взрослые формы анизакид в процессе спаривания: a – сцепление нематод, обнаруженных в печени наваги, b – образование клубка нематод, обнаруженных в икре наваги
Fig. 4. Adult nematodes in the mating process: a – coupling of nematodes found in the liver of navaga, b – formation of a tangle of nematodes found in the navaga caviar
Высокую зараженность наваги гельминтами семейства Anisakidae (ЭИ = 74 ± 5 %, ИИ = 5.5 ± 1.6 экз.) можно объяснить специфическими условиями обитания рыб в Белом море: наличие большого количества мелких защищенных от ветра губ, хорошо прогреваемых летом.
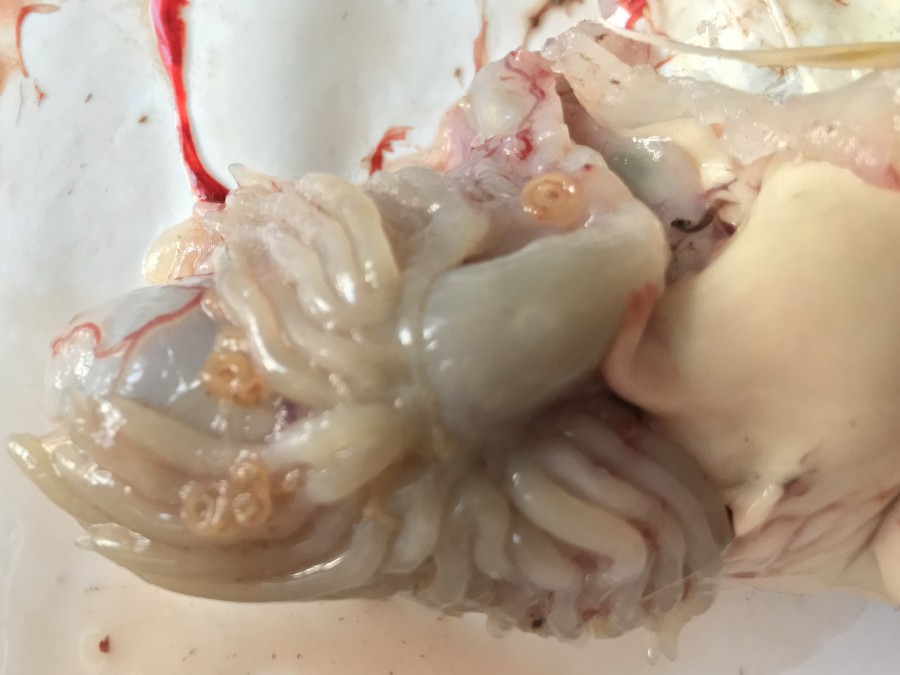
У наваги, как и большинства представителей тресковых, личинки анизакид локализуются в основном на внутренних органах, особенно на печени, пилорических придатках и кишечнике, что характерно в первые часы после вылова – свернуты в спираль и находятся в бесцветной прозрачной капсуле (рис. 5).
Рис. 5. Анизакидные нематоды на пилорических придатках наваги в состоянии плоской свернутой спирали
Fig. 5. The Anisakidae on the pyloric appendages of navaga in the state of a flat coiled spiral
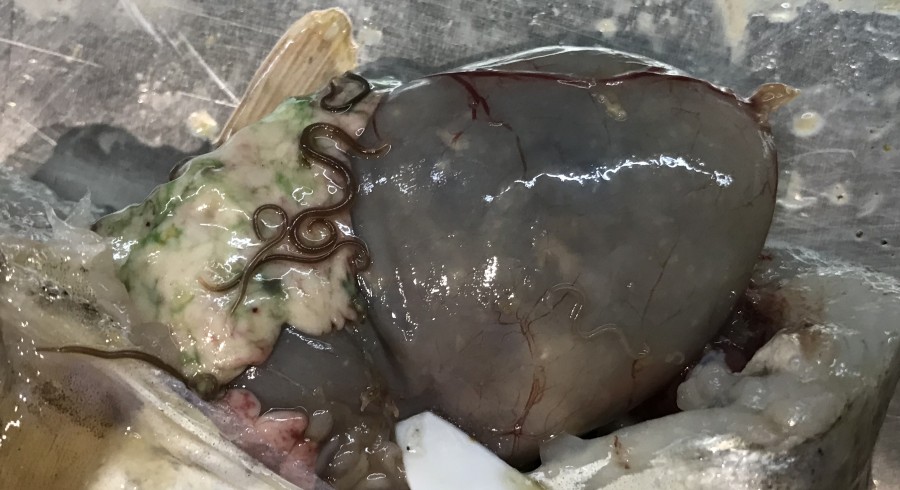
В процессе вскрытия рыбы также отмечено, что у отнерестившейся наваги, которая начала активно питаться, количество нематод увеличивается. В желудке наваги обнаружены мелкие корюшки и сельди, они являются основным источником питания взрослой наваги в этот период. Селедка белого моря, как известно, заражена Anisakis simplex и не только (Гаевская, 2005). Инкапсулированные личинки и взрослые формы анизакидных нематод представлены на рис. 6.
Рис. 6. Анизакиды на кишечнике и в печени наваги
Fig. 6. The Anisakidae on the intestines and in the liver of navaga
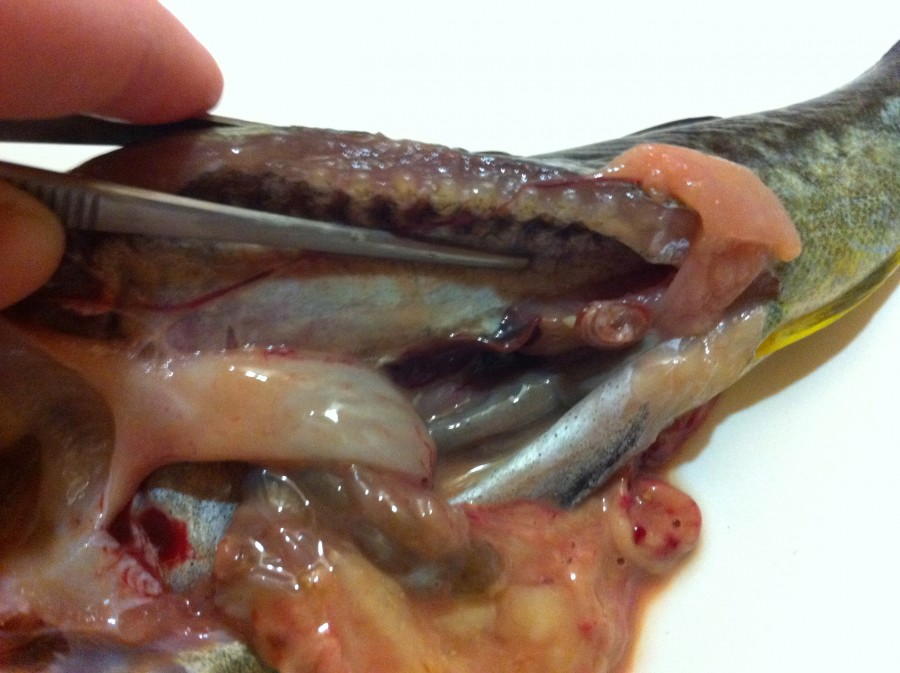
В отдельных случаях обнаруживали личинок семейства Anisakidae в форме спирали на внутренней части брюшной стенки в области анального отверстия (рис. 7).
Рис. 7. Анизакиды в состоянии плоской свернутой спирали в области анального отверстия
Fig. 7. The Anisakidae in the form of a spiral in the area of the anal opening of navaga
Устойчивость личинок к низкой температуре была подтверждена экспериментально: анизакидные нематоды, извлеченные из свежей наваги, длительное время (от 7 до 23 дней) оставались живыми в пробирке с водой в условиях холодильника (t= -4 ºС). Более того, при естественном замораживании рыбы (средняя температура воздуха ‑15 ºС) и дальнейшем ее хранении в течение 5 дней личинки также сохраняли свою жизнеспособность.
Обнаружение живых анизакид в мышцах свежевыловленной и охлажденной рыбы говорит о небезопасности ее реализации в торговой сети (СанПиН..., 2003). Поэтому навага, реализуемая сразу после вылова или в охлажденном виде должна подвергаться обязательному потрошению, а при длительном хранении – глубокой заморозке.
Опытным путем определено, что в наваге, замороженной более 15 суток с температурой в толще мышечной массы ‑18 ºС, после дефростации все обнаруженные личинки нематод оказались нежизнеспособными. Следовательно, условия замораживания рыб влияют на выживаемость анизакид. Для полного обеззараживания рыбной продукции должно проводиться искусственное воздушное (сухое) замораживание с температурой воздуха не менее -18 ºС.
Полученные результаты подтверждаются исследованиями Г. Н. Родюк (2001), согласно которым срок гибели паразитов семейства Anisakidae после замораживания и дальнейшего хранения при одинаковой температуре следующий: ‑12 ºС (35 суток), ‑18 ºС (10–14 суток), ‑20 ºС (7 суток) и ‑25 ºС (1 сутки).
Согласно санитарно-паразитологической оценке беломорской наваги, обнаруженные в ней личинки анизакид могут быть отнесены к группе паразитов, представляющих опасность для человека или хозяйственно-ценных млекопитающих (живые анизакиды в мышечной ткани рыб). Однако необходимо заметить, что гельминты, относящиеся к данной группе, опасны лишь в живом состоянии. Следовательно, обязательное требование для разрешения пищевого использования наваги – отсутствие в рыбе живых анизакид соответствующих видов, что может быть достигнуто путем специальной заморозки.
Кроме того, анизакиды относятся к группе паразитов, портящих товарный вид рыбного сырья или продукции (мертвые анизакиды в мышечной ткани рыб), для которых устанавливаются критерии допустимого их количества. В реализацию допускается рыба, в которой обнаружено не более 5 личинок анизакид на 1 кг веса, диаметр капсул которых достигает 3 мм, или если они имеют 1 см в длину (более мелкие личинки учету не подлежат). В противном случае рыбу допускают к продаже только после ее переработки (Методика…, 1989).
Беломорская навага для переработки не используется и на реализацию населению она поступает, как правило, в непотрошеном виде. Поэтому, если рыбу планируют использовать в свежем виде (без предварительной заморозки), важно ее своевременное потрошение (в первые часы после вылова).
Заключение
Основные результаты исследования представлены в виде выводов:
- Зараженность (ЭИ) беломорской наваги анизакидными нематодами составляет 74 ± 5 % с интенсивностью инвазий (ИИ) – 5.5 ± 1.6 экз. (от 1 до 20 экз.); достоверных отличий по годам или половой принадлежности по показателям ЭИ и ИИ установлено не было.
- Установлена зависимость (rs = 0.57 ± 0.10) между длиной тела наваги и интенсивностью ее заражения: чем крупнее рыба, тем больше показатель ИИ.
- У свежевыловленных рыб основными органами локализации анизакид являются печень, серозная оболочка кишечника, пилорических придатков и мышечная ткань рыб.
- Снижение интенсивности заражения наваги личинками анизакид при разных условиях хранения связано не только с эффективностью профилактических мероприятий (замораживание с помощью искусственного холода), но и с тем, что более зрелые личинки анизакид выходят из капсулы и стремятся выбраться наружу, покинуть рыбу.
- Результаты кластерного анализа подтверждают эффективность профилактических мероприятий в виде замораживания рыбы с целью элиминации личинок и взрослых особей анизакид (нематоды в полости тела рыбы лопаются, сохраняются в основном только личинки в мышечной ткани).
- Основной орган-мишень – печень, где наблюдается скопление личинок 2-й, 3-й стадий и предвзрослых личинок анизакид как у свежевыловленных рыб, так и у особей после 24 часов хранения. Употребление печени в пищу рекомендуется только после заморозки рыб.
Чтобы сохранить улов, поморы какое-то количество рыбы замораживают впрок, часть рыбы засаливают, но в основном используют в пищу свежевыловленную навагу. Хозяйки варят уху, запекают рыбу в тесте, из соленой делают холодные закуски. Употребление в пищу сырой, полусырой, недостаточно обработанной уксусом, непросоленной или копченой рыбы, икры-«пятиминутки» создает реальную угрозу для распространения анизакидоза. Избежать попадания живых личинок анизакид в человеческий организм возможно при соблюдении следующих профилактических мероприятий:
- Температура заморозки наваги не менее ‑18 ºС в течение 72 часов;
- Термическая обработка рыбы не менее 25 минут;
- Приготовление слабосоленой рыбы и икры только после предварительной заморозки.
В качестве профилактических мероприятий, проводимых при анизакидозе рыб, на территории Мурманской области действует Постановление Правительства от 29 мая 2008 года № 245-ПП/9, обязывающее продавцов информировать покупателей о проведении обязательной термической обработки живой и охлажденной морской рыбы перед употреблением в пищу. Информация доводится до покупателей в печатном виде на плакатах, листовках-памятках либо на упаковке продукции (О мерах…, 2008).
Библиография
Васильева О. А. Ветеринарно-санитарная экспертиза рыбы при анизакидозе : Дис. ... канд. ветеринар. наук. М., 2002. 202 с.
Гаврюшенко И. В. Видовая принадлежность и жизнеспособность личинок анизакид, обнаруженных в мясе морской рыбы // Биотика. 2016. Т. 2 (9). Апрель. С. 32–37.
Гаевская А. В. Паразиты рыб Северо-восточной Атлантики: фауна, экология, особенности формирования : Дис. … д-ра биол. наук. Л., 1984. 245 с.
Гаевская А. В. Паразиты и болезни морских и океанических рыб в природных и искусственных условиях . Севастополь, 2004. 236 с.
Гаевская А. В. Анизакидные нематоды и заболевания, вызываемые ими у животных и человека . Севастополь: ЭКОСИ-Гидрофизика, 2005. 223 с.
ГОСТ 7631-2008. Рыба, нерыбные объекты и продукция из них. Методы определения органолептических и физических показателей . М.: Стандартинформ, 2011. 10 с.
Головина Н. А., Стрелков Ю. А., Воронин В. Н. Ихтиопатология . М.: Мир, 2007. 447 с.
Государственный доклад о состоянии окружающей среды Республики Карелия . Ижевск: ООО «Принт», 2019. 316 с.
Дубинина М. Е. Ветеринарно-санитарная экспертиза различных видов рыб при анизакидозе : Автореф. дис. ... канд. ветеринар. наук. Чебоксары, 2009. 25 с.
Животовский Л. А. Популяционная биометрия . М.: Наука, 1991. 271 с.
Коросов А. В. Специальные методы биометрии . Петрозаводск: Изд-во ПетрГУ, 2007. 364 с.
Методика паразитологического инспектирования морской рыбы и рыбной продукции (морская рыба-сырец, рыба охлажденная и мороженная) . М.: ВНИРО, 1989. 40 с.
Микулич Е. Л. Паразиты морских рыб и кальмаров // Актуальные проблемы интенсивного развития животноводства. Горки, 2010. С. 387–394.
О мерах по реализации населению Мурманской области живой и охлажденной рыбы и морепродуктов : Постановление Правительства Мурманской области от 29 мая 2008 года № 245-ПП/9. URL: http://docs.cntd.ru/document/913513736.
Родюк Г. Н. Проблема анизакиоза салаки и пути ее решения в Калининградской области // Морская индустрия. 2001. № 2. С. 22–23.
СанПиН 3.2.1333-03. Санитарно-эпидемиологические правила и нормативы: Профилактика паразитарных болезней на территории Российской Федерации . М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2003. 64 с.
Ткаченко А. В., Прусов С. В., Карасев А. Б., Шкателов А. П. Современное состояние зараженности атлантического лосося р. Поной (Мурманская область) личинками нематоды Anisakis simplex // Вестник МГТУ. 2017. Т. 20. № 2. С. 455–462.
Шитиков В. К., Розенберг Г. С. Рандомизация и бутстреп: статистический анализ данных по биологии и экологии с использованием R . Тольятти: Институт экологии Волжского бассейна РАН, 2013. 289 с.
Шукарова Н. В., Сальникова М. М. Мониторинг паразитов беломорской прибрежной трески // Паразитология в изменяющемся мире: Материалы V съезда паразитологического общества РАН. Новосибирск: Гарамонд, 2013. С. 216.






 © 2011 - 2026
© 2011 - 2026