Введение
Rhabdias – самая крупная родовая совокупность в семействе нематод Rhabdiasidae. Во всех зоогеографических областях кроме Антарктики насчитывается 84 представителя рода (Kuzmin et al., 2014). Одним из наиболее распространенных видов рода является Rhabdias bufonis (Schrank, 1788) – паразит земноводных (Bombina, Pelobates, Bufo, Rana, Pelophylax и Amietophrynus) (Кузьмин, 1995; Kuzmin, Tkach, 2019). У амфибий, ведущих наземный образ жизни, названный вид зачастую является доминирующим в сообществах гельминтов (Ваккер, Тарасовская, 1988; Ибрагимова, 2013; Жигилева, 2017). R. bufonis распространен от восточных областей России (Однокурцев, Седалищев, 2008; Щепина, Балданова, 2010) до западных районов Франции (Combes et al., 1971). Вид описан у озерной лягушки (Pelophylax ridibundus) на Балканах (Spieler, 1994), у обыкновенной (Bufo bufo) и зеленой жаб (B. viridis) в Турции (Düşen, 2011), у африканской жабы Amietophrynus regularis = Sclerophrys regularis из Египта (Morsy et al., 2018). В Казахстане R. bufonis найден у обыкновенной и зеленой жаб, озерной, травяной (Rana temporaria) и остромордой (R. arvalis) лягушек (Соболева, 1975; Ваккер, Тарасовская, 1988; Ваккер и др., 1990; Аралханова, 2010; Тарасовская, 2016).
Развитие, морфология, систематика, распространение и многие другие стороны биологии гельминта изучены достаточно хорошо. Считается, что R. bufonis подходит для роли модельного вида при изучении ряда общих вопросов биологии и эволюции гельминтов (Буракова, 2010; Тарасовская, 2013; Langford, Janovy, 2009; Nigon, Felix, 2017). Однако для модельного вида в экологии R. bufonis недостаточно современных сведений о зараженности хозяев в разных биотопах и ландшафтах, мало данных по многолетней, сезонной и половозрастной динамике численности нематоды, в частности, в популяциях R. arvalis из степной зоны Казахстана. В большинстве источников обсуждается зараженность легких, форма нематоды, обитающая в полости тела (Л4), остается без внимания. Скудны данные, освещающие особенности цикла развития нематоды в естественных и антропогенных биотопах. Предлагаемая работа призвана восполнить указанные пробелы.
Материалы
Гельминтологический материал получен от вскрытия R. arvalis (2637 экз.), отловленных ручным методом в 14 биотопах степной зоны Республики Казахстан (Павлодарская область). Биотоп Усолка, в котором в течение 1984–1997 гг. проводили гельминтологический мониторинг, находится в правобережной пойме реки Иртыш, в 15 км выше города Павлодара (52 12' 32.15'' СШ и 77 01' 05.70'' ВД). Лягушки собраны на площадке длиной 500 м и шириной 0.5–7.0 м. Для изучения сезонной динамики зараженности R. arvalis в 1984–1988 гг. с мая по сентябрь на площадке делали по одной ежемесячной выборке. В остальные годы брали одну – четыре пробы в сезон. В трех учетных точках сезонные сборы R. arvalis проведены в 1987–1988 гг., а разовые – в 1986 г. Одна из них – Черноярка – расположена в правобережной пойме Иртыша, но 25 км ниже г. Павлодара. R. arvalis добыты среди растительности на берегах водоема, ежегодно пересыхающего к концу июня. Три километра восточнее Усольского биотопа в зеленом поясе г. Павлодара находится пункт Яблонька, где R. arvalis собраны около заполненного водой понижения рельефа, оставшегося после изъятия грунта при строительстве шоссе. Четвертая выборка амфибий сделана на берегах водоема, образовавшегося на месте заброшенного песчаного карьера. Этот биотоп под названием Карьер размещается в двух километрах на северо-восток от Яблоньки. Постоянное зеркало воды в двух последних водоемах поддерживается благодаря поднявшемуся уровню грунтовых вод. Эти надпойменные водоемы антропогенного происхождения служат для размножения R. arvalis и выроста головастиков. Пятый пункт сбора материала расположен около агробиологической станции Павлодарского государственного педагогического института (АБС). Хозяева отловлены в 1987 г. на побережьи антропогенного водоема, возникшего в понижении рельефа за счет талых вод и инфильтратов из поливных полей Черноярского агрообъединения. Кроме серийных проб из названных пяти учетных точек в 9 биотопах взяты разовые выборки R. arvalis. У остромордых лягушек графическим методом выделено шесть размерно-возрастных групп (Ваккер, Тарасовская, 1988). К первой относятся ювенильные особи (сеголетки), лягушата первого года рождения, длина тела (от кончика морды до клоаки) до 20.0, ко второй – от 20.1 до 25.0, к третьей – от 25.1 до 30.0, к четвертой – от 30.1 до 36.0, к пятой – от 36.1 до 44.0 и к шестой – более 44.1 мм.
Методы
Хранение и вскрытие хозяев, сбор, фиксацию, просветление паразитов проводили по общепринятым методикам (Боев и др., 1962). Достоверность отличия между выборками остромордой лягушки по экстенсивности инвазии R. bufonis (Р, prevalence) оценивали по критерию Стьюдента (tφ) с преобразованием долей зараженности в углы – φ (Плохинский, 1970). При распределении R. bufonis в популяциях хозяина, отличающемся от нормального, отличия между выборками по численности гельминта определяли не сравнением индексов обилия гельминта (M, mean abundance), а путем сопоставления фактической численности i-го вида гельминтов в j-й выборке хозяина с теоретической (Песенко, 1982). Подсчет последней проводили, исходя из нулевой гипотезы (Н0) о равномерном, случайном распределении гельминтов i-го вида в сравниваемых выборках лягушек по формуле: nij*= (ni / N) · Nj, где Nj – объем j-й выборки хозяина, ni – количество особей i-го вида во всех сборах объемом N. Достоверность отличия между эмпирическим (nij) и теоретическим числом гельминта i-го вида подтверждали, опираясь на критерий χ² Пирсона. Характер смещения числа i-го вида гельминтов к j-й выборке лягушек определяли по показателю биотопической приуроченности вида по формуле: Fij = ((nij / Nj) – (ni - nij) / (N – Nj)) / ((nij/Nj) + (ni – nij) / (N – Nj)). При величине Fij = -1 считали, что i-й вид гельминтов полностью избегает j-ю пробу, при Fij = 0 – i-й вид гельминтов относится к j-й выборке нейтрально, т. е. не предпочитает и не избегает, при Fij = +1 – i-й вид гельминтов предпочитает j-ю пробу, т. е. полностью сосредоточен в ней (Песенко, 1982). Коррелятивную зависимость между изменением экстенсивности инвазии хозяина (у) и индексом обилия гельминта i-го вида (х) в течение времени определяли по коэффициенту корреляции rxy Пирсона (Ивантер, Коросов, 1992). При малом числе пар показателей (n > 30) величину коэффициента rxy подвергали z-преобразованию Фишера (Лакин, 1990). На рисунках, для сравнимости величины индекса обилия нематоды и экстенсивности инвазии хозяина, последнюю уменьшали в 10 раз (Р/10). Динамику сезонных потоков численности легочных и полостных R. bufonis сравнивали по критерию λ (лямбда) Колмогорова – Смирнова (Песенко, 1982). Доминирование (численного преобладания) гельминта i-го вида определяли, используя индекс доминирования А. Ковнацкого, в соответствии с формулой: Di = Pi· (nij / Σn), где Di – численное преобладание (доминирование) гельминта i-го вида, Pi – экстенсивность инвазии хозяина гельминтом i-го вида, nij – численность i-го вида в j-й выборке, Σn – сумма численности всех сравниваемых видов гельминтов. С помощью индекса выделены четыре группы видов – доминанты (D = 100 – 10), субдоминанты (D = 10 – 1), адоминанты группы А (D = 1 – 0.1), адоминанты группы В (D = 0.1 – 0.01) (Баканов, 1987).
Результаты
Особенности морфологии и цикла развития Rhabdias bufonis
Существенных различий в размерах R. bufonis из легких R. arvalis из степной зоны Казахстана и хозяев, добытых в Средней Европе (Hartwich, 1972) и Египте (Morsy et al., 2018), не наблюдается (табл. 1). Однако у измеренных нами R. bufonis индекс «длина хвоста / длина тела» больше, чем по данным Г. Гартвих (Hartwich, 1972). Паразитические особи R. bufonis, обитающие в легких R. arvalis, имеют женский морфотип и являются протерандрическими гермафродитами (Шульц, Гвоздев, 1970). Вслед за наполнением семенного пузырька спермиями начинается образование и оплодотворение яиц. Оплодотворенные яйца движением мерцательного эпителия переносятся из легких в ротовую полость и проглатываются. В кишечнике развиваются рабдитовидные личинки (Л1), которые накапливаются в ректуме хозяина. Вместе с фекалиями Л1 попадают во внешнюю среду и три раза линяют. Из Л4 развиваются свободноживущие самцы и самки R. bufonis. В эксперименте на прокаленной и увлажненной почве первые самцы и самки из яиц появились через 2–3 дня (Ваккер, Тарасовская, 1988).
Таблица 1. Размеры Rhabdias bufonis (мм) в легких хозяев из Европы, Африки и Азии (Казахстан)
Table 1. Measurements of Rhabdias bufonis (mm.) in the lungs of hosts in Europe, Africa and Asia (Kazakhstan)
| Признаки | Виды хозяев (авторы описаний) | ||
| Rana temporaria (Hartwich, 1972) | Rana arvalis (Ваккер, Тарасовская, 1988) | Amietophrynus regularis (Morsy et al., 2018) | |
| Длина тела | 3.6–13.8 | 3.30–7.12 | 3.22–9.86 |
| Максимальная ширина | 0.14–0.52 | 0.18–0.38 | 0.09–0.48 |
| Размеры ротовой капсулы | 0.009–0.012 х 0.008–0.010 | 0.006–0.015 х 0.006–0.009 | 0.013–0.031 x 0.016–0.027 |
| Длина пищевода | 0.38–0.68 | 0.30–0.51 | 0.27–0.63 |
| Расстояние от вульвы до переднего конца тела | 1.95–8.11 | 1.76–3.98 | 1.47–5.98 |
| Размеры яиц | 0.078–0.119 х 0.047–0.064 | 0.069–0.096 х 0.033–0.054 | 0.120–0.132 x 0.039–0.812 |
| Длина хвоста | 0.212–0.549 | 0.240–0.416 | 0.131–0.435 |
| Индекс длина хвоста / длина тела | 1/15–1/35 или 0.067–0.0285 | 0.042–0.126 | |
У самок образуются три яйца, а также феромон, привлекающий самцов (Spieler, Schierenberg, 1995). После копуляции самцы гибнут. Самки дегенерируют через пять дней после оплодотворения. Из-за очень узкой вульвы яйца не выходят наружу и личинки гельминта развиваются под защитой погибших женских особей (Schaake, 1931). Во влажной прокаленной почве первые филяриевидные личинки появляются на 5–6-й день и сохраняются там 24 дня (Ваккер, Тарасовская, 1988). В экспериментах М. Шпилера и Е. Ширенберга (Spieler, Schierenberg, 1995) инвазионные филяриевидные личинки сохранялись до 70 дней. Авторы показали, что личинки нематоды нуждаются в кислороде и гибнут, если их поместить в воду. Этим, видимо, объясняется обычно очень слабая зараженность R. bufonis озерных лягушек, ведущих преимущественно водный образ жизни (Пятова и др., 2016; Зарипова, Файзулин, 2016). Инвазионные личинки R. bufonis, покинув остатки самок, начинают активный поиск хозяина. Во влажном субстрате за одну секунду Л3 преодолевает расстояние в 5–10 раз большее, чем длина тела (Schaake, 1931). Воротами инвазии земноводных являются отверстия крупных кожных желез. Роль транзитных хозяев (олигохеты, моллюски) в заражении амфибий нематодой не велика (Савинов, 1968; Langford, Janovy, 2009). Из кожных желез Л3 переходят в субкутанные лимфатические мешки. Из них, после линьки, Л4 мигрируют по кровеносным и лимфатическим сосудам к легким. В легких нематоды питаются кровью и продуцируют тысячи яиц. M. Шааке (Schaake, 1931) показал, что не все постинвазионные личинки R. bufonis достигают легких R. temporaria. Некоторые из них застревают в сосудах с малым диаметром, в воротных системах печени и почек и выходят в полость тела. Установлено, что R. bufonis накапливается в полости тела Bufo bufo (Goater, 1992). По нашим данным, нематоды аккумулируются и в полости тела R. arvalis. Длина их тела почти такая же, как у самок в легких (2.1–4.8 мм). В отличие от легочной формы, у полостных гельминтов половые органы не образуются. В литературе дискутировался вопрос о способности рабдитовидных личинок R. bufonis, подобно личинкам нематоды Strongyloides stercolaris (Strongyloididae), к аутоинвазии, т. е. заражению легких хозяина, минуя стадию половозрелых самцов и самок (Шульц, Гвоздев, 1970). М. Шпилер и Е. Ширенберг (Spieler, Schierenberg, 1995), модифицируя содержание половозрелых особей и личинок R. bufonis (5 разных сред, четыре уровня температуры – 16, 20, 25 и 30 °C), показали, что ни в одном из более чем тысячи случаев развитие нематоды не отклоняется от строгой смены свободноживущего и паразитического поколений, т. е. от гетерогонии.
Зараженность остромордой лягушки Rhabdias bufonis
В изученных биотопических выборках R. arvalis из биотопов степной зоны Республики Казахстан отношение дисперсии к индексу обилия R. bufonis (s²/M) превышает единицу (табл. 2). Это указывает на перерассеянный характер распределения численности гельминта (Бреев, 1972). Поэтому достоверность отличия проб лягушек по интенсивности инвазии нематодой определяли, сопоставляя при помощи критерия χ² фактическую и теоретическую численность паразита. Например, если в легких 2637 особей R. arvalis из 14 биотопов собрано 13475 экз. R. bufonis, то в легких одной лягушки в среднем должно находиться 13475/2637 = 5.091 экз. нематоды (см. табл. 2). Исходя из этого, при равномерном, случайном размещении нематоды среди 1269 лягушек, отловленных на Усолке, теоретически должно находиться: 1269 · 5.091 = 6460.5 экз. R. bufonis. Это число меньше фактического. Критерий χ² равен ((8287 – 6460,5)2 / 6460.5 = 516.4. Критическое значение χ²крит при одной степени свободы (df = 1) и уровне значимости 0.05 (α = 0.05) равно 3.84. При α = 0.001, df = 1, χ²крит = 10.83. Так как величина критерия χ² больше табличного, то от Н0 необходимо отказаться. Принимается Н1 о том, что у лягушек из Усолки наблюдается значимое отклонение эмпирического числа R. bufonis от ожидаемого при равномерном распределении. В целом в биотопических выборках из степной зоны Казахстана обилие R. bufonis в легких R. arvalis размещено значимо неравномерно. Сумма критериев χ² намного превышает χ²крит, равное 34.5 при α = 0.001 и df = 13 (см. табл. 2). В двух биотопах, Черноярка и оз. Малыбай, значение критерия хи-квадрат меньше критической величины. В этих выборках эмпирическое число нематоды соответствует теоретическому.
Таблица 2. Размещение обилия Rhabdias bufonis и параметры инвазии легких Rana arvalis в биотопах степной зоны Республики Казахстан
| Биотопы | Nj | s²/M | nij | nij* | χ² | Fij | Р ± m1 | M ± m |
| Сарыолен | 31 | 7.5 | 187 | 157.8 | 5.39 | +0.09 | 87.1 ± 6.0 | 6.0 ± 1.2 |
| Усолка | 1269 | 10.6 | 8287 | 6460.5 | 516.4 | +0.27 | 84.6 ± 1.0 | 6.5 ± 0.2 |
| Оз. Борли | 18 | 79.3 | 123 | 91.6 | 10.7 | +0.15 | 72.2 ± 10.6 | 6.8 ± 5.5 |
| Карьер | 345 | 12.3 | 1641 | 1756.4 | 7.58 | -0.04 | 76.2 ± 2.3 | 4.8 ± 0.4 |
| Черноярка | 274 | 9.3 | 1369 | 1394.9 | 0.48 | -0.01 | 65.7 ± 2.9 | 5.0 ± 0.4 |
| Оз. Малыбай | 39 | 29.3 | 175 | 198.5 | 2.79 | -0.06 | 25.6 ± 7.0 | 4.5 ± 1.8 |
| Оз. Сабандыколь | 67 | 4.0 | 58 | 147.6 | 54.4 | -0.44 | 73.1 ± 5.4 | 2.6 ± 0.4 |
| Оз. Кожа | 25 | 3.3 | 175 | 341.1 | 80.9 | -0.33 | 60.0 ± 9.8 | 2.2 ± 1.2 |
| Яблонька | 284 | 7.2 | 940 | 1445.8 | 176.9 | -0.23 | 59.2 ± 2.9 | 3.3 ± 0.3 |
| Спартак | 29 | 15.7 | 56 | 127.3 | 39.9 | -0.39 | 58.6 ± 9.1 | 2.0 ± 0.5 |
| АБС2 | 147 | 5.1 | 289 | 748.4 | 282.0 | -0.46 | 54.4 ± 4.1 | 2.0 ± 0.3 |
| Фёдоровка | 25 | 3.3 | 30 | 127.3 | 74.3 | -0.62 | 52.0 ± 10.0 | 1.2 ± 0.4 |
| Баянаул | 49 | 10.2 | 56 | 249.5 | 150.1 | -0.64 | 36.7 ± 6.9 | 1.1 ± 0.5 |
| Оз. Тлеуберды | 35 | 4.5 | 39 | 178.2 | 108.7 | -0.64 | 28.6 ± 7.6 | 1.1 ± 0.4 |
| Итого: | 2637 | 11.5 | 13425 | 13425.0 | 1510.7 | 73.4 ± 0.9 | 5.1 ± 0.1 | |
| Примечание. Nj – размер j-й выборки хозяина, экз.; s²/M – отношение дисперсии к средней, показатель агрегированности распределения гельминта; Р ± m – экстенсивность инвазии ± ошибка, %; M ± m – индекс обилия ± ошибка, экз.; nij – фактическая численность нематод i-го вида в j-й выборке хозяина, экз.; nij* – теоретическая численность нематод i-го вида в j-й выборке хозяина, экз.; Fij – показатель степени приуроченности i-го вида к j-й выборке хозяина; χ² – критерий Пирсона; 1 – цифровые данные в таблице ранжированы по столбцу экстенсивности инвазии хозяина, 2 – аббревиатура агробиологической станции биолого-химического факультета Павлодарского педагогического института. | ||||||||
При сопоставлении параметров зараженности хозяина R. bufonis, фактической и теоретической численности гельминта, знака и величины Fij исследованные выборки R. arvalis распадаются на три группы (см. табл. 2). Первая включает биотопы Усолка, оз. Борли и Сарыолен, у которых индекс обилия гельминта и экстенсивность инвазии хозяина превышают среднее значение, подсчитанное по всем биотопам. Фактическое обилие гельминта у R. arvalis в 1.2–1.3 раза и достоверно выше теоретического, Fij положителен. Данные биотопы располагаются в разных ландшафтах: Усолка – в пойменно-луговом интразональном ландшафте р. Иртыш, оз. Борли – в правобережной сухой степи, Сарыолен – в Центрально-Казахстанском мелкосопочнике. Во вторую группу входят биотопы Черноярка, Карьер и оз. Малыбай. Для них характерно меньшее, чем среднее по всем биотопам, значение индекса обилия R. bufonis и экстенсивности инвазии R. arvalis, фактическое число нематод в 1.0–1.1 раза меньше теоретического, значение Fij приближается к нулю. В биотопах Черноярка и оз. Малыбай величина подсчитанной численности, как было отмечено, статистически не отличается от эмпирической. На Карьере ожидаемое количество R. bufonis значимо выше фактического и соответствует Н1 о неравномерном, не случайном распределении гельминта. Из данных табл. 2 видно, что во второй группе биотопов выборка оз. Малыбай резко отличается низким значением экстенсивности инвазии. Это отличие, видимо, связано с тем, что данная проба лягушек взята 29 июня. Как будет показано далее, во всех биотопах с многолетними сборами в этот период лета наблюдается наименьшая величина зараженности R. arvalis нематодой. Биотопы второй группы размещаются в трех разных ландшафтах: в пойме р. Иртыш (Черноярка), антропогенном ландшафте (Карьер) и правобережной сухой степи (оз. Малыбай). В третьем комплексе выборок остромордой лягушки индекс обилия нематоды и экстенсивность инвазии хозяина заметно меньше, чем среднее по всем биотопам. Фактическое обилие R. bufonis в пробах из Федоровки, Баянаула и Тлеуберды в 4.2–4.6 раза меньше теоретического, а в остальных – в 1.5–2.6 раза. В биотопах третьей группы величина Fij значительно меньше нуля и имеет знак «минус». Два биотопа, Яблонька и АБС, представляют антропогенный ландшафт, оз. Кожа и оз. Тлеуберды – правобережную сухую степь, оз. Сабандыколь и Кафар – Центрально-Казахстанский мелкосопочник, Федоровка – колочную лесостепь, Спартак – левобережную пойму р. Иртыш. В многих работах показана связь степени увлажнения биотопов и зараженности хозяев R. bufonis (Марков, Рогоза, 1953а; Гинецинская, Голубева, 1990; Буракова, 2010). Оптимальные условия для развития рабдитовидных личинок в фекалиях, выделяемых амфибиями, формирования поколения свободноживущих самцов и самок, передвижения инвазионных личинок R. bufonis, согласно M. Шааке (Schaake, 1931), находятся в местах с увлажненным, богатым кислородом субстратом. На участках со сплошной пленкой воды личинки погибают из-за недостатка кислорода. Свободноживущие самцы и самки отрицательно реагируют на повышенную температуру (Spieler, Schierenberg, 1995). Наибольшая доля выживающих самок R. bufonis на стандартном агаре наблюдается при температуре 16–20 °С. По нашим наблюдениям, в учетных точках первой группы большая часть мест обитания и кормовых участков лягушек расположены на широких прибрежных увлажненных зонах. На Усолке и оз. Борли влажность субстрата в этих зонах обеспечивается изливающимися здесь родниками. Проба лягушек из пункта Сарыолен отличается от двух других тем, что взята среди ила почти высохшего водоема в русле одноименной степной речки. Подобные водные потоки в Центрально-Казахстанском мелкосопочнике к концу лета обычно пересыхают и представляют собой цепочку отдельных плесов (Гвоздецкий, Михайлов, 1963). Плес в пункте Сарыолен, очевидно, стал своеобразной ловушкой и местом выживания лягушек среди песчаных русловых отложений. Интересно, что в данном пункте установлена самая высокая экстенсивность инвазии R. arvalis нематодой. Очевидно, во влажных иловых отложениях существуют оптимальные условия для развития и существования поколения свободноживущих R. bufonis. Во второй группе местообитаний зоны с увлажненной прибрежной почвой менее обширны. Третья группы биотопов характеризуется относительно небольшой протяженностью и шириной увлажненных участков, совпадающих с кормовыми территориями и укрытиями R. arvalis. В трех антропогенных биотопах средняя экстенсивность инвазии хозяина нематодой довольно высока и равна 65.9 ± 1.7 %, нематода является здесь доминантным видом в сообществе гельминтов (D = 17.7). Очевидно, что зараженность остромордой лягушки R. bufonis мало зависит от антропогенного воздействия. А. В. Буракова (2010) также полагает, что гельминт обладает высокой устойчивостью к антропогенному загрязнению. Тип ландшафта в незначительной степени влияет на степень заражения остромордой лягушки нематодой. Например, проба из оз. Борли (правобережная степь) характеризуется высокими значениями показателей инвазии хозяина нематодой (см. табл. 2). В этом же ландшафте находится проба лягушек из побережья оз. Тлеуберды, в которой установлена наименьшая величина параметров заражения. Известно, что при распространении в нескольких ландшафтах виды гельминтов успешно заселяют такие биотопы или такие стации в них, где условия среды сходны с теми, в которых данные виды сформировались в ходе эволюции (Догель, 1947; Кеннеди, 1978; Пианка, 1981). Например, важную роль в становлении «кружева» ареала стронгилид играют температура и влажность, при которых успешно идет развитие яиц и личинок (Скрябин и др., 1954). В работе С. Н. Боева с соавторами (1962) показано, что отсутствие диктиокаул у овец в зоне северных пустынь Казахстана связано с чрезвычайной сухостью воздуха и почвы, которая препятствует развитию личинок гельминтов. Точно так же распространение R. bufonis в биотопах степной зоны Казахстана привязано к стациям с увлажненным, богатым кислородом субстратом, где могут успешно развиваться все члены свободноживущего поколения гельминта – рабдитовидные личинки, самцы, самки и филяриевидные личинки.
Сезонная динамика параметров инвазии Rana arvalis нематодой Rhabdias bufonis
Остромордая лягушка активна с середины апреля до первой половины сентября (Искакова, 1959; наши наблюдения). Самая ранняя проба из пяти лягушек (3 ♂ и 2 ♂) взята нами 07.04.1985 г. Очевидно, данные особи, передвигавшиеся по льду Усолки, только что вышли из зимней спячки. У них найдены неподвижные, сильно уплощенные, почти прозрачные гельминты: нематода Oswaldocruzia filiformis и трематоды Haplometra cylindracea, Opisthioglyphe ranae и Pleurogenes intermedius. В легких 3 лягушек обнаружены 13 экз. R. bufonis, а в полости тела – 10 нитевидных нематод (Л4) данного вида. При комнатной температуре в физиологическом растворе гельминты в течение 3 часов приобретали свою обычную форму и подвижность. Показано (Wharton, 1999), что у лесной лягушки R. sylvatica при -6 °C, из-за осмотической дегидратации органов, 65 % воды переходит в лед без образования кристалликов, разрушающих клеточные оболочки. Такое мягкое обезвоживание испытывают и паразиты, в частности легочная нематода R. ranae. Гельминты в эксперименте выдерживают понижение температуры окружающей среды до -21 °C. Состояние червей, найденных нами у R. arvalis, указывает на то, что, по-видимому, и при резко континентальном климате района исследования осмотическая дегидратация обеспечивает выживание остромордой лягушки и ее гельминтов в течение длительной зимы.
Установлено (Дубинина, 1950), что озерные лягушки в дельте р. Волга заражены R. bufonis осенью в 1.6 раза больше, чем весной. По данным М. К. Резванцевой (2009), озерная лягушка под г. Тамбовом заражается рабдиасом только весной, осенью хозяин свободен от гельминта. Г. С. Марков и М. Д. Рогоза (1953а) пишут, что экстенсивность и интенсивность заражения травяной лягушки держатся на высоком уровне в течение всего сезона. Однако параметры инвазии более внушительны летом, когда хозяин ведет преимущественно наземный образ жизни. Показатели заражения R. bufonis сибирской лягушки в окрестностях г. Якутска держатся в течение июня – августа приблизительно на одном уровне, а в сентябре резко уменьшаются (Однокурцев, Седалищев, 2008).
Таблица 3. Сезонная динамика зараженности легких и полости тела Rana arvalis нематодой Rhabdias bufonis в степной зоне Казахстана
| S | Nj | nij | nij* | χ² | Fij | P ± m | M ± m |
| Легкие | |||||||
| V | 375 | 2906 | 2025.5 | 382.7 | +0.22 | 84.8 ± 1.9 | 7.7 ± 0.5 |
| VI | 510 | 2715 | 2754.7 | 0.57 | -0.01 | 71.8 ± 2.0 | 5.3 ± 0.3 |
| VII | 473 | 1581 | 2554.9 | 371.2 | -0.28 | 61.9 ± 2.2 | 3.3 ± 0.3 |
| VIII | 508 | 1950 | 2743.9 | 229.7 | -0.21 | 77.2 ± 1.9 | 3.8 ± 0.2 |
| IX | 453 | 3374 | 2446.9 | 351.3 | +0.21 | 87.2 ± 1.6 | 7.4 ± 0.4 |
| Итого: | 2319 | 12526 | 12526 | 1335.5 | 76.1 ± 0.9 | 5.4 ± 0.2 | |
| Полость тела | |||||||
| V | 375 | 4160 | 1778.3 | 3189.8 | +0.52 | 74.4 ± 2.3 | 11.3 ± 0.8 |
| VI | 510 | 1350 | 2418.5 | 472.1 | -0.34 | 35.1 ± 2.1 | 2.7 ± 0.3 |
| VII | 473 | 625 | 2243.0 | 1167.2 | -0.62 | 20.1 ± 1.8 | 1.5 ± 0.2 |
| VIII | 508 | 1977 | 2409.0 | 77.5 | -0.12 | 50.2 ± 2.2 | 4.1 ± 0.4 |
| IX | 453 | 2885 | 2148.2 | 252.7 | +0.19 | 68.2 ± 2.2 | 6.4 ± 0.5 |
| Итого: | 2319 | 10997 | 10997 | 5159.3 | 48.2 ± 1.0 | 5.0 ± 0.2 | |
| Примечание. S – периоды сезона: V – май, VI – июнь, VII – июль, VIII – август, IX – сентябрь; Nj – объем j-й выборки хозяина, экз.; nij – эмпирическое число гельминтов i-го вида в j-й выборке хозяина, экз.; nij* – теоретическое число гельминтов i-го вида в j-й выборке хозяина, экз.; χ² – критерий согласия; Fij – показатель степени приуроченности обилия i-го вида гельминтов к j-й выборке хозяина; P ± m – экстенсивность инвазии ± ошибка, %; M ± m – индекс обилия ± ошибка, экз. | |||||||
Согласно нашим совокупным данным из пунктов с сериальными сборами, обилие R. bufonis в легких и полости тела R. arvalis размещено относительно периодов сезона значимо неравномерно (см. табл. 3). Подсчитанная для легких и, соответственно, полости тела сумма критериев χ² за пять месяцев значимо больше критической, равной 18.47 при α = 0.001 и df = 4. Наименьшее число рабдиасов отмечено в июле, наибольшее – в мае и сентябре. Фактическая численность нематод в легких хозяина в мае по сравнению с июлем больше в 1.8 раза, а в сентябре – в 2.1 раза. В полости тела количество Л4 в мае выше, чем в июле, в 6.7 раз. Сентябрьское число полостных нематод в 4.6 раза, превышает июльское. Самые высокие значения экстенсивности инвазии лягушек легочной и полостной формой гельминта отмечены в мае и сентябре, а самые низкие – в июле (см. табл. 3). Отличие экстенсивности инвазии легких R. arvalis в мае – июле и июле – сентябре достоверно. Величина критерия tφ = 7.66 и 9.11, α > 0.001. Значение критерия tφ при сравнении величины параметра полостной формы гельминта за май – июль равно 16.6, за июль – сентябрь – 15.4. Интересно, что M. Бейкер (Baker, 1979) тоже регистрирует самую низкую степень заражения нематодой R. ranae легких лесной лягушки R. sylvatica летом, а наиболее высокую – весной и ранней осенью.
Значения индекса обилия R. bufonis и экстенсивности инвазии легких и полости тела R. arvalis в течение сезона подвержены колебаниям. Так, в пойменном биотопе (Усолка) в течение 1985–1988 гг. в легких хозяина сменилось шесть волн численности нематод и восемь небольших флуктуаций зараженности этого органа (рис. 1). Положение смежных минимальных значений параметров инвазии позволяет определить длительность волн численности R. bufonis и зараженности R. arvalis. Одна из самых коротких флуктуаций в пойме р. Иртыш (Усолка) протяженностью в 3 месяца находится между минимумами индекса обилия в июне и августе 1988 г. (см. рис. 1). Самая длительная, в 13 месяцев, флуктуация числа гельминта в легких хозяина расположена между июлем 1985 г. и августом 1986 г. В надпойменном биотопе Карьер минимальные значения индекса обилия R. bufonis и экстенсивности инвазии R. arvalis, расположенные в августе 1987 г. и июле 1988 г., указывают на протяженность волн численности нематоды и зараженности хозяина, равную 11 месяцам (см. рис. 1). Разница между майским и июльским, июльским и сентябрьским значениями экстенсивности инвазии легких лягушек значима лишь в 1985 г. (см. рис. 1). Критерий tφ равен соответственно 3.66 и 3.92, α > 0.01. На Карьере отличия между максимумом показателя в сентябре 1986 г. и минимумом в июне 1987 г., между последним и новым пиком в августе 1987 г. достоверны. Значения критерия tφ равны 4.39 и соответственно 2.55. Сезонная динамика численности полостных R. bufonis существенно отличается от таковой легочных (рис 3). В Усольской популяции R. arvalis на это указывает максимальное значение критерия Колмогорова – Смирнова, равное 2.32 (α > 0.001). На Карьере, в сезонных пробах за 1986/1988 г., наибольшая величина критерия λ равна 1.99 (α > 0.001). Отличия между минимальными и максимальными значениями параметров инвазии R. bufonis полости тела хозяев, в отличие от легких, характеризуются меньшим размахом (рис. 2). В каждом сезоне отличия между максимальными значениями экстенсивности инвазии полости тела лягушек нематодой в мае и минимальными в июле, в июле и сентябре значимы. Величина критерия tφ в популяции хозяина из Усолки колеблется между 2.12–5.89, из Карьера между 5.52– 7.55. В пойменном и надпойменном биотопах наименьшие значения обеих параметров заражения полости тела хозяина, за одним исключением, наблюдаются в середине лета, в июле. Длина волн численности и заражения, т. е. «расстояние» между минимальными значениями показателей инвазии полости тела хозяина гельминтом, стабильно равны 12 месяцам. Лишь в 1988 г. флуктуация оказалась равной 13 месяцам. Из рис. 2 видно, что сезонная динамика показателей инвазии полости тела и легких имеет разную степень синхронности. Так, на Усолке за 1985–1988 гг. коэффициент корреляции между величинами индекса обилия нематоды (х) и долей R. arvalis с зараженными легкими (у), подсчитанный с поправкой на малочисленность числа пар значений, равен +0.56 ± 0.19. На Карьере (1986–1988 г.) – rxy = +0.44 ± 0.27. Достоверность коэффициентов корреляции, оцененная с помощью z-функции Фишера, равна соответственно tz = 2.64 (α > 0.05) и tz = 1.50 (α < 0.05). По общей системе классификации приведенные выше корреляции относятся к связям со средней силой (Ивантер, Коросов, 1992). Корреляции между двумя параметрами заражения, подсчитанные для полости тела, в пойменной и надпойменной популяциях лягушек относятся к сильным, значимым и равны соответственно rxy = +0.82 ± 0.14 (tz = 4.75, α > 0.001) и rxy = +0.72 ± 0.22 (tz = 2.72, α > 0.01).
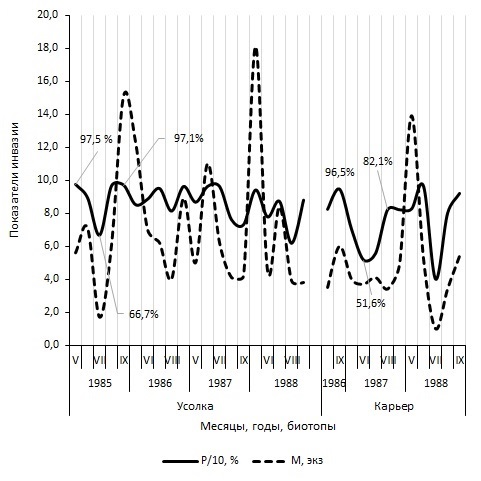
Рис. 1. Динамика инвазии легких Rana arvalis нематодой Rhabdias bufonis
Fig. 1. Dynamics of lung infestation of Rana arvalis by the nematode Rhabdias bufonis
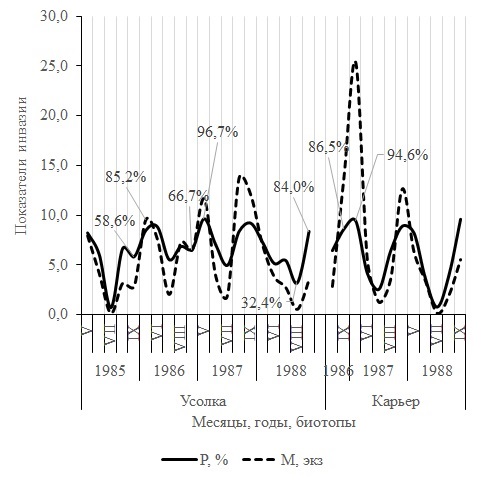
Рис. 2. Динамика проникновения в полость тела Rana arvalis нематоды Rhabdias bufonis
Fig. 2. Dynamics of invasion of the body cavity of Rana arvalis by the nematode Rhabdias bufonis
Значения экстенсивности заражения R. bufonis полости тела лягушек из Усолки в мае 1986 и 1987 гг. достоверно выше, чем в сентябре 1985 и 1986 гг. (см. рис. 2). Отличия значимы (tφ = 2.65 и 3.16, α ≥ 0.01). На Карьере в мае 1987 г. наблюдается рост значений показателя по сравнению с сентябрем 1986 г. Однако отличия между параметрами не достоверны (tφ = 1.22). Из табл. 3, включающей обобщенные данные, видно, что полость тела R. arvalis заражена R. bufonis весной (май) выше, чем осенью (сентябрь). Критерий tφ равен 1.97 (α > 0.05, df = 826). Эмпирическое число рабдиасов в мае больше, чем в сентябре, в 1.4 раза, а индекс обилия почти в 1.8 раза (см. табл. 3). Увеличенное число нематод и повышенная зараженность хозяина в мае по сравнению с сентябрем указывает на то, что гельминт осуществляет цикл развития. Экспериментально показано, что жизненный цикл нематоды от личинок в фекалиях до самок в легких B. bufo реализуется всего за 12 дней (Goater, 1992). По нашему мнению, в мае из яиц, отложенных гермафродитными самками, перезимовавшими в легких лягушек, образуется и выделяется в среду новое поколение рабдитовидных личинок. Из них формируется весенняя генерация свободно живущих самцов и самок нематоды и образуются инвазионные личинки. При заражении хозяина некоторая часть нового поколения Л4 аккумулируется в полости тела. Этим объясняется весенний рост параметров инвазии R. arvalis полостной формой рабдиаса.
Фактическая численность нематоды в легких, в отличие от полости тела, весной ниже в 1.2 раза, чем осенью (см. табл. 3). Значение экстенсивности инвазии легких хозяина весной также ниже, чем осенью. М. Шааке (Schaake, 1931) в своей монографии сообщает о сильном снижении числа R. bufonis у травяных лягушек после зимних месяцев. После зимовки гибель R. bufonis у озерных лягушек отмечает М. Н. Дубинина (1950). Векторы весенней инвазии остромордой лягушки легочными и полостными нематодами противоположны, как мы считаем потому, что весной в легких амфибий идет смена поколений R. bufonis. Пережившие зиму нематоды, отложив яйца, заканчивают существование. Их постепенно заменяет новое поколение паразитических самок, заселяющих легкие по мере реализации весеннего цикла развития гельминта. Существование в легких основной массы нового поколения гермафродитных самок заканчивается, видимо, в середине лета. На это указывает, как было показано, июльское снижение в каждом сезоне экстенсивности инвазии полости тела лягушек и численности полостных рабдиасов (см. рис. 2). Фактическая численность гельминта в полости тела в этот период сезона достоверно и значимо меньше теоретической в 3.6 раза. И в легких эмпирическое число самок снижаетс, по сравнению с ожидаемой в 1.6 раза (см. табл. 3). Знак при показателе приуроченности обилия Fij в июле отрицателен. Значение экстенсивности инвазии легких и полости тела R. arvalis в мае и июле существенно отличается. Критерии Стьюдента равны соответственно tφ = 7.66 и 16.6 (df = 846, α > 0.001). Однако следует подчеркнуть, что в июле еще остается больше половины хозяев с зараженными нематодой легкими (см. табл. 3). У пятой части амфибий в полости тела содержатся нематоды изучаемого вида. Следовательно, полного освобождения хозяина от гельминта в середине лета не происходит. Согласно экспериментальным данным М. Шааке (Schaake, 1931), R. bufonis обитает в полости тела R. temporaria 2–3 недели после заражения. В опытах по заражению Bufo bufo показано, что R. bufonis в легких выживают 3 месяца, вне легких – до 6 недель (Goater, 1992). Выборки R. arvalis из поймы р. Иртыш взяты с 5–29 мая по 1–27 июля, в антропогенных биотопах с 16–29 мая по 7–13 июля. Учитывая эти сроки, мы считаем, что в полевых условиях степной зоны основная доля весеннего поколения R. bufonis в легких и полости тела R. arvalis находится приблизительно с середины мая до середины июля, т. е. около 2.5–3 месяцев, или 10–12 недель. Некоторая часть нематод весеннего поколения продолжает паразитировать и после середины лета.
Вслед за июльским снижением значений зараженности легких и полости тела лягушек в сентябре наблюдается новое значительное нарастание экстенсивности инвазии лягушек нематодой (см. табл. 3). В сентябре доля лягушек с зараженными легкими достоверно выше, чем в июле (tφ = 9.11, df = 924, α > 0.001), так же как и доля хозяев с инвазированной полостью тела (tφ = 15.4, α > 0.001). В сентябре фактическая численность нематоды в легких и полости тела хозяев увеличивается по сравнению с теоретической в 1.4 и 1.3 раза соответственно (см. табл. 3). На рис. 2, отражающем динамику изменения параметров инвазии лягушек полостной формой нематоды в Усольской популяции лягушек, на отрезке июль – август в 1985 и 1986 гг. видны зубцеобразные изгибы кривых. Эти повторяющиеся в течение двух сезонов всплески величины обеих показателей инвазии не могут быть случайными. Мы полагаем, что эти ритмичные импульсы зараженности хозяина указывают на начало реализации паразитом еще одного цикла развития. По многолетним сводкам Павлодарской метеостанции, в районе исследования самая высокая среднемесячная температура характерна для июля. Так, в Павлодаре среднемесячная температура в июле 1985–1988 гг. колебалась между 20.4 и 23.5 °С. В этот период сезона уровень воды в водотоках и водоемах понижается. Например, уровень воды в Усолке настолько падает, что по обеим берегам открываются довольно обширные полосы донных отложений. Освобождающиеся от воды участки дна протоки, так же как и части побережий в других водоемах и водотоках, представляют собой процесс появления новых мест для развития свободноживущих стадий R. bufonis и контакта филяриевидных Л3 с амфибиями.
В 1988 г. на Усолке минимум экстенсивности инвазии хозяина полостной и легочной формами рабдиаса отмечен 9 августа (см. рис. 2). А 5 сентября, когда была взята последняя в этом году проба, отмечено повышение величины показателя в полости тела в 2.6 раза (tφ = 4.01, df = 53, α > 0.01). Заражение легких остромордой лягушки на отрезке август – сентябрь также достоверно повысилось в 1.5 раза (tφ = 2.52, α > 0.05). Достоверный рост показателя инвазии свидетельствует о том, что осенний цикл развития нематоды в 1988 г. длился один месяц. Вполне возможно, что такому ускоренному темпу способствовала теплая осень. Средние температуры августа и сентября в 1988 г. были равны соответственно +19.3 и +13.7 °C. Как следует из рис. 2, в сезоне 1988 г. между июнем и июлем наблюдается недостоверный подъем экстенсивности инвазии с 51.9 ± 3.9 до 54.8 ± 2.8 %, который сменяется спадом до 32.4 ± 0.6 % в августе. Разница между показателями в июле – августе недостоверна (tφ = 1.84, df = 63, α < 0.05). Тем не менее мы считаем, что этот всплеск величины показателя свидетельствует в пользу сдвига в 1988 г. цикла развития R. bufonis на июль. Вполне возможно, что это смещение произошло в связи с очень сухим июнем, в течение которого выпало всего 3 мм осадков.
Зараженность нематодой Rhabdias bufonis половозрастных групп Rana arvalis
Благодаря своей структурированности популяция R. arvalis является для паразитических организмов очень неоднородным местообитанием. Зараженность R. bufonis возрастных и половых групп изучена главным образом на примере P. ridibundus, R. temporaria или R. sylvatica. M. Шааке (Schaake, 1931) показал, что совсем молодые травяные лягушки свободны от R. bufonis, а у других возрастных групп различий в зараженности им не установлено. М. Н. Дубинина (1950) указывает, что весной в дельте Волги наибольшая частота встречаемости зараженных нематодой озерных лягушек характерна для 2-го и 3-го года жизни, а осенью – для сеголеток и годовиков. Г. С. Марков и М. Л. Рогоза (1953б) сообщают, что в Ленинградской области чаще заражены двухлетние травяные лягушки, а у трехлетних выше численность R. bufonis. У старших возрастов хозяина параметры инвазии остаются на достигнутом уровне. Интенсивность инвазии четырехлетних травяных лягушек в Карелии выше, чем у молодых (Кудинова и др., 1985). У монгольской жабы (Bufo raddei) в Забайкалье наибольшая зараженность установлена у годовиков (Щепина, Балданова, 2010).
Таблица 4. Динамика зараженности возрастных и половых групп остромордой лягушки нематодой Rhabdias bufonis
| Группы хозяина (длина тела, мм) | Nj | nij | nij* | χ² | Fij | H | P ± m | M ± m |
| Легкие | ||||||||
| 1-я (≤ 20.0) | 240 | 105 | 1221.8 | 1020.9 | -0.85 | 42.3 | 18.3 ± 2.5 | 0.4 ± 0.1 |
| 2-я (20.1–25.0) | 433 | 1428 | 2204.4 | 273.5 | -0.25 | 36.0 | 64.4 ± 2.3 | 3.3 ± 02 |
| 3-я (25.1–30.0) | 655 | 2932 | 3334.6 | 48.6 | -0.08 | 42.1 | 79.7 ± 1.6 | 4.5 ± 0.3 |
| 4-я (30.1–36.0) | 697 | 3515 | 3548.4 | 0.32 | -0.01 | 56.3 | 79.9 ± 1.5 | 5.1 ± 0.2 |
| 5-я (36.1–44.0) | 424 | 3558 | 2158.6 | 907.2 | +0.31 | 71.9 | 88.4 ± 1.6 | 8.4 ± 0.5 |
| 6-я (> 44.0) | 188 | 1887 | 957.1 | 903.4 | +0.36 | 87.7 | 84.6 ± 2.6 | 10.0 ± 1.0 |
| Полость тела | ||||||||
| 1-я (≤ 20.0) | 240 | 143 | 1009.1 | 743.4 | -0.77 | 5.0 ± 1.4 | 0.6 ± 0.4 | |
| 2-я (20.1–25.0) | 433 | 2534 | 1820.7 | 279.5 | +0.20 | 48.3 ± 2.4 | 7.0 ± 0.6 | |
| 3-я (25.1–30.0) | 655 | 4027 | 2754.1 | 588.3 | +0.27 | 58.9 ± 1.9 | 6.5 ± 0.5 | |
| 4-я (30.1–36.0) | 697 | 2728 | 2930.7 | 14.0 | -0.05 | 46.3 ± 1.9 | 4.1 ± 0.3 | |
| 5-я (36.1–44.0) | 424 | 1392 | 1782.8 | 85.7 | -0.14 | 37.5 ± 2.4 | 3.5 ± 0.4 | |
| 6-я (> 44.0) | 188 | 264 | 790.5 | 350.7 | -0.52 | 26.1 ± 3.2 | 1.6 ± 0.4 | |
| Легкие | ||||||||
| ♂ (31.4 ± 8.1) | 1255 | 6359 | 6389.2 | 0.14 | -0.01 | 55.1 | 72.2 ± 1.3 | 5.1 ± 0.2 |
| ♀ (31.1 ± 8.2) | 1382 | 7066 | 7035.8 | 0.13 | +0.01 | 54.4 | 74.5 ± 1.2 | 5.1 ± 0.2 |
| Полость тела | ||||||||
| ♂ | 1255 | 5172 | 5277 | 2.09 | -0.02 | 43.3 ± 1.4 | 4.5 ± 0.2 | |
| ♀ | 1382 | 5916 | 5811 | 1.90 | +0.02 | 43.0 ± 1.3 | 4.6 ± 0.3 | |
| Примечание. Nj – объем j-й выборки хозяина, экз.; nij – эмпирическое число гельминтов i-го вида в j-й выборке хозяина, экз.; nij* – теоретическое число гельминтов i-го вида в j-й выборке хозяина, экз.; χ² – критерий согласия; Fij – показатель степени приуроченности обилия i-го вида к j-й выборке хозяина; H – мера успешной миграции гельминтов i-го вида в легкие хозяина, хоминг, %; P ± m – экстенсивность инвазии ± ошибка, %; M ± m – индекс обилия ± ошибка, экз. | ||||||||
В соответствии с полученными нами данными, в наименьшей степени легкие и полость тела заражены у сеголеток R. arvalis (см. табл. 4). Экстенсивность инвазии легких ювенильных лягушат достоверно ниже, чем у годовиков (2-я размерная группа) (tφ = 12.2, α > 0.001). Количество R. bufonis в легких сеголеток в 13.5 раз меньше, чем у 2-й группы. Экстенсивность инвазии полости тела первой группы R. arvalis значимо меньше (tφ = 13.5, α > 0.001), чем у второй. Количество нематод в полости тела ювенильных лягушат в 17.7 раз меньше, чем у годовиков. Согласно К. И. Искаковой (1959) и нашим наблюдениям, массовый метаморфоз и появление первых сеголеток начинаются в середине июня. Следовательно, ювенильные R. arvalis заражаются инвазионными личинками только одного, осеннего, поколения R. bufonis. В то время как годовики в ходе сезона испытывают заражение двумя генерациями Л3 нематоды. Наибольшие значения параметров инвазии легких отмечены у лягушек 5-й и 6-й групп. Число гельминтов, фактически найденных в данных группах, в 1.6–2.0 раза больше ожидаемого согласно Н0. Положительное значение Fij свидетельствует о смещении обилия легочной формы нематоды к двум самым старшим возрастным группам R. arvalis (см. табл. 4). Наиболее высокие значения параметров зараженности полости тела установлены у 2-й и 3-й возрастных групп остромордой лягушки, а наиболее низкие – у 5-й и 6-й. Так, разница между величиной экстенсивности заражения полости тела лягушек 3-й и 5-й групп существенна. Критерий tφ равен 6.92 (α > 0.001). Показатели у 3-й и 6-й групп значимо различны: tφ = 8.19 (α > 0.001). Эмпирическая численность нематоды в легких 4-й группы R. arvalis соответствует ожидаемой по Н0. Величина критерия χ² меньше стандартной при α = 0.05. Индекс обилия нематоды в легких при увеличении возраста R. arvalis (средняя длина тела группы) нарастает линейно (y = 1е8257x – 1.1067, R2 = 0.9659), а в полости тела изменяется согласно уравнению полинома третьей степени (y = 0.362x3 – 4.549x2 + 16.488x – 11.433, R2 = 0.9248). Значение экстенсивности заражения нематодой R. bufonis в легких и полости тела при увеличении возраста лягушек изменяется в соответствии с уравнениями полинома второй степени (y = –4.9411x2 + 46.122x – 17.27, R2 = 0.9406 и y = –6.269x2 + 45.616x – 27.55, R2 = 0.8274).
О роли представителей разных полов амфибий в заражении гельминтами существует различное мнение. Так, M. Шааке (Schaake, 1931) утверждает, что пол хозяина не влияет на уровень заражения травяной лягушки нематодой R. bufonis. Этого же мнения придерживаются М. А. Кудинова с соавторами (1985), которые отмечают отсутствие половых различий в зараженности травяных лягушек из Карелии. E. Лиис и Л. Басс (Lees, Bass, 1960) обратили внимание на роль половых гормонов в регуляции уровня заражения и установили более высокую степень инвазии у самцов травяных лягушек. По данным M. Шпилера (Spieler, 1990), в легких самок обыкновенной жабы в среднем находится 3.4, а у самцов – 12.0 R. bufonis на хозяина. Самцы R. amurensis из Якутии заражены R. bufonis на 2.2 % больше, чем самки (Однокурцев, Седалищев, 2008). О. Даре, М. Форбс (Dare, Forbes, 2009) показали, что самцы R. sylvatica в эксперименте заражаются R. ranae больше, чем самки. K. Пласота (Plasota, 1969), напротив, установил более высокую зараженность самок Rana esculenta гельминтами.
В изученных нами биотопах с многолетними сборами только в Черноярке у самок R. arvalis экстенсивность инвазии легких достоверно больше, чем у самцов (tφ = 2.30, α > 0.05, df = 272). В остальных пунктах межполовые различия по частоте встречаемости амфибий с зараженными легкими статистически недостоверны. В половых группах лягушек из Карьера обилие R. bufonis в легких распределено неравномерно и достоверно смещено к представителям женского пола (Fij = +0.13). В остальных четырех биотопах фактическое и теоретическое обилие легочной формы нематоды у представителей разных полов статистически не различаются. Согласно обобщенным данным, межполовые отличия в зараженности R. arvalis нематодой R. bufonis также не достоверны (см. табл. 4). Обилие гельминта относительно половых групп хозяина распределено в течение сезона равномерно. Однако в мае легкие самцов амфибии заражены (80.3 ± 2.9 %) существенно меньше (tφ = 1.99, α > 0.05, df = 421), чем в сентябре (87.4 ± 2.2 %). У самок в этот период, наоборот, отмечается недостоверный рост показателя с 87.0 ± 2.3 до 89.6 ± 2.3 %. Не исключено, что данные особенности связаны с межполовыми этологическими различиями R. arvalis. В конце апреля – начале мая идет активная миграция половозрелых R. arvalis к нерестилищам (Искакова, 1959; наши наблюдения). Как известно (Банников с соавт., 1977; Кузьмин, 2012), самцы остромордой лягушки приходят к нерестилищам раньше самок и находятся в водоеме почти месяц. Поскольку инвазионные личинки R. bufonis в воде гибнут, то вероятность заражения самцов R. arvalis весенней генерацией инвазионных личинок нематоды не высока. Самки, в отличие от самцов, сразу после откладки икры покидают нерестилище и далее ведут наземный образ жизни. Этим, видимо, объясняются повышенная весенняя зараженность самок амфибий и достоверно пониженная самцов. На побережьях нерестилищ в этот период сезона присутствуют зоны влажного субстрата, где может реализоваться весенний цикл развития R. bufonis. Не исключено, что последний полностью приурочен лишь к побережьям нерестовых водоемов.
Данные табл. 4 позволяют определить уровень хоминга (Homing), или долю постинвазионных личинок R. bufonis, достигших легкие хозяина. Например, в легких и полости тела у R. arvalis первой размерно-возрастной группы собрано 105 + 143 = 248 экз. R. bufonis (см. табл. 4). Хоминг рабдиасов в данной группе хозяина равен: H = 105 · 100 / 248 = 42.3 %. Конечно, при подсчете не учитывается доля нематод, погибающих на пути к легким хозяина. Тем не менее таким путем, как нам кажется, открывается возможность в первом приближении оценить долю R. bufonis, успешно достигших легкие R. arvalis. Три младшие возрастные группы остромордой лягушки имеют приблизительно равный уровень хоминга, чуть меньше половины личинок рабдиаса достигают место окончательной локализации (см. табл. 4). Самая большая квота успешной миграции R. bufonis в легкие характерна для R. arvalis 5-й и 6-й групп. В полости тела лягушек самой старшей возрастной группы находится в пять раз меньше рабдиасов, чем, например, у 2-й. Отличия разных линейно-возрастных групп R. arvalis по успешности миграции R. bufonis от ворот проникновения к легким связаны с тем, что хоминг осуществляется по сосудам кровеносной и лимфатической систем. Чем меньше размеры хозяина, тем меньше диаметр магистральных сосудов кровеносной и лимфатической систем, сосудов воротных систем печени и почек, тем больше вероятность задержки мигрирующих личинок в небольших сосудах и переход их в полость тела хозяина. Этим объясняется пониженный процент хоминга у младших возрастных групп остромордой лягушки. У старших возрастных групп хозяина мигрирующие нематоды меньше «застревают» в сосудах, реже переходят в полость тела и успешнее заражают легкие хозяина.
Многолетние колебания численности Rhabdias bufonis и зараженности остромордой лягушки нематодой
Теория и практика гельминтологии требуют длительного наблюдения процессов, протекающих в паразитарных системах (Догель, 1947; Корытин, 2012; Kennedy, 1997). В ходе 14-летнего мониторинга выявлено, что численность R. bufonis в легких R. arvalis распределяется значимо неравномерно (табл. 5). Сумма χ² превышает критическое значение, равное 34.5 (df = 13, α = 0.01). В распределении нематод в полости тела сумма χ² также выше критической величины (χ²крит = 32.9, α = 0.01, df = 12). Следует отметить, что в 1987, 1988 и 1992 гг. фактическое и теоретическое число гельминтов в легких амфибии статистически не отличаются. Недостоверное отличие между эмпирическим и ожидаемым числом полостных Л4 отмечено в 1989 и 1995 гг. Распределение численности нематоды в легких и полости тела хозяина в названные годы соответствует Н0.
В полости тела R. arvalis в течение мониторинга четко выделяются четыре волны численности R. bufonis и заражения лягушек (рис. 3). Первая в 1985–1988, вторая в 1988–1991, третья в 1991–1994 и четвертая в 1994–1997 гг. (см. табл. 5, рис. 3). В первой флуктуации в 1986 г. повышение экстенсивности инвазии хозяина, в сравнении с минимумом в 1985 г., достоверно (tφ = 2.87, df = 334, α > 0.01). Спад значений экстенсивности инвазии между 1987 и 1988 гг. тоже значим (tφ = 4.15, df = 254, α > 0.001). Всплеск размеров показателя в 1989 г., в сравнении с 1988 г., недостоверен (tφ = 1.14, df = 169, α < 0.05). Причина, по нашему мнению, заключается в том, что каждые пять лет (1989 и 1994 гг.) с целью релаксации популяции хозяина мы делали по одной выборке в сезон (см. табл. 5). Малый объем выборок, по-видимому, является причиной недостоверности различий между экстенсивностью инвазии хозяев в 1988 и 1989 гг. Соотнесение значений экстенсивности инвазии в 1993 г. с таковым в 1995 г. (tφ = 2.06, df = 147, α > 0.05) и последнего с 1997 г. (tφ = 3.96, df = 115, α > 0.001) позволяет сделать заключение о достоверности последней волны численности полостных R. bufonis в популяции R. arvalis в пойме р. Иртыш. В отличие от легких, показатели зараженности полости тела хозяина изменяются синхронно (см. рис. 3). Так, корреляционная зависимость между изменениями экстенсивности инвазии лягушек и индекса обилия нематоды в полости тела в течение 13 лет наблюдений значима (rxy = +0.84 ± 0.16, tz = 3.90, α > 0.01). В легких хозяина rxy лишь достоверен (+0.68 ± 0.21, tz = 2.74, α > 0.05), так что Н1 принять нельзя.
Таблица 5. Многолетние колебания численности Rhabdias bufonis в Усольской популяции Rana arvalis (пойма реки Иртыш)
| Год | Nj | Легкие хозяина | Полость тела хозяина | |||||||
| nij | nij* | Fij | χ² | H | nij | nij* | Fij | χ² | ||
| 1984 | 134 | 388 | 875.1 | -0.41 | 271.1 | |||||
| 1985 | 210 | 1767 | 1371.4 | +0.15 | 114.1 | 67.9 | 834 | 1092.9 | -0.16 | 61.3 |
| 1986 | 126 | 950 | 822.8 | +0.08 | 19.7 | 51.8 | 883 | 655.8 | +0.17 | 78.7 |
| 1987 | 132 | 808 | 862.0 | -0.04 | 3.38 | 41.0 | 1163 | 687.0 | +0.30 | 329.8 |
| 1988 | 124 | 806 | 809.8 | ± 0.00 | 0.02 | 59.8 | 541 | 645.3 | -0.10 | 16.9 |
| 1989 | 11 | 165 | 71.8 | +0.40 | 120.8 | 74.0 | 58 | 57.2 | +0.01 | 0.01 |
| 1990 | 68 | 688 | 444.1 | +0.23 | 134.0 | 58.1 | 496 | 353.9 | +0.18 | 57.1 |
| 1991 | 102 | 740 | 666.1 | +0.06 | 8.20 | 63.8 | 420 | 530.8 | -0.13 | 23.1 |
| 1992 | 69 | 423 | 450.6 | -0.03 | 1.69 | 38.2 | 684 | 359.1 | +0.34 | 293.9 |
| 1993 | 70 | 316 | 457.1 | -0.19 | 43.6 | 56.2 | 246 | 364.3 | -0.20 | 38.4 |
| 1994 | 18 | 72 | 117.5 | -0.24 | 17.6 | 75.8 | 23 | 93.7 | -0.61 | 53.3 |
| 1995 | 79 | 617 | 515.9 | +0.10 | 19.8 | 58.5 | 438 | 411.1 | +0.03 | 1.75 |
| 1996 | 88 | 351 | 574.7 | -0.26 | 87.1 | 80.1 | 87 | 458.0 | -.70 | 300.5 |
| 1997 | 38 | 196 | 248.2 | -0.12 | 11.0 | 85.2 | 34 | 197.8 | -0.71 | 135.6 |
| Итого | 1269 | 8287 | 8287.0 | 852.1 | 5907 | 5907.0 | 1390.6 | |||
| Примечание. Nj – объем j-й выборки хозяина, экз.; nij – эмпирическое число гельминтов i-го вида в j-й выборке хозяина, экз.; nij* – теоретическое число гельминтов i-го вида в j-й выборке хозяина, экз.; χ² – критерий согласия; Fij – показатель степени приуроченности обилия i-го вида к j-й выборке хозяина; H – мера успешной миграции гельминтов i-го вида в легкие хозяина, хоминг, %. | ||||||||||
В легких остромордых лягушек наблюдается три волны численности R. bufonis (см. рис. 3). Первая волна численности продолжается 4 года – от минимума величины параметров инвазии в 1984, через максимум в 1985 и до нового минимума в 1988 г. Резко выделяющаяся на рис. 3 вторая флуктуация численности гельминта длится 7 лет. Она начинается от минимального значения индекса обилия нематоды в 1988 и заканчивается следующим низким значением показателя в 1994 г. В отличие от индекса обилия гельминта, экстенсивность инвазии легких лягушки испытывает четыре флуктуации с пиками в 1985, 1989, 1992 и 1995 гг. (см. рис. 3). Разница между параметрами экстенсивности инвазии легких в 1984 и 1985 гг. значима (tφ = 5.94, α > 0.001), так же как в 1985 и 1988 гг. (tφ = 3.15, α > 0.01). В других волнах инвазии отличия между минимумом и максимумом параметра недостоверны. Но бросается в глаза почти полное совпадение по фазе с колебаниями показателей инвазии полости тела амфибий (см. рис. 3). Мы считаем, что семилетняя волна численности R. bufonis в легких R. arvalis кажущаяся, она, видимо, сформировалась благодаря наложению потоков численности нематоды. Явление интерференции численности гельминтов, могущих затемнять картину многолетних колебаний, хорошо известно. Например, в оз. Уиндермир (Англия) у Discocotyle sagittata, паразитирующей на жабрах форели, из-за продолжительности жизни в 3–4 года перекрываются несколько поколений паразита. В результате колебания численности моногенеи в озере не регистрируются (Трухачёв и др., 2005, с. 223). По нашему мнению, многолетняя динамика обилия нематоды в легких хозяина, так же как в полости тела, насчитывает четыре волны. Последняя волна численности легочных R. bufonis продолжается три года, с 1995 по 1997 г. Положительный знак Fij и величина эмпирического обилия гельминта в 1995 г., существенно превышающая теоретическую за 1994 и 1996 гг., свидетельствуют в пользу достоверности данной волны численности нематоды (см. табл. 5).
Как известно, по характеру количественных изменений популяции делятся на оппортунистические и равновесные (стационарные): у первых отмечаются регулярные или случайные колебания численности, у вторых они практически отсутствуют (Пианка, 1981; Трухачёв и др., 2003). Например, в паразитарной системе корюшка (Schistocephalus solidus) – цестода (Proteocephallus filicollis) колебания численности хозяина и паразита совпадают и укладываются в 4–5 лет, поэтому отсутствует цикл изменений заражения (Кеннеди, 1978). Р. С. Шульц и Е. В. Гвоздев (1972) отмечают отсутствие заметных колебаний инвазии гемонхами у овец. Регулярные вспышки численности наблюдается у многих видов животных, в том числе у организмов эпидемического и эпизоотологического значения (Максимов, 1984). Классическим примером оппортунистических популяций служит печеночный сосальщик (Fasciola hepatica), у которого отмечены периодические колебания численности, определяемые погодой отдельных лет (Odening, 1974). Одиннадцатилетние волны зараженности филяроидозом и скрябингелезом лесной куницы установлены в Западной Сибири (Корытин, 1976). В Карасукской системе озер Западной Сибири с 1965 по 1975 г. непрерывно изучались колебания инвазии моногенеями рода Dactylogyrus у 5 видов рыб (Соусь, 1982). Смена высокой степени зараженности хозяев 7 видами паразитов на низкую наблюдалась каждые 2–4 года. Полученные нами данные свидетельствуют о том, что в биотопах степной зоны Казахстана оппортунистические популяции R. bufonis колеблются у R. arvalis с периодичностью в 3–4 года.
В течение мониторинга просматривается тенденция к снижению величины показателей заражения полости тела R. arvalis Л4 (см. рис. 3). Так, в 1985 г. экстенсивность инвазии лягушек равнялась 58.6 ± 3.4 %, а в 1997 г. - 21.1 ± 6.6 % (tφ = 4.27, df = 242, α > 0.001). Численность нематоды в полости тела за этот период уменьшилась в 24.5 раз, в легких – в 9.0 раза (см. табл. 5). Данная тенденция подтверждается данными Н. Е. Тарасовской (2016). Автор сообщает о снижении зараженности легких остромордой лягушки R. bufonis в пойме Иртыша в 2005–2014 гг. Подсчитанная по данным названного исследователя средняя за 10 лет экстенсивность инвазии равна 31.5 ± 1.2 % (Nj = 1373 экз.), что значительно меньше среднего значения показателя по нашим данным за период с 1984 по 1997 г. – 84.6 ± 1.0 % (Nj = 1269 экз.). Вполне возможно, что происходящие в легких и полости тела пойменных R. arvalis колебания R. bufonis с амплитудой в 3–4 года являются составной частью более протяженных волн численности и инвазии хозяина.
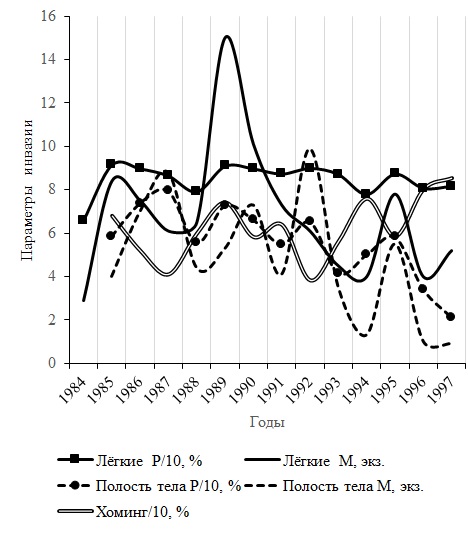
Рис. 3. Многолетние колебания экстенсивности инвазии легких и полости тела Rana arvalis нематодой Rhabdias bufonis, индекса обилия и хоминга гельминта в пойменном биотопе реки Иртыш (Усолка)
Fig. 3. Long-term fluctuations of invasion of the lungs and body cavity of Rana arvalis by the nematode Rhabdias bufonis, and of the abundance and the homing of the helminth (floodplain biotope of the Irtysh River, Usolka)
Кривые, отражающие колебания процента успешной миграции R. bufonis в легкие хозяина (хоминг), «антипараллельны» с линиями, характеризующими флуктуации индекса обилия и экстенсивности инвазии хозяина полостной формой гельминта (см. рис. 3). В 1995 г. подобное соотношение наблюдается и для динамики зараженности легких. В годы максимальной величины параметров инвазии хозяина наблюдается минимум хоминга рабдиасов. И наоборот, в годы слабой зараженности R. arvalis отмечается высокий процент R. bufonis, успешно заселивших легкие лягушек. Мы полагаем, что указанная противоположность в динамике показателей инвазии отражает колебания патогенности нематоды. В экспериментах по заражению ювенильных особей Bufo bufo показано, что уже при небольшом уровне заражения нематодой из-за анорексии снижаются трофические способности жаб, ухудшается их взаимодействие с конкурентами и хищниками, наблюдается гибель зараженных особей (Goater, Ward, 1992; Goater et al., 1993). О патогенности R. bufonis сообщает О. Н. Жигилева с соавторами (2002). В биотопах степной зоны в течение каждого сезона происходит смена двух генераций свободноживущих самцов, самок и инвазионных личинок R. bufonis, учитывая это, мы допускаем, что в череде сменяющихся поколений изменяется патогенность рабдиаса и, соответственно, иммунный статус R. arvalis. Приблизительно так, как при циклически сбалансированном полиморфизме в системе человек – трипаносома (Бигон и др., 1989). Возбудитель сонной болезни Trypanosoma brucei имеет комплекс антигенов, поочередно активирующихся в ответ на образуемые хозяином средства иммунитета. В результате в спинномозговой жидкости больного происходят значительные колебания численности трипаносом. Предполагаемая связь колебаний численности R. bufonis и зараженности R. arvalis со скоррелированными между собой инвазивностью паразита и иммунной системой хозяина сложна, но интересна своей эволюционной древностью.
Заключение
Исследованные биотопические пробы R. arvalis (2637 экз.) из степной зоны Казахстана по степени экстенсивности инвазии амфибии, значениям индекса обилия R. bufonis, соотношению фактической и теоретической численности нематоды распадаются на три группы: с высоким, средним и малым значением параметров зараженности. Степень инвазии остромордой лягушки нематодой зависит от наличия и величины в биотопах зон с увлажненным и обогащенным кислородом субстратом.
Установлено, что часть постинвазионных личинок R. bufonis, мигрирующих от ворот заражения в легкие R. arvalis, застревают в мелких сосудах кровеносной и лимфатической системы, выходят в полость тела и там накапливаются. Полостные гельминты растут в длину, но половые органы у них не развиваются. Эти данные подтверждаются литературными, согласно которым R. bufonis аккумулируются в полости тела R. temporaria и Bufo bufo.
Максимальные значения экстенсивности инвазии легких и полости тела остромордой лягушки, индекса обилия и смещение фактической численности гельминта в естественных условиях поймы р. Иртыш и в антропогенных биотопах отмечены в мае и сентябре, минимальные – в июле. Наименьшая численность R. bufonis и экстенсивность инвазии легких R. arvalis характерна для младших размерно-возрастных групп (длина тела 13.0–30.0 мм), максимальная – для двух самых старших (длина тела > 36.1 мм). В легких лягушек двух старших групп находится в 3.4 раза больше паразитических самок, чем суммарно у первых трех. В полости тела младших размерно-возрастных групп хозяина сосредоточено в 5.1 раза больше Л4 R. bufonis, чем у старших. Пол хозяина заметного влияния на зараженность нематодой легких и полости тела не оказывает.
Хоминг (Homing), или доля постинвазионных личинок R. bufonis, успешно заселивших легкие сеголеток амфибии, в два раза меньше, чем у самых крупных особей, и равен соответственно 42.3 и 87.7 %. С повышением длины тела (возраста) R. arvalis диаметр магистральных кровеносных сосудов и воротных систем печени и почек увеличивается. Поэтому мигрирующие нематоды у старших возрастных групп хозяина меньше «застревают» в сосудах, реже переходят в полость тела хозяина и успешнее достигают место окончательной локализации. Противоположный характер многолетней динамики численности нематод в полости тела хозяина и хоминга свидетельствует о возможной сложной связи иммунного статуса R. arvalis и патогенности R. bufonis, сформировавшейся в ходе длительной сопряженной эволюции гельминта и хозяина.
В условиях поймы р. Иртыш и антропогенных биотопов г. Павлодар R. bufonis дважды в сезоне реализует жизненный цикл. Первый, весенне-летний, осуществляется в мае – июле каждого сезона. Из яиц, выделенных перезимовавшими в легких хозяина самками R. bufonis, развиваются рабдитовидные личинки, из них формируется свободно живущие поколение самцов и самок, инвазионные филяриевидные личинки. В результате нового заражения в легких R. arvalis происходит замена прошлогодней генерации паразитических самок новой. Основная часть особей весенней генерации Л4, накопившихся в полости тела хозяина, остаются там 2.5–3 месяца. Гермафродитные самки нового поколения обитают в легких дольше и могут добавляться к сезонному потоку численности осеннего поколения гельминта. Осенний жизненный цикл R. bufonis протекает в две фазы. В течение первой фазы формируется свободноживущее поколение нематоды, заражаются легкие, заселяется полость тела хозяина. Эта фаза прерывается зимним покоем хозяина. Зимнее промораживание R. bufonis и другие виды гельминтов переживают в обезвоженном, сильно уплощенном, почти прозрачном состоянии. Мягкое, без разрушения клеточных стенок, обезвоживание R. arvalis и фауны ее паразитов происходит, вероятно, путем осмотической дегидратации. Вторая фаза цикла развития заканчивается весной следующего сезона и заключается в откладке яиц самками R. bufonis, пережившими зиму. В природных условиях степной зоны Казахстана существование второй генерации R. bufonis в легких и полости тела R. arvalis, включая время зимнего покоя, длится 11–13 месяцев.
Численность компонентных популяций R. bufonis в легких и полости тела R. arvalis испытывает сезонные и многолетние колебания. Протяженность ежегодной весенне-летней флуктуации равна 3, летне-осенней, включая период зимнего покоя, 11–13 месяцам. Для многолетних волн численности R. bufonis и зараженности легких и полости тела R. arvalis в пойме р. Иртыш установлена периодичность в 3–4 года.
Библиография
Аралханова А. Е. Особенности биологии и морфологии нематоды Rhabdias bufonis от амфибий Восточно-Казахстанской области // Вестник Павлодарского государственного университета. 2010. № 1. Серия химико-биологическая. С. 31–37.
Баканов А. И. Количественная оценка доминирования в экологических сообществах . Борок: ВИНИТИ, 1987. 64 с.
Банников А. Г., Даревский И. С., Ищенко В. Г., Рустамов А. К., Щербак Н. Н. Определитель земноводных и пресмыкающихся фауны СССР . М.: Просвещение, 1977. 415 с.
Бигон М., Харпер Дж., Таунсенд К. Экология. Особи, популяции и сообщества . Т. 1. М.: Мир, 1989. 667 с.
Боев С. Н., Соколова И. Б., Панин В. Я. Гельминты копытных животных Казахстана . Алма-Ата: Изд-во АН Казахской ССР, 1962. Т. 1. 377 с.
Бреев К. А. Применение негативного биномиального распределения для изучения популяционной экологии паразитов. Методы паразитологических исследований . Л.: Наука, 1972. 71 с.
Буракова А. В. Эколого-генетические особенности и гельминтофауна остромордой лягушки (Rana arvalis Nilsson.) в градиенте урбанизации: Автореф. дис. ... канд. биол. наук . Екатеринбург, 2010. 22 c.
Ваккер В. Г., Брушко З. К., Тарасовская Н. Е. К гельминтофауне амфибий Казахстана // Материалы Всесоюзного научно-методического совещания зоологов педагогических вузов СССР / Ред. С. П. Наумов. Махачкала: Изд-во ДГУ, 1990. С. 59–61.
Ваккер В. Г., Тарасовская Н. Е. Биология Rhabdias bufonis (Schrank,1788) (Rhabdiasidae) в Среднем Прииртышье . Деп. ВИНИТИ 1988, № 4147 – В88, анн. В РЖБ 1988, 6К – 120, 17 с.
Гинецинская Т. А., Голубева Е. Б. Изменение гельминтофауны Rana temporaria в Петергофском парке за 50 лет // Эволюция паразитов. Тольятти, 1991. С. 211–215.
Догель В. А. Курс общей паразитологии . Л., 1947. 318 с.
Дубинина М. Н. Экологическое исследование паразитофауны озерной лягушки (Rana ridibunda Pall.) дельты Волги // Паразитологический сборник. М.; Л, 1950. Т. XII. С. 340–350.
Жигилева О. Н. Взаимосвязь зараженности гельминтами и генетического разнообразия популяций животных: Дис. ... д-ра биол. наук . Тюмень, 2017. 327 с.
Жигилева О. Н., Сурель О. В., Злобина Л. С. Паразитарные сообщества остромордой лягушки на юге Западной Сибири // Вестник экологии, лесоведения и ландшафтоведения. Тюмень, 2002. Вып. 3. С. 63–68.
Зарипова Ф. Ф., Файзулин А. И. Характеристика функционирования сообщества гельминтов озерной лягушки (Pelophylax ridibundus (Pallas, 1771)) (Amphibia, Anura) в следующие друг за другом годы в условиях Зауралья Республики Башкортостан // Современная герпетология. 2016. Т. 15. Вып. 1/2. С. 14–19.
Ибрагимова Д. В. Амфибии в экосистемах города Сургута: Автореф. дис. ... канд. биол. наук . Новосибирск, 2013. 16 с.
Ивантер Э. В., Коросов А. В. Основы биометрии: Введение в статистический анализ биологических явлений и процессов: Учеб. пособие . Петрозаводск: Изд-во ПГУ, 1992. 163 с.
Искакова К. И. Земноводные Казахстана . Алма-Ата: Изд-во АН Казахской ССР, 1959. 145 с.
Кеннеди К. Экологическая паразитология . М.: Мир, 1978. 230 с.
Корытин С. А. Космическая информация и прогнозирование количественного и качественного состава популяций // Численность животных и ее прогнозирование. Киров, 1976. С. 132–135.
Корытин Н. С. Влияние гельминтозов на демографические параметры популяции хозяина (на примере обыкновенной лисицы) // Известия РАН. Серия биологическая. 2012. № 6. С. 652–657.
Кудинова М. А., Жерихова Г. В., Петрова О. Е. Гельминтофауна лягушки травяной в Южной Карелии // Гельминты и их промежуточные хозяева / Ред. Л. С. Шалдыбин. Горький, 1985. С. 24–27.
Кузьмин С. Л. Земноводные бывшего СССР . М.: Т-во научных изданий КМК, 2012. 370 c.
Кузьмин Ю. Жизненные циклы рабдиазидных нематод (Nematoda: Rhabdiasidae) из Палеарктики // Труды Юбилейной конференции Украинского научного общества паразитологов «Паразитология в Украине. Вчера, сегодня и завтра». Киев, 1995. С. 133–138.
Лакин Г. Ф. Биометрия: Учеб. пособие для биол. спец. вузов . М.: Высшая школа, 1990. 352 с.
Максимов А. А. Многолетние колебания численности животных, их причины и прогноз . Новосибирск: Наука. Сибирское отд-ние, 1984. 250 с.
Марков Г. С., Рогоза М. Л. Сезонные и микрозональные различия в паразитофауне травяной лягушки // Доклады АН СССР. 1953a. Т. ХСIII. № 1. С. 169–172.
Марков Г. С., Рогоза М. Л. Возрастная динамика паразитофауны травяной лягушки // Доклады АН СССР. 1953б. Т. XCIII. № 3. С. 581–584.
Однокурцев В. А., Седалищев В. Г. Гельминтофауна сибирской лягушки Якутии, ее половозрастная и сезонная изменчивость // Поволжский экологический журнал. 2008. № 2. С. 112–119.
Песенко Ю. А. Принципы и методы в фаунистических исследованиях . М.: Наука, 1982. 288 с.
Пианка Э. Эволюционная экология . М.: Мир, 1981. 400 с.
Плохинский Н. А. Биометрия . М.: Изд-во МГУ, 1970. 359 с.
Пятова М. В., Равковская Е. А., Хворова И. А., Лада Г. А. Многолетняя динамика видового состава и численности гельминтов озерной лягушки Pelophylax ridibundus // Вестник СПбГУ. 2016. Сер. 3. Вып. 3. С. 126–130. DOI: 10.21638/11701/spbu03.2016.321
Резванцева М. В. Сезонная и многолетняя динамика численности гельминтов озерной лягушки (Rana ridibunda) в окрестностях Тамбова // Вестник ТГУ. 2009. Т. 14. Вып. 2. С. 389–393.
Савинов В. А. Некоторые новые экспериментальные данные о резервуарном паразитизме у нематод // Материалы к научной конференции Всесоюзного общества гельминтологов. М.: АН СССР, 1968. Ч. 2. С. 73–75.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека. Основы нематодологии . М.: Наука, 1954. Т. 3. 683 с.
Соболева Т. Н. К гельминтофауне водных амфибий и рептилий Казахстана // Экология водных животных / Ред. Е. В. Гвоздев. Алма-Ата: АН Каз. ССР, 1975. С. 186–192.
Соусь С. М. Многолетние колебания численности некоторых видов рода Dactylogyrus (Monogenoidea, Dactylogyridae) // Опыт комплексного изучения и использования Карасукских озер. Новосибирск, 1982. С. 148–156.
Тарасовская Н. Е. Гельминтофауна наземных холоднокровных позвоночных Павлодарской области и сопредельных регионов // Матеріали Х Міжнародної науково-практичної інтернет-конференції «Проблеми та перспективи розвитку науки на початку третього тисячоліття у країнах СНД». Переяслав-Хмельницкий, 2013. С. 31–33.
Тарасовская Н. Е. Многолетняя динамика показателей зараженности остромордой лягушки легочной нематодой Rhabdias bufonis в пойме р. Иртыш // Наука сегодня: проблемы и перспективы развития: Материалы междунар. научно-практ. конф. 30 ноября 2016 г. Вологда, 2016. Ч. 1. С. 157–158.
Трухачёв В. И., Толоконников В. П., Лысенко И. О. Научные основы экологической паразитологии . Ставрополь: Изд-во СтГАУ «АГРУС», 2005. С. 121–244.
Шульц Р. С., Гвоздев Е. В. Основы общей гельминтологии. Биология гельминтов . М.: Наука, 1970. Т. 1. 492 с.
Шульц Р. С., Гвоздев Е. В. Основы общей гельминтологии. Биология гельминтов . М.: Наука, 1972. Т. 2. 516 с.
Щепина Н. А., Балданова Д. Р. Гельминтофауна монгольской жабы (Bufo raddei Strauch, 1876) в Забайкалье // Паразитология. 2010. Т. 44. Вып. 2. С. 153–159.
Baker M. R. Seasonal population changes in Rhabdias ranae Walton, 1929 (Nematoda: Rhabdiasidae) in Rana sylvatica of Ontario // Can. J. Zool. 1979. Vol. 57. P. 179–183.
Combes C., Leger N., Pesson B. Variations dans le temps des populations d`Helminthes parasites de Rana temporaria L. // Annales de Parasitologie (Paris). 1971. Vol. 46. No 6. P. 685–698.
Dare O. K., Forbes M. R. Pattern of trematode nematode lungworm infections in northern leopard frogs and wood frogs from Ontario, Canada // Journal of Helmintology. 2009. Vol. 83. P. 339–343.
Düşen S. The helminth parasites of the two bufonid toads, European Common Toad, Bufo bufo (Linnaeus, 1758) and European Green toad, Bufo (Pseudepidalea) viridis Laurenti, 1768 (Anura: Bufonidae), collected from Denizli Province, Inner-West Anatolia Region, Turkey // Helminthologia (Košice). 2011. Vol. 48. No 2. P. 101–107.
Goater C. P. Experimental population dynamics of Rhabdias bufonis (Nematoda) in toads (Bufo bufo): density–dependence in the primary infection // Parasitology. 1992. Vol. 104. P. 179–187.
Goater C. P., Semlitsch R. D., Bernasconi M. V. Effects of Body Size and Parasite Infection on the Locomotory Performance of Juvenile Toads, Bufo bufo // OIKOS. 1993. Vol. 66. No 1. P. 129–136.
Goater C. P., Ward P. I. Negative Effects of Rhabdias bufonis (Nematoda) on the Growth and Survival of Toads (Bufo bufo) // Oecologia. 1992. Vol. 89. P. 161–165.
Hartwich G. Über Rhabdias bufonis (Schrank, 1788) und die Abtrennung von Rhabdias dossei nov. spec. (Nematoda, Rhabdiasidae) // Mitt. Zool. Museum Berlin. 1972. Bd. 48. Heft 2. S. 401–414.
Janovy J., Clopton R. E., Percival T. J. The roles of ecologic and evolutionary influences in providing structure to parasite species assemblages // J. Parasitol. 1992. Vol. 78 (4). P. 630–640.
Kennedy C. R. Long-term and seasonal changes in composition and richness of intestinal helminths communities in eels Anguilla anguilla of an isolated English river // Folia Parasitologica. 1997. Vol. 44. P. 267–273.
Kuzmin J., Tkach V. Family Rhabdiasidae Railliet, 1915. 2019. URL: http://izan.kiev.ua/ppages/rhabdias/list.htm (03.08.2019).
Kuzmin Y., Junker K., Bain O. Infective larvae of Rhabdiasidae (Nematoda): comparative morphology of seven European species // Acta Parasitologica. 2014. Vol. 59 (1). P. 31–41.
Langford G. J., Janovy J. Comparative Life Cycles and Life Histories of North American Rhabdias Spp. (Nematoda: Rhabdiasidae): Lung worms from Snakes and Anurans // J. Parasitology. 2009. Vol. 95 (5). P. 1145–1155. DOI: 10.1645/GE-2044.1 https://www.researchgate.net/publication/24259593
Lees E., Bass L. Sex hormones as a possible factor influencing the level of parasitation in frogs // Nature (L.). 1960. P. 1207–1208.
Morsy K., Ali S., Abdel-Ghaffar F., El-Fayoumi H., Abdel-Haleem H. Rhabdias bufonis (Rhabdiasidae) from the lung of the African common toad, Amietophrynus regularis (Bufonidae) in Egypt. New data on the basis of light and scanning electron microscopic study. Publ: 25 Mar 2018. Peerj 6:e5328. https://doi.org/10.7717/peerj.5328
Nigon V. M., Felix M.-A. History of research on C. elegans and other free-living nematodes as model organism // WormBook. 2017. 83 p. DOI: 10.1895/wormbook.1.181.1, http://www.wormbook.org
Odening K. Parasitismus. Grundfragen und Grundbegriffe. WTB Band 112. Berlin, 1974. 170 S.
Plasota K. The effect of some ecological factors on the parasitofauna of frogs // Acta Parasit. Pol. 1969. Vol. XVI. Fasc. 6. P. 47–60.
Schaake M. Infektionsmodus und Infektionsweg der Rhabdias bufonis Schrank (Angiostomum nigrovenosum) und die Hermaphroditischen Generation // Z. Parasitenkd. 1931. 3B. P. 518–545.
Spieler M. Parasitologische Untersuchungen an einheimischen Moorfroschlurchen // Duisburg. Jahrbuch f. Feldherpetologie. 1994. Beiheft 2. S. 25–112.
Spieler M., Schierenberg E. On the development of the alternating free–living and parasitic generations of the nematode Rhabdias bufonis // Invertenrate Reproduction and Development. 1995. Vol. 28. No 3. P. 193–203.
Wharton D. A. Parasites and low temperatures // Parasitology. 1999. Suppl. 119. S. 7–17.
Благодарности
Отдаю глубокую дань памяти Маме Нелли Рейнгольдовне и Папе Георгию Готлибовичу. В моем сердце жива глубокая благодарность моим родителям за их терпеливое, доброе и уважительное отношение, за неоценимую моральную помощь, материальную поддержку и постоянную веру в меня.






 © 2011 - 2026
© 2011 - 2026