Введение
К числу свойств цианобактерий (ЦБ), которые можно использовать в биотехнологическом аспекте, относится их способность синтезировать биологически активные вещества, выделяемые в окружающую среду в виде экзометаболитов. ЦБ выделяют свои метаболиты не только после отмирания клеток, но и в процессе нормальной физиологической деятельности. Выделение метаболитов ЦБ является для них одним из приспособлений к изменениям внешних условий (Сакевич, 1985). Первые детальные обзоры о химической природе подобных веществ в русскоязычной литературе обобщены в монографиях (Сиренко, Козицкая, 1988; Андреюк и др., 1990). Однако в данных обзорах, как и в более поздних исследованиях, в основном приводятся сведения о структуре и свойствах, в том числе токсиногенной агрессивности, веществ, образуемых преимущественно водными формами ЦБ (Румянцев, Крюков, 2012; Белых и др., 2015; Voloshko et al., 2008; Wejnerowski et al., 2018; Rott et al., 2018). Данных же об экзогенных метаболитах почвенных ЦБ не так много. При этом почвенные ЦБ в течение многих лет используются в качестве агентов становления супрессивности химически и биологически загрязненных почв, а также для инокуляции семян различных сельскохозяйственных, лесных и декоративных культур (Домрачева, 2005; Домрачева и др., 2009). Полученные результаты о положительном влиянии интродукции ЦБ на повышение урожайности растений, подавлении активности фитопатогенов, их ремедиационной активности в почвах, загрязненных ионами тяжелых металлов, пестицидами, нефтепродуктами, требуют дальнейшего глубокого изучения химического состава экзометаболитов ЦБ. В частности, высокая метаболитическая активность и экологический потенциал отмечен у ЦБ рода Nostoc (Огородникова и др., 2010; Фокина и др., 2015; Řezanka, Dembitsky, 2006).
Цель данной работы – выявить состав и влияние экзометаболитов почвенной цианобактерии Nostoc paludosum Kütz 18 на рост и развитие растений ячменя сорта Изумруд в присутствии сульфата меди(II) и без него.
Материалы
В работе использовали:
– двухмесячную культуру ЦБ N. paludosum 18 с титром 3·107 кл./см3, выращенную на жидкой среде Громова № 6 без азота;
– культуральную жидкость (КЖ) N. paludosum 18;
– ячмень яровой сорта Изумруд. Выведен при обработке семян ячменя сорта Биос-1 биологическим препаратом «Агат 25 К».
Для эксперимента культуру ЦБ гомогенизировали в течение 2 минут с помощью гомогенизатора марки HG-15А-Set-A (DAIHAN Scientific, Ю. Корея) при 30 тыс. об./мин. Далее использовали суспензию ЦБ, ее КЖ (отделяли от микроорганизмов центрифугированием) и вытяжки из КЖ, приготовленные экстрагированием веществ из КЖ в гексан (C6Н14) и четыреххлористый углерод (ЧХУ, ССl4). Экстракция гексаном – один из самых распространенных способов выделения биологически активных веществ (каротина, каротиноидов, токоферолов, флавоноидов и т. д.) из образцов растительного происхождения химически индифферентным нейтральным органическим растворителем (Ивкова, Петрова, 2012). Четыреххлористый углерод – зарекомендовавший себя неселективный экстрагент, способный растворять многие не только мономеры, но и соединения – полимеры (Химическая энциклопедия..., 2012). Экстракция проведена в соотношении КЖ : экстрагент, равном 1 : 1, порциями с последующим их соединением.
Определение состава органических веществ в КЖ, вытяжках из нее и растительных тканях. Определение состава органических веществ в изучаемых субстратах проводили методом высокоэффективной жидкостной хроматографии на хроматографе Shimadzu LC-20, серия Prominence с диодноматричным детектором и газовой хроматографии на хроматографе GC-2014 Shimadzu с детектором TCD-2014 (Япония).
Методы
Исследование влияния экзометаболитов почвенной цианобактерии N. paludosum на рост и развитие проростков ячменя
Фильтровальную бумагу пропитывали исследуемыми субстанциями (суспензия ЦБ, КЖ, вытяжки С6H14 и CCl4 из КЖ), высушивали в термостате до постоянной массы при 37 °С, помещали в стерильные чашки Петри и увлажняли дистиллированной водой таким образом, чтобы фильтр был увлажнен настолько, что последующая капля воды не впитывается в бумагу. Таким образом поддерживали влажность фильтра на максимально возможном уровне, ежедневно добавляя необходимое до полной влагоемкости количество воды с помощью пипетки Пастера. На увлажненные фильтры раскладывали по 20 зерновок в каждую чашку Петри. Опыт проведен в трехкратной повторности для каждого варианта. На третьи и пятые сутки определяли высоту проростков и длину самого длинного корня. Для оценки влияния субстанций на развитие проростков ячменя сорта Изумруд использовали индекс роста (I) (Андреева, Кожевин, 2014):
I = (R + P ) · D,
где I – индекс роста;
R + P – суммарные значения длин корней и проростков соответственно, см;
D – доля проросших семян, %.
Исследование влияния экзометаболитов почвенной цианобактерии N. paludosum на рост и развитие 7-суточных растений ячменя без зерновок
Фильтровальную бумагу помещали в чашки Петри и увлажняли стерильной дистиллированной водой до полной влагоемкости фильтра. Влажность фильтра поддерживали ежедневным внесением воды на фильтр пипеткой Пастера. На увлажненные фильтры раскладывали заранее обработанные в течение пяти минут 75 %-ным этиловым спиртом зерновки ячменя. На 7-е сутки проращивания отделяли зерновки от проростков пинцетом, чтобы исключить питание растений веществами, содержащимися в эндосперме зерновок.
Проростки без зерновок помещали в чашки Петри на фильтровальную бумагу (предварительно пропитанную раствором СuSO4; суспензией ЦБ; суспензией ЦБ + CuSO4; КЖ; КЖ + CuSO4; C6H14; C6H14 + CuSO4; CCl4; CCl4 + CuSO4, высушенную до постоянной массы и перед раскладкой растений увлажненную стерильной водой). В контрольном варианте фильтры смачивали дистиллированной водой. В вариантах с сульфатом меди(II) была создана концентрация Сu2+ 3 мг/кг субстрата, что соответствует предельно допустимой концентрации подвижных форм меди в почве. В каждом варианте было по 30 растений (n = 3). На 3-и сутки экспозиции проростков без зерновок определяли высоту проростков и длину самого длинного корня. Интенсивность перекисного окисления липидов (ПОЛ) в ячмене оценивали по накоплению малонового диальдегида (МДА), который образуется в растительных тканях в процессе ПОЛ при реакции с тиобарбитуровой кислотой (Лукаткин, 2002). Содержание МДА оценивали фотометрически с использованием спектрофотометра SPEKOL 1300 (Analytik Jena, Германия). Определяли содержание борофицина (Merken, Beecher, 2000) и меди в проростках (Сборник методик..., 2004). На протяжении всего эксперимента чашки с растениями находились в климатостате с температурой в ночное время +12–13 °С, в дневное – +21–23 °С.
Статистическая обработка и построение графиков выполнено в программе Excel 2002 for Windows. На рисунках приведены средние арифметические величины и стандартная ошибка. Достоверность различий между двумя средними оценивали с использованием t-критерия Стьюдента.
Результаты
Экзометаболитный состав культуральной жидкости цианобактерии N. paludosum. В процессе жизнедеятельности ЦБ образуется ряд биологически активных веществ, которые выделяются в окружающую среду. В условиях водной культуры экзометаболиты ЦБ накапливаются в КЖ. Установлено, что вытяжки из КЖ и, соответственно, сама КЖ содержат такие вещества, как фитоин (0.5–0.8 мкг/дм3), фитофлуин (0.6–0.8 мкг/дм3), N-ацетилглюкозамин (порядка 2.5 мкг/дм3), пептидогликан муреин, антиоксиданты: ликопин (190–195 мкг/дм3 – органические вытяжки и КЖ, 240–250 мкг/дм3 – в суспензии ЦБ) и лютеин (20–25 мкг/дм3). Обнаружены гормоны, предшественники гиббереллинов (каурен), витамин А и провитамины. Следует отметить, что в основном составы цианобактериальной суспензии, КЖ и вытяжки из нее по количеству определенных органических веществ существенно не отличаются. Единственной отличительной особенностью является высокое содержание ликопина в суспензии ЦБ. Теоретически большинство из этих веществ могут оказывать положительное влияние на развитие растений. Ранее было установлено, что N. muscorum вырабатывает цианопептид борофицин, обладающий антимикробной активностью (Banker, Carmeli, 1998; Swain et al., 2017). Вероятно, именно он может определять антифунгальную активность исследуемых субстанций. В нашем эксперименте концентрация данного цианопептида при его экстракции в соотношении субстанция:экстрагент, равном 1:1, во всех типах субстанций находилась в пределах 0.05–0.06 мкг/дм3. Наличие борофицина у ЦБ рода Nostoc, в частности у Nostoc linkia и N. spongiaeforme, было отмечено в 1994 г. (Hemscheidt et al., 1994). Данный цианопептид биологически активен, поэтому необходимо исследовать возможность его миграции в растения.
Влияние экзометаболитов цианобактерии N. paludosum на развитие проростков ячменя. Экзометаболиты ЦБ являются биологически активными соединениями, которые оказывают влияние на процессы прорастания семян, роста и развития проростков. На третьи сутки экспозиции ячменя на фильтрах, обработанных исследуемыми субстанциями, наибольшую энергию прорастания семян наблюдали в вариантах, выращиваемых на вытяжках С6Н14 (95 %), ССl4 (90 %) и ЦБ (85 %) (рис. 1А). Достоверный ризогенный эффект, по сравнению с контролем, установлен во всех вариантах, проростков – в вариантах с ЦБ и КЖ. Максимальное стимулирующее действие на рост ячменя по обоим показателям оказала суспензия ЦБ. В этом варианте отличие от контроля составило почти 100 % как по длине корней, так и по высоте проростков.
К пятым суткам нивелируется стимулирующий эффект КЖ, хотя в остальных вариантах по-прежнему показатели высоты проростка и длины корня превышают данные показатели в контроле на 10–15 % и 33–37 % соответственно (рис. 1Б).
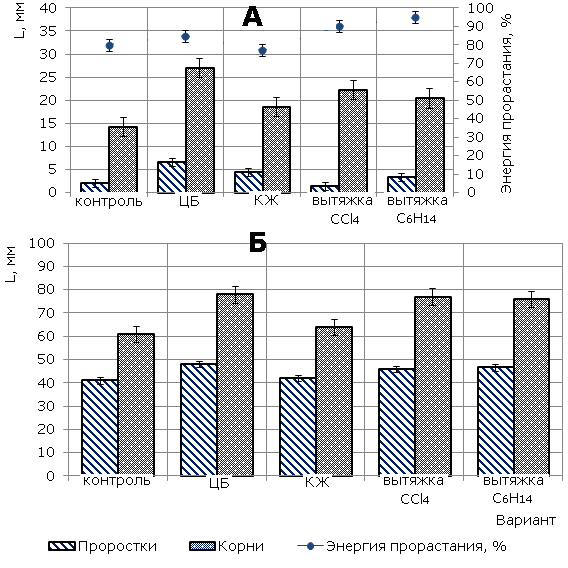
Рис. 1. Влияние цианобактрии N. paludosum и ее экзометаболитов на морфометрические параметры ячменя сорта Изумруд (А – 3-е сутки, Б – 5-е сутки). «*» – результаты достоверно отличаются от контроля при Р > 0.95
Fig.1. The influence of cyanobacterium N.Paludosum and its exometabolites on morphometric parameters of barley of Izumrud variety (A - the 3rd day, B - the 5th day), "*" - results are reliably different from the controls at P>0.95
Использование показателя индекса роста (рис. 2) для иллюстрации наблюдаемых эффектов позволило выявить интегральную характеристику влияния исследуемых субстанций на рост и развитие растений ячменя. Использование цианобактериальной суспензии, вытяжек С6Н14 и ССl4 в целом оказывает ростстимулирующий эффект, что выявлено на 3-суточных проростках. К пятым суткам опыта данная тенденция сохраняется, однако достоверно судить о стимуляции роста уже не удается.
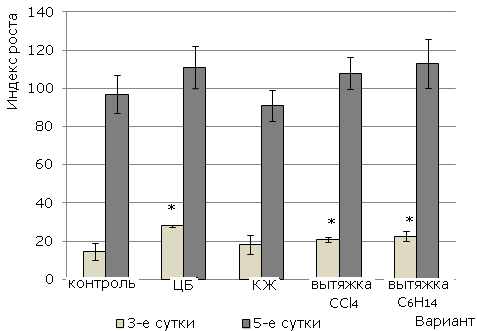
Рис. 2. Влияние цианобактерии N. paludosum и ее экзометаболитов на индекс роста растений ячменя сорта Изумруд. «*» – результаты достоверно отличаются от контроля при Р > 0.95 (n = 60)
Fig. 2. The effect of cyanobacterium N. paludosum and its exometabolites on the plant growth index of barley Izumrud variety. "*" - results are reliably different from controls at P>95 (n=60)
Таким образом, установлено, что комплекс веществ всех субстанций стимулирует рост корней на ранних стадиях развития ячменя. При этом цианобактериальная суспензия обладает наибольшим ростстимулирующим действием.
Оценка влияния исследуемых веществ на рост и развитие растений ячменя, освобожденных от зерновок. Действие цианобактериальных метаболитов на рост ячменя изучали в опыте с 7-суточными проростками с удаленными зерновками. 7-суточные растения без зерновок переносили в чашки Петри на фильтровальную бумагу, предварительно обработанную изучаемыми субстанциями. После 3-суточной экспозиции определяли морфометрические показатели, содержание борофицина в проростках, меди – в проростках и корнях.
Высота проростков. Наибольший ростстимулирующий эффект по отношению к высоте проростков установлен в вариантах с вытяжкой C6H14 (95 ± 3 мм) и суспензией ЦБ (94 ± 5 мм) против 90 ± 4 мм в контроле. Однако достоверного отличия между величинами данного параметра у всех вариантов без добавления сульфата меди(II) не обнаружено (рис. 3).
Длина корней. Выращивание 7-суточных растений ячменя без зерновок на средах, содержащих ЦБ и их метаболиты, привело к торможению роста корневой системы (см. рис. 3). Данное явление можно рассматривать как реакцию на стресс, направленную на адаптацию растений к условиям среды выращивания, или отсутствие необходимости к увеличению линейных размеров корней, обеспечивающему полноценное питание растения. В варианте, где метаболиты отсутствовали, ионы меди(II) в количестве, равном 3 мг/кг субстрата, вызвали достоверное отставание роста корней по сравнению с контролем.
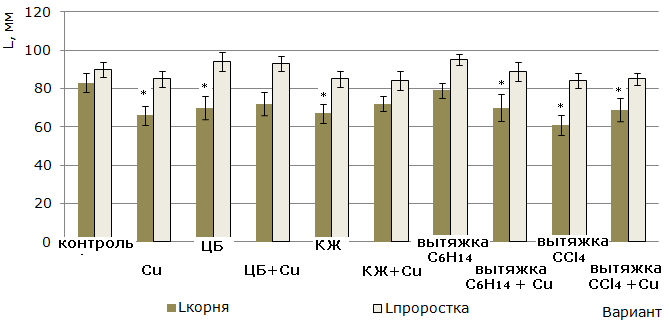
Рис. 3. Влияние N. paludosum, ее экзометаболитов и меди на рост проростков ячменя после удаления зерновок. «*» – результаты достоверно отличаются от контроля при Р > 0.95 (n = 30)
Fig. 3. The effect of N. paludosum, its exometabolites and copper on the growth of barley seedlings after the removal of grains. "*" - results are reliably different from controls at P>0.95 (n=30)
Влияние компонентов культуральной жидкости цианобактерии на накопление меди корнями и проростками ячменя. Обнаружение меди в растениях вариантов без добавления соли металла является следствием того, что Cu – микроэлемент, входящий в состав зерновок в естественном состоянии. Среднее содержание меди в растениях, по Виноградову, составляет 2 мкг/г (Ягодин и др., 2002), допустимое остаточное количество – 10 мкг/г (Найштейн и др., 1987). В данные параметры вполне вписывается значение содержания меди не только контрольного варианта, но и вариантов с КЖ, вытяжками C6H14, ССl4 (рис. 4). В остальных вариантах при благополучии с содержанием меди в проростках несколько повышено количество меди в корнях. При этом добавление сульфата меди(II) приводит к тенденции увеличения накопления металла.

Рис. 4. Содержание меди в проростках и корнях 10-суточных растений ячменя сорта Изумруд, освобожденных от зерновок (n = 30; P = 0.95)
Fig. 4. The content of copper in the seedlings and roots of 10-day-old barley of Izumrud variety, after the removal of grains (n=30; P=0.95)
Влияние компонентов культуральной жидкости на накопление борофицина в проростках ячменя. С одной стороны, цианопептид борофицин может вызывать отравления у млекопитающих, играя, таким образом, отрицательную роль, с другой – обладает антимикробными свойствами по отношению к фитопатогенам. Интерес, проявляемый к пептидам в последние годы, связан как с возможностью использования генов микроорганизмов, отвечающих за выработку вещества, для создания устойчивых форм сельскохозяйственных растений, так и с перспективностью их применения для разработки лекарственных препаратов нового поколения (Кокшарова, 2010; Одинцова и др., 2012).
Установлено, что борофицин накапливается в проростках при выращивании ячменя на суспензии ЦБ и вытяжке ССl4 из КЖ в количестве, равном 0.0008–0.001 мкг/г сухой массы. В проростках остальных вариантов его не обнаружено. При этом борофицин присутствует практически в одинаковом количестве (0.04 мкг/дм3) во всех субстанциях. Логично, что такая особенность связана с комплексом факторов как со стороны растения, так и силой действия комплекса веществ субстанций, на которых растения выращивали. Однозначного ответа пока нет.
Влияние экзометаболитов на перекисное окисление липидов в листьях ячменя. Перекисное окисление липидов – окислительная деградация липидов в растениях происходит в основном под действием свободных радикалов и является одним из симптомов окислительного стресса в растительных клетках (Apel, Hirt, 2004). В норме ПОЛ поддерживается на определенном уровне за счет эффективной работы систем антиоксидантной защиты (антиокислительные ферменты, вещества с антиоксидантными свойствами) (Blokhina et al., 2003). В стрессовых условиях изменение интенсивности процессов ПОЛ может свидетельствовать как о патологических состояниях (Лелевич, 2009), так и о процессах адаптации.
Выращивание проростков ячменя на испытуемых субстратах приводило к достоверному, по сравнению с контролем (вода), снижению накопления продукта ПОЛ – малонового диальдегида (МДА) в клетках листьев (рис. 5). Низкая интенсивность процессов ПОЛ отмечалась в варианте с действием солей меди, что, возможно, связано с ходом адаптационных перестроек в клетках. Известно, что сразу после действия стресс-фактора в клетках происходит значительная активация антиоксидантных ферментов и накопление веществ с антиоксидантными свойствами. Все это приводит к снижению уровня активных форм кислорода, что сказывается на скорости протекания процессов ПОЛ в клетках. Известно, что фосфорорганический ксенобиотик – метилфосфоновая кислота и ЦБ – N. muscorum вызывают снижение уровня МДА в клетках листьев ячменя (Коваль, Огородникова, 2014), низкие температуры, также могут приводить к уменьшению уровня МДА в клетках листьев табака (Попов и др., 2010). Снижение интенсивности ПОЛ в клетках ячменя, выращенных на испытуемых субстратах, возможно, обусловлено действием на них экзометаболитов ЦБ, в составе которых присутствуют вещества с выраженными антиоксидантными свойствами – ликопин, лютеин, витамин А и др.
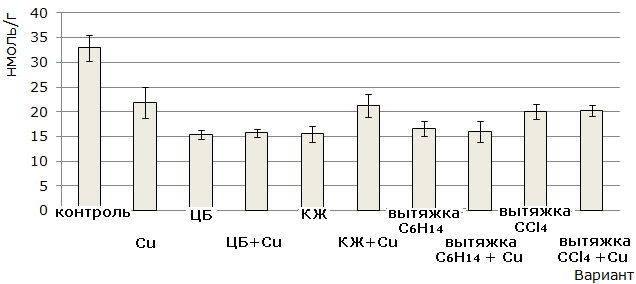
Рис. 5. Содержание малонового диальдегида в клетках листьев 10-суточных проростков ячменя сорта Изумруд, освобожденных от зерновок (пересчет на сырую биомассу)
Fig.5. The content of malonic dialdehyde in the leaf cells of 10-days-old seedlings of barley of Izumrud variety after the removal of grains (raw biomass equivalent)
Заключение
В культуральной жидкости цианобактерии N. paludosum методом ВЭЖХ обнаружены вещества, которые могут обладать биологической активностью (ликопин, лютеин – антиоксиданты, витамин А и провитамины, предшественники гиббереллинов), способствующей росту ячменя. Также в составе культуральной жидкости обнаружен цианопептид борофицин. Цианобактерия N. paludosum 18 и еe экзометаболиты в большей степени влияют на развитие ячменя сорта Изумруд в первые трое суток его роста, оказывая стимулирующее действие, на линейный рост надземных органов и корней. Исследование показало, что присутствие цианобактерии N. paludosum и ее экзометаболитов приводит не только к ростстимулирующему эффекту, но и снижению интенсивности процессов перекисного окисления липидов в растительных клетках.
Библиография
Андреева О. А., Кожевин П. А. Оптимизация естественного сообщества микроорганизмов почвы как способ создания микробных удобрений // Вестник Московского университета. Сер. 17: Почвоведение. 2014. № 4. С. 42–45.
Андреюк Е. И., Коптева Ж. П., Занина В. А. Цианобактерии . Киев: Наукова думка, 1990. 200 с.
Белых О. И., Гладких А. С., Сороковикова Е. Г., Тихонова И. В., Потапов С. А., Бутина Т. В. Сакситоксин-продуцирующие цианобактерии в озере Байкал // Сибирский экологический журнал. 2015. № 2. С. 229–237.
Домрачева Л. И. «Цветение» почвы и закономерности его развития . Сыктывкар, 2005. 336 с.
Домрачева Л. И., Кондакова Л. В., Попов Л. Б., Зыкова Ю. Н. Биоремедиационные возможности почвенных цианобактерий (обзор) // Теоретическая и прикладная экология. 2009. № 1. С. 8–17.
Ивкова А. В., Петрова С. Н. Качественный анализ гексановых экстрактов листьев шиповника // Известия вузов. Прикладная биохимия и биотехнология. 2012. № 2 (3). С. 158–159.
Коваль Е. В., Огородникова С. Ю. Влияние цианобактерии Nostoc muscorum на устойчивость растений ячменя к действию метилфосфоновой кислоты // Теоретическая и прикладная экология. 2014. № 2. С. 61–66.
Кокшарова О. А. Применение методов молекулярной генетики и микробиологии в экологии и биотехнологии цианобактерий // Микробиология. 2010. Т. 79. № 6. С. 734–747.
Лелевич В. В. Биологическая химия . Гродно: ГрГМУ, 2009. 275 с.
Лукаткин А. С. Холодовое повреждение теплолюбивых растений и окислительный стресс . Саранск: Изд-во Мордов. ун-та, 2002. 208 с.
Найштейн С. Я., Меренюк Г. В., Чегринец Г. Я. Гигиена окружающей среды и применение удобрений . Кишинев: Штиинца, 1987. 143 с.
Огородникова С. Ю., Зыкова Ю. Н., Березин Г. И., Домрачева Л. И., Калинин А. А. Комплексная оценка состояния цианобактерии при воздействии различных поллютантов // Теоретическая и прикладная экология. 2010. № 3. С. 47–51.
Одинцова Т. И., Коростылева Т. В., Уткина Л. Л., Андреев Я. А., Славохотова А. А., Истомина Е. А., Пухальский В. А., Егоров Ц. А. Антимикробные пептиды пшеницы // Вавиловский журнал генетики и селекции. 2012. Т. 16. № 1. С. 107–115.
Попов В. Н., Антипина О. В., Трунова Т. И. Перекисное окисление липидов при низкотемпературной адаптации листьев и корней теплолюбивых растений табака // Физиология растений. 2010. Т. 57. № 1. С. 153–156.
Румянцев В. А., Крюков Л. Н. Особенности природы цианобактерий // Здоровье населения и среда обитания. 2012. № 2. С. 221–227.
Сакевич А. И. Экзометаболиты пресноводных водорослей . Киев: Наукова думка, 1985. 199 с.
Сборник методик измерений концентрации ионов меди, кадмия, цинка, висмута, марганца и никеля методом вольтамперометрии на вольтамперометрическом анализаторе «Экотест-ВА» . М.: ООО «Эконикс-Эксперт», 2004. 61 с.
Сиренко Л. А., Козицкая В. Н. Биологически активные вещества водорослей и качество воды . Киев: Наукова думка, 1988. 256 с.
Фокина А. И., Горностаева Е. А., Огородникова С. Ю., Зыкова Ю. Н., Домрачева Л. И., Кондакова Л. В. Адаптационные резервы почвенных природных биопленок с доминированием цианобактерий рода Phormidium // Сибирский экологический журнал. 2015. № 2. С. 842–851. DOI: 10.15372/SEJ20150604
Химическая энциклопедия / Под ред. Н. С. Зефирова М.: Большая Российская энциклопедия, 1998. Т. 5. 783 с.
Ягодин Б. А., Жуков Ю. П., Кобзаренко В. И. Агрохимия / Под ред. Б. А. Ягодина. М.: Колос, 2002. 584 с.
Apel K., Hirt H. Reactive Oxygen Species: Metabolism, Oxidative Stress, and Signal Transduction // Annu. Rev. Plant Biol. 2004. Vol. 55. P. 373–399. DOI: 10.1146/annurev.arplant.55.031903.141701
Banker R., Carmeli S. Tenuecyclamides A-D, cyclic hexapeptides from the cyanobacterium Nostoc spongiaeforme var. tenue // Journal of Natural Products. 1998. Vol. 61. Issue 10. P. 1248–1251. DOI: 10.1021/np980138j
Blokhina O., Virolainen E., Fagerstedt K. V. Antioxidants, Oxidative Damage and Oxygen Deprivation Stress: a Review // Annals of Botany. 2003. Vol. 91. Р. 179–194. DOI: 10.1093/aob/mcf118
Hemscheidt T., Puglisi M. P., Larsen L. K., Patterson G. M. L., Moore R. E., Rios J. L., Clardy J. Structure and biosynthesis of borophycin, a new boeseken complex of boric acid from a marine strain of the blue-green alga Nostoc linckia // J. Org. Chem. 1994. Vol. 59. P. 3467–3471.
Merken H. M., Beecher G. R. Liquid chromatographic method for the separation and quantification of prominent flavonoid aglycones // Journal of Chromatography A. 2000. Vol. 897. Issues 1–2. Р. 177–184. DOI: 10.1016/s0021-9673(00)00826-8
Řezanka T., Dembitsky V. M. Metabolites produced by cyanobacteria belonging to several species of the family Nostocaceae // Folia Microbiologica. 2006. Vol. 51. Issue 3. P. 159–182. DOI: 10.1007/BF02932119
Rott E., Pentecost A., Mareš J. Introduction: Recent developments in cyanobacterial research with special reference to aquatic habitats, molecular ecology and phylogenetic taxonomy // Hydrobiologia. 2018. Vol. 811. Issue 1. P. 1–6. DOI: 10.1007/s10750-017-3468-9
Swain S. S., Paidesetty S. K., Padhy N. R. Antibacterial, antifungal and antimycobacterial compounds from cyanobacteria // Biomedicine & Pharmacotherapy. 2017. June. Vol. 90. P. 760–776. DOI: 10.1016 / j. biopha.2017.04.030
Voloshko L., Safronova T., Pljusch A., Titova N., Kopecky J., Hrouzek P., Drabkova V. Toxins and other bioactive compounds produced by cyanobacteria in Lake Ladoga // Estonian Journal of Ecology. 2008. No 2. P. 100–110. DOI: 10.3176/eco.2008.2.02
Wejnerowski Ł., Rzymski P., Kokociński M., Meriluoto J. The structure and toxicity of winter cyanobacterial bloom in a eutrophic lake of the temperate zone // Ecotoxicology. 2018. Vol. 27. Issue 6. P. 752–760. DOI: 10.1007 / s10646-018-1957-X.






 © 2011 - 2026
© 2011 - 2026