Введение
Бактерии рода Azotobacter относятся к свободноживущим азотфиксаторам почвы (ризобактериям) и способны, как и клубеньковые бактерии растений (ризобии), с помощью нитрогеназного комплекса фиксировать молекулярный азот воздуха, превращая его в ион аммония (Howard, Rees, 2006; Wani et al., 2013; Феоктистова и др., 2016). Бактерии рода Azotobacter населяют экторизосферу (зона почвы с наружной стороны корня) и ризоплану (поверхность корневой системы) различных видов небобовых растений, используя экссудаты корневой системы для питания. В обмен растение получает азот в виде доступных для усвоения соединений, улучшается фосфорное питание растений благодаря растворению труднодоступных почвенных фосфатов в процессе жизнедеятельности ризобактерий, фитогормоны, вырабатываемые ризобактериями, стимулируют рост растений, бактерии рода Azotobacter подавляют развитие фитопатогенных грибов и бактерий (Феоктистова и др., 2016). Способность разных штаммов Azotobacter chroococcum Beijer. влиять на прорастание семян и развитие проростков различных видов растений изучена недостаточно (Кириченко и др., 2010). Хотя в настоящее время этому вопросу уделяется значительное внимание в связи с поиском эффективных штаммов этого вида с целью использования их для повышения продуктивности сельскохозяйственных культур (Кириченко, Коць, 2011). Имеются сведения о том, что некоторые штаммы А. сhroococcum способны вступать в симбиотические отношения с пшеницей мягкой (Triticum aestivum L.) (Кириченко, 2016). Однако подобные данные для штаммов А. сhroococcum почв Нижегородской области являются фрагментарными, в том числе и для выделенного нами из почвы сельскохозяйственных угодий Нижегородского региона штамма № 4. Известно, что бактерии рода Azotobacter образуют ассоциации с пектинолитическими и целлюлозоразрушающими бактериями рода Bacillus, потребляя продукты разложения полимеров бациллами, снабжая их фиксированным азотом, что приводит к ускорению усвоения полимеров и стимуляции азотфиксации (Феоктистова и др., 2016). В связи с этим при изучении способности А. сhroococcum непосредственно воздействовать на состояние растений более объективные данные можно получить в условиях эксперимента при культивировании растений на питательном растворе, поскольку таким образом можно вычленить взаимодействие в системе «растение – А. сhroococcum» в чистом виде, т. е. без участия других видов почвенных бактерий.
В связи с этим нами впервые была оценена способность штамма № 4 А. сhroococcum, выделенного из почвы сельскохозяйственных угодий Нижегородской области (Россия), влиять на всхожесть семян и состояние проростков пшеницы (Triticum aestivum L.) при внесении в первый день эксперимента в питательный раствор различных количеств клеток в широком диапазоне значений (от 109 кл/мл (А) до А/256).
Материалы
Штамм № 4 А. сhroococcum был выделен из почвы пахотных земель возле с. Оранки Богородского района Нижегородской области. А. сhroococcum культивировали на жидкой питательной среде Эшби. В эксперименте использовали семена озимой пшеницы Московская 39.
Методы
Для исследования были выбраны 9 концентраций бактериальных клеток от 109 кл/мл (А) до значений, на несколько порядков меньших (А/256) (соседние концентрации различались в 2 раза), поскольку наибольшие исследованные нами концентрации клеток А. chroococcum используют для инокуляции семян пшеницы другими штаммами этого вида (Кириченко, 2016). Растения выращивали в течение 8 дней на питательном растворе Кнопа с разным содержанием клеток А. chroococcum (опытные группы) или растворе Кнопа (контрольная группа). В чашки опытных групп раствор Кнопа с добавлением А. chroococcum вносили только в первый день эксперимента. Далее каждый день добавляли раствор Кнопа во все чашки (контрольные и опытные) без клеток азотфиксатора. Семена пшеницы, раствор Кнопа и чашки Петри не стерилизовали, для того чтобы определить, оказывает ли данный штамм влияние на изучаемые показатели пшеницы в нестерильных условиях, т. к. на практике обработка семян сельскохозяйственных культур различными штаммами А. chroococcum проводится перед посевом в почву, что исключает условия стерильности. В каждой группе растения выращивали в 5 чашках Петри (50 семян в каждой чашке) на подложке из фильтровальной бумаги, смоченной раствором, при 17 ч световом периоде и температуре 17–22 °С.
У семидневных проростков в первом листе определяли интенсивность перекисного окисления липидов (ПОЛ), уровень хлорофиллов и каротиноидов, а также сырую биомассу корневой системы и побега, всхожесть семян. При изучении биохимических показателей в каждой группе было 10 биологических повторностей (1 биологическая повторность – объединенные фрагменты первого листа 5–6 разных растений данной группы; брали по 2 биологические повторности из каждой чашки). Биомассу корневой системы и побега определяли у 30 растений каждой группы (брали по 6 растений из каждой чашки; 6 растений х 5 чашек = 30). Интенсивность ПОЛ оценивали по содержанию ТБК-активных продуктов липопероксидации, среди которых наиболее массовым является малоновый диальдегид (МДА) (Камышников, 2002). Содержание хлорофиллов и каротиноидов в листе определяли согласно общепринятой методике, для экстрагирования пигментов использовали 80 % ацетон (Шлык, 1971).
Соответствие распределения в выборках изученных количественных признаков нормальному определяли с помощью критерия Шапиро – Уилка (программа Statistica 10). Поскольку в некоторых выборках распределение отличалось от нормального (p < 0.05), то для проверки нулевой гипотезы были использованы непараметрические критерии Крускала – Уоллиса и Ньюмена – Кейлса (программа Биостатистика 4.03). Аналогичную процедуру для качественного признака (всхожесть семян) проводили с помощью критерия хи-квадрат (Биостатистика 4.03) с учетом поправки Бонферрони для множественных парных сравнений. На графиках представлены выборочные медианы и их ошибки (количественные признаки), а также доли и их ошибки (всхожесть семян).
Результаты
Все концентрации изученного штамма A. chroococcum, за исключением наименьшей, приводили к снижению всхожести семян T. aestivum на 14–30 % по сравнению с контролем (p < 0.05) (рис. 1).
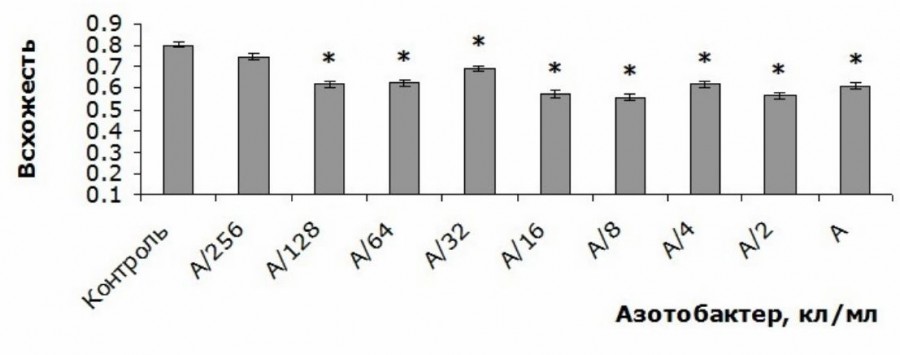
Рис. 1. Всхожесть семян T. aestivum при внесении различных количеств клеток A. chroococcum в питательный раствор в первый день эксперимента (доля ± ошибка доли): * – статистически значимые различия по сравнению с данным показателем в контрольной группе при p < 0.05; А – 109 кл/мл
Fig. 1. T. aestivum seed germination when adding different amounts of A. chroococcum cells to nutrient solution in the first day of the experiment (share ± share error): * – indicates statistically significant differences compared to this endicator in the control group at p < 0.05; А – 109 c/ml
При этом статистически значимые различия между эффектами разных концентраций не были выявлены (p > 0.05).
Низкие концентрации A. chroococcum (A/256-A/64) не влияли на массу корневой системы (рис. 2а). Концентрации A/16-A/32 увеличивали данный показатель на 34–38 % относительно контрольного уровня. Однако дальнейшее повышении концентрации до А/8 приводило к исчезновению эффекта. Наиболее высокие концентрации A. chroococcum A/4-A вновь увеличивали массу корня проростков T. aestivum (на 50–68 % относительно контроля) (см. рис. 2а).
Динамика изменения биомассы побега T. aestivum при уменьшении концентрации A. chroococcum была очень сходна с изменением данного показателя у корневой системы, о чем свидетельствует сильная положительная корреляция между этими параметрами (по Спирмену: r = 0.86; p < 0.05). Однако стимулирующий эффект был менее выражен, поэтому его удалось зафиксировать только для концентраций А/2 и А/4. Они приводили к увеличению биомассы побега на 21 и 30 % по сравнению с контролем соответственно. Более низкие концентрации и наиболее высокая из изученных концентраций не влияли на данный показатель (рис. 2б).
Интенсивность перекисного окисления липидов в листе проростков пшеницы при действии всех изученных концентраций A. chroococcum не отличалась от контрольного уровня (p > 0.05) (данные на рисунках не представлены). Содержание хлорофиллов и каротиноидов у растений всех опытных групп соответствовало контрольному уровню (p > 0.05) (данные на рисунках не представлены).
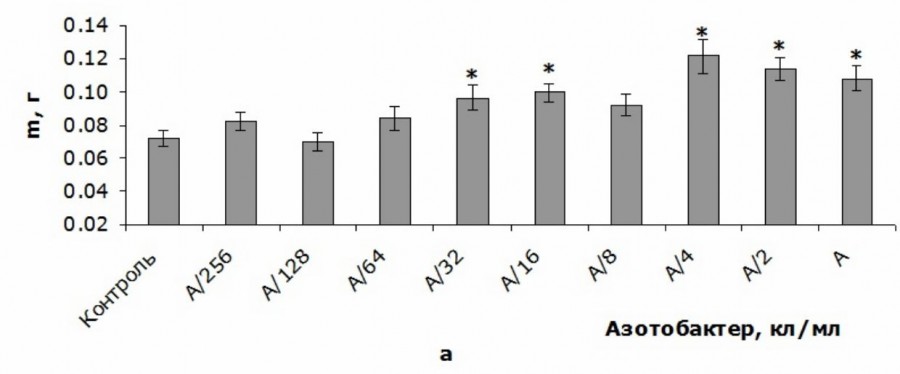
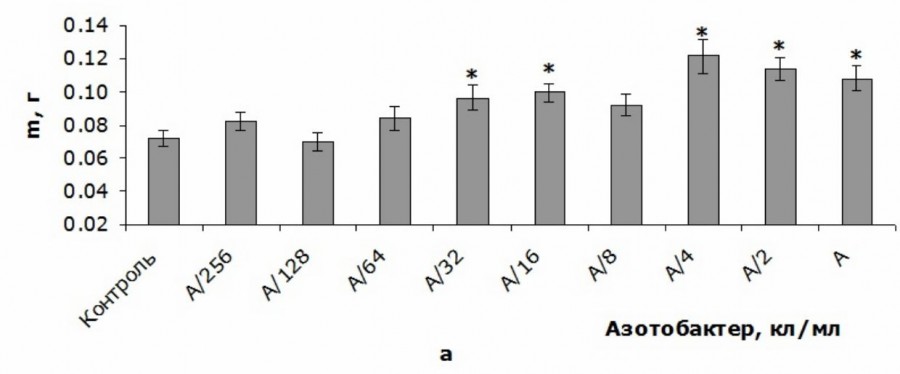
Рис. 2. Сырая биомасса корневой системы (а) и побега (б) T. aestivum при внесении различных количеств клеток A. chroococcum в питательный раствор в первый день эксперимента (Me ± SMe): * – статистически значимые различия по сравнению с данным показателем в контрольной группе при p < 0.05; А – 109 кл/мл
Fig. 2. Raw biomass of root system (a) and shoot (b) of T. aestivum with adding of different amounts of A. chroococcum cells to nutrient solution in the first day of the experiment (Me ± SMe): * – indicates statistically significant differences compared to this indicator in the control group at p < 0.05; А – 109 c/ml
Обсуждение
Ранее другими авторами показано, что бактерии рода Azotobacter способны стимулировать рост корневой системы и побега растений (Феокстистова и др., 2016). Полагают, что ризобактерии, в том числе рода Azotobacter, оказывают такой эффект путем синтеза фитогормонов, стимулирующих рост (ауксинов, цитокининов, гиббереллинов) и улучшения азотного и фосфорного питания растений (Феоктистова и др., 2016). Возможно, данный механизм лежит и в основе обнаруженного нами стимулирующего эффекта бактерий в отношении роста пшеницы.
Известно, что в сухом семени в большом количестве находится фитогормон индолил-3-уксусная кислота, которая в высокой концентрации вместе с абсцизовой кислотой семян ингибирует прорастание (Нефедьев и др., 2013). Бактерии рода Azotobacter способны синтезировать ауксины, в том числе индолил-3-уксусную кислоту (Феоктистова и др., 2016). Скорее всего, выявленный нами ингибирующий эффект азотфиксирующих бактерий в отношении прорастания семян пшеницы обусловлен действием вырабатываемых ими ауксинов.
Следует отметить, что изменение биомассы побега и корневой системы, выявленное нами у проростков T. aestivum при внесении в питательный раствор различных концентрации клеток A. chroococcum, было немонотонным, поскольку наибольшая из исследованных концентраций не влияла на биомассу побега, затем данный эффект появлялся у концентраций А/2-А/4 и исчезал у более низких количеств бактериальных клеток. Биомасса корневой системы также претерпевала немонотонное изменение при снижении концентрации клеток A. chroococcum: концентрации А-А/4 увеличивали биомассу, А/8 не влияла, А/16-А/32 увеличивали, А/64-А/256 не влияли (см. рис. 2).
В последние годы широкое распространение получили взгляды о том, что у биосистем широко представлены немонотонные ответы при действии разных факторов среды (Calabrese, Blain, 2005). Так, например, ранее нами установлено, что различные химические загрязнители могут достаточно часто приводить к немонотонным изменениям морфологических и физиолого-биохимических показателей у разных видов растений (Erofeeva, 2014). Подобные данные имеются и для фитогормонов растений, в том числе ауксинов. Показано, что они могут вызывать разнонаправленный эффект либо не оказывать его, в результате чего зависимость «доза – эффект» является немонотонной (Weyers, Paterson, 2001; Calabrese, Blain, 2005).
Известно, что любые стрессовые факторы среды вызывают увеличение продукции активных форм кислорода, что приводит к усилению процесса перекисного окисления в мембранах клеток (Камышников, 2002). На основании наших данных можно сделать вывод, что использованные концентрации A. chroococcum не вызывали стрессового состояния у проростков пшеницы.
Заключение
На основе вышесказанного можно заключить, что изученный штамм A. chroococcum способен непосредственно влиять на всхожесть семян и состояние проростков T. aestivum. Однако его способность изменять изученные показатели T. aestivum зависит от количества клеток азотфиксатора, внесенных в питательный раствор, а также от вида показателя. Так, A. chroococcum во всех изученных концентрациях не влиял на биохимические параметры (интенсивность перекисного окисления липидов и содержание хлорофиллов и каротиноидов в листе), снижал всхожесть семян и приводил к увеличению биомассы проростков. При этом изменение концентрации клеток A. chroococcum, вносимых в питательный раствор, вызывало немонотонный ответ для сырой биомассы побега и корневой системы T. aestivum. По-видимому, эффекты в отношении всхожести и биомассы преимущественно связаны с воздействием ауксинов, синтезируемых азотфиксатором, поскольку данные фитогормоны способны стимулировать рост и тормозить процесс прорастания. Кроме того, известно, что зависимость «доза – эффект» для ауксинов может быть немонотонной. Результаты исследования могут послужить основой для развития представлений о специфике биотических отношений между изученными видами, а также совершенствования методов предпосевной обработки семян T. aestivum.
Библиография
Камышников В. С. Справочник по клинико-биохимической лабораторной диагностике . Минск: Беларусь, 2002. Т. 2. 495 с.
Кириченко Е. В. Биологическая активность ризосферной почвы пшеницы яровой в ассоциации с бактериями Azotobacter chroococcum Т79, модифицированными N-ацетил-D-глюкозамином // Мiкробiологiя i бiотехнологiя. 2016. № 3. С. 30–42.
Кириченко Е. В., Коць С. Я. Использование Аzotobacter chroococcum для создания комплексных биологических препаратов // Биотехнологiя. 2011. Т. 4. № 3. С. 74–81.
Кириченко Е., Титова Л., Коць С. Эффективность бактеризации семян пшеницы яровой новым штаммом Аzotobacter chroococcum T76 // Stiinta Agricola. 2010. № 1. С. 21–24.
Нефедьева Е. Э., Белопухов С. Л., Верхотуров В. В., Лысак В. И. Роль фитогормонов в регуляции прорастания семян // Известия вузов. Прикладная биохимия и биотехнология. 2013. № 1. С. 61–65.
Феоктистова Н. В., Марданова А. М., Хадиева Г. Ф., Шарипова М. Р. Ризосферные бактерии // Ученые записки Казанского университета. Сер. Естественные науки. 2016. Т. 158. Кн. 2. С. 207–224.
Шлык А. А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев // Биохимические методы в физиологии растений. М.: Наука, 1971. С. 154–170.
Сalabrese E. J., Blain R. B. The occurrence of hormetic dose responses in the toxicological literature, the hormesis database: an overview // Toxicology and Applied Pharmacology. 2005. Vol. 202. P. 1451–1474.
Erofeeva E. A. Hormesis and paradoxical effects of wheat seedling (Triticum aestivum L.) parameters upon exposure to different pollutants in a wide range of doses // Dose Response. 2014. Vol. 12. No 1. P. 121–135.
Howard J. B., Rees D. C. How many metals does it take to fix N2? A mechanistic overview of biological nitrogen fixation // Proceedings of the National Academy of Sciences of the United States of America. 2006. Vol. 103. No 46. P. 17088–17093.
Wani S. A., Chand S., Ali T. Potential use of Azotobacter chroococcum in crop production // Current Agriculture Research Journal. 2013. Vol. 1. No 1. P. 35–38.
Weyers J. D., Paterson N. W. Plant hormones and the control of physiological processes // New Phytol. 2001. Vol. 152. P. 375–407.






 © 2011 - 2026
© 2011 - 2026