Введение
Основная функция пероксидазы – защитная: окисление химических соединений за счет кислорода перекиси с образованием промежуточных комплексов, обладающих различными спектральными характеристиками (Андреева, 1988; Анджана, 2007; Айзенштадт, Боголицын, 2009).
Исследователи неоднократно отмечали появление окрашивания при действии системы пероксидазы на некоторые амины и фенолы, однако обычно они рассматривали эти реакции лишь как качественные пробы на пероксидазу и не пытались определить природу продуктов.
Подчеркнем, что к настоящему времени набор классов субстратов для пероксидаз довольно ограничен и структура продуктов реакций выявлена лишь для небольшого числа случаев (Газарян, 2006). Поэтому в данной статье мы попытались с помощью метода электронной спектроскопии расширить круг соединений, с которыми могут взаимодействовать подобные ферменты, и предложить новые субстраты, пригодные для разработки удобных аналитических методов определения активности пероксидаз. Одновременно с этим мы выяснили, с какими субстратами осуществляются наиболее быстрые видимые изменения в электронных спектрах для исследования в дальнейшем механизмов реакций и разработки «зеленых» методов препаративных синтезов продуктов реакций.
Материалы
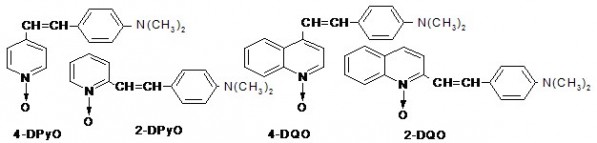
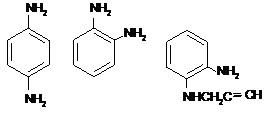
Исследования выполнены с использованием стирильных диметиламинопроизводных N-оксидов пиридинов и хинолинов 4-DPyO, 2-DPyO, 4-DQO, 2-DQO (Андреев, Соболев, 2015), фенолов с различным числом и положением метильных групп, 3-аминофенолом, орто- (о-ФДА) и пара- (п-ФДА) фенилендиаминами, пара-метокси- и пара-нитроанилинами, а также такими их ацетиленовыми аналогами, как N-пропаргил- (о-ПФДА) и N,N’-дипропаргил- (о-ДПФДА) орто-фенилендиаминами, пара-метилпропаргиланилином (п-МПА) и пара-метоксидипропаргиланилином (п-МДПА).
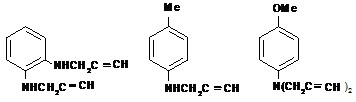
п-ФДА о-ФДА о-ПФДА о-ДПФДА п-МПА п-МДПА
Ацетиленовые амины синтезировали, как описано в работах (Андреев и др., 1979; Андреев и др., 2014), гетероароматические N-оксиды – в работе (Андреев и др., 2011). Эксперименты с растениями выполнены в июне – августе 2014 г. Активность препарата пероксидазы хрена фирмы «Диа-М» (удельная активность 100 ед./мг) имела RZ = 1.4 (RZ – отношение A403/A280, характеризующее процент включения гемина в апо-пероксидазу). В опытах с коммерческим препаратом пероксидазы хрена конечные концентрации веществ в 2.04 мл пробы составляли: 2·10-5 М 4-DPyO, фенолов или анилинов, 0.002% (5.88·10-4 моль/л) Н2О2 и 0.03 мкг/мл (7.41·10-10 моль/л) пероксидазы хрена.
Растительный материал (100 мг) растирали в ступке с 5 мл фосфатного буфера pH 7.2–7.4. Полученную массу переносили в мерную колбу на 50 мл, разбавляли буфером и через 15 минут фильтровали (ссылка 16). При определении активности пероксидаз из тканей растительного материала реакционная смесь (2.04 мл) содержала: 0.2 мл фильтрата, 40 мкл 0.3 % Н2О2, 3·10-6 М раствор 4-DPyO или 2·10-5 М раствор 2,6-диметилфенола в фосфатном буфере.
Методы
Активность пероксидаз тканей растений рассчитывали спектрофотометрически на основании результатов 2–3 параллельных опытов по формуле (ссылка 16):
А = D' · N / m · l,
где D' – скорость изменения оптической плотности (ед. опт. плотности/мин) (при 384 нм для 4-DPyO и при 420 нм для 2,6-диметилфенола),
N – разведение (10),
m – сырая масса навески [г].
Электронные спектры снимали в кварцевых кюветах толщиной 1 см на приборе СФ 2000-02 против буферного раствора.
Результаты
Нами показано, что в электронных спектрах поглощения (ЭСП) 4-DPyO в процессе реакции с пероксидазой хрена исчезает полоса поглощения около 384 нм и появляется новая при 260 нм (рис. 1а). Для сравнения на рис. 1б приведено изменение ЭСП 4-DPyO при взаимодействии с пероксидазами экстракта плода редьки.
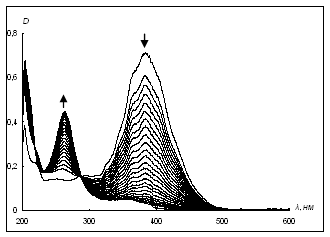
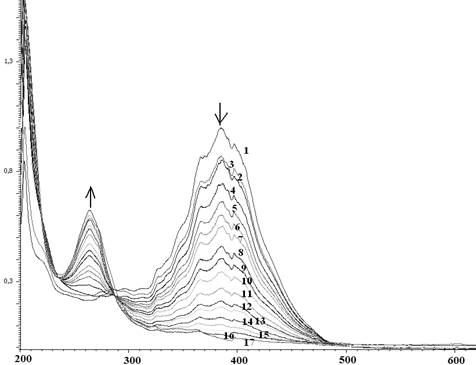
Рис. 1. Изменение ЭСП реакционной смеси, содержащей перекись водорода а) 4-DPyO (20 мкМ) и пероксидазу хрена, в течение 1 часа и б) 4-DPyO (3 мкМ) и экстракт корня редьки – в течение 1.5 часа (с экстрактом листьев маранты беложильчатой реакция заканчивается в течение 8 мин)
Fig 1. Change of the electronic spectra of the reaction mixture containing hydrogen peroxide a) 4-DPyO (20 µm) and horseradish peroxidase for 1 hour and б) 4-DPyO (25 µm) and the extract of radish root for 1.5 hours (with the extract of Maranta leuconeura leaves the reaction ends within 8 min)
Обычно при определении пероксидазной активности в качестве субстратов используют гваякол или бензидин. Отметим (Андреев и др., 2011), что в этих случаях можно наблюдать только, как накапливаются продукты реакции (ди-, три-, тетра- (и т. д.) меры гваякола) либо расходуется субстрат (бензидин). При применении 4-DPyO (рис. 1) наличие изобестической точки указывает на то, что идет лишь одна реакция с количественным превращением субстрата в какое-то соединение, природа которого пока неизвестна. Ввиду того, что в данном случае скорость реакции можно оценивать методом ЭСП как по исчезновению исходного соединения с низкой (3–20 мкмоль) концентрацией, так и по накоплению продукта реакции, мы рекомендуем использовать 4-DPyO как очень удобный стандартный субстрат при определении пероксидазной активности.
В случае 2-DPyO, 4-DQO и 2-DQO изменения в ЭСП в общем похожи на те, что происходят с 4-DPyO, но с последним соединением реакция заканчивается лишь за 1–2 дня. С незамещенными же стерильными аналогами (N-оксиды 4-стирилпиридина, 2- и 4-стирилхинолина), а также содержащими метокси- или нитрогруппы (N-оксиды 4-(4-метоксистирил)пиридина, 2-(2,4-диметоксистирил)- и 4-(4-нитростирил)хинолина) пероксидаза хрена реагирует очень медленно либо никак (Андреев и др., 2011).
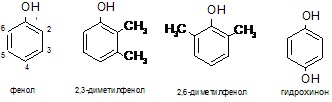
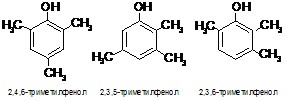
С такими субстратами, как 2,4,6-, 2,3,5- и 2,3,6-триметилфенол, в течение 10 часов отмечаются очень слабые изменения в электронных спектрах реакционной смеси, лишь через сутки немного возрастает интенсивность максимума при 270 нм. На наш взгляд, препятствием реакции являются стерические факторы со стороны метильных групп, не позволяющие образующимся радикалам участвовать в цепной полимеризации с образованием лигниноподобных веществ.
В случае 2,3- и 3,4-диметилфенолов в течение суток довольно быстро увеличивается интенсивность максимумов при 270 нм, но затем она начинает падать (рис. 2а), в то время как в длинноволновой области наблюдается постоянное увеличение интенсивности «хвоста», имеющего тонкую структуру.
На рис. 2–8 цифрами 1 и 2 отмечены соответственно кривые поглощения растворов субстрата и его смеси с пероксидазами в фосфатном буферном растворе (pH 7.2–7.4).
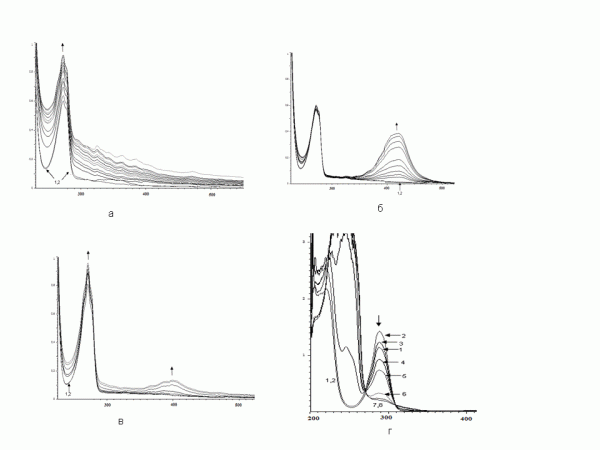
Рис. 2. Изменение ЭСП реакционной смеси (зависимость D от λ), содержащей пероксидазу хрена и (а) 2,3-диметилфенол (4.5 часа), (б) 2,6-диметилфенол (2.5 часа), (в) фенол (1 час), (г) гидрохинон (1 час)
Fig 2. Change of the electronic spectra of the reaction mixture (the dependence of D -λ) containing horseradish peroxidase and (a) 2,3-dimethylphenol (4.5 hours); (б) 2,6-dimethylphenol (2.5 hours), (в) phenol (1 hour), (г), hydroquinone (1 hour)
Поведение 2,6-диметилфенола (рис. 2б; при использовании экстракта листьев маранты беложильчатой вид ЭСП такой же, но реакция проходит в течение 3–4 часов) является принципиально иным – слабое изменение интенсивности пика при 270 нм и сильное увеличение при 420 нм. Этот субстрат также может быть использован в качестве стандартного при определении пероксидазной активности. Незамещенный фенол вступает в реакцию подобным же образом, но гораздо медленнее (в течение 1 часа в ЭСП происходят небольшие по сравнению с 2,6-диметилфенолом изменения; рис. 2в). Различие в реакционной способности этих двух субстратов может быть обусловлено тем, что в 2,6-диметилфеноле по сравнению с незамещенным фенолом имеются две электронодонорные алкильные группы, хотя наиболее реакционно способное пара-положение является пространственно доступным в них в одинаковой степени.
Двухатомный фенол гидрохинон (рис. 2г) показывает более сложное изменение электронных спектров, что показано с помощью цифр. При добавлении к субстрату (кривая 1) пероксидазы хрена возрастает оптическая плотность раствора при 288 нм (образование ферментсубстратного комплекса (кривая 2)), но она со временем постепенно уменьшается в присутствии перекиси водорода (кривые 3–8). Однако при 246 нм, наоборот, происходит увеличение интенсивности поглощения света. Гидрохинон – единственное соединение в рассматриваемом ряду, которое может легко окисляться до хинона, и, по-видимому, изменения спектров связаны с подобным превращением.
При использовании в качестве субстрата орто-фенилендиамина в ЭСП реакционной смеси в течение 1.5 часа наблюдается увеличение интенсивности поглощения света при 259 нм и 410 нм и уменьшение при 210 нм (рис. 3). 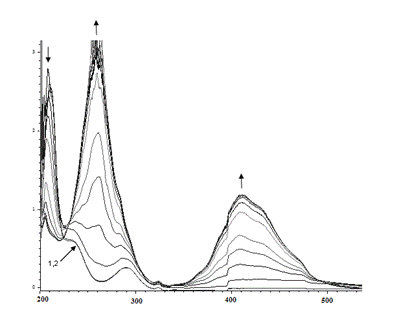
Рис. 3. Изменение ЭСП реакционной смеси (зависимость D от λ), содержащей орто-фенилендиамин, пероксидазу хрена и перекись водорода в течение 1.5 часа
Fig 3. Change of the electronic spectra of the reaction mixture (the dependence of D-λ) containing ortho-phenylendiamine, horseradish peroxidase and hydrogen peroxide for 1.5 hours
Согласно литературным данным (Кирейко и др., 2006), конечным продуктом окисления о-ФДА является 2,3-диаминофеназин, окрашенный в желто-оранжевый цвет:
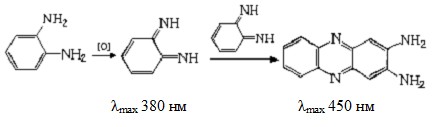
При недостатке субстрата – окислителя H2O2 (соотношение концентраций восстановителя и окислителя 10:1) в спектре поглощения продуктов реакции вначале проявляется максимум, соответствующий промежуточному продукту окисления о-ФДА при 380 нм, который со временем переходит в максимум основного продукта (Кирейко и др., 2006).
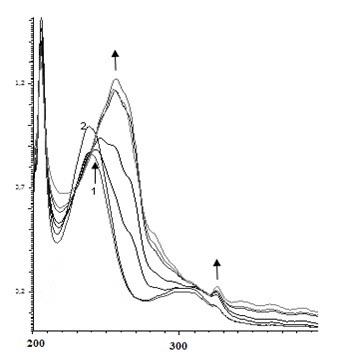
В случае реакции с пара-фенилендиамином (рис. 4, с = 2·10-5 М) реакция идет иначе: в течение первых 23 минут увеличивается оптическая плотность раствора при 256 нм и 324 нм (в присутствии перекиси водорода наблюдается батохромный сдвиг полос поглощения о-фенилендиамина). Затем интенсивность первого пика начинает уменьшаться, указывая на то, что с первоначально образующимся продуктом реакции начинают происходить какие-то дальнейшие превращения. При этом появляется новая полоса поглощения при 280 нм.
а б
Рис. 4. Изменение ЭСП реакционной смеси, содержащей пара-фенилендиамин (с = 2·10-5 М), пероксидазу хрена и перекись водорода в течение а) первых 23 мин; б) от 23 мин до 4 часов
Fig 4. Change of the electronic spectra of the reaction mixture (the dependence of D -λ) containing ortho-phenylendiamine (с = 2·10-5 М) , horseradish peroxidase and hydrogen peroxide a) for the first 23 minutes; б) from 23 min to 4 hours
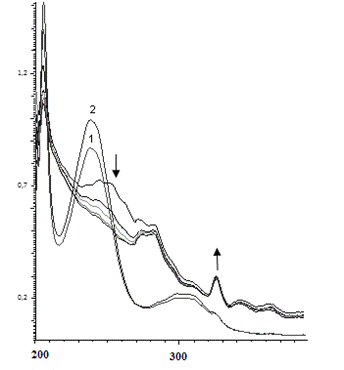
При более низкой концентрации субстрата и фермента (рис. 5, с = 7·10-6 M) наблюдается несколько иная картина: в течение 1.5 часа происходит уменьшение оптической плотности при 257 нм, а на следующий день при комнатной температуре появляется пик при 313 нм, который на третий день смещается до 327 нм.
а б
Рис. 5. Изменение ЭСП реакционной смеси, содержащей пара-фенилендиамин (с = 7·10-6 М), пероксидазу хрена и перекись водорода в течение а) первых 1.5 часа; б) от 1.5 часа до 3 суток
Fig 5. Change of the electronic spectra of the reaction mixture (the dependence of D -λ) containing ortho-phenylendiamine (с = 2·10-5 М), horseradish peroxidase and hydrogen peroxide a) for the first 1.5 hours; б) from 1.5 hours to 3 days
Таким образом, взаимное положение аминогрупп в бензольном кольце, по-видимому, не только определяет скорость, но и направление реакции с участием пероксидазы хрена.
Мы не нашли литературных данных, касающихся структуры конечных продуктов превращения пара-фенилендиамина, и в дальнейшем предполагаем выделить их и исследовать различными физико-химическими методами.
Далее мы изучили изменения ЭСП реакционных смесей, содержащих моно- или дипропаргил-орто-фенилендиамина.
При взаимодействии N-пропаргил-орто-фенилендиамина с пероксидазой хрена и перекисью водорода в течение 2.5 часа происходит увеличение пиков при 273 нм и 468 нм (рис. 6).
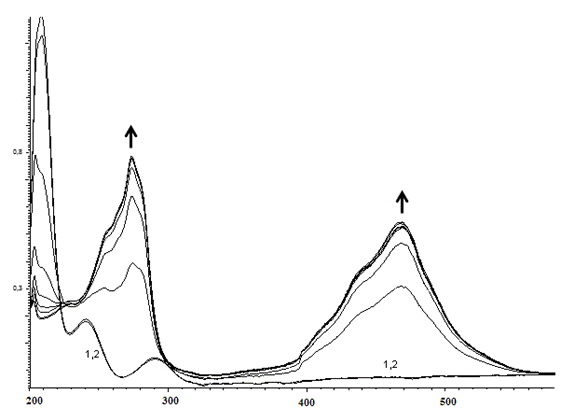
Рис. 6. Изменение ЭСП реакционной смеси, содержащей N-пропаргил-орто-фенилендиамин, пероксидазу хрена и перекись водорода, в течение 2.5 часа
Fig 6. Change of the electronic spectra of the reaction mixture (the dependence of D-λ) containing N-propargyl-ortho-phenylendiamine, horseradish peroxidase and hydrogen peroxide for 2.5 hours
В ЭСП реакционной смеси, содержащей N,N’-дипропаргил-орто-фенилендиамин (рис. 7), в течение 2.5 часа наблюдается увеличение оптической плотности при 290 нм и 476 нм. В течение следующих суток при комнатной температуре никаких видимых изменений не происходит.
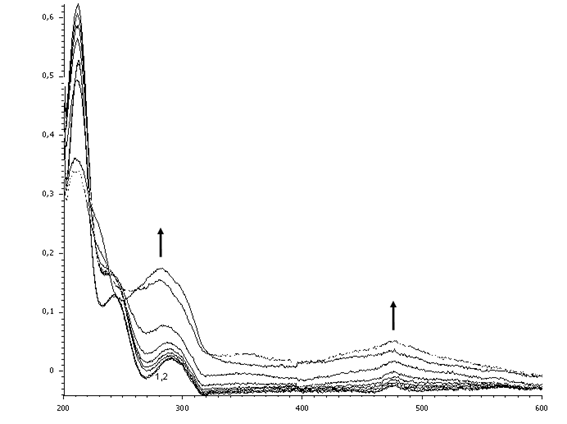
Рис. 7. Изменение ЭСП реакционной смеси, содержащей N,N’-дипропаргил-орто-фенилендиамин, пероксидазу хрена и перекись водорода, в течение 2.5 часа
Fig 7. Change of the electronic spectra of the reaction mixture (the dependence of D -λ) containing N,N’-dipropargyl-ortho-phenylendiamine, horseradish peroxidase and hydrogen peroxide for 2.5 hours
В ЭСП реакционных смесей, содержащих в качестве субстратов пара-метилпропаргиланилин или пара-метоксидипропаргиланилин, реакция идет очень медленно и через 15 минут прекращается.
Следует отметить, что во время реакции пероксидазы хрена с анилинами, не содержащими тройных связей, такими как 3-аминофенол (рис. 8а, увеличение интенсивности полосы поглощения при 286 нм) и пара-нитроанилин (рис. 8б, уменьшение оптической плотности при 382 нм), изменения в ЭСП осуществляются несколько быстрее.

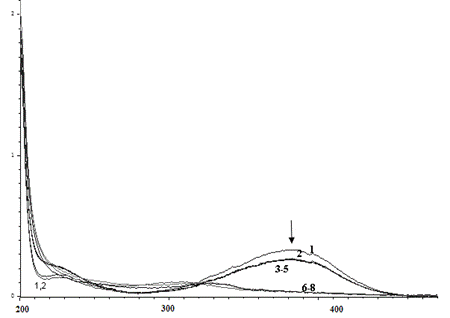
Рис. 8. Изменение ЭСП реакционной смеси, содержащей пероксидазу хрена, перекись водорода и (а) 3-аминофенол (10 дней) или (б) пара-нитроанилин (сутки)
Fig 8. Change of the electronic spectra of the reaction mixture (the dependence of D-λ) containing horseradish peroxidase, hydrogen peroxide and (a) 3-aminophenol (10 days) or (б) para-nitroaniline (1 day)
Ввиду того, что мы предлагаем 4-DPyO и 2,6-диметилфенол использовать в качестве стандартных субстратов при определении пероксидазной активности, мы сравнили методом электронной спектроскопии скорость реакции этих соединений с пероксидазами, присутствующими в экстракте из листьев маранты беложильчатой (Maranta leuconeura). Оказалось, что активность пероксидаз в данном случае (таблица) по отношению к 4-DPyO (38.8 (ед. опт. плотности/мин/г (сырой ткани)) является максимальной в ряду исследованных нами растений и даже значительно выше, чем у классически используемого для этих целей хрена (корень – 6.40, листья – 6.48). Однако с 2,6-диметилфенолом пероксидазы из листьев этого растения реагируют в 15 раз медленнее (2.3 (ед. опт. плотности/мин/г (сырой ткани)).
Таблица. Активность пероксидаз растений по отношению к 4-DPyO в фосфатном буфере pH 7.2–7.4 при комнатной температуре, А (ед. опт. плотности/мин/г (сырой ткани))
| Растение | активность (А) |
| листья маранты беложильчатой (Maranta leuconeura) | 38.8 |
| листья хрена (Armoracia rusticana) | 6.48 |
| корень хрена (Armoracia rusticana) | 6.40 |
| плод редьки (Raphanus sativus) | 4.17 |
| плоды редиса (Raphanus sativus L. Var radicula) | 2.59 |
| корень ромашки пахучей (Matricaria discoidea) | 1.07 |
| листья лопуха (Arctium lappa) | 0.61 |
| листья ромашки пахучей (Matricaria discoidea) | 0.60 |
| листья редиса (Raphanus sativus L. Var radicula) | 0.39 |
| листья щавеля кислого (Rumex acetosa (L)) | 0.39 |
| стебель ромашки пахучей (Matricaria discoidea) | 0.33 |
| плод огурца (Cucumis sativus) | 0.17 |
| плоды картофеля (Solanum tuberosum) | 0.15 |
| стебель трехреберника пахучего (Tripleurospermum inodorum) | 0.14 |
| листья крапивы двудомной (Urtica dioica) | 0.11 |
| цветы одуванчика лекарственного (Taraxacum officinale) | 0.10 |
| листья одуванчика лекарственного (Taraxacum officinale) | 0.10 |
Наименьшей активностью по отношению к 4-DPyO (см. таблицу) обладают пероксидазы цветов одуванчика и листьев крапивы (0.1–0.11 (ед. опт. плотности/мин/г (сырой ткани)).
Обсуждение
К сожалению, в отличие от органической химии, в которой пути окисления фенолов и анилинов разнообразными окислителями очень подробно исследованы, в биохимии структура продуктов их окисления во многих случаях не известна; обычно изучается лишь скорость исчезновения реагента.
Особый интерес представляют оксидоредуктазные ферменты, из которых лакказа и пероксидаза являются наиболее доступными (Куприянович, 2009; Рогожин, 2004). Субстратная специфичность этих ферментов позволяет вовлекать в реакции окисления широкий ряд соединений, включая 2,4-замещенные дифенолы, аминофенолы, ароматические амины, полифенолы и полиамины. При этом для ряда анилинов и фенолов были проведены кинетические исследования (Dunford, Aderian, 1986; Rodriguez-Lopez et al., 2000; Sakurada et al., 1990) и показано, что скорость реакции описывается корреляционными уравнениями типа уравнения Гаммета (Андреев, Соболев, 2012; Андреев, Соболев, 2015).
На основании выполненного нами к настоящему времени эксперимента можно сделать вывод о том, что скорость и направление реакции окисления субстратов пероксидазами зависит от их класса (гетероароматический N-оксид, фенол или анилин) и определяется числом атомов водорода при аминогруппе, донорно-акцепторными свойствами заместителей в бензольном кольце анилина или фенола и взаимным расположением амино- и гидроксильных групп. Выявлены соединения, с которыми реакции идут достаточно быстро.
По-видимому, направление реакции в фосфатном буфере pH 7.2–7.4 не зависит от природы растения и типа его частей, но ее скорость может изменяться до 40 раз (см. таблицу).
Заключение
В результате исследования обнаружены новые типы превращений гетероароматических N-оксидов, анилинов и фенолов под действием растительных пероксидаз. Продукты превращений могут быть получены экологически безопасными методами (с использованием растительных ферментов). N-Оксид 4-(4'-диметиламиностирил)пиридина и 2,6-диметилфенол (с экстрактом листьев маранты беложильчатой реакция идет в 15 раз медленнее) предлагаются нами в качестве удобных субстратов при определении пероксидазной активности в фосфатном буфере в диапазоне pH 7.2–7.4.
Библиография
Айзенштадт М. А., Боголицын К. Г. Пероксидазное окисление лигнина и его модельных соединений // Химия растительного сырья. 2009. № 2. С. 5–18.
Анджана Г. Изоформы пероксидаз и кодирующие их РНК в листьях подсолнечника после заражения // Физиология растений. 2007. Т. 54. № 4. С. 579–583.
Андреев В. П., Ремизова Л. А., Утсаль О. Г., Фаворская И. А. Пропаргилирование первичных и вторичных аминов // Журнал органической химии. 1979. Т. 15. Вып. 3. С. 467–471.
Андреев В. П., Соболев П. С., Зайцев Д. О., Галибина Н. С., Зыкина Н. С., Плясунова Л. Ю., Романова М. И. Взаимодействие Zn-ТФП, бромистого пропаргила и пероксидазы хрена с анилинами // Ученые записки Петрозаводского государственного университета. 2011. № 6. C. 7–15.
Андреев В. П., Соболев П. С. Количественные корреляции, связывающие взаимодействие Zn(II)-тетрафенилпорфина и пероксидазы хрена с аминами // Биоорганическая химия. 2012. Т. 38. № 2. С. 242–250.
Андреев В. П., Соболев П. С., Зайцев Д. О., Визер С. А., Ержанов К. Б., Тафеенко В. А. Нуклеофильность N-пропаргиланилинов в процессах координации с Zn-тетрапорфирином в хлороформе // Журнал общей химии. 2014. Т. 84. № 8. С. 1378–1387.
Андреев В. П., Соболев П. С. Молекулярные комплексы металлопорфиринов как модельная система исследования донорно-акцепторных взаимодействий n,v-типа . Петрозаводск: Издательство ПетрГУ, 2015. 355 с.
Андреева В. А. Фермент пероксидаза: участие в защитном механизме растений . М.: Наука, 1988. 128 с.
Газарян Г. Особенности структуры и механизма действия пероксидаз растений // Биоорганическая химия. 2006. Т. 32. № 1. С. 80–86.
Куприянович Ю. Н. Ферменткатализируемое окисление замещенных фенолов: автореф. дис. … канд. хим. наук . Иркутск, 2009. 18 с.
Определение активности пероксидазы. URL: https://docviewer.yandex.ru/url=http%3A%2F%2Fplantphys.bio.msu.ru%2Feducation%2Frespiration.doc&name=respiration.doc&lang=ru&c=5830a05f8ee5 (дата обращения 19.11.2016).
Рогожин В. В. Пероксидаза как компонент антиоксидантной системы живых организмов . СПб.: ГИОРД, 2004. 240 с.
Dunford H. B., Aderian A. J. Hammett ρσ correlation for reactions of horseradish peroxidase compound II with phenols // Arch. Biochem. Biophys. 1986. Vol. 251. P. 536–542.
Rodriguez-Lopez J. N., Gilabert M. A., Tudela J., Thorneley R. N. F., Garcia-Canovas F. Reactivity of horseradish peroxidase compound II toward for a two-step mechanism // Biochem. 2000. Vol. 39. P. 13201–13209.
Sakurada J., Sekiguchi R., Sato K., Hosoya T. Kinetic and molecular orbital studies on the rate of oxidation of monosubstituted phenols and anilines by horseradish peroxidase compound II // Biochem. 1990. Vol. 29. P. 4093–4098.






 © 2011 - 2026
© 2011 - 2026