Введение
В окружающую среду постоянно поступают и циркулируют в ней вещества, искусственно синтезированные человеком и, следовательно, не свойственные природе. В загрязненных экосистемах происходит поглощение этих веществ и продуктов их деструкции различными организмами. Особенно опасно включение ксенобиотиков в круговорот веществ в агроценозах, т. к. это может приводить к накоплению вредных соединений в товарных частях сельскохозяйственных культур. В литературе многократно обсуждались негативные последствия для организма человека и животных загрязнения продуктов питания и кормов пестицидами, продуктами разложения химического оружия, деструкции полимеров и другими веществами, связанными с антропогенными факторами (Донченко, Надыкта, 2001; Клюев, 2000).
Как правило, для веществ, вредный эффект воздействия которых на человека доказан, вводят предельно допустимые концентрации (ПДК). Кроме того, создана система оценки степени токсичности поллютантов, включающая биотестирование и биоиндикацию с использованием организмов различной систематической принадлежности (Биологический мониторинг…, 2011).
Однако существует достаточно большой круг соединений, не проходящих через биомониторинговые испытания. Априори подобные соединения признаются безвредными. В частности, до последнего времени к таким безопасным соединениям относились отходы производства фторполимеров.
В жизнь современного человека широко вошли изделия, произведенные из фторполимеров. Они используются в машиностроении, электронике и радиотехнике, для хранения и транспортировки химически активных веществ. Так, например, фторкаучук СКФ-26 используют для изготовления резинотехнических, кабельных и других изделий (ГОСТ 18376-79). Одним из наиболее массовых отходов производства данных фторполимеров являются маточные растворы (МР), попадающие в окружающую среду вместе со сточными водами химических предприятий. В них содержится от 0,02 до 0,05 % целевого продукта и более низкомолекулярных веществ, включая инициирующие и другие группы и побочные продукты. До настоящего времени для этих соединений ПДК не установлены, т. к. их считают практически безопасными. В настоящее время отсутствуют работы по влиянию отходов производства СКФ-26 на биоту, которые можно было бы рассматривать как биоиндикационные испытания.
Цель данной работы – определение степени токсичности маточных растворов СКФ-26 в различных концентрациях по отношению к тест-организму цианобактерии Nostoc paludosum Kütz. и почвенной микрофлоре.
Материалы
Испытанию на токсичность подвергали один из отходов производства фторкаучука СКФ-26 МР СКФ-26 (МР и продукты его разведения 1:1, 1:50 и 1:100), попадающий в водоисточники, находящиеся в зоне водозабора г. Кирова.
На первом этапе работы объектом исследования была альгологически чистая культура ЦБ N. Paludosum штамм 18 из коллекции фототрофных микроорганизмов кафедры биологии растений, селекции и семеноводства, микробиологии Вятской ГСХА, которую использовали как тест-культуру в рамках определения степени влияния снижающихся концентраций МР СКФ-26 на жизнеспособность клеток.
На втором этапе работы для изучения биоиндикационных возможностей альго-циано-микологических комплексов при действии снижающихся концентраций СКФ-26 в модельных лабораторных опытах использовали образцы полевой дерново-подзолистой почвы.
Третий этап нашей работы был связан с изучением влияния снижающихся концентраций СКФ-26 на состояние почвенной микрофлоры в полевом опыте.
Полевой опыт был заложен в конце мая 2012 г. в Даровском районе Кировской области. Почва – дерново-подзолистая супесчаная, pHKCl не превышает 4.4. Содержание гумуса не выше 2 %. Предварительно участок был вскопан на глубину 25 см и выровнен. В подготовленную почву внесли снижающиеся концентрации СКФ-26 (МР и его разведения 1:1, 1:50, 1:100). В контроле для полива использовали артезианскую воду.
Методы
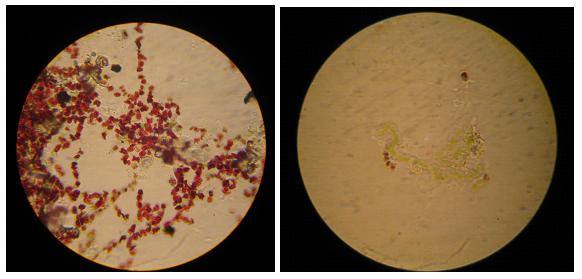
При тестировании токсичности различных концентраций МР СКФ-26 определяли жизнеспособность клеток ЦБ тетразольно-топографическим методом. Суть метода состоит в дифференциации живых и погибших клеток по наличию в живых клетках кристаллов формазана красного цвета, который образуется из бесцветного 2,3,5-трифенилтетразолий хлорида (ТТХ) в результате дегидрогеназной активности живых клеток (рис. 1). Соотношение живых и мертвых клеток определяется при микроскопировании мазков, приготовленных из культуры ЦБ, которую сначала выдерживали в тестируемом веществе, а затем помещали в раствор ТТХ (Домрачева и др., 2011).
Рис. 1. Живые (с кристаллами формазана) и мертвые клетки цианобактерий
Fig. 1. Living ( with formazan crystals) and dead cells of cyanobacteria
При проведении модельных лабораторных опытов почву высушивали, растирали в ступке до однородного состояния, готовили навески по 50 г, которые помещали в стерильные чашки Петри и увлажняли до 60 % от полной влагоемкости испытуемыми концентрациями МР СКФ-26. В контрольном варианте использовали артезианскую воду. После увлажнения почвы на гладко выровненную поверхность раскладывали покровные стекла, на которых впоследствии проводили микроскопический количественный учет клеток водорослей и цианобактерий. Время экспозиции – 3 месяца.
Состояние альго-циано-микологических комплексов в полевых опытах оценивали через сутки после внесения снижающихся концентраций СКФ-26, через 7, 30 и 90 суток с момента закладки опыта. Для этого отбирались почвенные образцы с глубины 0–5 см. После приготовления средней пробы готовили мазки, на которых методом прямого микроскопического учета подсчитывали численность клеток водорослей, цианобактерий (Домрачева, 2005) и длину мицелия (Полянская, 1996) с раздельным учетом пигментированных и бесцветных фрагментов мицелия.
Результаты
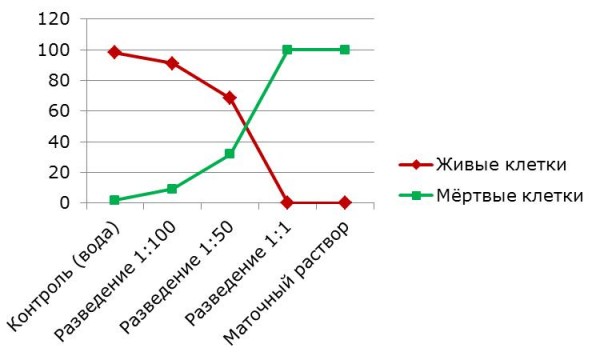
При воздействии снижающихся концентраций СКФ-26 на клетки N. paludosum было установлено, что все они в той или иной степени являются токсичными. МР СКФ-26 и его концентрация 1:1 вызвали 100 %-ную гибель клеток ЦБ (рис. 2). В то же время СКФ-26 в разведении 1:100 приводил к несущественному снижению численности живых клеток, т. е. в подобной концентрации в водной среде соединение можно признать мало токсичным для используемого тест-организма.
Действие любых соединений на организмы в такой гетерогенной системе, как почва, значительно отличается от воздействия на организмы в водной среде. При изучении реакции микрофлоры на внесение в почву МР СКФ-26 в модельных опытах было установлено, что во всех вариантах развиваются зеленые и диатомовые водоросли (табл. 1). При этом все концентрации МР СКФ-26 стимулируют размножение зеленых водорослей более чем в 3 раза. Наиболее ярко выраженный эффект отмечается при максимальном разведении СКФ-26 (1:100). Для диатомовых водорослей пик размножения выявлен в варианте с разведением 1:50 (почти в 3 раза по сравнению с контролем). Кроме водорослей, в почвах постоянно присутствуют прокариотные фототрофные организмы – цианобактерии, развитие которых в ходе аутогенной сукцессии, как правило, идет в последовательности: безгетероцистные формы → гетероцистные формы, размножением которых характеризуется климаксная стадия в сезонном ходе альго-цианобактериальной сукцессии. Безгетероцистные цианобактерии развиваются во всех вариантах. Как и в случае водорослей, все концентрации МР СКФ-26 приводят к ускоренному размножению этой группы организмов. Максимум развития безгетероцистные цианобактерии достигли при разведении 1:100.
Рис. 2. Влияние МР СКФ-26 на жизнеспособность клеток цианобактерии Nostoc paludosum (%)
Fig. 2. Effect of MR SKF-26 on the cell viability of cyanobacteria Nostoc paludosum (%)
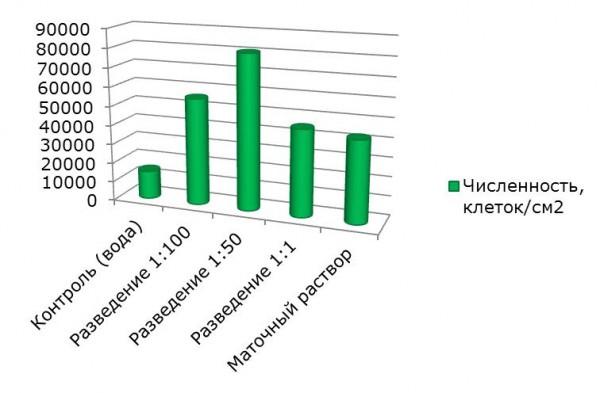
Известно, что внесение некоторых соединений в почву ускоряет ход аутогенных сукцессий микроорганизмов, что, например, сопровождается более ранним появлением в фототрофных комплексах азотфиксирующих ЦБ (Помелов и др., 2012). Подобное явление наблюдается и при действии МР СКФ-26 на цианобактериальный комплекс. Так, разведение 1:50 провоцирует размножение азотфиксирующих цианобактерий. Именно эта группа организмов стала причиной появления пика численности альго-цианофлоры в варианте с разведением МР СКФ-26 1:50 (табл. 1, рис. 3).
Таблица 1. Влияние различных концентраций МР СКФ-26 на количественные показатели почвенной альгофлоры
| Концентрация СКФ-26 | Водоросли (клеток/см2) | Цианобактерии (клеток/см2) | ||
| Зеленые | Диатомовые | Безгетероцистные | Гетероцистные | |
| Контроль (вода) | 14245 ± 975 | 37.5 ± 1.25 | 400 ± 10 | – |
| Разведение 1:100 | 54600 ± 3075 | 37.5 ± 1.25 | 1050 ± 35 | – |
| Разведение 1:50 | 46200 ± 2675 | 100 ± 0 | 875 ± 35 | 33200 ± 110 |
| Разведение 1:1 | 44375 ± 10500 | 46 ± 1.75 | 737 ± 50 | – |
| Маточный раствор | 41925 ± 5250 | 50 ± 0 | 575 ± 17,5 | – |
Примечание. «–» – цианобактерии не обнаружены.
Рис. 3. Влияние МР СКФ-26 на численность почвенной альгофлоры, клеток/см2
Fig. 3. Effect of MR SKF-26 on the number of soil algal flora, cells/cm2
Следовательно, МР СКФ-26 выступает как стимулятор размножения почвенной альгофлоры и инициатор ускоренного протекания альго-цианобактериальной сукцессии. МР СКФ-26 в разведении 1:50 создает оптимальные условия для развития почвенных водорослей и цианобактерий и ускоряет ход аутогенной сукцессии в модельных опытах.
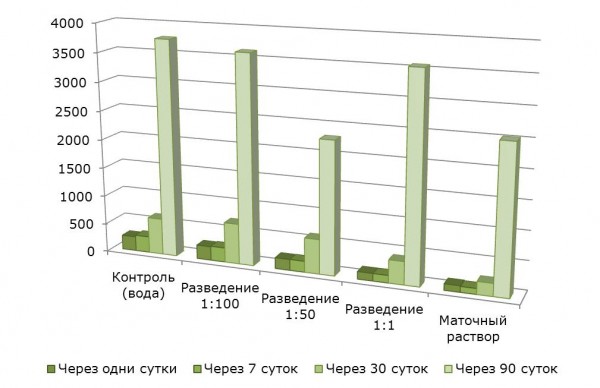
При изучении влияния снижающихся концентраций МР СКФ-26 на динамику численности почвенных водорослей в полевом опыте установлено, что это соединение по-разному действует на развитие микрофототрофов (рис. 4). Через сутки после внесения МР СКФ-26 во всех вариантах, кроме варианта с разведением МР СКФ-26 1:100, отмечено снижение численности водорослевых клеток. В варианте с разведением МР СКФ-26 1:1 и в варианте с внесением МР данный показатель снижается в 2 раза по сравнению с контролем. Через сутки в варианте с разведением СКФ-26 1:100 численность альгофлоры осталась на уровне контроля (250 тыс. кл./г почвы). Через 7 суток численность водорослей во всех вариантах практически не изменилась. Через 30 суток наблюдался рост численности фототрофных популяций во всех вариантах, особенно выраженный при внесении в почву МР СКФ-26 в разведении 1:100 (в 2 раза по сравнению с первым сроком наблюдения).
Рис. 4. Влияние МР CКФ-26 на динамику численности фототрофных организмов, тыс. клеток/г почвы
Fig. 4. Effect of MR SKF-26 on the dynamics of phototrophic organisms population, thousand cells/g soil
Эта же тенденция неуклонного роста численности клеток почвенных альгоценозов сохраняется и через 90 суток с момента закладки опыта. Увеличение численности фототрофных популяций в ходе сезонной сукцессии в почве обусловлено тем, что через 30 и 90 суток к группировкам эукариотных водорослей последовательно присоединяются группировки прокариотов – безгетероцистные и гетероцистные цианобактерии. Однако ни в одном варианте с применением МР СКФ-26 не был достигнут уровень развития водорослей, характерный для контроля.
Изучение группового состава почвенных фототрофов показало, что на завершающих этапах сезонной сукцессии (через 90 суток) решающую роль играют прокариотные фототрофы (цианобактерии), которые вносят основной вклад в количественные параметры альго-цианобактериальных комплексов (табл. 2). При этом безгетероцистные формы интенсивно развиваются во всех вариантах, а гетероцистные формы (азотфиксаторы) обнаружены только в контроле и в варианте с разведением 1:100. Следовательно, достаточно высокие концентрации МР СКФ-26 1:50, 1:1 и сам МР, не оказывая существенного влияния на общую численность популяций в альгоценозе, выбивают из структуры популяций важнейшую для почвенного плодородия группу – азотфиксирующие цианобактерии.
Таблица 2. Влияние различных концентраций МР CКФ-26 на численность
фототрофов через 90 суток с момента закладки опыта (тыс. клеток/г почвы)
| Вариант | Водоросли | Цианобактерии | Фототрофов (всего) | ||
| БГЦ | ГЦ | Всего | |||
| Контроль | 830 ± 25 | 2200 ± 36 | 730 ± 100 | 2930 ± 136 | 3760 ± 161 |
| Разведение 1:100 | 1060 ± 200 | 1930 ± 50 | 630 ± 150 | 2560 ± 200 | 3620 ± 400 |
| Разведение 1:50 | 830 ± 33 | 1470 ± 60 | – | 1470 ± 60 | 2300 ± 93 |
| Разведение 1:1 | 1230 ± 185 | 2330 ± 50 | – | 2330 ± 50 | 3560 ± 235 |
| Маточный раствор | 560 ± 20 | 1967 ± 150 | – | 1967 ± 150 | 2520 ± 170 |
Примечание. БГЦ – безгетероцистные цианобактерии; ГЦ – гетероцистные цианобактерии; «–» – цианобактерии не обнаружены.
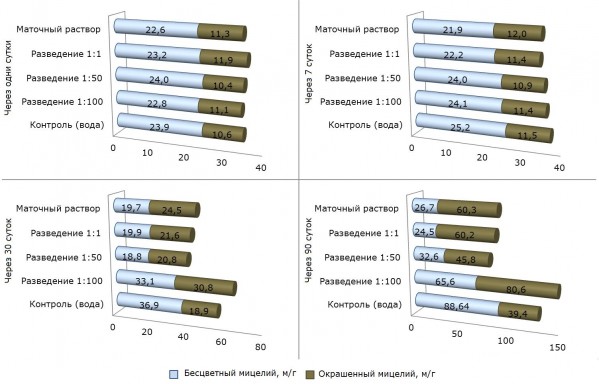
При изучении влияния различных доз МР СКФ-26 на динамику роста длины мицелия почвенных микромицетов установлено, что их введение по-разному действует на развитие микофлоры в почве (рис. 5).
Рис. 5. Влияние МР CКФ-26 на динамику роста длины мицелия почвенных микромицетов, м/г
Fig. 5. Effect of MR SKF-26 on the dynamics of the growth of mycelium length of soil micromycetes, m/g
Через одни и 7 суток после внесения МР СКФ-26 ни в одном из вариантов не было отмечено существенного изменения длины мицелия грибов. Через 30 суток наблюдался рост мицелия в длину во всех вариантах, особенно выраженный при внесении в почву МР СКФ-26 в разведении 1:100 (почти в 2 раза по сравнению с первым сроком наблюдения).
Эта же тенденция неуклонного роста длины мицелия почвенных грибов сохраняется и через 90 суток с момента закладки опыта. Только начиная с разведения 1:50 происходит не такой усиленный рост мицелия в длину. Рост длины мицелия к концу вегетационного периода, как правило, связан с увеличением запасов в почве доступного органического вещества в виде корневого и листового опада. Даже к моменту снятия опыта этот показатель не достигает уровня контроля. МР СКФ-26 в разведении 1:100 можно признать стимулятором роста длины грибного мицелия.
Изучение структуры популяций микромицетов по соотношению особей с бесцветным и меланизированным мицелием показывает, что в первый срок наблюдения во всех вариантах преобладающей группировкой являются микромицеты с бесцветным мицелием (табл. 3).
Только к 30-м суткам опыта начиная с разведения МР СКФ-26 1:50 доля грибов с окрашенным мицелием увеличивается в среднем до 53 %.
Через 90 суток наблюдается бесспорное доминирование окрашенных форм микромицетов по мере возрастания концентраций МР СКФ-26, что достоверно указывает на возрастание экологической напряженности в почве, т. к. одним из биоиндикационных признаков оценки состояния почвы является соотношение в структуре популяций грибов бесцветных и окрашенных форм. Подобные же реакции почвенных грибов отмечены на действие таких поллютантов, как тяжелые металлы, пестициды, нефть и нефтепродукты, радионуклиды и др. (Терехова, 2005). Следовательно, меланизация микоценозов под влиянием МР СКФ-26 явно указывает на начинающийся токсикоз почвы.
Таблица 3. Структура популяций микромицетов в почве с внесением МР СКФ-26 (%)
| Концентрация СКФ-26 | Через одни сутки | Через 7 суток | Через 30 суток | Через 90 суток | ||||
| Б | О | Б | О | Б | О | Б | О | |
| Контроль (вода) | 69.3 | 30.7 | 68.7 | 31.3 | 66.1 | 33.9 | 69.2 | 30.8 |
| Разведение 1:100 | 67.3 | 32.7 | 67.9 | 32.1 | 51.8 | 48.2 | 44.9 | 55.1 |
| Разведение 1:50 | 69.8 | 30.2 | 68.8 | 31.2 | 47.5 | 52.5 | 41.6 | 58.4 |
| Разведение 1:1 | 66.1 | 33.9 | 66.1 | 33.9 | 48.0 | 52.0 | 28.9 | 71.1 |
| Маточный раствор | 66.7 | 33.3 | 64.6 | 35.4 | 44.6 | 55.4 | 30.7 | 69.3 |
Примечание. Б – бесцветный мицелий, О – окрашенный мицелий.
Обсуждение
Серия проведенных лабораторных и полевых опытов по изучению влияния МР СКФ-26 на водоросли, ЦБ и грибы показала, что МР активно влияет на развитие этих групп микроорганизмов. Особенно четко угнетающее действие МР СКФ-26 проявляется в водной среде. Так, при использовании в качестве тест-организма ЦБ N. paludosum был установлен репрессивный эффект вплоть до полной гибели клеток при экспозиции ЦБ в МР СКФ-26 и при разведении 1:1. 30 %-ная гибель клеток наблюдалась и при разведении 1:50. Следовательно, сброс в водоемы МР СКФ-26 или его малых разведений потенциально опасен для обитателей водоема.
Модельные опыты с малым количеством почвы в непроточной системе (чашки Петри) в ходе 30-суточного опыта, напротив, показали, что МР СКФ-26 во всех концентрациях не только стимулирует размножение почвенных микрофототрофов, но ускоряет протекание альго-цианобактериальной сукцессии. В первую очередь, это проявляется в развитии группировки гетероцистных ЦБ, которые, как правило, завершают естественный цикл сезонных сукцессий и являются климаксной стадией в развитии почвенных альгоценозов. Размножение азотфиксирующих цианопрокариот провоцирует МР СКФ-26 в разведении 1:50.
В полевых опытах на развитие почвенной микрофлоры всегда действует множество факторов одновременно, и испытуемый агент также подвергается деструктивным процессам со стороны почвенной микробиоты. Изучение динамики численности фототрофных микроорганизмов показало, что этот процесс во всех вариантах носит сходный характер: практически не меняется численность фототрофных популяций через 1 и 7 суток после внесения в почву МР СКФ-26, незначительно возрастает численность клеток этих организмов через 30 суток и наблюдается стремительный скачок этого показателя через 90 суток. Поскольку вектор развития альгоценозов одинаков во всех вариантах, то это можно объяснить комплексом климатических и агрохимических свойств почвы. Однако размножение азотфиксирующих ЦБ зафиксировано только в контроле и при разведении МР СКФ-26 1:100. Следовательно, в отличие от замкнутой системы, высокие концентрации МР СКФ-26 замедляют протекание сезонных альгосукцессий.
Изучение состояния грибных популяций показывает, что внесение МР СКФ-26 в почву в начальный период (1–7 суток) не сказывается на соотношении форм микромицетов с бесцветным и окрашенным мицелием. Однако с течением времени увеличивается степень токсического влияния различных концентраций МР, что приводит к резкому возрастанию в структуре микоценозов грибов с окрашенным мицелием (63.9 % при внесении в почву маточного раствора через 90 суток после внесения против 30.8 % в контроле). Данный факт может указывать на то, что продукты превращения МР СКФ-26 в почве после 3-месячной экспозиции могут быть гораздо токсичнее самого соединения.
Заключение
Проведенные исследования показывают, что отходы производства фторкаучука СКФ-26 не являются безопасными или нейтральными для таких групп почвенных микроорганизмов, как водоросли, ЦБ и микромицеты. Особенно ярко по губительному воздействию на тест-организм N. paludosum токсичность высоких концентраций МР СКФ-26 проявляется в водной среде.
Полевые опыты подтвердили токсичность не только самих МР, но и возможных продуктов их превращений, что четко иллюстрирует изменение структуры микоценозов, в которых происходит прогрессирующее нарастание популяций с меланизированным мицелием.
Библиография
Биологический мониторинг природно-техногенных систем / Под общ. ред. Т. Я. Ашихминой, Н. М. Алалыкиной. Сыктывкар: Коми научный центр УрО РАН, 2011. 388 с.
ГОСТ 18376-79 Фторкаучуки СКФ-26 и СКФ-32. Технические условия .
Домрачева Л. И. «Цветение» почвы и закономерности его развития . Сыктывкар, 2005. 336 с.
Домрачева Л. И., Кондакова Л. В., Огородникова С. Ю., Олькова А. С., Фокина А. И. Применение тетразольно-топографического метода определения дегидрогеназной активности цианобактерий в загрязненных средах // Биологический мониторинг природно-техногенных систем. Сыктывкар, 2011. С. 113–120.
Донченко Л. В., Надыкта В. Д. Безопасность пищевой продукции . М.: Пищепромиздат, 2001. 525 с.
Клюев Н. А. Эколого-аналитический контроль стойких органических загрязнений в окружающей среде . М.: Джеймс, 2000. 48 с.
Полянская Л. М. Микробная сукцессия в почве : Автореф. дис. … д-ра биол. наук. М., 1996. 96 с.
Помелов А. В., Березин Г. И., Домрачева Л. И. Адаптационные резервы высшего растения и почвенной альгофлоры к действию пестицидов // Теоретическая и прикладная экология. 2011. № 3. С. 87–93.
Терехова В. А. Микромицеты в экологической оценке водных и наземных экосистем . М.: Наука, 2007. 215 с.






 © 2011 - 2026
© 2011 - 2026