Введение
Деятельность многих промышленных предприятий приводит к поступлению в почву опасных химических веществ, в т. ч. радиоактивных, которые могут негативно влиять на живые организмы (Maboeta et al., 2018; Orekhova, 2020; Geras'kin et al., 2021). Неопределенность оценки экологического состояния природно-техногенных систем усиливается сочетанным действием комплекса абиотических факторов разной природы, интенсивности и продолжительности. Дождевые черви составляют значительную часть биомассы почвенной макрофауны и являются важнейшим компонентом сообществ многих наземных экосистем. Поэтому виды рода Eisenia используют как биоиндикаторы экологического состояния почв (Česynaitė et al., 2021; Vullo et al., 2023) или в лабораторных тест-системах для оценки токсичности химических веществ (OECD, 1984, 2016). Биомаркеры воздействия могут быть измерены как в тканях дождевых червей, так и в клетках-мишенях ‒ целомоцитах животных, подвергшихся влиянию токсических агентов. Изменение параметров нормального функционирования целомоцитов, их жизнеспособности и соотношения субпопуляций этой гетерогенной группы клеток приводит к изменениям в иммунном ответе дождевых червей и может служить показателем общего стрессового воздействия (Höckner et al., 2020). Показано, что повышенные концентрации тяжелых металлов в среде нарушают стабильность лизосомальных мембран в целомоцитах дождевых червей (Maboeta et al., 2018). Эти изменения, оцениваемые по уменьшению концентрации удерживаемого клетками красителя нейтрального красного (НК), служат количественным критерием цитотоксичности действующих агентов. При изучении реакции дождевых червей на действие загрязнителей наряду с анализом накопления НК также используют такие простые и информативные параметры, как индекс целомоцитов организма (СI), абсолютный (ATI) и относительный (RTI) трофические индексы (Curieses et al., 2018). Эти характеристики позволяют оценить плотность суспензии целомических клеток относительно морфометрических показателей особей и частоту встречаемости основных субпопуляций целомоцитов.
Добыча и переработка полезных ископаемых является одним из источников загрязнения биосферы тяжелыми металлами и радиоактивными изотопами природного происхождения. Выявление нарушений в отдельных структурах и системах организма при загрязнении почвы химическими веществами позволяет на раннем этапе воздействия оценить состояние среды и степень токсичности агентов. Целью нашего исследования являлось изучение влияния металл(оид)ов (ТМ) и радионуклидов (РН) при их совместном присутствии в почве на жизнеспособность целомоцитов дождевых червей Eisenia fetida после острого и хронического воздействия в течение 7 и 56 дней соответственно.
Материалы
Сбор образцов почвы и приготовление почвенных субстратов
Образцы загрязненной почвы собирали летом 2021 года из верхнего 20-сантиметрового слоя на одном из участков территории, загрязненной в результате работы предприятия по добыче и производству радия (Республика Коми, пос. Водный) (Maystrenko, Rybak, 2023). Перед отбором проб поверхность почвы расчищали от растительности, опавших листьев и остатков древесины. В лаборатории почву высушивали и просеивали через сито с ячейками 1 мм. В качестве контроля и для приготовления почвенных субстратов с более низкими, чем в загрязненной почве, концентрациями металлов и радионуклидов использовали искусственную OECD почву, содержащую 10 % торфа, 20 % каолиновой глины и 70 % кварцевого песка (OECD, 1984). Сухие компоненты загрязненной и OECD почвы смешивали в различных соотношениях, субстраты увлажняли, помещали в пластиковые контейнеры и выдерживали двое суток перед инкубацией животных. Содержание загрязненной РН и ТМ почвы в составе почвенных субстратов К, С5, С10, С25 и С50 составляло 0, 5, 10, 25 и 50 % (по массе сухого вещества). Химический анализ репрезентативных образцов загрязненной почвы и компонентов OECD почвы выполнен в испытательных лабораториях «Экоаналит» и миграции радионуклидов и радиохимии ФИЦ Коми НЦ УрО РАН. Удельные активности радионуклидов 226Ra и 238U определяли радиохимическими методами, рН ‒ потенциометрически, концентрации органического вещества (OM) и ТМ ‒ методами газовой хроматографии на элементном анализаторе и атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой соответственно.
Дождевые черви и экспериментальный дизайн (схема эксперимента)
Половозрелых дождевых червей E. fetida массой около 300 мг, выращенных в почвенно-растительном субстрате при температуре 22‒24 °C в течение нескольких месяцев, извлекали из маточной лабораторной культуры и помещали в тестируемые субстраты. Животных содержали в контейнерах размером 14 × 9 × 10 см (по 10 особей на контейнер) при температуре 21 ± 2 °C, световом периоде день / ночь 16/8 ч и постоянной влажности почвенной среды. Рацион червей составляли сухие овощи. Дождевых червей экспонировали 7 или 56 дней в 5 или только в 4 (исключая С50) образцах почвенных субстратов соответственно. Использовали по две повторности на каждый вариант эксперимента. Всего в опытах использовано 180 особей.
Методы
Экструзия целомической жидкости
Перед экструзией дождевых червей (6–8 особей на вариант) промывали в воде, взвешивали, помещали в чашки Петри на влажную фильтровальную бумагу и выдерживали двое суток для очистки кишечника. Целомоциты собирали с использованием неинвазивного метода экструзии, описанного Eyambe et al. (1991), с некоторыми модификациями. Для этого каждого червя помещали в 500 мкл PBS буфера (5 % этанол, 0.25 % ЭДТА) и инкубировали в течение 2 мин. Суспензию, содержащую экструдированные клетки, центрифугировали при 500 g в течение 7 мин при 4 °C. После удаления супернатанта осадок ресуспендировали в 500 мкл PBS. Плотность суспензии клеток подсчитывали с помощью счетной камеры Горяева.
Характеристика клеток целомической жидкости и трофические индексы
Выделенную суспензию клеток наносили на поверхность сетки камеры Горяева и с помощью светового микроскопа «Биолам-Л» (Россия) с цифровой камерой МС-12 (ООО «ЛОМО-МА») подсчитывали число амебоцитов и элеоцитов в соответствии с характеристиками клеток согласно описанию (Adamowicz, 2005; Kurek et al., 2007). Долю клеток в каждой субпопуляции определяли как соотношение числа амебоцитов или элеоцитов к общему числу целомоцитов в 1 мл жидкости.
Индекс целомоцитов (CI), отражающий плотность суспензии выделенных клеток относительно морфологических характеристик организма, абсолютный (ATI) и относительный (RTI) трофические индексы рассчитывали согласно (Curieses et al., 2016, 2018) по формулам: CI = log10(Cn/m), ATI = En/Cn и RTI = ATI/m, где En и Cn ‒ среднее число элеоцитов и целомоцитов в 1 мл суспензии целомической жидкости червя соответственно; m ‒ масса червя без содержимого кишечника. В предварительных экспериментах при экспонировании особей в загрязненной и OECD почве в течение 48 ч не выявили статистически значимых отличий значений этих показателей, поэтому указанные параметры оценивали только для дождевых червей после 56 дней воздействия субстратов.
Анализ накопления нейтрального красного
Для оценки стабильности лизосомальных мембран использовали анализ поглощения нейтрального красного целомоцитами дождевых червей после воздействия почвенных субстратов в течение 7 или 56 дней. Накопление красителя целомоцитами определяли спектрофотометрически в соответствии с (Irizar et al., 2015) с небольшими модификациями. Для этого по 200 мкл клеточной суспензии, содержащей 1×105 клеток / ячейку, помещали в 96-луночный планшет по две повторности на червя. Суспензию выдерживали в течение 1 часа при комнатной температуре в темноте для адгезии клеток к стенкам лунки. После удаления неприкрепившихся клеток в ячейки добавляли по 200 мкл свежеприготовленного 0.05 % раствора НК в PBS и инкубировали в течение 1 часа. После двукратного промывания клеток раствором PBS в лунки добавляли экстракционный раствор (50 % этанола, 1 % уксусной кислоты) и выдерживали 20 мин для экстракции красителя из клеточных лизосом. Оптическую плотность измеряли на планшетном мультимодальном ридере CLARIOstar Plus (BMG Labtech, Германия) при длине волны 540 нм.
Статистическая обработка результатов
Статистическая обработка данных выполнена на основе методов описательной статистики и непараметрических Н-критерия Краскела – Уоллиса и U-критерия Манна – Уитни для независимых выборок с использованием пакетов программ MS Excel 2016 и GraphPad Prism 8. Для корректировки результатов множественных сравнений применяли поправку Бонферрони.
Результаты
Химический анализ субстратов
Основные химические характеристики компонентов почвенных субстратов, использованных для эксперимента, представлены в табл. 1.
Для разных вариантов эксперимента рН почвенных субстратов варьировал от 6.02 до 6.29, что позволяло инкубировать дождевых червей. Содержание органического вещества в загрязненной почве соответствовало диапазону значений, типичных для таежных почв (Атлас…, 2010). В спектре изученных токсикантов концентрации 226Ra, 238U, As и Pb были наиболее высокими, превышая на два-три порядка фоновые значения для данного района.
Таблица 1. Основные характеристики компонентов почвенных субстратов
| Параметр | Загрязненная почва*
(M ± S) |
Почва OECD | ||
| Торф | Глина | Песок | ||
| pH (КСl) | 5.92 ± 0.17 | 5.04 | 7.52 | 6.84 |
| OM, % | 6.7 ± 0.6 | > 15.0 | < 0.17 | < 0.17 |
| Cu, мг/кг | 558 ± 13 | 2.7 | 7.4 | 0.32 |
| Pb, мг/кг | 3750 ± 100 | 4.0 | 5.8 | 0.47 |
| Cd, мг/кг | 51.0 ± 2.5 | 0.14 | 0.15 | < 0.1 |
| Ni, мг/кг | 218 ± 5 | 1.5 | 6.2 | 0.29 |
| Cr, мг/кг | 24 ± 5 | 1.8 | 19 | 0.90 |
| As, мг/кг | 1065 ± 70 | 0.48 | 0.7 | 0.13 |
| Mn, мг/кг | 493 ± 15 | 40 | 26 | < 3.0 |
| 226Ra, Бк/кг | 89000 ± 9000 | 6.7 | 20.8 | 3 |
| 238U, мг/кг | 170 ± 20 | 0.3 | 0.7 | < 0.1 |
Примечание. * ‒ приведено среднее ± стандартное отклонение (n = 4).
Субпопуляции целомоцитов
Среднее значение индекса целомоцитов CI, рассчитанное для дождевых червей после 56 дней инкубации, составило от 5.41 до 6.18 (рис. 1). Статистически значимых различий между значениями показателя для животных, экспонированных в субстратах с разным содержанием ТМ и РН, не найдено.
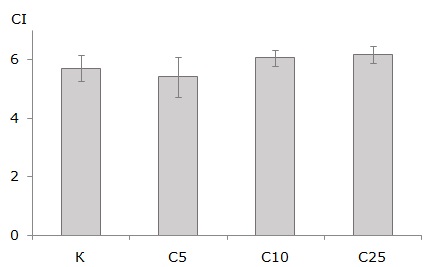
Рис. 1. Индексы целомоцитов CI для дождевых червей E. fetida, инкубированных в течение 56 дней в: К ‒ OECD почве; С5, С10 и С25 ‒ субстратах, содержащих 5, 10 и 25 % загрязненной почвы соответственно. Показаны средние значения и планки погрешностей для стандартного отклонения
Fig. 1. Coelomocyte indexes CI for E. fetida earthworms incubated during 56 days in: К – OECD soil; С5, С10 and С25 – substrates containing 5, 10 and 25 % contaminated soil, respectively. The mean values with error bars for standard deviation are shown
С использованием световой микроскопии в целомической жидкости E. fetida выявлено две основные субпопуляции иммунокомпетентных клеток – амебоциты и элеоциты. Наибольшую долю амебоцитов в суспензии регистрировали для животных после хронического воздействия OECD почвы (рис. 2А). Анализ соотношений субпопуляций целомоцитов E. fetida показал небольшое снижение по сравнению с соответствующим значением для OECD почвы доли амебоцитов и увеличению доли элеоцитов у дождевых червей после 56 дней инкубации в субстрате С25 с максимальным содержанием в составе радиоактивной почвы. Однако эти различия между вариантами эксперимента не были статистически значимыми.
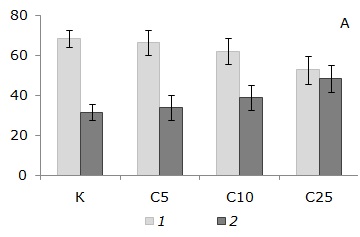
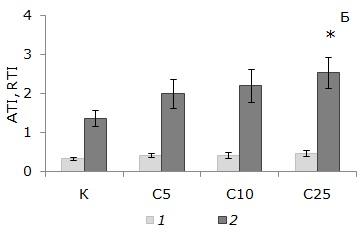
Рис. 2. Доля амебоцитов и элеоцитов в популяции (А) и трофические индексы (Б) целомоцитов дождевых червей E. fetida после 56 дней инкубирования в: К ‒ OECD почве; С5, С10 и С25 ‒ субстратах, содержащих 5, 10 и 25 % загрязненной почвы соответственно. * ‒ различия с контролем значимы при p < 0.05 (по критерию Манна ‒ Уитни). А: 1 – амебоциты, 2 – элеоциты. Б: 1 – ATI, 2 – RTI. Показаны средние значения и планки погрешностей для стандартных ошибок среднего
Fig. 2. Proportion of amoebocytes and elaeocytes in population (A) and trophic indexes (Б) of coelomocytes of E. fetida earthworms after 56 days incubation in: К – OECD soil; С5, С10 and С25 – substrates containing 5, 10 and 25 % contaminated soil, respectively. * ‒ differences from reference are significant at p < 0.05 (according to the Mann ‒ Whitney test). A: 1 – amoebocytes, 2 – elaeocytes. Б: 1 – ATI, 2 ‒ RTI. The mean values with error bars for standard errors are shown
Индексы ATI, отражающие долю элеоцитов в популяции, изменялись от 0.34 ± 0.04 для контроля до 0.47 ± 0.07 для субстрата С25. Нормированные значения RTI были более контрастны для разных вариантов эксперимента и увеличивались от 1.36 ± 0.21 г‒1 для контроля до 2.49 ± 0.39 г‒1 для субстрата С25 (рис. 2Б). Выявлены статистически значимые (p < 0.05) различия индексов RTI, рассчитанных для варианта С25 и контроля. Наибольшие значения трофических индексов были получены для животных, инкубированных в субстрате С25, что свидетельствует об увеличении вклада субпопуляции элеоцитов в ответную реакцию организмов при длительном воздействии среды с экстремальным загрязнением.
Оценка накопления нейтрального красного в целомоцитах
Накопление НК в целомоцитах, выделенных из дождевых червей после воздействия загрязненных субстратов, оценивали относительно значений оптической плотности, измеренных для животных из контрольных выборок при соответствующем времени экспонирования (7 или 56 дней). Не отмечено токсического влияния на лизосомы целомоцитов как при кратковременном, так и при длительном инкубировании E. fetida в субстрате С5. При остром воздействии (7 дней) с увеличением в субстрате концентраций ТМ и РН регистрировали постепенное уменьшение накопления НК в клетках целомической жидкости животных. Через неделю после начала эксперимента поглощение красителя целомоцитами червей при выдержке в субстратах С25 и С50 снизилось относительно контрольного варианта (К) на 52 и 74 % (р < 0.05) соответственно (рис. 3А). Выявлены статистически значимые различия (р < 0.05) в накоплении НК целомоцитами между дождевыми червями, экспонированными 7 дней в субстратах С10, С25 и С50 с содержанием элементов в среде, существенно превышающих фоновые. Поглощение красителя клетками целомической жидкости E. fetida после 7 дней выдержки в наиболее загрязненной ТМ и РН почве С50 составило только 26 % от значения, регистрируемого для интактного варианта. Цитотоксический эффект у животных после 56 дней инкубирования в среде с повышенным содержанием токсикантов обнаружен при меньших концентрациях металлов. Так, при доле загрязненной почвы в субстрате 10 % отмечено уменьшение накопления красителя в клетках в два раза (р < 0.05) по сравнению с контрольным вариантом (рис. 3Б). В хроническом эксперименте для животных из двух наиболее загрязненных субстратов (С10 и С25) различий в поглощении НК целомическими клетками E. fetida не выявлено. Средние величины определяемого параметра для этих вариантов составили 43 и 49 % соответственно. При этом для животных, экспонированных в субстрате С25 только 7 дней, поглощение красителя клетками целомической жидкости также было низким и составляло 48 % относительно контроля. В связи с выраженным токсическим воздействием компонентов загрязненной почвы, высокой летальностью особей и отсутствием достаточного объема выборки не удалось оценить стабильность лизосомальных мембран в целомоцитах червей при 56-дневном экспонировании в субстрате С50.
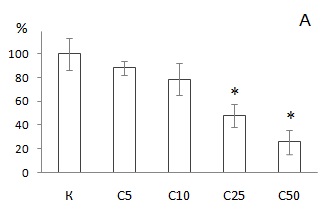
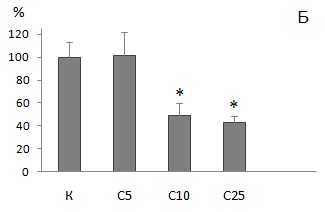
Рис. 3. Накопление нейтрального красного в целомоцитах дождевых червей E. fetida относительно контроля после экспонирования в течение 7 дней (А) или 56 дней (Б ) в: К ‒ OECD почве; С5, С10, С25 и С50 ‒ субстратах, содержащих 5, 10, 25 и 50 % загрязненной почвы соответственно. * ‒ отличие от контроля достоверно при р < 0.05 (по критерию Манна ‒ Уитни с поправкой Бонферрони). Показаны средние значения и планки погрешностей для стандартного отклонения
Fig. 3. Accumulation of neutral red in coelomocytes of E. fetida earthworms compared to control after exposure for 7 days (A) or 56 days (Б) in: K – OECD soil; C5, C10, C25 and C50 – substrates containing 5, 10, 25 and 50 % contaminated soil, respectively. * ‒ differences from reference are significant at p < 0.05 (according to the Mann ‒ Whitney test with the Bonferroni correction). The mean values with error bars for standard deviation are shown
Обсуждение
Влияние повышенных концентраций тяжелых металлов и радионуклидов природного происхождения на целомоциты дождевых червей E. fetida изучали с использованием почвы, отобранной с территории хвостохранилища бывшего завода по производству радия и содержащей повышенные концентрации Cu, Pb, Cd, Ni, Cr, As, Mn, 226Ra, 238U.
Анализ плотности суспензии целомоцитов E. fetida не выявил отличий по этому показателю между дождевыми червями после хронического воздействия как загрязненных субстратов, так и OECD почвы. В литературе представлены данные о разном характере влияния ТМ на этот параметр. Так, при оценке цито- и генотоксичности образцов, содержащих повышенные концентрации ТМ, Curieses et al. (2016) выявили, что количество целомоцитов E. fetida не менялось спустя 7 дней, но снижалось через 14 дней экспозиции. В то же время в исследовании (Urionabarrenetxea et al., 2022) показана более низкая концентрация целомоцитов в организмах E. fetida, подвергшихся трехдневному воздействию загрязненной почвы, в том числе с относительно низкими концентрациями Pb, Cr, Ni и Cd. Известно, что с участием целомической жидкости в организмах дождевых червей осуществляется несколько биологических процессов, включая гемолитические, протеолитические, цитотоксические и антибактериальные (Bodó et al., 2021). Целомоциты напрямую взаимодействуют с внешней средой через дорсальные поры и соединенные нефридиальные канальцы, которые выделяют метаболиты. Как отмечают авторы цитируемого исследования, эти поры также участвуют в элиминации бактерий и истощенных целомоцитов. Отсутствие различий в индексах целомоцитов CI, рассчитанных нами для червей из интактных и контрольного субстратов, отражает, скорее всего, незначительный вклад механизма удаления целомической жидкости и клеток с нарушениями лизосомальных мембран в снижение цитотоксичности среды при продолжительном стрессовом воздействии. Также мы не нашли статистически значимых различий соотношения численности клеток в субпопуляциях целомоцитов дождевых червей после хронического воздействия, однако регистрировали небольшое уменьшение доли амебоцитов и увеличение доли элеоцитов, а соответственно, трофических индексов ATI и RTI с увеличением в среде концентрации металлов и As. Наши данные согласуются с результатами, полученными Lourenço et al. (2011, 2012). Эти авторы наблюдали более высокую частоту элеоцитов и более низкую частоту амебоцитов в организмах E. andrei, подвергшихся воздействию загрязненной ТМ и РН почвы из заброшенного уранового рудника как в лабораторных условиях, так и in situ. При изучении эффектов инсектицида ацетамиприда на E. andrei Saggioro et al. (2019) обнаружили, что амебоциты были преобладающими клетками иммунной системы на 15-й и 30-й день, в то время как элеоциты ‒ на 45-й день экспозиции. Хотя защитная роль элеоцитов изучена слабо и является весьма ограниченной, у представителей рода Eisenia эти клетки проявляют фагоцитарную активность и осуществляют детоксикацию организма, изолируя токсичные вещества от остального (Stanovova, 2019). Полагаем, что наблюдаемое нами незначительное увеличение доли элеоцитов в структуре популяции целомических клеток E. fetida при усилении стрессового воздействия связано с участием элеоцитов в важных метаболических и регуляторных процессах, обеспечивающих нормальное функционирования всего организма, а также в накоплении металлов и As. При относительно низких концентрациях токсикантов роль амебоцитов в механизмах фагоцитоза и инкапсуляции химикатов, по всей видимости, более значима для снижения цитотоксичности субстрата. Необходимо подчеркнуть, что трофические индексы учитывают не только соотношение субпопуляций целомоцитов, но и морфометрические параметры особей, такие как масса. В наших экспериментах выявлены статистически значимые различия между индексом RTI для особей из контроля и варианта С25, что, вероятно, связано с более интенсивной выработкой целомоцитов для детоксификации поступивших РН и ТМ в организм и снижением массы особей по причине сильного токсического эффекта.
Оценка цитотоксичности почв с комплексным загрязнением всегда является сложной проблемой вследствие широкого разнообразия свойств как самого субстрата, так и спектра химических веществ. Оба эти компонента в значительной степени влияют на транспорт токсикантов в организм животных. Для дождевых червей ситуация еще более затруднительна, поскольку в этом случае одновременно задействованы два пути поступления загрязняющих веществ: через кожный покров и через кишечник, где биодоступность металлов может значительно различаться (Karczewska et al., 2023). Одновременное присутствие в среде нескольких химикатов, трансформация их физико-химической формы и продолжительность воздействия агентов также модифицируют реакцию клеток животных на действие токсикантов. Например, в исследовании (Hønsi et al., 2003) бóльшие значения рН почвы при более низком содержании металлов явились причиной одинаковых цитотоксических эффектов у животных, подвергавшихся воздействию почв с разным уровнем загрязнения. При изучении ответа организмов E. fetida на присутствие в искусственной почве одинаковых концентраций наночастиц Cu и CuO авторы работы (Лебедев и др., 2017) отмечали различия в биоаккумуляции металла дождевыми червями и активности ферментов их антиоксидантной системы. В некоторых случаях неопределенность комплекса действующих факторов и их разнообразие не позволяет однозначно объяснить полученный результат (Vivas et al., 2022). Однако исследование цитотоксического действия почв с разным спектром ТМ дает возможность оценить диапазон действующих концентраций металлов для реальных экосистем и выявить закономерности изменений клеточного биомаркера.
В сложном составе исследуемой нами почвы ксенобиотики As, Pb, Cd, жизненно важная Cu, а также U и Ra могли в первую очередь повлиять на реакцию клеточных органелл, поскольку значительно превышали фоновые значения. При анализе цитотоксического воздействия загрязненной ТМ и РН почвы мы ожидали уменьшения накопления красителя целомоцитами E. fetida по сравнению с контролем для всех вариантов эксперимента, принимая во внимание повышенное более чем на порядок содержание металлов в смесях. Подобную реакцию клеточных органелл отмечали во многих работах (Maboeta et al., 2018; Hattab et al., 2023 и др.). Однако мы не регистрировали негативные эффекты для организмов после острого воздействия почвенных субстратов С5 и С10. Небольшое уменьшение накопления НК в целомоцитах животных после 7 дней воздействия этих смесей отражает, скорее всего, связанную с изменением поверхности клеток или лизосомальных мембран общую реакцию организмов на стресс (Irizar et al., 2015). Причиной отсутствия негативной реакции субклеточного биомаркера может быть кинетика биоаккумуляции элементов в животных, как показано, например, в работе (Zhang et al., 2015). Авторы регистрировали максимальную концентрацию Pb в организмах E. fetida на 14-й день воздействия и последующее незначительное снижение к 28-му дню. Изменение кинетики биоаккумуляции РН дождевыми червями выявили Lourenço et al. (2011). Лабораторное исследование показало, что накопление в организмах E. andrei 238U и дочернего 210Po увеличивалось на протяжении всего 56-дневного периода воздействия радиоактивно загрязненной почвы, тогда как накопление других РН (226Ra, 210Pb и 230Th) к 14-му дню увеличивалось, а затем уменьшалось к концу эксперимента. Возможно, в нашем исследовании при экспонировании червей в субстрате С5 в течение недели накопление ими некоторых из токсикантов еще не достигло действующих концентраций, а к 56-му дню могли снизиться как содержание металлов в организме вследствие выведения, так и их биодоступность из субстрата в связи с активными процессами жизнедеятельности.
Изучение накопления Cu дождевыми червями E. andrei (Svendsen, Weeks, 1997а) показало, что при концентрации металла более 80 мг/кг происходит запуск механизма регуляции содержания Cu в организме, приводящий к уменьшению коэффициента биоаккумуляции с 1 до 0.3. Кроме того, одновременное присутствие других металлов, в частности Cd, способствует активной экспрессии целомоцитами металлотионеинов (МТ) и их участию в процессах компартментализации и дезактивации как Cd, так и Cu (Yadav et al., 2023). Также физиологическая адаптация особей к низкоинтенсивному стрессовому воздействию может ослабить цитотоксическое действие ТМ. Так, авторы исследования (Reinecke, Reinecke, 2003) продемонстрировали, что при одинаковых концентрациях Pb в организме E. fetida время удержания НК целомоцитами было ниже у животных, ранее не экспонированных в Pb-содержащем субстрате. Полагаем, что сочетанное действие рассмотренных выше процессов, позволяющих снизить негативный эффект для организма после инкубации в течение 56 дней в слабозагрязненном субстрате С5, обусловили более высокое поглощение красителя НК клетками E. fetida по сравнению с острым воздействием.
Инкубирование животных в субстрате С10 в течение 7 дней еще не приводило к выраженным изменениям проницаемости лизосомальных мембран (рис. 3А). Поглощение НК целомоцитами в этом варианте эксперимента составило 79 ± 13 % относительно контроля. Однако у червей, экспонированных в таких образцах более длительное время, пиноцитозная активность целомоцитов была значительно нарушена (рис. 3Б). Хроническое воздействие на животных субстрата С10 привело к уменьшению поглощения красителя в целомических клетках в 1.6 раза по сравнению c кратковременной экспозицией в такой же среде. Влияние продолжительности воздействия Cu на время удержания НК целомоцитами Lumbricus rubellus в полевом почвенном мезокосме продемонстрировали (Svendsen, Weeks, 1997b). Авторы отмечали, что с увеличением длительности инкубирования время удержания НК увеличивалось в большей степени при низкоинтенсивном (20 и 40 мг/кг) воздействии металла, чем при более высоких концентрациях Cu, а на реакцию красителя практически не влияли естественные и сезонные колебания климатических параметров.
Содержание в тестируемых смесях Cd ‒ ксенобиотика, который наряду со Pb способен связываться с сульфгидрильными группами глутатиона и приводить к их дезактивации, в нашем эксперименте не превышало 14 мг/кг. При таких низких концентрациях Cd другие исследователи не выявили существенных различий в способности целомоцитов E. fetida удерживать краситель после острого воздействия почвы на червей (Urionabarrenetxea et al., 2020). При этом авторы отмечали, что мультистрессовое воздействие может вызывать токсическую реакцию при более низких дозах. На особенности процессов детоксикации Cd в организмах E. fetida при разных режимах экспонирования и концентрациях металла в почве 30 мг/кг и выше указывали Maity et al. (2018). Показано, что острое (до 14 дней) воздействие на животных содержащей Cd почвы приводило к увеличению активности ферментов детоксикации и снижению уровня глутатиона (GSH) в организме при относительно высоком уровне биоаккумуляции токсиканта в первые три недели инкубации дождевых червей в загрязненной среде. При этом субхроническое воздействие (28 дней) металла усиливало перекисное окисление липидов и подавляло активность ферментов детоксикации. Изменение вклада различных детоксификационных механизмов при разных режимах экспозиции червей в субстрате С10, наряду с другими факторами (концентрацией в животных ТМ и РН и их биодоступностью для систем организма), могло повлиять на стабильность лизосомальных мембран целомоцитов и привести к уменьшению накопления НК при продолжительном воздействии.
При определении элементного состава загрязненной почвы мы обнаружили высокие (до 1100 мг/кг) концентрации As ‒ хорошо известного своей иммунотоксичностью элемента (Medina et al., 2020). Результаты оценки токсичности сильно загрязненных As луговых и лесных почв из бывших районов добычи и переработки As, представленные в работе (Karczewska et al., 2023), показали, что дождевые черви E. fetida могут переносить чрезвычайно высокие общие концентрации As в почве, например, 8000 мг/кг. Однако в исследованиях (Lee and Kim, 2009; Wang et al., 2016) уменьшение времени удержания НК в лизосомах червей E. fetida наблюдали при концентрациях As в почве примерно на три порядка ниже. Реакция биомаркера зависела от содержания в почве органического вещества, химической формы элемента и времени экспозиции. В нашем эксперименте для наименее загрязненных образцов С5 с концентрацией элемента 31 мг/кг почвы статистически значимых различий в накоплении НК целомоцитами червей не выявлено. Трансформация химической формы металлоида могла также снизить цитотоксичность элемента после 56 дней по сравнению с острым воздействием. Так, Thomas et al. (2007) показали, что при более длительном воздействии токсиканта изменение характеристик среды (содержания органического вещества и рН) и активные метаболические процессы способствуют сдвигу соотношения метилированных и неорганических соединений As, влияющих на цитотоксичность субстрата.
Присутствующие в загрязненной почве в повышенных концентрациях радиоактивные элементы обладают также химической токсичностью, как рассмотренные выше ТМ. Например, снижение времени удержания НК целомоцитами E. fetida наблюдали при концентрациях природного или обедненного урана в почве 9.3 мг/кг и более (Giovanetti et al., 2010). При этом авторы сообщали об отсутствии статистически значимого влияния продолжительности воздействия урана в концентрациях 1.86–600 мг/кг на стабильность лизосомальных мембран клеток дождевых червей. В нашем изучении при оценке накопления НК целомоцитами E. fetida после воздействия субстрата С5, содержащего 9 мг/кг 238U, отличий показателей от контрольных значений не выявили. Здесь стоит отметить выраженное рН-зависимое распределение форм урана в почве и весьма значительные, как показано (Echevarria et al., 2001), различия в сорбционных свойствах химических частиц, что изменяет поступление элемента в организм и его цитотоксичность.
Наименьшее поглощение НК клетками целомической жидкости, как и ожидали, наблюдали для дождевых червей E. fetida после воздействия субстратов С25 и С50 с максимальными концентрациями металлов. Существенное ухудшение целостности лизосомальной мембраны клеток (более чем на 50 %) регистрировали даже при кратковременном воздействии смесей. Наблюдаемые при разных режимах воздействия близкие значения (43 и 48 %) биомаркера, полученные для почвы С25 с высоким уровнем загрязнения, могут быть связаны с возможным уменьшением при хронической экспозиции коэффициентов биоаккумуляции некоторых из присутствующих токсикантов при их высоких концентрациях в субстрате и влиянием метаболических процессов на химическую форму элементов. Например, чрезвычайно низкие значения коэффициентов биоаккумуляции 226Ra получены для дождевых червей E. fetida после двух месяцев инкубирования в субстратах с экстремальной удельной активностью РН (52–103 кБк/кг) (Maystrenko, Rybak, 2023). При удельной активности радия в организме животных выше фоновых значений повреждение мембран органелл может быть обусловлено как механизмами токсического действия элемента ‒ представителя группы тяжелых металлов (Скугорева и др., 2016), так и активацией процессов перекисного окисления липидов, инициируемых ионизирующим излучением радиоактивного вещества.
Анализируя изученные в настоящем исследовании эффекты, отражающие жизнеспособность целомоцитов E. fetida, отметим значительные индивидуальные различия особей. На это же указывали Bleeker и van Gestel (2007) при оценке времени удержания НК у особей L. rubellus с участков, различающихся характеристиками почвы и концентрациями металлов (Fe, Zn, Ni, Cu и Cd).
Результаты оценки накопления красителя НК целомоцитами E. fetida при остром и хроническом воздействии загрязненной почвы свидетельствуют о том, что присутствие в субстратах повышенных концентраций ТМ и РН повлияло на иммунную систему дождевых червей. При этом важным фактором был не только уровень загрязнения среды, но и продолжительность экспозиции. Относительно низкие концентрации ТМ и РН в субстрате С5 не приводили к статистически значимому изменению накопления НК целомоцитами E. fetida как после 7, так 56 дней инкубирования. Сублетальные концентрации элементов при хроническом воздействии на дождевых червей увеличивали проницаемость лизосомальных мембран по сравнению с кратковременной экспозицией, снижая накопление красителя клетками целомической жидкости. Для животных, экспонированных 56 дней в искусственной OECD почве и загрязненных субстратах с разным содержанием металлов, не выявили различий частоты встречаемости целомоцитов и соотношения в целомической жидкости субпопуляций амебоцитов и элеоцитов. Однако для червей, инкубированных в субстрате С25, показано статистически значимое увеличение по сравнению с интактным контролем относительного трофического индекса RTI, отражающего вклад субпопуляции элеоцитов в ответ организма. В целом, несмотря на сложный состав загрязненной почвы, негативные эффекты регистрировали при уровнях воздействия, сопоставимых с данными, полученными другими исследователями. Хотя здесь стоит отметить, что присутствующие в смеси РН за счет ИИ могут модифицировать иммунную реакцию клеток, усиливая или подавляя цитотоксическое действие химических компонентов (Lourenço et al., 2011).
Заключение
Настоящее исследование показало, что загрязнение среды обитания ТМ и РН может влиять на жизнеспособность целомических клеток дождевых червей E. fetida. При увеличении концентрации металлов в среде наблюдали изменение стабильности лизосомальной мембраны целомоцитов ‒ основных иммунных эффекторных клеток дождевого червя. Ответ биомаркера зависел от интенсивности и продолжительности воздействия. Анализ накопления НК лизосомами клеток E. fetida после 56 дней инкубирования в умеренно загрязненных субстратах показал более высокую чувствительность биомаркера к воздействию цитотоксичных компонентов, чем в 7-дневном эксперименте. Увеличение концентраций ТМ и РН в почве при хроническом воздействии на дождевых червей сопровождалось изменением распределения субпопуляций клеток и сдвигом соотношения в сторону элеоцитов и снижением доли амебоцитов.
Библиография
Атлас почв Республики Коми / Под ред. Г. В. Добровольского, А. И. Таскаева, И. В. Забоевой. Сыктывкар: ООО «Коми республиканская типография», 2010. 356 с.
Лебедев С. В., Сизова Е. А., Гавриш И. Трофометаболический потенциал Eisenia fetida Savigny, 1826 (Oligohata, Limbricidae), обусловленный присутствием в почве наночастиц меди и ее оксида // Поволжский экологический журнал. № 2. С. 147–156.
Adamowicz A. Morphology and ultrastructure of the earthworm Dendrobaena veneta (Lumbricidae) coelomocytes // Tissue Cell. 2005. Vol. 37, № 2. P. 125–133. DOI: 10.1016/j.tice.2004.11.002
Bleeker E. A., van Gestel C. A. Effects of spatial and temporal variation in metal availability on earthworms in floodplain soils of the river Dommel, The Netherlands // Environ. Pollut. 2007. Vol. 148, № 3. P. 824–832. DOI: 10.1016/j.envpol.2007.01.034
Bodó K., Kellermayer Z., László Z., Boros Á., Kokhanyuk B., Németh P., Engelmann P. Injury-Induced Innate Immune Response During Segment Regeneration of the Earthworm, Eisenia andrei // Int. J. Mol. Sci. 2021. Vol. 22, № 5. Article number: 2363. DOI: 10.3390/ijms22052363
Česynaitė J., Praspaliauskas M., Pedišius N., Sujetovienė G. Biological assessment of contaminated shooting range soil using earthworm biomarkers // Ecotoxicology. 2021. Vol. 30, № 10. P. 2024–2035. DOI: 10.1007/s10646-021-02463-w
Curieses S. P., Sáenz M. E., Larramendy M., Di Marzio W. Ecotoxicological evaluation of foundry sands and cosmetic sludges using new earthworm biomarkers // Ecotoxicology. 2016. Vol. 25, № 5. P. 914–923. DOI: 10.1007/s10646-016-1649-3
Curieses S. P., Sáenz M. E., Alberdi J. L., Martinez S., Larramendy M. L., Di Marzio W. Genotoxic evidences of glyphosate and chlorpyriphos on Eisenia fetida coelomocytes // Advances Environ. Stud. 2018. Vol. 2, № 2. P. 82–90.
Echevarria G., Sheppard M. I., Morel J. Effect of pH on the sorption of uranium in soils // J. Environ Radioact. 2001. Vol. 53, № 2. P. 257–264. DOI: 10.1016/s0265-931x(00)00116-8
Eyambe G. S., Goven A. J., Fitzpatrick L. C., Venables B. J., Cooper E. L. A non-evasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxic studies // Lab. Anim. 1991. Vol. 25. P. 61–67.
Geras'kin S., Yoschenko V., Bitarishvili S., Makarenko E., Vasiliev D., Prazyan A., Lychenkova M., Nanba K. Multifaceted effects of chronic radiation exposure in Japanese red pines from Fukushima prefecture // Sci. Total. Environ. 2021. Vol. 763. Article number: 142946. DOI: 10.1016/j.scitotenv.2020.142946
Giovanetti A., Fesenko S., Cozzella M. L., Asencio L. D., Sansone U. Bioaccumulation and biological effects in the earthworm Eisenia fetida exposed to natural and depleted uranium // J. Environ. Radioact. 2010. Vol. 101, iss. 6. P. 509–516. DOI: 10.1016/j.jenvrad.2010.03.003
Hattab S., Boughattas I., Cappello T., Zitouni N., Touil G., Romdhani I., Livet A., Bousserrhine N., Banni M. Heavy metal accumulation, biochemical and transcriptomic biomarkers in earthworms Eisenia andrei exposed to industrially contaminated soils from south-eastern Tunisia (Gabes Governorate) // Sci. Total. Environ. 2023. Vol. 20, № 887. Article number: 163950. DOI: 10.1016/j.scitotenv.2023.163950
Höckner M., Piechnik C. A., Fiechtner B., Weinberger B., Tomanek L. Cadmium-Related Effects on Cellular Immunity Comprises Altered Metabolism in Earthworm Coelomocytes // Int. J. Mol. Sci. 2020. Vol. 21, № 2. Article number: 599. DOI: 10.3390/ijms21020599
Hønsi T. G., Stubberud H. E., Andersen S., Stenersen J. Lysosomal fragility in earthworms (Eisenia veneta) exposed to heavy metal contaminated soils from two abandoned pyrite ore mines in Southern Norway // Water. Air. & Soil. Pollution. 2003. Vol. 142. P. 27–37. DOI: 10.1023/A:1022003809634
Irizar A., Rodríguez M. P., Izquierdo A., Cancio I., Marigómez I., Soto M. Effects of soil organic matter content on cadmium toxicity in Eisenia fetida: Implications for the use of biomarkers and standard toxicity tests // Arch. Environ. Contam. Toxicol. 2015. Vol. 68. P. 181–192. DOI: 10.1007/s00244-014-0060-4
Karczewska A., Gruss I., Szopka K., Dradrach A., Twardowski J., Twardowska K. Arsenic toxicity to earthworms in soils of historical As mining sites: an assessment based on various endpoints and chemical extractions // Environ. Geochem. Health. 2023. Vol. 45. P. 6713–6726. DOI: 10.1007/s10653-023-01665-x
Kurek A., Homa J., Kauschke E., Płytycz B. Characteristic of coelomocytes of the stubby earthworm, Allolobophora chlorotica (Sav.) // European Journal of Soil Biology. 2007. Vol. 43. P. S121–S126. DOI: 10.1016/j.ejsobi.2007.08.051
Lee B. T., Kim K. W. Lysosomal membrane response of earthworm, Eisenia fetida, to arsenic contamination in soils // Environ. Toxicol. 2009. Vol. 24, № 4. P. 369–376. DOI: 10.1002/tox.20441
Lourenço J., Pereira R., Silva A., Carvalho F., Oliveira J., Malta M., Paiva A., Gonçalves F., Mendo S. Evaluation of the sensitivity of genotoxicity and cytotoxicity endpoints in earthworms exposed in situ to uranium mining wastes // Ecotoxicol. Environ. Saf. 2012. Vol. 75, № 1. P. 46–54. DOI: 10.1016/j.ecoenv.2011.08.024
Lourenço J. I., Pereira R. O., Silva A. C., Morgado J. M., Carvalho F. P., Oliveira J. M., Malta M. P., Paiva A. A., Mendo S. A., Gonçalves F. J. Genotoxic endpoints in the earthworms sub-lethal assay to evaluate natural soils contaminated by metals and radionuclides // J. Hazard. Mater. 2011. Vol. 18, № 1. P. 788–795. DOI: 10.1016/j.jhazmat.2010.11.073
Maboeta M. S., Oladipo O. G., Botha S. M. Ecotoxicity of Mine Tailings: Unrehabilitated Versus Rehabilitated // Bull. Environ. Contam. Toxicol. 2018. Vol. 100, № 5. P. 702–707. DOI: 10.1007/s00128-018-2322-8
Maity S., Banerjee R., Goswami P., Chakrabarti M., Mukherjee A. Oxidative stress responses of two different ecophysiological species of earthworms (Eutyphoeus waltoni and Eisenia fetida) exposed to Cd-contaminated soil // Chemosphere. 2018. Vol. 203. P. 307–317. DOI: 10.1016/j.chemosphere.2018.03.189
Maystrenko T., Rybak A. Radium uptake by earthworms E. fetida after exposure to contaminated soil // J. Environ. Radioact. 2023. Vol. 257. Article number: 107085. DOI: 10.1016/j.jenvrad.2022.107085
Medina S., Lauer F. T., Castillo E. F., Bolt A. M., Ali A. S., Liu K. J., Burchiel S. W. Exposures to uranium and arsenic alter intraepithelial and innate immune cells in the small intestine of male and female mice // Toxicol. Appl. Pharmacol. 2020. Vol. 403. Article number: 115155. DOI: 10.1016/j.taap.2020.115155
OECD Guideline for the testing of chemicals. Earthworm Reproduction Test (Eisenia fetida/Eisenia andrei). V. 222 OECD. Paris, 2016.
OECD. Guideline for testing of chemicals. Earthworm. Acute Toxicity Tests. V. 207 OECD. Paris, 1984.
Orekhova N. A. Hepatic effects of low-dose rate radiation in natural mouse populations (Apodemus uralensis and Apodemus agrarius): comparative interspecific analysis // Int. J. Radiat. Biol. 2020. Aug. Vol. 96, № (8). P. 1038–1050. DOI: 10.1080/09553002.2020.1770362
Reinecke A. J., Reinecke S. A. The influence of exposure history to lead on the lysosomal response in Eisenia fetida (Oligochaeta) // Ecotoxicol. Environ. Saf. 2003. Vol. 55, № 1. P. 30–37. DOI: 10.1016/s0147-6513(02)00086-6
Saggioro E. M., do Espírito Santo D. G., Sales Júnior S. F., Hauser-Davis R. A., Correia F. V. Lethal and sublethal effects of acetamiprid on Eisenia andrei: Behavior, reproduction, cytotoxicity and oxidative stress // Ecotoxicol. Environ. Saf. 2019. Vol. 183. P. 109572. DOI: 10.1016/j.ecoenv.2019.109572
Stanovova M. V. Morphology, cytogenesis and functions of Annelida coelomocytes // Invert. Zool. 2019. Vol. 16, № 3. P. 254–282. DOI: 10.15298/invertzool.16.3.06
Svendsen C., Weeks J. M. Relevance and applicability of a simple earthworm biomarker of copper exposure. I. Links to ecological effects in a laboratory study with Eisenia andrei // Ecotoxicol. Environ. Saf. 1997a. Vol. 36, № 1. P. 72–79. DOI: 10.1006/eesa.1996.1491
Svendsen C., Weeks J. M. Relevance and applicability of a simple earthworm biomarker of copper exposure. II. Validation and applicability under field conditions in a mesocosm experiment with Lumbricus rubellus // Ecotoxicol. Environ. Saf. 1997b. Vol. 36, № 1. P. 80–88. DOI: 10.1006/eesa.1996.1492
Thomas D. J., Li J., Waters S. B., Xing W., Adair B. M., Drobna Z., Devesa V., Styblo M. Arsenic (+3 oxidation state) methyltransferase and the methylation of arsenicals // Exp. Biol. Med. (Maywood). 2007. Vol. 232, № 1. P. 3–13.
Urionabarrenetxea E., Garcia-Velasco N., Marigómez I., Soto M. Effects of elevated temperatures and cadmium exposure on stress biomarkers at different biological complexity levels in Eisenia fetida earthworms // Comp. Biochem. Physiol. C. Toxicol. Pharmacol. 2020. Vol. 231. Article number: 108735. DOI: 10.1016/j.cbpc.2020.108735
Vivas F., Balladares S., Lobos M. G., Gaete H. Assessment toxicity of soils from areas with mining activity through the stability of the lysosomal membrane and avoidance behavior in the earthworm Eisenia fetida // Bull. Environ. Contam. Toxicol. 2022. Vol. 110, № 1. Article number: 13. DOI: 10.1007/s00128-022-03662-9
Vullo A. I., Vullo D. L., Basack S. B. Assessment of intensive periurban agriculture soil quality applying biomarkers in earthworms // J. Environ. Manage. 2023. Vol. 344. Article number: 118535. DOI: 10.1016/j.jenvman.2023.118535
Wang Z., Cui Z. Accumulation, biotransformation, and multi-biomarker responses after exposure to arsenic species in the earthworm Eisenia fetida // Toxicol. Res. (Camb.). 2016. Vol. 5, № 2. P. 500–510. DOI: 10.1039/c5tx00396b
Yadav R., Kumar R., Kumar Gupta R., Kaur T., Kiran, Kour A., Kaur S., Rajput A. Heavy metal toxicity in earthworms and its environmental implications: A review // Environmental Advances. 2023. Vol. 12. Article number: 100374. DOI: 10.1016/j.envadv.2023.100374
Zhang W., Liu K., Li J., Chen L., Lin K. Uptake and depuration kinetics of lead (Pb) and biomarker responses in the earthworm Eisenia fetida after simultaneous exposure to decabromodiphenyl ether (BDE209) // Ecotoxicol. Environ. Saf. 2015. Vol. 113. P. 45–51. DOI: 10.1016/j.ecoenv.2014.11.014
Благодарности
Исследование проведено в рамках государственного задания ИБ ФИЦ Коми НЦ УрО РАН (№ 122040600024-5). Спектрофотометрический анализ выполнен с использованием оборудования ЦКП «Молекулярная биология» ИБ ФИЦ Коми НЦ УрО РАН.






 © 2011 - 2026
© 2011 - 2026