Введение
В агроэкосистеме плодового питомника происходит значительное потребление элементов минерального питания из почвы растущими саженцами, что требует применения высоких доз минеральных удобрений (Сергеев, Исаев, 2012; Гурин, 2016). Использование минеральной системы удобрения на протяжении многих лет приводит к накоплению труднорастворимых фосфатов в почве и загрязнению подпочвы и грунтовых вод нитратами (Мишустин, 1956; Кузнецова, Тыщенко, 2015). Кроме того, из-за дороговизны минеральных и нехватки органических удобрений в питомниках используют в основном только азотные удобрения (аммонийная селитра, мочевина и др.), что вызывает дисбаланс элементов питания как в почве, так и в плодовом растении. Поэтому особое значение приобретают разработки новых биологизированных способов повышения эффективности растениеводства, обогащения микробного разнообразия в агроэкосистеме плодового питомника за счет интродукции в микробоценоз активных штаммов полезных микроорганизмов. Они способны улучшать питание сельскохозяйственных растений, усиливать рост, защищать от патогенов и фитофагов, повышать устойчивость к стрессам и продуктивность (Шапошников и др., 2011; Крыжко, Смаглий, 2022; Hassani et al., 2018; Vyas, Kaur, 2019; Nazari, Smith, 2020). Способность почвенных микроорганизмов в ассоциации с культурными растениями поставлять им минеральные и физиологически активные вещества широко используется в биотехнологии при выделении активных штаммов микроорганизмов из почвы, их культивировании и создании на их основе биопрепаратов (БП) (Коломиец, 2011; Grzyb et al., 2012). Их успешно используют как биоудобрения в различных агроценозах при выращивании зерновых, бобовых, овощных, кормовых и других культур для поддержания высокой продуктивности агроценоза и формирования экологически устойчивых агроэкосистем (Тихонович, Проворов, 2009; Liu et al., 2016; Raheem et al., 2018).
Вместе с тем различные виды и сорта сельскохозяйственных растений, в т. ч. и плодовых, могут иметь различную способность к ассоциации с интродуцированными бактериями. Создание растительно-микробных ассоциаций в ризосфере саженцев косточковых культур изучено довольно подробно, в т. ч. и в наших исследованиях (Формы микробных…, 2007; Клименко и др., 2016; Klymenko et al., 2010). Установлено усиление роста, улучшение состояния и минерального питания саженцев абрикоса, алычи и черешни, а также увеличение численности полезных микроорганизмов в ризосфере при применении активных штаммов бактерий и БП. Однако в плодовом питомнике семечковых плодовых культур такие исследования немногочисленны (Рябцева и др., 2005; Клименко и др., 2020; Aslantas et al., 2007). В связи с этим биологизация агроценоза питомника семечковых плодовых культур при создании эффективных растительно-микробных взаимодействий для снижения доз минеральных удобрений и средств защиты растений является весьма актуальной.
Цель исследования заключалась в анализе влияния биопрепаратов Азотобактерин-Агро и Микробиоком-Агро на состояние и продуктивность фитоценоза груши в плодовом питомнике, а также на элементы плодородия и биологической активности почвы.
Материалы
Для достижения поставленной цели были проведены полевые мелкоделяночные опыты в плодовом питомнике отделения «Степное» Никитского ботанического сада (с. Новый Сад Симферопольского района Республики Крым) в 2019–2022 гг. в течение трех двухлетних циклов выращивания саженцев. Вариантами опыта были: 1 – контроль − без применения БП; 2 – Азотобактерин 07-Агро (АБ) на основе штамма Azotobacter vinelandii 10702 – азотфиксатор, ростстимулятор; 3 – Микробиоком-Агро (МБК) – бактериальный комплекс, включающий три препарата различного спектра действия: Азостим-Агро (Agrobacterium radiobacter 204) – азотфиксатор; Фосфостим-Агро (Lelliottia nimipressuralis CCM 32-3) – фосфатмобилизатор и Биопрофид-Агро (Paenibacillus polymyxa П) – биопротектор (https://ckp-rf.ru/catalog/usu/507484/).
Варианты опыта располагались рендомизированно в пределах ряда питомника. Схема посадки растений 0.7 х 0.15 м. Площадь учетной делянки 2–3 м2 по 20–30 штук подвоев на делянке. Повторность опыта трехкратная. Общее число опытных растений на варианте – 60–90. Площадь опыта составила 100 м2. Перед посадкой (в ноябре) корневую систему однолетних стандартных подвоев, предварительно отобранных по размеру, помещали на 20 мин в болтушку, состоящую из почвы и рабочей суспензии БП, которую готовили разведением исходной суспензии БП (титр 1.01…1.08 х 108 КОЕ/мл для МБК, 5 х 108 КОЕ/мл для АБ) чистой водопроводной водой при соотношении 1:100 из расчета 80 мл рабочей суспензии на одно растение. В контроле болтушку готовили на чистой водопроводной воде. Как следует из литературных источников и наших работ, длительность экспозиции была достаточной для успешного заселения ризосферы микроорганизмами (Клименко, 2019; Клименко и др., 2020; Иванченко, Зотиков, 2020). В качестве растительных объектов исследовали подвои айвы: ВА 29 и КА 53 и сорта груши селекции Никитского ботанического сада: Таврическая – осенний и Мария – позднезимний сорт. Сорта были привиты способом окулировки в приклад в августе на второй год после посадки подвоев. Черенки для окулировки заготавливали с 7–9-летних апробированных маточных растений груши.
Методы
Закладка и проведение опытов осуществлялись согласно методике полевых опытов (Доспехов, 1985). Учеты и наблюдения за растениями в опыте проводили по методике сортоизучения плодовых культур (Программа и методика…, 1999). Для определения состояния саженцев в питомнике (число прижившихся подвоев и глазков привоя, число живых глазков после перезимовки и выход саженцев) учитывали число растений на каждой делянке, рассчитывали процент растений от числа посаженных, т. к. число посаженных растений на делянке могло быть различным.
Питомник орошаемый, агротехника общепринятая для зоны степного садоводства, минеральные азотные удобрения вносили во втором поле питомника в дозе 50 кг д.в. на гектар.
Почва опытного участка – чернозем южный карбонатный, слабощелочная (рН 8.17–8.28), содержала 2.0–2.6 % гумуса, 5–11 мг/кг азота нитратов, 5–10 мг/кг подвижного фосфора и 360–508 мг/кг обменного калия. Отбор образцов почвы для анализа проводили ежегодно в конце июля в слое 0–40 см в области ризосферы растений. В почве определяли величину рН водного потенциометрически (ГОСТ 26423-85), подвижные формы фосфора и калия модифицированным методом Мачигина (ГОСТ 26205-91), нитратный азот – потенциометрически (ГОСТ 26951-86), гумус – по Тюрину в модификации Симакова, Цыпленкова (ГОСТ 26213-91). Численность микроорганизмов семи эколого-трофических групп в ризосфере саженцев груши учитывали методом посева почвенной суспензии на твердые питательные среды в трехкратной повторности: аммонифицирующих бактерий – на мясо-пептонном агаре, амилолитических – на крахмало-аммиачном, фосфатмобилизующих – на глюкозо-аспарагиновом, олигонитрофильных – на среде Эшби, олиготрофных – на почвенном агаре, микромицетов – на среде Чапека, целлюлолитических микроорганизмов – на среде Гетчинсона (Теппер и др., 2004). Коэффициент минерализации-иммобилизации азота (КМИ) рассчитывали как отношение численности амилолитических бактерий к числу аммонифицирующих микроорганизмов (Мишустин, 1956); индекс олиготрофности (ИО) – как отношение численности олигонитрофильных бактерий к количеству аммонификаторов в ризосфере; индекс педотрофности (ИП) – как отношение числа олиготрофных бактерий к численности аммонифицирующих (Титова, Козлов, 2012).
Полученные данные обработаны статистически с использованием программ пакета Microsoft Excel 2016 и программы ANOVA в Statistica 07. Достоверность различий средних независимых выборок оценивали по t-критерию, достоверным принят 5 % уровень значимости.
Результаты
Исследования приживаемости подвоев в первом поле питомника показали, что в среднем за три года опыта в контроле (К) она была более высокой у КА 53; подвой ВА 29 имел меньшую приживаемость (табл. 1). Применение БП создавало тенденцию к увеличению приживаемости обоих подвоев, более значительно ВА 29 при применении АБ на 5 % относительно контроля, что важно при его пониженной приживаемости в питомнике.
Таблица 1. Влияние БП на приживаемость подвоев, состояние и выход саженцев груши в питомнике, среднее за 3 года (2019–2022 гг.)
| Сорт Подвой | Вари ант | Прижилось подвоя | Приняло окулировку (осенняя ревизия) | Сохранность привоя (весенняя ревизия) | Высота | Выход саженцев | ||||||
| % | тыс. шт./га | |||||||||||
| % от числа посаженных | % от контроля | % от числа посаженных | % от контроля | см | % от контроля | % от числа посаженных | % от контроля | всего | доп. число саженцев | |||
| Таври-ческая на КА 53 | К | 97.0 | 97.0 | 100 | 88.1 | 100 | 63.1 | 100 | 88.1 | 100 | 83.9 | – |
| АБ | 98.5 | 98.5 | 102 | 97.2 | 110 | 71.9 | 114 | 97.2 | 110 | 92.4 | 8.5 | |
| МБК | 97.0 | 97.0 | 100 | 91.2 | 104 | 71.8 | 114 | 89.8 | 102 | 85.5 | 1.6 | |
| Таври-ческая на ВА 29 | К | 90.9 | 88.0 | 100 | 85.4 | 100 | 87.4 | 100 | 80.6 | 100 | 76.8 | – |
| АБ | 94.9 | 92.9 | 106 | 90.1 | 106 | 102.2 | 117 | 85.5 | 106 | 81.4 | 4.6 | |
| МБК | 91.9 | 91.9 | 104 | 88,4 | 104 | 90.8 | 104 | 81.0 | 101 | 77.1 | 0.3 | |
| Мария на КА 53 | К | 94.0 | 92.4 | 100 | 83.3 | 100 | 70.1 | 100 | 76.6 | 100 | 73.0 | – |
| АБ | 97.1 | 97.1 | 105 | 92.4 | 111 | 88.6 | 126 | 92.4 | 121 | 88.0 | 15.0 | |
| МБК | 95.4 | 95.4 | 103 | 90.9 | 109 | 71.9 | 103 | 90.9 | 119 | 86.6 | 13.6 | |
| Мария на ВА 29 | К | 86.9 | 85.0 | 100 | 83.4 | 100 | 96.9 | 100 | 82.6 | 100 | 78.7 | – |
| АБ | 91.9 | 91.9 | 108 | 90.9 | 109 | 119.2 | 123 | 90.9 | 110 | 86.6 | 7.9 | |
| МБК | 88.9 | 88.9 | 105 | 85.2 | 102 | 99.5 | 103 | 83.0 | 101 | 79.0 | 0.3 | |
| НСР05 | Fф < F05 | 5.7 | – | 5.8 | – | 8.9 | – | 8.0 | – | – | – | |
Примечание. К – контроль без применения БП; АБ – Азотобактерин-Агро; МБК – Микробиоком-Агро.
В среднем за 3 года опыта в контроле приняло окулировку 92–97 % растений груши на подвое КА 53 и 85–88 % на подвое ВА 29 (см. табл. 1). Применение БП повысило число растений, принявших окулировку для обоих сортов и подвоев, в большей мере под действием АБ на подвое ВА 29 на 6–8 % от контроля, максимально и существенно относительно контроля на сорте Мария.
Неблагоприятные условия зимнего периода (иссушение, низкие температуры и весенние заморозки) повлияли на число сохранившихся после перезимовки растений (весенняя ревизия). В среднем за 3 года опыта сохранность глазков после перезимовки была более высокой у сорта Таврическая на обоих подвоях (на подвое КА 53 более высокая), чем у сорта Мария (не различалась по подвоям). Применение АБ способствовало повышению сохранности глазков сорта Таврическая на 6–10 % относительно контроля, сорта Мария – на 9–11 %, в большей мере на подвое КА 53 для обоих сортов, что свидетельствует о повышении их зимостойкости. Исследования роста саженцев во втором поле питомника показали, что БП положительно влияли на высоту саженца. Значительным и статистически значимым (р ≤ 0.05) было действие АБ на сорте Таврическая, привитом на ВА 29 (117 % от контроля), и сорте Мария на обоих подвоях (123−126 %), с наибольшим приростом на подвое ВА 29 (см. табл. 1).
Повышение приживаемости, зимостойкости глазков и усиление роста саженцев при применении БП приводило к увеличению количества полученных саженцев груши в питомнике. Установлено, что наибольшее число саженцев в контроле было на сорте Таврическая, привитом на подвое КА 53, – 88.1 % от числа посаженных подвоев. На сорте Мария максимальный выход саженцев в контроле был получен на подвое ВА 29 – 82.6 % от числа посаженных растений. БП способствовали увеличению выхода саженцев груши, в большей степени и достоверно на варианте с АБ на всех изученных сорто-подвойных комбинациях, максимально на сорте Мария (подвой КА 53) на 21 % от контроля. На этом же сорто-подвойном сочетании при использовании МБК выход саженцев увеличивался на 19 %. В целом в пересчете на 1 га на варианте с АБ выявлено увеличение выхода саженцев груши на 5–15 тыс. шт., максимально на сорте Мария (подвой КА 53). На варианте с МБК на этом сочетании общий выход саженцев увеличился на 13.6 тыс. шт. с 1 га (см. табл. 1).
Биологизация агроценоза плодового питомника груши способствовала изменению показателей плодородия почв. Под действием БП содержание гумуса под саженцами в основном оставалось стабильным или увеличивалось на 0.03–0.20 %; в варианте с КМП на саженцах сорта Мария, подвой КА 53 достоверно, на 0.46 % (рис. 1). Применение АБ (вариант 2) способствовало большему увеличению содержания нитратного азота по сравнению с МБК: на 1.3–4.0 мг/кг, максимально на сорте Мария, привитом на ВА 29. Содержание подвижных форм фосфора в почве существенно увеличивалось также на варианте 2 (АБ) – под саженцами сорта Таврическая на подвое КА 53 на 3.5 мг/кг (37 %) и Мария на ВА 29 на 3.6 мг/кг (22 %) от соответствующего контроля. МБК (вариант 3) также способствовал увеличению содержания подвижных форм фосфора в почве на этих сочетаниях на 4.8 (51 %) и 1.2 (8 %) мг/кг по отношению к контролю. Содержание обменного калия в ризосфере саженцев было высоким в контроле и по вариантам опыта. Накоплению его способствовали оба препарата в большей степени на саженцах, привитых на ВА 29, на 24–71 мг/кг, или на 7–24 % от контроля.
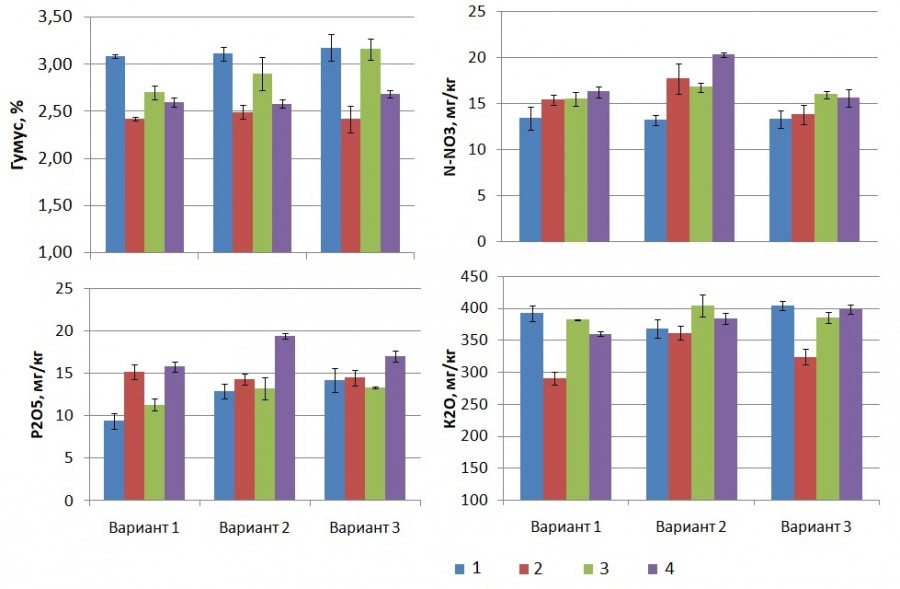
Рис. 1. Показатели плодородия почвы при инокуляции подвоя груши БП, слой 0–40 см, среднее за 3 года (2020–2022 гг.) в сочетаниях: 1 – сорт Таврическая на подвое КА 53; 2 – сорт Таврическая на подвое ВА 29; 3 – сорт Мария на подвое КА 53; 4 – сорт Мария на подвое ВА 29. Вариант 1 – контроль без БП, вариант 2 – АБ, вариант 3 – МБК (среднее и стандартное отклонение)
Fig. 1. Indicators of soil fertility in inoculation of pear rootstock with BP, layer 0–40 cm, average for 3 years (2020–2022): 1 – variety Tavricheskaya on rootstock KA 53; 2 – variety Tavricheskaya on rootstock VA 29; 3 – variety Maria on rootstock KA 53; 4 – variety Maria on rootstock VA 29. Variant 1 – control without BP, variant 2 – AB, variant 3 – MBC (mean and standard deviation)
Исследование биологической активности почвы в ризосфере саженцев груши показало, что численность всех изученных эколого-трофических групп микроорганизмов на всех вариантах опыта была выше в ризосфере саженцев сорта Таврическая по сравнению с сортом Мария, привитых на ВА 29, что, по-видимому, характеризует специфику генотипа (табл. 2).
Таблица 2. Изменение состава эколого-трофических групп микроорганизмов в ризосфере саженцев груши на подвое ВА 29 под действием БП, 2022 г., среднее в слое 0–40 см
| Сорт | Вариант | Аммони-фицирующие бактерии | Амилоли-тические бактерии | Фосфат-мобилизу-ющие бактерии | Олигонит-рофильные бактерии | Олиготроф-ные бактерии | Микромицеты | Целлюло-золитиче-ские бактерии |
| млн. КОЕ/г а.с.п. | тыс. КОЕ/г а.с.п. | |||||||
| Таври-ческая | К | 20.70±0.75 | 18.23±0.66 | 11.37±0.84 | 14.90±0.75 | 13.20±0.75 | 7.23±0.32 | 9.83±0.84 |
| АБ | 27.80±0.64* | 21.20±1.04* | 14.63±1.01* | 19.3±0.98* | 17.40±1.10* | 9.50±0.40* | 11.23±0.9 | |
| МБК | 25.20±1.15* | 17.50±0.58 | 12.40±0.29 | 16.20±0.81 | 15.20±0.58 | 7.70±0.40 | 10.23±0.9 | |
| Мария | К | 19.03±0.43 | 15.30±0.52 | 9.17±0.61 | 11.97±0.49 | 9.77±0.26 | 4.80±0.17 | 8.00±0.46 |
| АБ | 23.77±0.66* | 19.10±0.75* | 10.90±0.81 | 17.2±0.64* | 15.20±0.52* | 7.17±0.49* | 9.60±0.40 | |
| МБК | 22.20±1.10 | 15.83±0.78 | 9.80±0.64 | 14.30±0.69 | 12.63±0.78* | 5.00±0.23 | 8.97±0.32 | |
Примечание. * – разница с контролем значима на 5 % уровне (р ≤ 0.05); среднее из трех повторений ± стандартная ошибка (X ± Sx).
Применение БП способствовало повышению численности микроорганизмов, участвующих в превращении органического вещества почвы, в ризосфере саженцев. Так, существенное увеличение всех изученных групп (кроме целлюлолитиков) произошло на варианте с АБ на сорте Таврическая на 3–7 млн КОЕ/г а.с.п., микромицетов – на 2.3 тыс. КОЕ/г а.с.п. по сравнению с контролем. Бактеризация корневой системы саженцев МБК способствовала существенному увеличению лишь числа аммонифицирующих бактерий на этом сорте на 4.7 млн КОЕ/г а.с.п. против контроля.
На сорте Мария на варианте с АБ наблюдалось существенное возрастание численности изученных нами эколого-трофических групп микроорганизмов кроме фосфатмобилизующих и целлюлолитических бактерий, в последнем случае создавалась тенденция к увеличению их численности по сравнению с контролем. В варианте с МБК наблюдалась тенденция к возрастанию числа бактерий основных эколого-трофических групп микроорганизмов относительно контроля – на 4–29 %. В варианте с использованием АБ выявлено существенное увеличение количества фосфатмобилизаторов в ризосфере саженцев сорта Таврическая – на 29 % против контроля.
Отмечено, что на варианте с АБ произошло существенное возрастание численности олигонитрофилов по сравнению с контролем: на 44 и 30 % в ризосфере груши сортов Мария и Таврическая соответственно (см. табл. 2). Что касается микромицетов, то они участвуют в деструкции органического вещества, гумусообразовании, а также способствуют повышению доступности биогенных элементов для растений. Нами установлено, что существенное возрастание числа микромицетов в ризосфере обоих сортов груши произошло на варианте с АБ: у сорта Мария на 49 %, у сорта Таврическая – на 31 % от контроля. На варианте с МБК создавалась лишь тенденция к увеличению числа микромицетов на уровне 4–6 % от контроля. Применение БП не оказало существенного влияния на численность целлюлолитических бактерий. Однако следует подчеркнуть, что использование АБ обеспечило увеличение количества целлюлолитиков в ризосфере груши сорта Таврическая и Мария на 14 и 20 % по сравнению с контролем соответственно.
Обсуждение
Проведенные нами исследования показали, что бактеризация корневой системы саженцев груши биоагентами БП способствовала улучшению зимостойкости заокулированных растений, усиливала рост и выход саженцев в питомнике, что подтверждает ранее полученные сведения для других плодовых саженцев (Klymenko et al., 2010; Grzyb et al., 2012). Показано, что как подвой, так и сорт влияли на степень таких изменений. Сорт Мария был более восприимчив к ассоциации с БП, чем Таврическая, а из подвоев на обоих сортах более продуктивными были саженцы, привитые на КА 53. Наиболее существенно на изменение показателей продуктивности питомника груши оказало использование АБ по сравнению с МБК, что подтверждает данные, полученные нами для саженцев яблони (Клименко и др., 2020). Воздействие БП на показатели плодородия почвы также было в основном положительным, наиболее существенным и достоверным (р ≤ 0.05) было увеличение содержания гумуса под действием МБК на сорте Мария (подвой КА 53), а также Р2О5 в почве под этим же сортом, привитом на ВА 29, что обусловлено присутствием в комплексе штамма Lelliottia nimipressuralis CCM 32-3, продуцирующего гумусоподобные вещества, способствующего повышению содержания органического вещества в почве, а также преобразованию слаборастворимых фосфатов в подвижные соединения (Чайковская и др., 2018). Содержание нитратного азота в большей мере увеличивалось под действием АБ, существенно на обоих сортах, привитых на ВА 29, что связано с азотфиксирующими свойствами биоагента АБ, а также существенным увеличением численности олигонитрофильных бактерий на этом варианте. Бактерии олигонитрофильной группы способны ассимилировать малые количества азотистых соединений из почвенного раствора, а также фиксировать азот атмосферы. Это способствует усилению роста растений за счет улучшения азотного питания и накоплению некоторого количества нитратного азота в почве, особенно под действием АБ (Титова, Козлов, 2012).
Определение численности микроорганизмов основных эколого-трофических групп, участвующих в трансформации органического вещества почвы, позволяет рассчитать эколого-физиологические индексы и коэффициенты для оценки взаимоотношений отдельных групп микроорганизмов (рис. 2). Коэффициент минерализации и иммобилизации Мишустина (КМИ), свидетельствующий об активности амилолитической части микробиоты в трансформации углеводов почвы и связывании свободного азота, был близок к единице в контроле, что свидетельствует о равновесии в процессах мобилизации и иммобилизации азота в черноземе и подтверждается данными В. И. Кулагиной с соавторами (2019). При применении БП КМИ в большинстве случаев снижался, более существенно и достоверно на варианте с МБК. Это свидетельствует о сбалансированности процессов минерализации, т. е. об отсутствии в настоящее время угрозы разложения гумусовых веществ чернозема (Гридасова и др., 2015).
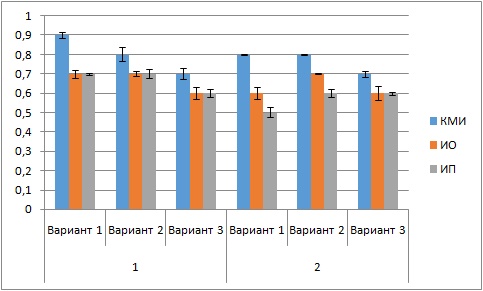
Рис. 2. Значения эколого-трофических индексов. КМИ – коэффициент минерализации по Мишустину, ИО – индекс олиготрофности, ИП – индекс педотрофности в ризосфере сортов: 1 – Таврическая, 2 – Мария на подвое ВА 29. Вариант 1 – контроль без БП, вариант 2 – АБ, вариант 3 – МБК (среднее и стандартное отклонение)
Fig. 2. Values of ecological and trophic indices. CMI - mineralization coefficient according to Mishustin, IO – oligotrophy index, IP – pedotrophy index. Variant 1 – control without BP, variant 2 – AB, variant 3 – MBC (mean and standard deviation)
Индекс олиготрофности показывает активность олиготрофной части микробоценоза почвы. В целом он был невысоким и мало изменялся под действием БП. Существенное увеличение этого индекса (р ≤ 0.05) наблюдалось только при применении АБ (вариант 2) на сорте Мария (см. рис. 2). Увеличение индекса может свидетельствовать о замедлении процессов деструкции органического вещества почвы и переходе биоценоза в более устойчивое состояние (Титова, Козлов, 2012).
Индекс педотрофности показывает степень развития микроорганизмов, как относящихся к автохтонной части почвы, так и участвующих в образовании гумусовых соединений. В контроле под обоими сортами груши этот индекс был низким, что свидетельствует о высоком антропогенном влиянии в подавлении автохтонной микробиоты. Применение БП на сорте Таврическая либо не изменяло его значения (вариант 2), либо снижало (вариант 3). На сорте Мария применение БП вызывало достоверное увеличение этого индекса, что показывает стабилизацию агроценоза и образование гумусоподобных органических веществ в почве.
Заключение
Установлено, что применение БП как биоудобрений в плодовом питомнике груши способствовало увеличению приживаемости окулянтов и их зимостойкости, максимально на сорте Мария под действием АБ на 9–11 % относительно контроля. Применение БП стимулировало рост саженцев груши, в большей мере АБ на сорте Мария, привитом на обоих подвоях на 23–26 %. Все это приводило к увеличению выхода саженцев груши в питомнике. Максимальная прибавка числа полученных саженцев на обоих сортах получена на подвое КА 53 при применении АБ: на сорте Мария – 15 (21 %), на сорте Таврическая – 8.5 тыс. шт./га (10 %) по сравнению с контролем. МБК способствовал получению дополнительно 14 тыс. саженцев (19 %) с 1 га на сорте Мария, привитом на КА 53.
Применение БП в агроценозе питомника груши приводило к изменению плодородия почвы. Под действием БП содержание гумуса под саженцами в основном оставалось стабильным или увеличивалось, максимально в варианте с КМП на саженцах сорта Мария (подвой КА 53). Если саженцы были привиты на КА 53, где наблюдалось значительное увеличение выхода саженцев под действием БП, происходило обеднение почвы элементами питания, особенно на сорте Мария (более сильнорослом), особенно при применении МБК, что требует внесения дополнительного количества минеральных удобрений. На саженцах, привитых на подвое ВА 29, при применении БП содержание подвижных форм элементов питания в почве оставалось стабильным или увеличивалось на 5–24 %, в большей степени при применении АБ на сорте Мария.
Установлено, что применение БП в плодовом питомнике груши, привитой на подвое ВА 29, положительно повлияло на численность бактерий основных эколого-трофических групп, участвующих в трансформации органического вещества почвы, на 15–50 %, в большей степени и достоверно при применении АБ на сорте Таврическая. На сорте Мария абсолютные величины всех групп микроорганизмов были ниже, но увеличение их численности под действием АБ для большинства групп было более значительным (20–56 % от контроля). Расчет эколого-трофических индексов показал, что применение АБ на сорте Мария свидетельствует о сбалансированности процессов минерализации гумусовых веществ чернозема, улучшении азотного питания растений, а также способствует повышению устойчивости агроценоза к негативным факторам окружающей среды (Титова, Козлов, 2012). На сорте Таврическая при применении БП эти индексы либо оставались неизменными, либо снижались, что отражает усиление деструкции органического вещества, снижение устойчивости агроценоза и необходимость пополнения запаса органического вещества почвы за счет органических удобрений. Таким образом, бактеризация оказалась более эффективной на сорте Мария при применении АБ. Если груша была привита на подвое КА 53, этот препарат обеспечивал наибольший выход саженцев при стабильном состоянии агроценоза; прививка на ВА 29 обеспечивала достоверное повышение продуктивности питомника на уровне 10 % от контроля при увеличении содержания элементов питания в почве.
Библиография
Гридасова О. В., Верховцева Н. В., Проценко А. А., Проценко Е. П., Савченко Л. А., Неведров Н. П. Особенности микробных сукцессий в вегетационной и многолетней динамике в черноземах заповедной луговой степи и черного пара // Проблемы агрохимии и экологии. 2015. № 4. С. 37–44.
Гурин А. Г. Физиологические аспекты применения минеральных удобрений в плодово-декоративном питомнике // RJOAS. 2016. № 3 (51). С. 92–98. DOI: 10.18551/rjoas.2016-03.10
Доспехов Б. А. Методика полевого опыта (с основами статистической обработки результатов исследований) . 4-е изд., перераб. и доп. М.: Колос, 1985. 416 с.
Иванченко В. И., Зотиков А. Ю. Комплексное влияние новых микробных препаратов на развитие привитых черенков винограда во время открытой стратификации // Виноградарство и виноделие. 2020. Т. 49. С. 157–160.
Клименко Н. И., Клименко О. Е., Попов А. И. Экологизация выращивания саженцев яблони // Бюллетень Государственного Никитского ботанического сада. 2020. Вып. 134. С. 72–80. DOI: 10.36305/0513-1634-2020-134-72–80
Клименко Н. Н. Оценка влияния микробных препаратов на укореняемость черенков винограда подвойного сорта Шасла х Берландиери 41 Б // Проблемы развития АПК региона. 2019. № 3 (39). С. 74–79.
Клименко О. Е., Клименко Н. И., Каменева И. А., Клименко Н. Н. Изменения в микробном ценозе ризосферы саженцев персика под влиянием комплекса микробных препаратов // Труды КубГАУ. 2016. Вып. 3 (60). С. 113−117.
Коломиец Э. И. Инновационные биотехнологии в экономике Республики Беларусь // Микробные биотехнологии. Фундаментальные и прикладные аспекты: Сб. науч. тр. 2011. Т. 3. С. 7–19.
Крыжко А. В., Смаглий Н. Н. Влияние штаммов Bacillus thuringiensis на ростовые и метаболические процессы в проростках Pisum sativum L. // Известия вузов. Прикладная химия и биотехнология. 2022. Т. 12, № 4. С. 557–565. DOI: 10.21285/2227-2925-2022-12-4-557-565.
Кузнецова А. П., Тыщенко Е. Л. Тенденции развития отечественного питомниководства на современном этапе // Труды КубГАУ. 2015. Вып. 4 (55). С. 124–128.
Кулагина В. И., Сунгатуллина Л. М., Тагиров Р. М., Рязанов С. С., Хисамова А. М. Выбор микробиологических показателей для выполнения интегральной эколого-биологической оценки почв при переувлажнении // Принципы экологии. 2019. № 4. С. 45–56.
Мишустин Е. Н. Микроорганизмы и плодородие почвы . М.: Изд-во АН СССР, 1956. 342 с.
Программа и методика сортоизучения плодовых, ягодных и орехоплодных культур / Под ред. Е. Н. Седова, Т. П. Огольцовой. Орел, 1999. 608 с.
Рябцева Т. В., Липская С. Л., Камзолова О. И. Влияние биологических и минеральных удобрений на биохимический состав плодов, листьев и агрохимические показатели почвы в саду яблони // Плодоводство. Самохваловичи, 2005. Т. 17, ч. 1. С. 166–171.
Сергеев Д. В., Исаев Р. Д. Влияние минеральных удобрений на биометрические показатели подвоев и однолетних саженцев груши в питомнике // Вестник МичГАУ. 2012. № 3. С. 102–105.
Теппер Е. З., Шильникова В. К., Переверзева Г. И. Практикум по микробиологии / Под ред. В. К. Шильниковой. 5-е изд., перераб. и доп. М.: Дрофа, 2004. 256 с.
Титова, В. И., Козлов А. В. Методы оценки функционирования микробоценоза почвы, участвующего в трансформации органического вещества: Научно-методическое пособие . Нижний Новгород, 2012. 64 с.
Тихонович И. А., Проворов Н. А. Симбиозы растений и микроорганизмов: молекулярная генетика агросистем будущего . СПб.: Изд-во Санкт-Петербургского ун-та, 2009. 209 с.
Формы микробных препаратов для сельского хозяйства / Т. Н. Мельничук, И. А. Каменева, Л. Ю. Гритчина . Симферополь: КГФУКЦ, 2007. 8 с.
Чайковская Л. А., Ключенко В. В., Баранская М. И., Овсиенко О. Л. Фосфатмобилизующие бактерии в агроценозах Крыма . Симферополь: ИТ «Ариал», 2018. 156 с.
Шапошников А. И., Белимов А. А., Кравченко Л. В., Виванко Д. М. Взаимодействие ризосферных бактерий с растениями: механизмы образования и факторы эффективности ассоциативных симбиозов (обзор) // Сельскохозяйственная биология. 2011. № 3. С. 16–22.
Aslantas R., Cakmakci R., Sahin F. Effect of plant growth promoting rhizobacteria on young apple tree growth fruit yield under orchard condition // Scientia Horticulture. 2007. Vol. 11, № 4. P. 371–377.
Grzyb Z. S., Piotrowski W., Bielicki P., Sas Paszt L., Malusà E. Effect of different fertilizers and amendments on the growth of apple and sour cherry rootstocks in an organic nursery // Journal of Fruit and Ornamental Plant Research. 2012. Vol. 20, № 1. P. 43–53.
Hassani M. A., Durán P., Hacquard S. Microbial interactions within the plant holobiont // Microbiome. 2018. № 6. P. 58. DOI: 10.1186/s40168-018-0445-0.
Klymenko O., Klymenko M., Kartyzhova L., Alechenkova Z. Cultivation of sweet cherry (Cerasusavium (L.) Moench) seedlings with using of phosphate-mobilizing microorganisms // Agronomy Research (Special Issue III). 2010. № 8. P. 633–636.
Liu M., Liu X., Cheng B.-S., Ma X.-L., Lyu X.-T., Zhao X.-F., Ju Y.-L., Min Z., Fang Y.-L. Selection and evaluation of phosphate-solubilizing bacteria from grapevine rhizospheres for use as biofertilizers // Spanish Journal of Agricultural Research. 2016. № 14 (4). e1106. DOI: 10.5424/sjar/2016144-9714.
Nazari M., Smith D. L. A PGPR-produced bacteriocin for sustainable agriculture: a review of thuricin 17 characteristics and applications // Frontiers in Plant Science. 2020. Vol. 11. P. 916. DOI: 10.3389/Fpls.2020.00916.
Raheem A., Shaposhnikov A., Belimov A. A., Dodd I. C., Ali B. Auxin production by rhizobacteria was associated with improved yield of wheat (Triticum aestivum L.) under drought stress // Archives of Agronomy and Soil Science. 2018. Vol. 64. P. 574–587. DOI: 10.1080/03650340.2017.1362105.
Vyas P., Kaur R. Culturable stress-tolerant plant growth-promoting bacterial endophytes associated with Adhatoda vasica // Journal of Soil Science and Plant Nutrition. 2019. Vol. 19. P. 290–298. DOI: 10.1007/ s42729-019-00028-9.
Благодарности
Работа выполнена в рамках госзадания Никитского ботанического сада FNNS-2022-0005 «Принципы и технологии создания экологически ориентированных, ресурсо- и почвосберегающих высокопродуктивных агроэкосистем (плодовых насаждений) для почвенно-климатических условий Крыма и юга России».






 © 2011 - 2026
© 2011 - 2026