Введение
Цезий – самый активный щелочной металл, распространен в низких концентрациях в почвенных растворах, преимущественно в виде одновалентного катиона Cs+, активно поглощается растениями и переносится по цепям питания (Greenwood, Earnshaw, 1997; Genies et al., 2021). Из 34 изотопов цезия с массовыми числами 114–148 только 133Cs стабильный, остальные – радиоактивные (Василенко, 1999). Искусственные радионуклиды поступают в атмосферу при испытаниях ядерного оружия и в результате аварий на АЭС (Сапожников и др., 2006; Konoplev et al., 2016; Mikami et al., 2015; Saito et al., 2015; Ihara et al., 2021). Изотопы 134Cs и 137Cs – β- и γ-излучатели, период полураспада 2.06 года и 30.17 года соответственно, что делает их опасными загрязнителями окружающей среды (Ihara et al., 2021). В результате аварий на Чернобыльской атомной электростанции (СССР) в атмосферу выброшено 85 ПБк 137Cs и 47 ПБк 134Cs, АЭС Три-Майл-Айленд (США) – 40 ПБк 137Cs, Фукусима-1 (Япония) – 8.8 ПБк 137Cs и 9.0 ПБк 134Cs (Сапожников и др., 2006; Imanaka et al., 2015). Наиболее радиоактивно загрязненными после катастрофы на ЧАЭС внутренними водоемами оказались непроточные озера на территориях, загрязненных 137Cs на уровне >15 Ки/км2 (Вакуловский и др., 2006). Стабильный цезий в повышенных концентрациях в почву и воду попадает из минералов, в частности поллуцита. Поллуцит – водный алюмосиликат цезия и натрия, основной природный источник цезия. Наибольшие залежи поллуцитовых руд находятся в Канаде (озеро Берник-Лейк) (Teerstra et al., 1992), где цезий может оказывать токсическое воздействие на окружающую среду (Hampton et al., 2004; Burger, Lichtscheidl, 2018).
Растения являются первичным звеном в трофических цепях. В экспериментах с растениями, выросшими в природных условиях, было показано, что ряска малая Lemna minor L. является одним из наиболее эффективных аккумуляторов цезия среди высших водных растений (Платонова и др., 2019). В настоящее время роль цезия для растений не изучена, более того, цезий признан токсичным для растений. Рассматриваются различные теории токсичности цезия. Цезий является аналогом калия, проникает через калиевые каналы, поэтому поглощение и токсичность цезия как химического вещества зависят от концентрации калия в среде. Внеклеточный цезий может предотвращать поглощение калия, что может привести к K-голоданию, но профили транскрипции у растений K-голодных и испытывающих Cs-стресс различны (Hampton et al., 2004). Это согласуется с интоксикацией цезием, возникающей в результате конкуренции между K+ и Cs+ за сайты связывания на основных K+-активированных белках, как было предложено Avery (1995). Есть несколько работ, где растения выращивались на низкокалиевых средах (Платонова и др., 2019; Hampton et al., 2004). Токсичность цезия может быть вызвана не только его способностью замещать калий. Внутриклеточный цезий взаимодействует с жизненно важными сайтами связывания в белках конкурентно и неконкурентно, нарушая их активность (Hampton et al., 2004).
На сегодняшний день принято считать, что растения не различают между стабильными и радиоактивными изотопами Cs+ (White, Broadley, 2000; Genius et al., 2021). Поступление, аккумуляция цезия активно изучаются с помощью его нерадиоактивных изотопов. Ряска малая подходит для фиторемедиации, особенно это актуально для небольших водоемов (Burger, Lichtscheidl, 2018). Знание особенностей фитотоксичности цезия на морфологическом и биохимическом уровне необходимы для успеха работ по восстановлению и очистке водных объектов.
Целью данного исследования было определение токсичности стабильного Cs для растений по морфологическим и биохимическим показателям.
Материалы
Растительный материал
В работе использовали лабораторную культуру ряски малой (Lemna minor L.) из коллекции Института биологии ФИЦ Коми НЦ УрО РАН. Удельную скорость роста рассчитывали согласно OECD (2006). Контрольные и экспериментальные растения выращивали на среде Штейнберга (Steinberg, 1946) в климатической камере Binder (16/8 часов свет/темнота, 24 ± 0.1 °С, интенсивность освещения 5000 люкс, влажность 70 %). Удвоение количества растений за период менее 60 часов было необходимым условием для работы.
Условия эксперимента
Растения выращивали на среде (в т. ч. содержит 3.46 ммоль/л KNO3) с добавлением цезия в концентрациях 0.17; 0.51; 0.85; 1.19; 1.36; 1.53; 2.55; 3.4 ммоль/л. В качестве источника цезия использовали стерильный раствор CsNO3. Через семь дней после начала эксперимента подсчитывали удельную скорость роста, число фрондов с хлорозами и некрозами, площадь поверхности фронда. Биохимические показатели (хлорофилл, каротиноиды, малоновый диальдегид) определяли через четыре дня после начала эксперимента. Эксперимент проводили в трех повторностях.
Методы
Определение удельной скорости роста
В емкости с 200 мл среды переносили колонии из 2–4 растений (всего по 9–12) из материнской культуры. Через семь дней послРе начала эксперимента проводили подсчет. Удельную скорость роста рассчитывали по формуле:
μi-j = (ln (Nj) – ln (Ni))/t,
где μi-j – средняя удельная скорость роста от времени i до времени j,
Nj – переменная теста в опыте во время j,
Ni – переменная теста в контроле во время i,
t – период времени от i до j (OECD, 2006).
Площадь и повреждения фрондов
Для расчета площади фрондов растения фотографировали. Фотографии анализировали с использованием программного обеспечения Image J (NIH, USA). В работе использовали соотношение площади растений в начале и в конце эксперимента (S2/S1). Через 7 дней после начала эксперимента производили подсчет поврежденных фрондов (с хлорозами и / или некрозами).
Определение хлорофиллов (а + b) и каротиноидов
Растения высушивали до исчезновения видимых капель при комнатной температуре, затем растирали 25 мг ряски с кварцевым песком и карбонатом кальция. После этого приливали 0.5 мл 96 % водного раствора этанола, выдерживали 30 мин при температуре 4 °С и центрифугировали 10 мин при 13000 g. Экстракт сливали, снова добавляли этанол и все повторяли до серой окраски осадка. Оптическую плотность проб определяли при 470, 649 и 664 нм на спектрофотометре Spectrumlab SS2107 (LEKI Instruments, Finland). Концентрацию пигментов рассчитывали согласно формулам (Lichtenthaler, 1987).
Определение малонового диальдегида (МДА)
50 мг высушенной при комнатной температуре ряски измельчали с кварцевым песком, добавляли 1.5 мл 20 % трихлоруксусной кислоты, центрифугировали 15 мин при 10000 g. После этого 0.3 мл супернатанта смешивали с 1.2 мл 0.5 % тиобарбитуровой кислотой, растворенной в 20 % трихлоруксусной кислоте. Полученную смесь выдерживали при 95 °С 30 мин, охлаждали и центрифугировали 15 мин при 10000 g. Определяли оптическую плотность при длине волн 532 и 600 нм на спектрофотометре Spectrumlab SS2107 (LEKI Instruments, Finland). Концентрацию МДА вычисляли по формуле
Cx = (E532 − E600) × Ve/k × ms × Va,
где Сx – содержание МДА, нмоль/г сырой массы; E532, 600 – оптическая плотность раствора; Va – объем экстракта, взятый для анализа, мл; Ve – объем экстракта, мл; k – коэффициент молярной экстинкции МДА: 156 мМ-1 × см-1; ms – масса образца для экстракции (Heath, Packer, 1968; Молекулярно-генетические и биохимические методы…, 2012).
Статистическая обработка
Для достоверного определения отличий в опыте и контроле использовали критерии Стьюдента, Манна – Уитни, односторонний дисперсионный анализ. Статистическую обработку осуществляли с использованием программного пакета Statistica 6.0 (StatSoft, USA).
Результаты
Изменение удельной скорости роста, площади и поврежденности фрондов
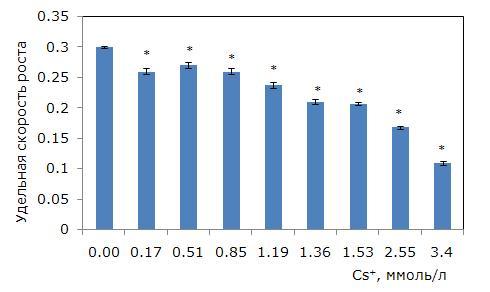
В качестве основного параметра при оценке фитотоксичности использовалась удельная скорость роста лабораторной культуры ряски малой. Как показал анализ данных, скорость роста растений обратно пропорциональна концентрации ионов металла в среде (рис. 1). Зависимость «доза – эффект» линейная и описывается уравнением y = 0.29 – 0.05x. Минимально действующая концентрация составила 0.17 ммоль/л. В интервале 0.17–0.85 ммоль/л цезия скорость роста снизилась на 10–13 % относительно контроля, а при 1.19; 1.36; 2.55 ммоль/л – на 21, 30 и 44 % соответственно. Максимальная из рассматриваемых концентраций 3.4 ммоль/л привела к снижению темпов роста на 64 %.
Рис. 1. Изменение удельной скорости роста ряски малой в зависимости от содержания ионов цезия в среде (7-дневный тест). * – отличия достоверны по сравнению с контролем (p ≤ 0.05), критерий Стьюдента
Fig. 1. Change in the specific growth rate of duckweed depending on the content of cesium ions in the medium (7-day test). * – differences are significant in comparison with the control (p ≤ 0.05), Student’s t-test
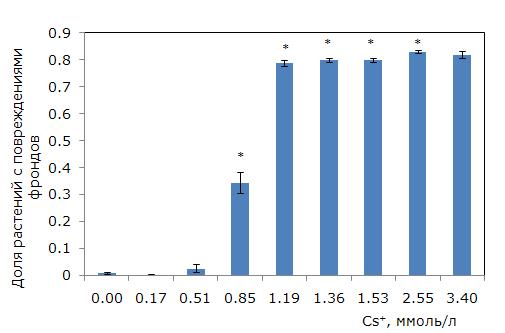
Для экспериментов выбраны растения без видимых признаков повреждения листоподобной пластинки или фронда. Через 7 дней в контроле возможно появление хлорозов, но доля таких растений составила менее 5 %. Отличный от контрольных растений уровень повреждений появился при 0.85 ммоль/л цезия (рис. 2). После воздействия ионов металла у дочерних фрондов появились белесые пятна, размер которых увеличивался с ростом концентрации токсиканта. При концентрации 1.53 ммоль/л корни у родительских особей отмирали, а у развившихся молодых растений были светлыми, небольшими. Максимальные концентрации привели к повреждению фрондов у 83 % растений.
Рис. 2. Доля поврежденных фрондов ряски малой в зависимости от содержания ионов цезия в среде (7-дневный тест). * – отличия достоверны по сравнению с контролем (p ≤ 0.05), критерий Манна – Уитни
Fig. 2. Change in the proportion of damaged fronds, depending on the content of cesium ions in the medium. * – the differences are significant in comparison with the control (p ≤ 0.05), Mann – Whitney’s test
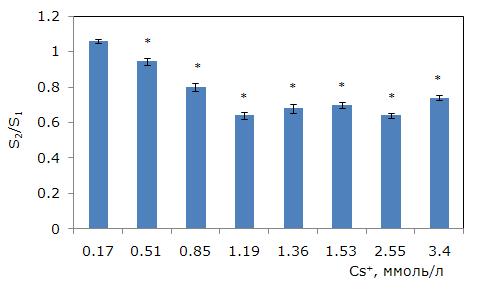
Зависимость между средней площадью фрондов и концентрацией ионов цезия нелинейная. Цезий приводит к сокращению площади, начиная с концентрации 0.51 ммоль/л (рис. 3). Минимальная средняя площадь при 1.19 ммоль/л составила 64 % от первоначальной. При дальнейшем увеличении концентрации цезия в среде средняя величина возросла за счет снижения доли дочерних растений и увеличения вклада родительских особей. У контрольных растений площадь через семь дней не изменилась (соотношение S2/S1 = 1, где S1 – средняя площадь растений в первый день, S2 – средняя площадь растений через 7 дней).
Рис. 3. Изменение площади фрондов ряски малой в зависимости от концентрации ионов цезия в среде (S2/S1 – отношение площадей фрондов, S1 – первоначальная площадь фрондов, мм; S2 – площадь фрондов через 7 дней, мм). * – отличия достоверны по сравнению с контролем (p ≤ 0.05), критерий Стьюдента
Fig. 3. Changes in the average frond area (S2/S1, where S1 is the initial area, S2 is the area after 7 days). * – differences are significant compared to the control (p ≤ 0.05), Student's t-test
Таким образом, при добавлении в среду цезия минимально действующая концентрация варьировала в зависимости от показателя. Наиболее чувствительным параметром оказалась удельная скорость роста, а наименее – площадь фрондов. При оценке уровня повреждений необходимо проанализировать данные по содержанию хлорофиллов a + b и каротиноидов.
Содержание хлорофиллов (a + b) и каротиноидов
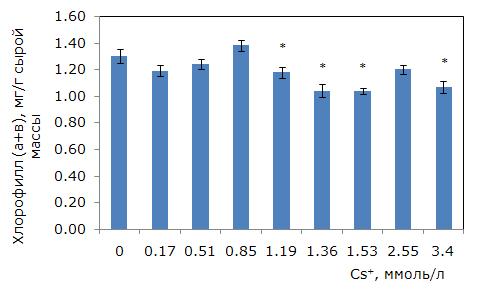
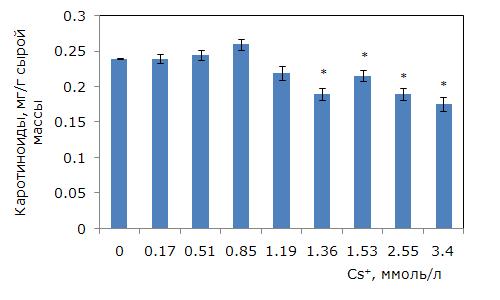
При росте концентрации цезия в среде уровень фотоассимилирующих пигментов снизился (однофакторный дисперсионный анализ, p ≤ 0.01). Минимально действующая концентрация цезия, приводящая к снижению суммы хлорофиллов (a + b), составила 1.19 ммоль/л (рис. 4). Самый низкий уровень пигментов при 1.36 и 1.53 ммоль/л, что на 20 % меньше контрольного. Средний уровень каротиноидов снизился при концентрации цезия 1.36 ммоль/л (рис. 5). Наименьшие значения были при 2.55 и 3.4 ммоль/л цезия, что на 18 % ниже, чем в контроле.
Рис. 4. Изменение содержания суммы хлорофиллов (a + b) в зависимости от концентрации ионов цезия в среде. * – отличия достоверны по сравнению с контролем (p ≤ 0.05), критерий Стьюдента
Fig. 4. Changes in chlorophyll (a + b) content, depending on the concentration of cesium ions in the medium. * – differences are significant in comparison with the control (p ≤ 0.05), Student’s t-test
Рис. 5. Изменение содержания каротиноидов в зависимости от концентрации ионов цезия в среде. * – отличия достоверны по сравнению с контролем (p ≤ 0.05), критерий Стьюдента
Fig. 5. Changes in the content of carotenoids depending on the concentration of cesium ions in the medium. * – differences are significant in comparison with the control (p ≤ 0.05), Student’s t-test
Содержание малонового диальдегида (МДА)
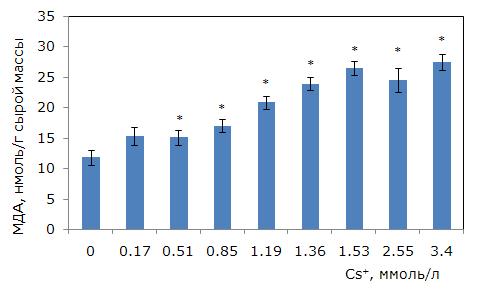
МДА характеризует уровень перекисного окисления липидов мембран при окислительном стрессе от воздействия различных стрессоров, в т. ч. химической природы. При росте концентрации цезия происходило увеличение уровня МДА (однофакторный дисперсионный анализ, р ≤ 0.01). При 0.51 ммоль/л цезия концентрация МДА выше, чем в контроле, на 29.4 %, при 0.85 ммоль/л – на 44 %, а при 1.36 – в 2 раза (p ≤ 0.05). Наиболее высокий уровень МДА при 3.4 ммоль/л цезия, в 2.3 раза выше, чем в контроле (рис. 6).
Рис. 6. Изменение содержания малонового диальдегида в клетках ряски малой в зависимости от концентрации ионов цезия в среде для культивирования. * – отличия достоверны по сравнению с контролем (p ≤ 0.05), критерий Манна – Уитни
Fig. 6. Changes in the content of malondialdehyde in duckweed cells depending on the concentration of cesium ions in the medium. * – differences are significant in comparison with the control (p ≤ 0.05), Mann – Whitney’s test
Обсуждение
133Cs считается условно нетоксичным металлом, т. к. в окружающей среде он присутствует в достаточно низких концентрациях. Средняя мировая концентрация цезия в реках составляет 0.011 мг/л (Gaillardet et al., 2003, Mathurin et al., 2014). Несравнимо большую опасность представляет загрязнение радиоцезием. 134Cs и 137Cs – искусственные радионуклиды, попадающие в природные водоемы, почву в результате работы предприятий ядерно-топливного цикла, при хранении радиоактивных отходов, а также аварийных ситуациях. Среднегодовые уровни объемной активности (кБк/м3) 137Cs в р. Припять в створе г. Чернобыль в 1986 г. составляли 1.6 кБк/м3 (Twenty-five years…, 2011), что во много раз превышает современные нормы радиационной безопасности. Высокие средние активности измерены в водоемах-хранилищах жидких радиоактивных отходов предприятия атомной промышленности ПО «Маяк» (Пряхин и др., 2009). 137Cs может образовываться до 300 лет после окончательного захоронения обедненного отработавшего топлива из-за его высокого выхода при делении 235U (6.3 % топлива с обедненным ураном) (Söderlund et al., 2011). Анализ действия радионуклидов как поллютантов на экосистемы осложняется двойственностью загрязнения, сочетанными эффектами радиационного и химического воздействия на живые организмы.
В данной работе лабораторную культуру ряски малой культивировали на среде Штейнберга с добавлением стабильного цезия для изучения собственной токсичности металла для водных растений. Полученные действующие концентрации оказались в миллимолярном диапазоне, что на несколько порядков выше тех, что встречаются в природе и описаны для радиоактивно загрязненных водоемов. Наиболее радиоактивно загрязненным водоемом в мире было озеро Карачай (В-9), которое на данный момент законсервировано как хранилище, с активностью 1.6·107 Бк/л (Осипов и др., 2011), что в миллион раз превышает нормы радиационной безопасности (11 Бк/л) (НРБ, 1999). В пересчете на концентрацию это составляет 4.8 мкг/л. Токсичность нерадиоактивного цезия на порядок меньше, чем у эссенциальных элементов. Токсические эффекты проявляются у растений при меньших концентрациях радиоцезия по сравнению с химической токсичностью стабильного цезия. Гамма-излучение испускается цезием и продуктами его распада, такими как 137Ba, из внешних источников (воздух, вода и почва). Бета-частицы реагируют с организмами в основном после включения (Burger, Lichtscheidl, 2018).
Загрязнение воды радиоцезием представляет собой чрезвычайно серьезную экологическую проблему. Высокий потенциал водных растений по поглощению элементов листьями и корнями (ризофильтрация; удаление элементов из воды корневым поглощением) следует использовать для удаления 137Cs из водной среды (Kamel et al., 2007). Концентрации 137Cs в водных растениях могут быть в 10000 раз выше, чем в окружающей воде (Pinder et al., 2006; Burger, Lichtscheidl, 2018). Ряска малая способна накапливать более 3000 мг/кг цезия (Платонова и др., 2019). Растение обладает потенциалом для фиторемедиации радиоактивно загрязненных водоемов, т. к. имеет широкую экологическую валентность. Угнетение роста при действии стабильного цезия происходит от 0.17 ммоль/л, что выше, чем встречается в реальных условиях. Как показали наши предыдущие исследования, воздействие γ-излучения на скорость роста происходит при дозе от 7 Гр (Боднарь и др., 2016). Это подтверждает возможность использования Lemna minor для фиторемедиации загрязненных радионуклидами водоемов.
В растительных клетках до сих пор не найдено специфических транспортеров для цезия. Cs+ использует транспортеры калия для проникновения в растения и их клетки. На коэффициенты переноса цезия и радиоцезия влияет присутствие других элементов. Поэтому очень важно учитывать тип и питательный статус ростового раствора, где рассматривается поглощение цезия растениями (Burger, Lichtscheidl, 2018). При недостатке макро- и микроэлементов, действии излучения токсичность цезия может проявляться и при более низких концентрациях (Платонова и др., 2019).
Цезий негативно влияет на изменение площади фрондов у ряски. Средняя площадь фрондов сокращается до 36 %. Причина в том, что ионы не задерживаются корнями, а чрезвычайно подвижны. Растения способны поглощать цезий как листьями, так и корнями. Внутри растений цезий очень подвижен и может распределяться по различным органам (Yan et al., 2013). Одновалентные катионы, такие как Cs+, с большей вероятностью поглощаются листьями, чем двухвалентные, такие как Sr2+, и легко мигрируют через кутикулы (Fregoni, 1985; Carini, Lombi, 1997; Madoz-Escande et al., 2004).
Одним из специфических признаков действия цезия является обесцвечивание фрондов. Снижение уровня фотосинтетических пигментов происходит уже на 4-е сутки, начиная с концентрации 1.19 ммоль/л. Zhang и Liu (2018) показали на Brassica juncea, что в условиях избытка цезия снижалось содержание хлорофилла и фотохимическая активность, повреждалась ФСII в листьях. Cs+ препятствовал экспрессии генов метаболизма хлоропластов и ингибировал экспрессию PsaB, PsbC, PetF, LHCA1 и LHCB5. Стабильный Cs приводил к аномальной экспрессии генов, связанных с путем фотосинтеза, блокируя электронный транспортный процесс от пластохинона-QA к пластохинону-QB (Zhang, Liu, 2018).
Цезий не является редокс-активным металлом, но его избыток обладает прооксидантными эффектами за счет его участия в метаболических процессах по причине схожести с калием и способности его замещать. Максимальный уровень МДА при воздействии ионов меди как редокс-активного металла в 2 раза выше, чем при избытке цезия, и в 4 раза выше, чем в контроле (Боднарь, Чебан, 2020). Изменение концентрации МДА в зависимости от концентрации цезия может использоваться в экотоксикологических исследованиях при загрязнении стабильными и радиоактивными изотопами.
Заключение
Стабильный цезий в концентрациях, встречающихся в природе, мало токсичен для ряски малой. Токсичность радиоцезия обусловлена в большей мере его радиоактивностью, вред от цезия как от химического вещества не так значителен, как от радионуклида. Особенностью токсического действия цезия на ряску в миллимолярных концентрациях является угнетение роста, обесцвечивание растений, снижение площади листоподобной поверхности. Цезий в концентрациях от 0.51 ммоль/л обладал прооксидантным действием. На биохимическом уровне происходило разрушение хлорофилла и каротиноидов.
Библиография
Боднарь И. С., Чебан Е. В. Влияние 24-эпибрассинолида на ростовые показатели, уровень окислительного стресса и фотосинтетических пигментов ряски малой (Lemna minor L.) после воздействия тяжелых металлов // Принципы экологии. 2020. № 1. С. 27–42. DOI: 10.15393/j1.art.2020.9422.
Боднарь И. С., Юшкова Е. А., Зайнуллин В. Г. Влияние γ-излучения на морфометрические характеристики ряски малой (Lemna minor L.) // Радиационная биология. Радиоэкология. 2016. Т. 56, № 6. С. 617–622. DOI: 10.7868/S0869803116060035.
Вакуловский С. М., Газиев Я. И., Колесникова Л. В., Петренко Г. И., Тертышник Э. Г., Уваров А. Д. 137Cs и 90Sr в поверхностных водных объектах Брянской области в 1987–2002 гг. // Атомная энергия. 2006. Т. 100, № 1. С. 68–74.
Василенко И. Я. Радиоактивный цезий-137 // Природа. 1999. № 3. С. 70–76.
Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Вл. В. Кузнецова, В. В. Кузнецова, Г. А. Романова. М.: Бином. Лаб. знаний, 2012. 487 с.
Нормы радиационной безопасности (НРБ 99) . М.: Минздрав России, 1999. 115 с.
Осипов Д. И., Духовная Н. И., Тряпицына Г. А., Дерябина Л. В., Пряхин Е. А. Планктонные сообщества озера Карачай // Вопросы радиационной безопасности. 2011. № 5. С. 50–59.
Платонова Е. В., Карташов А. В., Беляев Д. В., Карпычев И. В. Гипераккумуляция цезия ряской Lemna minor // Известия Самарского НЦ РАН. 2019. Т. 21, № 2. С. 51–59.
Пряхин Е. А., Дерябина Л. В., Гаврилова Е. В., Тряпицына Г. А., Аклеев А. В. Некоторые показатели состояния биоты водоема В-17. Пилотные исследования // Вопросы радиационной безопасности. 2009. № 5. С. 86–91.
Сапожников Ю. А., Алиев Р. А., Калмыков С. Н. Радиоактивность окружающей среды . М.: Бином. Лаб. знаний, 2006. 286 с.
Avery S. V. Caesium accumulation by microorganisms: uptake mechanisms, cation compartmentalization and toxicity // Journal of Industrial Microbiology. 1995. Vol. 14. P. 76–84. DOI: 10.1007/BF01569888.
Burger A., Lichtscheidl I. Stable and radioactive cesium: A review about distribution in the environment, uptake and translocation in plants, plant reactions and plants’ potential for bioremediation // Science of The Total Environment. 2018. Vol. 618. P. 1459–1485. DOI: 10.1016/j.scitotenv.2017.09.298.
Carini F., Lombi E. Foliar and soil uptake of 134Cs and 85Sr by grape vines // Science of the Total Environment. 1997. Vol. 207. P. 157–164. DOI: 10.1016/s0048-9697(97)00261-1.
Fregoni M. Viticoltura Generale. Roma: REDA, 1985. pp. 172-239.
Gaillardet J., Viers J., Dupré B. Trace elements in river waters // Treatise on Geochemistry / Eds. D. H. Heinrich, K. T. Karl. Amsterdam: Elsevier-Pergamon, 2003. P. 225–272. DOI: 10.1016/B0-08-043751-6/05165-3.
Genies L., Martin L., Kanno S., Chiarenza S., Carasco L., Camilleri V., Vavasseur A., Henner P., Leonhardt N. Disruption of AtHAK/KT/KUP9 enhances plant cesium accumulation under low potassium supply // Physiol Plant. 2021. Vol. 173 (3). P. 1230–1243. DOI: 10.1111/ppl.13518.
Greenwood N. N., Earnshaw A. Chemistry of the Elements (2nd Ed.). Pergamon Press, 1997. 1341 p.
Hampton R. R., Hampstead B. M., Murray E. A. Selective hippocampal damage in rhesus monkeys impairs spatial memory in an open-field test // Hippocampus. 2004. Vol. 14 (7). P. 808–818. DOI: 10.1104/pp.104.046672.
Heath R. L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Archives in Biochemistry and Biophysics. 1968. Vol. 125. P. 189–198.
Ihara H., Kumagai A., Hori T., Nanba K., Aoyagi T., Takasaki M., Katayama Y. Direct comparison of bacterial communities in soils contaminated with different levels of radioactive cesium from the first Fukushima nuclear power plant accident // Science of the Total Environment. 2021. P. 1–8. DOI: 10.1016/j.scitotenv.2020.143844.
Imanaka T., Hayashi G., Endo S. Comparison of the accident process, radioactivity release and ground contamination between Chernobyl and Fukushima-1 // Journal of Radiation Research. 2015. Vol. 56, No S1. P. 56–61. DOI: 10.1093/jrr/rrv074.
Kamel H., Eskander S., Aly M. Physiological response of Epipermnum aureum for cobalt-60 and casium-137 translocation and rhizofiltration // Int. J. Phytorem. 2007. Vol. 9. P. 403–417. DOI: 10.1080/15226510701606281.
Konoplev A. V., Golosov V. N., Yoschenko V. I., Nanba K., Onda Y., Takase T., Wakiyama Y. Vertical distribution of radiocesium in soils of the area affected by the Fukushima Dai-ichi nuclear power plant accident // Eurasian Soil Sci. 2016. Vol. 49. P. 570–580. DOI: 10.1134/S1064229316050082.
Lichtenthaler H. K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Methods in Enzymology. 1987. № 148. P. 350–382. DOI: 10.1016/0076-6879(87)48036-1.
Madoz-Escande C., Henner P., Bonhomme T. Foliar contamination of Phaseolus vulgaris with aerosols of 137Cs, 85Sr, 133Ba and 123mTe: influence of plant development stage upon contamination and rain // J. Environmental Radioactivity. 2004. Vol. 73. P. 49–71. DOI: 10.1016/j.jenvrad.2003.08.001.
Mathurin F. A., Аström M. E., Drake H., Maskenskaya O. M., Kalinowski B. E. REE and Y in groundwater in the upper 1.2 km of Proterozoic granitoids (Eastern Sweden) – Assessing the role of composition and origin of groundwaters, geochemistry of fractures, and organic/inorganic aqueous complexation // Geochim. Cosmochim Acta. 2014. Vol. 144. P. 342–378. DOI: 10.1016/j.gca.2014.02.001.
Mikami S., Maeyama T., Hoshide Y., Sakamoto R., Sato S., Okuda N. Spatial distributions of radionuclides deposited onto ground soil around the Fukushima Daiichi nuclear power plant and their temporal change until December 2012 // Journal of Environmental Radioactivity. 2015. Vol. 139. P. 320–343. DOI: 10.1016/j.jenvrad.2014.09.010.
OECD Guidelines for the testing chemicals. Lemna sp. Growth Inhibition Test. Organisation for Economic Co-operation and Development. Paris, 2006. 22p.
Pinder III J., Hinton T., Whicker F. Foliar uptake of cesium fro the water column by aquatic macrophytes // J. Environ. Radioact. 2006. Vol. 85. P. 23–47. DOI: 10.1016/j.jenvrad.2005.05.005.
Saito K., Tanihata I., Fujiwara M., Saito T., Shimoura S., Otsuka T., et al. Detailed deposition density maps constructed by large-scale soil sampling for gamma-ray emitting radioactive nuclides from the Fukushima Dai-ichi nuclear power plant accident // Journal of Environmental Radioactivity. 2015. Vol. 139. P. 308–319. DOI: 10.1016/j.jenvrad.2014.02.014.
Söderlund M., Lusa M., Lehto J., Hakanen M., Lahdenperä, A. Sorption of iodine, chlorine, technetium and cesium in soil. Posiva Working Report. 2011. 04. 130 p.
Steinberg R. Mineral requirement of Lemna minor L. // Plant Physiol. 1946. Vol. 21. P. 42–48. DOI: 10.1104/pp.21.1.42.
Teerstra D. K., Cerny P., Chapman R. Compositional heterogeneity of pollucite from High Grade Dyke, Maskwa Lake, southeastern Manitoba // Canadian Mineralogist. 1992. Vol. 30. P. 687–697.
Twenty-five years after Chornobyl accident: safety for the future. National report of Ukraine. Kyiv: KIM, 2011. 328 p.
White P. J., Broadley M. R. Mechanisms of caesium uptake by plants // New Phytol. 2000. Vol. 147. P. 241–256.
Yan D., Zhao Y., Lu A., Wang S., Xu D., Zhang P. Effects of accompying anions on cesium retention and translocation via droplets on soybean leaves // J. Environmental Radioactivity. 2013. Vol. 126. P. 232–238. DOI: 10.1016/j.jenvrad.2013.08.009.
Zhang Y., Liu G. Effects of cesium accumulation on chlorophyll content and fluorescence of Brassica juncea L. // Journal of Environmental Radioactivity. 2018. Vol. 195. P. 26–32. DOI: 10.1016/j.jenvrad.2018.09.017.
Благодарности
Работа выполнена в рамках темы государственного задания «Действие ионизирующего излучения и факторов нерадиационной природы на биологические объекты и биогенная миграция тяжелых естественных радионуклидов» ИБ ФИЦ Коми НЦ УрО РАН (№ 122040600024-5).






 © 2011 - 2025
© 2011 - 2025