Введение
Условия почвенной среды играют приоритетную экологическую роль в жизни и разнообразии почвенных микроорганизмов, что ярко проявляется в интразональных почвах с четко выраженными лимитирующими факторами. В засоленных почвах ими являются щелочная реакция среды, накопление водорастворимых солей (натрия в солонцах более 15 % от суммы обменных катионов), большая плотность, малая водопроницаемость (Семендяева, 2002). Все это формирует специфический микробный ценоз и сильно ограничивает продуктивность растений. Сельскохозяйственное использование таких почв связано с их преобразованием с помощью гипса или длительной мелиорацией травами. Эти приемы рассоляют солонец, трансформируют его биологические свойства (Елизаров и др., 2019; Semendyaeva et al., 2014) и в конечном итоге в разы увеличивают массу трав. Длительное использование фитомелиорантов экономически предпочтительнее, чем разовое внесение гипса. На солонцах Барабинской низменности Сибири, площадь которых составляет 3686 тыс. га, солетолерантные травы-мелиоранты рекомендовано возделывать в кормовых севооборотах (Константинов, Кучеренко, 2000). Это позволяет сочетать положительный эффект воздействия на почву самой культуры с воздействием механической обработки (агробиологический метод мелиорации). При относительно невысоких концентрациях солей на засоленной почве рекомендовано залужение бобовыми и злаковыми травами (Константинов, Кучеренко, 2000; Суюндуков и др., 2007). Такой подход возможен не только на интразональных почвах, но и на вторично засоленных пахотных землях, которых сегодня насчитывается 950 млн га (Gao, 2020).
Влияние характера растительности на сообщество микроорганизмов прикорневой зоны (ризосферы) изучено в большом количестве исследований. Наиболее полно микробиом (культивируемые и некультивируемые формы микроорганизмов) был охарактеризован с появлением метода высокопроизводительного секвенирования и метагеномики (Handelsman, 2004; Gottel et al., 2011; Knief et al., 2012; Mendes et al., 2014). Было показано, что изменения в составе ризосферного микробиома связаны главным образом с видом растительности, а фактор почвы является следующим по силе воздействия (Girvan et al., 2003; Berg et al., 2009). Микробиом изучался под однодольными и двудольными растениями (Coleman-Derr et al., 2016). Под последними повышенное представительство в микробиоценозе было отмечено у филлумов Actinobacteria (семейство Streptomicetaceae) и Proteobacteria (Pseudomonadaceae), под однодольными растениями – у Bacteroidetes и Rhizobiales (Bulgarelli et al., 2015).
В Барабинской низменности Западной Сибири влияние севооборотов с многолетником кострецом безостым (однодольное растение) и двулетником донником (двудольное) на солонцы изучается в динамике более 30 лет. Направление трансформации микрофлоры солонцов в первые 20 лет возделывания кормовых севооборотов показано в работе Т. Г. Ломовой, Л. Н. Коробовой (2015). Дальнейшие изменения в микробоценозе под воздействием севооборотов отражены в работах Л. Н. Коробовой (2018), В. С. Риксен, Л. Н. Коробовой (2021а) и В. С. Риксен с соавторами (2021б). Но совершенно неизученным остался вопрос о том, что происходит с почвенной микрофлорой трансформированного севооборотами солонца после того, как, отказавшись от его механического рыхления, часть севооборотной площади залужили, т. е. оставили воздействие на почву только трав-мелиорантов.
Цель данной работы – показать изменения в микрофлоре солонца мелкого и содержании солей, произошедшие за 13 лет залужения почвы травосмесью костреца и люцерны после разных кормовых севооборотов.
Материалы
Исследования провели в Чановском районе Новосибирской области на стационаре СибНИИ кормов СФНЦА РАН (55.389º с. ш., 78.927º в. д.). Природно-климатическая зона – лесостепь Центрально-Барабинской низменности, отличающаяся умеренно-холодной зимой и теплым, в отдельные дни жарким летом со средним коэффициентом увлажнения 0.67. Рельеф опытного участка равнинный. В естественно-луговых фитоценозах произрастают кермек Гмелина, бескильница, полынь азотистая, волоснец солончаковый и луговое разнотравье (Вагина, 1962).
Объекты исследования:
- бактериальный комплекс солонцов;
- солонец мелкий целины (солонец луговый гидроморфный; WRB, 2006, Gleyic Solonetz Albic.), высокостолбчатый средненатриевый содово-сульфатного типа засоления, тяжелого гранулометрического состава;
- солонец мелкий, залуженный кострецом и люцерной в течение 13 лет; травосмесь посеяна после 20-летнего возделывания севооборотов. Химические характеристики измененного травосеянием солонца приведены в работе Н. В. Елизарова с соавторами (2019).
Микрофлору изучали в вариантах: 1) целина; 2) залужение после севооборота с донником; 3) залужение после севооборота с кострецом.
Севообороты в солонцовом стационаре были представлены 6 полями. Севооборот с донником: 1-е поле – донник 1-го года жизни с покровной культурой суданской травой; 2-е поле – донник 2-го года жизни; 3-е поле – овес на зерносенаж; 4–6-е поля – повторение 1–3-го. Севооборот с кострецом безостым: 1-е поле – просо; 2-е поле – кострец безостый с покровной культурой просом; 3–6-е поля – кострец безостый.
В севооборотах и на залужении сотрудниками СибНИИ кормов высевались донник желтый сорта Альшеевский, кострец безостый сорта СибНИИСХоз 189, люцерна синегибридная сорта Омская 8893. Обработка почвы в севооборотах – послойное фрезерование на глубину 8–10 см либо дискование тяжелыми боронами раз за ротацию, а затем безотвальное рыхление стойками СибИМЭ до 30–35 см. На залужении обработка почвы отсутствует.
Почвенные образцы отбирали в первой декаде августа в 2016, 2018–2020 гг. из слоя 0–20 см (в целине 0–15) на нечетных делянках стационара площадью 200 м2 в 10 повторениях с каждой делянки по диагональной трансекте. Для классических микробиологических исследований составляли один смешанный образец, для метагеномного анализа в 2020 г. четыре смешанных образца.
Методы
Общее содержание солей в почве определялось с помощью кондуктометра КЛ-С-1 по удельной электропроводности почвенной пасты (УЭП), разведенной водой в соотношении 1:5.
Таксономическую принадлежность бактерий выявляли в образцах 2020 г. на базе ИХБФМ РАН в ЦКП «Геномика» (г. Новосибирск) методом высокопроизводительного секвенирования последовательностей участка V3–V4 гена 16S рРНК. Тотальная ДНК из образцов была выделена с помощью набора DNeasy PowerSoil Kit (Qiagen). Пробы секвенировались на приборе MiSeq (Illumina, США), последовательности ОТЕ отнесены к таксонам с помощью SINTAX (Edgar, 2016). Повторность анализа почвенных образцов – четырехкратная.
Статистическая значимость различий в представительстве таксонов и индексах разнообразия (анализировали Usearch v11.0.667) по вариантам доказывалась с помощью U-критерия Манна – Уитни.
В классических микробиологических исследованиях на плотных питательных средах методом предельных разведений изучали численность микроорганизмов, усваивающих органический (МПА) и минеральный азот (КАА), и олигонитрофилов (ГА). Повторность посева на 1 питательную среду – 3 чашки на смешанный образец.
На основании полученных данных рассчитывали коэффициент минерализации (КАА/МПА) и олиготрофности (ГА/МПА).
Результаты
Метагеномное исследование микробиома показало, что фитомелиорация солонца (включающая 20-летнее возделывание кормовых севооборотов и последующее тринадцатилетнее залужение кострецом и люцерной) на биоразнообразие бактерий повлияла в разных таксонах по-разному (табл. 1). Разнообразие филумов в фитомелиорируемом солонце возросло: на залужении после севооборота с кострецом на 18 %, после севооборота с донником на 11.1 %. В остальных таксонах изменения на залужении не были однонаправленны и больше были связаны с видом трав, возделываемых ранее в севообороте, чем с влиянием позже посеянной травосмеси. Так, в варианте «залужение после севооборота с донником» выявился 361 бактериальный род из 197 семейств, в то время как в целине их было меньше на 9.1 %. При залужении после севооборота с кострецом родовой состав бактерий оказался на 8.5 % менее представительным, чем в целине, и они относились к 181 семейству.
Таблица 1. Таксономическое представительство в микробиомах целинного и фитомелиорированного травами солонца мелкого
| Таксон | Вариант | ||
| Целина | Залужение после севооборота с донником | Залужение после севооборота с кострецом | |
| Phylum | 18 | 20 | 22 |
| Class | 66 | 62 | 60 |
| Order | 113 | 109 | 100 |
| Family | 191 | 197 | 181 |
| Genus | 331 | 361 | 303 |
Среди домена Bacteria везде доминировали 14 филумов: Actinobacteria, Acidobacteria, Proteobacteria, бактерии, выделенные как unc_Bacteria, Verrucomicrobia, Gemmatimonadetes, Bacteroidetes и др. (рисунок). Долевое присутствие их в целинном и трансформированном травами солонце различалось, что показано для каждого из четырех повторений изучаемых вариантов на рисунке. В целине максимально распространенными оказались микроорганизмы филума Actinobacteria, представительство которых составило 30.3 % (табл. 2). Вторыми были прокариоты из филума Acidobacteria, составляющие до 25.1 % микробиома, третьими Proteobacteria (13.2 %). У них долевое присутствие оказалось ниже, чем у ацидобактерий, в 1.9 раза и в 2.3 раза ниже, чем у актинобактерий. Такое распределение с преобладанием актинобактерий, по-видимому, является характерным для микробиомов засоленных почв, что находит подтверждение в работах N. Fierer с соавторами (2012) и T. P. Makhalanyane с соавторами (2015).
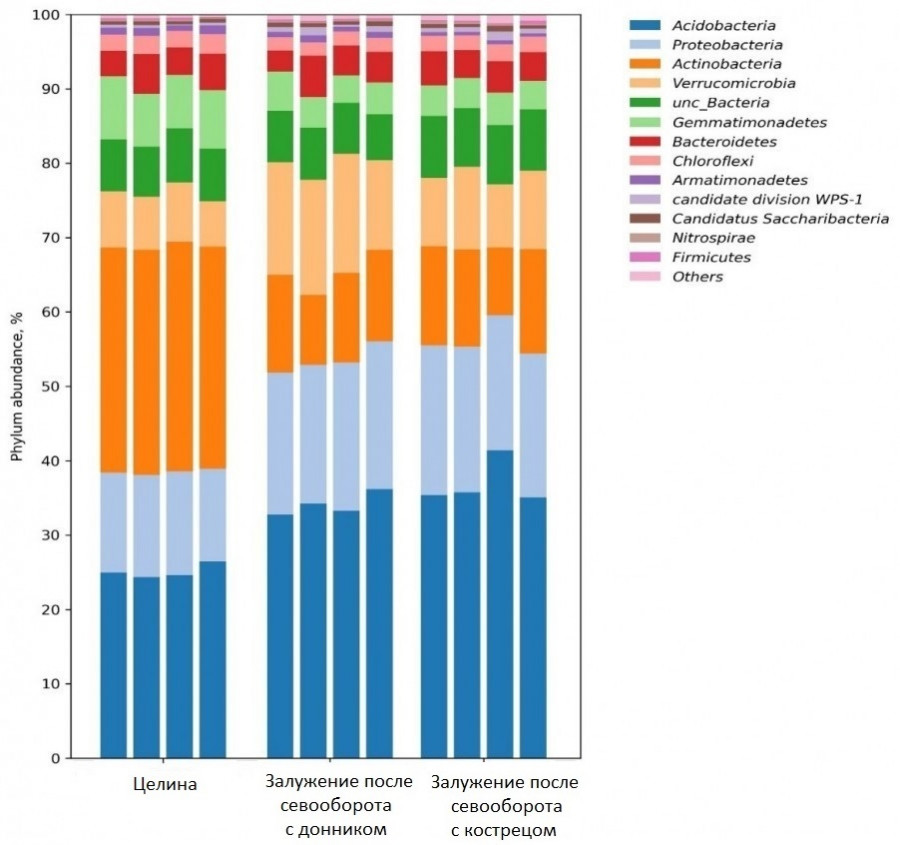
Бактериальные типы солонца мелкого на залужении и в целине с долей выше 0.1 % микробиома хотя бы в одном варианте
Bacterial types of small solonetz when grassing and on virgin land with a share above 0.1 % of the microbiome in at least one variant
Таблица 2. Процентное представительство доминирующих филумов бактерий в целинном и трансформированном травами солонце мелком
| Доминирующий филум | Вариант | ||
| Целина | Залужение после севооборота с донником | Залужение после севооборота с кострецом | |
| Acidobacteria | 25.1 b | 34.1 ас | 36.9 b |
| Proteobacteria | 13.4 а | 19.2 d | 19.2 bd |
| Actinobacteria | 30.3 а | 11.7 b | 12.4 b |
| unc_Bacteria | 10.5 b | 9.3 b | 11.3 а |
| Verrucomicrobia | 7.2 а | 14.7 b | 9.8 d |
| Gemmatimonadetes | 5.8 a | 3.1 c | 2.5 c |
Примечание. Разными буквами обозначены средние значения вариантов, существенно различающиеся между собой при р < 0.05.
В микробиоме 5 филумов из 6 наиболее значимых доминантов залуженных участков (т. е. 83.4 %) имели процентное содержание, статистически отличающееся от целины (табл. 2). Филум unc_Bacteria был стабильно одинаков как в целине, так и в каждом варианте залужения.
Находящиеся на 8–10-м месте филы Bacteroidetes, Chloroflexi и Candidatus Saccharibacteria были менее представительными, чем рассмотренные в табл. 2. В микробиомах они составляли 1.5–4.4 %, но каждый из них тоже имел сравнимые доли в целинной и фитомелиорированной почве.
Анализ состава и долевой численности более мелких таксонов, входящих в филумы, позволил выявить характер изменений в солонце, которые произошли под сеяными травами. Установлено, что в трансформированной почве значительно увеличилось число геномных последовательностей из групп Gp 6 и Gp 4 самого многочисленного филлума Acidobacteria. В варианте «залужение после севооборота с донником» они суммарно стали представлять 22.8 %, в варианте с залужением после севооборота с кострецом – 29.5 %. В почве же целины этих ацидобактерий было гораздо меньше: в 1.9 и 2.4 раза соответственно.
Исследователи домена бактерий нередко связывают численность ацидобактерий групп Gp 6 и Gp 4 с рН почвенного раствора (Jones et al., 2009; Lin et al., 2019). Доля этих ацидобактерий выше в почвах с низким значением кислотности (рН). Поэтому можно считать, что фитомелиоративный эффект травосеяния на солонце мелком проявился в снижении щелочности почвы. Стоит отметить, что в залуженном солонце произошло и рассоление верхнего горизонта почвы (табл. 3). За 13 лет залужения и 20 лет возделывания фитомелиоративных севооборотов количество солей по показаниям удельной электропроводности (УЭП) в нем снизилось: в 6.8 раза в варианте «залужение после севооборота с донником» и в 7.1 раза в варианте «залужение после севооборота с кострецом».
Таблица 3. Показатели биологической активности и засоленности солонца мелкого при длительном постсевооборотном залужении (среднее за 2016, 2018–2020 гг.)
| Показатель | Вариант | |||||
| Целина | Залужение после севооборота с донником | Залужение после севооборота с кострецом | ||||
| среднее | медиана | среднее | медиана | среднее | медиана | |
| Коэффициент минерализации | 8.2 | 9.05 | 11.5* | 5.7 | 12.8* | 5.6 |
| Коэффициент олиготрофности | 7.4 | 3.7 | 1.1* | 1.1 | 1.7* | 1.9 |
| Удельная электропроводность почвенного раствора, мкСм/см (ср. за 2016, 2018, 2020 гг.) | 1063 | 159* | 150* | |||
Примечание. * – p < 0.05 по сравнению с целиной.
Многолетняя фитомелиорация изменила водно-воздушный режим изученных почв. Индикатором этого факта стала численность бактериального типа Gemmatimonadetes. В литературе отмечено, что представительство их в микробном сообществе всегда выше в условиях недостатка влаги (DeBruyn et al., 2011). В трансформированном фитомелиорантами солонце гемматимонадет стало меньше: в почве с залужением после севооборота с донником в 1.9 раза, под севооборотом с кострецом в 2.3 раза. Поэтому можно считать, что на фоне длительной фитомелиорации произошло изменение гидротермических свойств почв, которые оказали влияние на их биотическую компоненту.
Многолетнее возделывание трав в севообороте и последующее залужение сопровождались дополнительным поступлением в почву растительной массы, и это повысило содержание в почве углерода и азота. В итоге в трансформированном солонце возросла численность филума протеобактерий, в особенности классов Betaproteobacteria (в 1.6–2 раза по сравнению с целиной), Gammaproteobacteria (в 1.9–2.1 раза), Deltaproteobacteria (в 2.9–3.2 раза по сравнению с целиной). Это копиотрофные микроорганизмы, обладающие высокой метаболической активностью. Функционально они всегда связаны с улучшением почвенного плодородия (Krishna et al., 2020).
Об улучшении почвенного плодородия в трансформированной почве свидетельствует и уменьшение процентного содержания олиготрофов среди первых шести доминирующих филумов. Их представительство в микробном сообществе солонца снизилось на залуженом участке до 48.9 и 51.8 % против 61.2 % в целине. Олиготрофные актинобактерии, ацидобактерии и гемматимонадеты (Bhattacharyya et al., 2021) вытеснились в почве представителями Proteobacteria, которые предпочитают богатую питанием среду обитания.
Преобладание в микробном сообществе целины олиготрофной флоры отмечено нами также с помощью методов классической микробиологии в 2016, 2018–2020 гг. Рассчитанный на основании этих данных коэффициент олиготрофности целинного солонца в среднем оказался выше трансформированной травами почвы в 4.4–6.7 раза (см. табл. 3). При этом в залуженной почве в 1.4–1.6 раза увеличился коэффициент минерализации, что говорит о повышенном содержании азота под сеяными травами. Все вышеперечисленное свидетельствует о функциональных изменениях в сообществе микроорганизмов под действием фитомелиорации.
Заключение
Длительное возделывание кормовых севооборотов и последующее их залужение стало главным экологическим фактором в преобразовании микробного сообщества целинного солонца мелкого и его свойств. Агробиологическое воздействие и травосеяние костреца с люцерной привели к рассолению верхнего горизонта засоленной почвы и формированию специфичного почвенного метагенома. Он отличается увеличением доли копиотрофов в доминирующих филах домена бактерий и падением представительства олиготрофов, что косвенно свидетельствует о возрастании в фитомелиорируемом солонце содержания углерода и азота. На основании данных о таксономической структуре микробиома выявили положительные изменения водно-воздушного режима трансформированного травами солонца и снижение его щелочности. Выявленные микробиологические особенности залуженного солонца мелкого способствуют новым знаниям о том, насколько долго сохраняются постсевооборотные изменения под травами при отсутствии механической обработки почвы.
Библиография
Вагина Т. А. Луга Барабы . Новосибирск, 1962. Ч. 1. 198 с.
Елизаров Н. В., Ломова Т. Г., Устинов М. Т., Попов В. В. Действие агробиологической мелиорации на солевой профиль солонцов Восточной Барабы // Вестник Новосибирского государственного аграрного университета. 2019. № 1. С. 18–25. DOI: 10.26898/0370-8799-2018-6-2.
Константинов М. Д., Кучеренко А. М. Сроки и способы залужения солонцов Барабы // Кормопроизводство. 2000. № 4. С. 13–15.
Коробова Л. Н. Влияние фитомелиоративных севооборотов на микрофлору мелкого и среднего солонца Барабы // Материалы научно-производственной конференции с международным участием. Тюмень: Гос. аграрный ун-т Северного Зауралья, 2018. С. 425–431.
Ломова Т. Г., Коробова Л. Н. Фитомелиоративное окультуривание солонцов Барабы и его влияние на биологическую активность почвы // Сибирский вестник сельскохозяйственной науки. 2015. № 1. С. 12–18.
Муха В. Д. О показателях, отражающих интенсивность и направленность почвенных процессов // Сборник трудов Харьковского сельскохозяйственного института. 1980. Т. 273. С. 13–16.
Риксен В. С., Коробова Л. Н. Биоразнообразие бактерий солонца мелкого через 30 лет фитомелиорации донником // Актуальные вопросы агропромышленного комплекса России и за рубежом: Материалы всерос. (нац.) науч.-практ. конф. с междунар. участием. Молодёжный: Иркутский ГАУ им. А. А. Ежевского, 2021а. С. 129–134.
Риксен В. С., Коробова Л. Н., Ломова Т. Г. Изменение микробиома мелкого солонца под действием длительного возделывания донника // Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2021б. № 10. С. 54–58. DOI: 10.37882/2223-2966.2021.10.20.
Семендяева Н. В. Свойства солонцов Западной Сибири и теоретические основы химической мелиорации / Под ред. А. Н. Власенко. Новосибирск: ГУП РПО СО РАСХН, 2002. 157 с.
Суюндуков Я. Т., Хасанова Р. Ф., Суюндукова М. Б. Фитомелиоративная эффективность многолетних трав на черноземах Зауралья / Под ред. чл.-корр. АН РБ, проф. Ф. Х. Хазиева. Уфа: Гилем, 2007. 132 с.
Berg G., Smalla K. Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere // FEMS Microbiol. Ecol. 2009. Vol. 68. P. 1–13. DOI: 10.1111/j.1574-6941.2009.00654.x.
Bhattacharyya A., Pablo C. H. D., Mavrodi O. V., Weller D. M., Thomashow L. S., Mavrodi D. V. Rhizosphere plant-microbe interactions under water stress / Eds.: G. M. Gadd, S. Sariaslani // Advances in Applied Microbiology. 2021. Vol. 115. P. 65–113. DOI: 10.1016/bs.aambs.2021.03.001.
Bulgarelli D., Garrido-Oter R., Munch P. C., Weiman A., Dröge J., Pan Y., McHardy A. C., Schulze-Lefert P. Structure and function of the bacterial root microbiota in wild and domesticated barley // Cell Host Microbe. 2015. Vol. 17. P. 392‒403. DOI: 10.1016/j.chom.2015.01.011.
Coleman-Derr D., Desgarennes D., Fonseca-Garcia C., Gross S., Clingenpeel S., Woyke T., North G., Visel A., Partida-Martinez L. P., Tringe S. G. Plant compartment and biogeography affect microbiome composition in cultivated and native Agave species // New Phytol. 2016. Vol. 209. P. 798‒811. DOI: 10.1111/nph.13697.
De Bruyn J., Nixon L., Fawaz M., Johnson M., Radosevich M. Global Biogeography and Quantitative Season Dynamics of Gemmatimonadetes in Soil // Appl Environ. Microbiol. 2011. Vol. 77 (17). P. 6295–6300. DOI: 10.1128/AEM.05005-11.
Edgar R. C. SINTAX, a Simple Non-Bayesian Taxonomy Classifier for 16S and ITS Sequences // bioRxiv preprint. 2016. Vol. 9. P. 074161. DOI: 10.1101/074161.
Fierer N., Leff J. W., Adams B. J., Nielsen U. N., Bates S. T., Lauber C. L., Owense S., Gilberte J. A., Wall D. H., Caporaso J. G. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes // Proceedings of the National Academy of Sciences. 2012. Vol. 109 (52). P. 21390–21395. DOI: 10.1073/pnas.1215210110.
Gao W., Xu J., Zhao J., Zhang H., Ni Y., Zhao B., Jia Z. Prokaryotic community assembly after 40 years of soda solonetz restoration by natural grassland and reclaimed farmland // European Journal of Soil Biology. 2020. Vol. 100. Р. 103213.
Girvan M. S., Bullimore J., Pretty J. N., Osborn A. M., Ball A. S. Soil type is the primary determinant of the composition of the total and active bacterial communities in arable soils // Appl. Environ. Microbiol. 2003. Vol. 69. P. 1800–1809. DOI: 10.1111/1462-2920.12452.
Gottel N. R., Castro H. F., Kerley M., Yang Z., Pelletier D. A., Podar M., Karpinets T., Uberbacher E., Tuskan G. A., Vilgalys R., Doktycz M. J., Schadt C. W. Distinct microbial communities within the endosphere and rhizosphere of Populus deltoides roots across contrasting soil types // Appl. Environ. Microbiol. 2011. Vol. 77. P. 5934‒5944. DOI: 10.1128/AEM.05255-11.
Handelsman J. Metagenomics: application of genomics to uncultured microorganisms // Microbiology and molecular biology reviews. 2004. Vol. 68 (4). P. 669‒685. DOI: 10.1128/MMBR.68.4.669-685.2004.
Jones R. T., Robeson M. S., Lauber C. L., Hamady M., Knight R., Fierer N. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses // ISME J. 2009. Vol. 3 (4). P. 442–453. DOI: 10.1038/ismej.2008.127.
Knief C., Delmotte N., Chaffron S., Stark M., Innerebner G., Wassmann R., von Mering C., Vorholt J. A. Metaproteogenomic analysis of microbial communities in the phyllosphere and rhizosphere of rice // ISME J. 2012. Vol. 6. P. 1378‒1390. DOI: 10.1038/ismej.2011.192.
Krishna M., Gupta S., Delgado-Baquerizo M., Morriën E., Garkoti S. C. et al. Successional trajectory of bacterial communities in soil are shaped by plant-driven changes during secondary succession // Scientific reports. 2020. Vol. 10. Р. 1–10. DOI: 10.1038/s41598-020-66638-x.
Lin Y. T., Lin Y. F., Tsai I. J. Structure and Diversity of Soil Bacterial Communities in Offshore Islands // Scientific reports. 2019. Vol. 9 (1). P. 4689. DOI: 10.1038/s41598-019-41170-9.
Makhalanyane T. P., Valverde A., Gunnigle E., Frossard A., Ramond J.-B., Cowan D. A. Microbial ecology of hot desert edaphic systems // FEMS Microbiol Rev. 2015. Vol. 39 (2). P. 203–221. DOI: 10.1093/femsre/fuu011.
World reference base for soil resources 2006. IUSS Working Group. World Soil Resources Reports. No 103. Rome, 2006. 145 p.
Mendes L. W., Kuramae E. E., Navarrete A. A., van Veen J. A., Tsai S. M. Taxonomical and functional microbial community selection in soybean rhizosphere // ISME J. 2014. Vol. 8. P. 1577‒1587. DOI: 10.1038/ismej.2014.17.
Semendyaeva N. V., Korobova L. N., Elizarov N. V. Changes in the Properties and Biological Activity of Crusty Solonetzes in the Baraba Lowland under the Long-Term Impact of Gypsum // Eurasian Soil Science. 2014. Vol. 11. P. 1116‒1122. DOI: 10.1134/S1064229314110118.
Благодарности
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-34-90096.






 © 2011 - 2025
© 2011 - 2025