Введение
В морях, расположенных в умеренных широтах, в том числе и в Черном море, интенсивность свечения гидробионтных организмов является важным фактором функционирования пелагического сообщества и подвержена периодическим циркадным и ультрадианным изменениям (Tett, 1971; Meeson, 1977; Krasnow et al., 1980; Gitel’son and Levin, 1989; Akimoto et al., 2004; Токарев, 2006; Заворуев и др., 2012; Tokarev and Melnikova, 2012).
Светящиеся организмы являются активными участниками функционирования пелагической системы (их биомасса тесно коррелирует с биомассой планктона и других обитателей пелагиали), и поэтому интенсивность свечения гидробионтов является весьма важной информационной характеристикой биологических процессов жизнедеятельности морских сообществ (Tett, 1971; Lapota et al., 1989; Ondercin et al., 1995; Черепанов и др., 2007; Moline et al., 2009). Для изучения миграций, пространственного и временного распределения гидробионтных сообществ в естественных природных условиях обитания без нарушения структуры гидробионтных сообществ, в состав которых входят биолюминесцентные организмы, могут быть применены методы экспрессной оценки, основанные на использовании быстродействующих биофизических приборов (Widder et al., 2002; Токарев и др., 2009).
На распределение светящихся гидробионтов в толще воды и процессы их жизнедеятельности влияют биотические факторы (возраст, пол, размножение, миграции и т. д.) и абиотические факторы (степень освещенности, температура, соленость, течение, наличие пищи и т. д.) (Hastings, 2007; Widder, 2010; Polonsky, Mel’nikova et al., 2018).
Как показывает анализ литературных данных, в жизненных циклах большинства видов святящихся гидробионтов можно выделить несколько повторяющихся через определенные промежутки времени процессов, которые являются циркадными и ультрадианными ритмами (Meeson, 1977; Krasnow et al., 1980; Sullivan and Swift, 1994; Akimoto et al., 2004; Titlyanov et al., 2004). В частности, эндогенные ритмы проявляются во многих физиологических процессах микроводорослей: питании, дыхании, росте, образовании пигментов и др. (Ondercin et al., 1995; Titlyanov et al., 2004; Tokarev and Melnikova, 2012). Известно, что большинство физиологических и биохимических процессов изменяются в течение суток. Некоторые из процессов активизируются в темное время суток, другие – в дневное. Суточная смена дня и ночи, фиксируемая фитопланктоном за счет работы фитохром и криптохром, подобных фоторецепторам, обеспечивает возможность фитопланктону точно распределять во времени светозависимые и темновые процессы (в частности, рост и репродукцию) (Li et al., 1996; Hamman et al., 1981; Hastings, 2007).
В последнее время все более широкое распространение получают методы исследования жизненных процессов, происходящих в биологических системах, на основе измерения параметров физических полей, возникающих в процессе функционирования биологических систем, в частности морских пелагических сообществ (Токарев, 2006; Tokarev, Melnikova, 2012; Polonsky et al., 2018). При этом использование биофизических приборов позволяет проводить изучение процессов жизнедеятельности пелагических сообществ в естественных условиях в реальном масштабе времени без нарушения структуры и межвидовых связей гидробионтов (Widder et al., 2002; Токарев и др., 2009). Если обработку амплитудно-временной изменчивости интенсивности свечения, создаваемого пелагическими сообществами, провести с использованием аналитико-математических и статистических методов обработки информации, то появляется возможность не только выявить биологические ритмы пелагических сообществ, но и оценить их параметры и рассмотреть особенности межвидовых взаимоотношений.
Целью работы является моделирование процессов функционирования пелагической системы и определение параметров биологических ритмов, приводящих к изменению интенсивности свечения гидробионтных сообществ.
Материалы
Материалом для исследования послужили данные, полученные в Институте биологии южных морей (ИнБЮМ) им. А. О. Ковалевского на суточной станции в 77-м рейсе НИС «Профессор Водяницкий» (02.09–08.09.2014 г) в прибрежных водах г. Севастополя в районе б. Круглая. Для исследования временной изменчивости пространственного и вертикального распределения интенсивности свечения организмов в верхнем 100-метровом слое использовали метод многократного батифотометрического зондирования толщи воды с помощью измерительного гидробиофизического комплекса «Сальпа-М» (Токарев и др., 2009). Каждый час проводили по 10 зондирований с интервалом 2 мин. Затем эти данные усреднялись. Наблюдения проводились в течение суток. При анализе временных изменений интенсивности свечения организмов были использованы усредненные по каждому часу значения. Дискретность измерений в режиме зондирования составляла 1 м.
Вертикальное зондирование интенсивности свечения организмов проводили в диапазоне глубин 0–60 м. Далее определялся диапазон глубин с высоким уровнем интенсивности свечения организмов. Для этого при анализе полученных результатов была проведена разбивка диапазона глубин, на которых производились измерения, на 5-метровые слои. Затем был найден 5-метровый слой с максимальным значением интенсивности свечения организмов и диапазон глубин, в котором интенсивность свечения гидробионтов превышала уровень 0.5 от максимального. Таким образом был выделен диапазон глубин с высоким уровнем интенсивности свечения организмов. Это оказался диапазон глубин от 0 до 35 м. Дальнейший анализ проводился для этого слоя.
Синхронизирующим фактором, дающим старт темновым процессам, является смена светлого и темного времени суток, поэтому изменения интенсивности биолюминесценции повторяются каждые последующие сутки в одно и то же время. Это дает основание делать расчеты на основе измерений, проводимых в течение одних суток. Поэтому в расчетах использовался ряд значений длиной 24 отсчета, охватывающий одни сутки.
Методы
Наблюдаемые процессы нарастания и спада интенсивности биолюминесценции планктонных организмов повторяются в одно и то же время суток. Этот факт дает основание считать их периодически повторяющимися процессами, и поэтому к ним применимо дискретное преобразование Фурье (Дженкинс и Ваттс, 1972; Marple-ml., 1990; Кривошеев, 2006). Представим изменения интенсивности свечения гидробионтов в виде конечного числа гармонических функций (спектральных составляющих), различающихся по периодам и амплитудам и дающих представление о циркадных и ультрадианных ритмах, существующих в пелагических системах, в следующем виде:
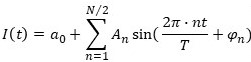 (1)
(1)
где I(t) – интенсивность свечения организмов в момент времени t;
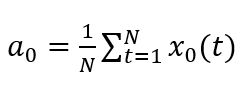 – постоянная составляющая или нулевая гармоника, x0(t) – экспериментально измеренное значение интенсивности биолюминесценции в момент времени t, N – количество точек экспериментально измеренного временного ряда, N/2 – количество гармоник ряда Фурье, An – амплитуда n-й гармоники, n = 1, 2, … N/2 – номер гармоники, T – период первой гармоники, φn – начальная фаза n-й гармоники.
– постоянная составляющая или нулевая гармоника, x0(t) – экспериментально измеренное значение интенсивности биолюминесценции в момент времени t, N – количество точек экспериментально измеренного временного ряда, N/2 – количество гармоник ряда Фурье, An – амплитуда n-й гармоники, n = 1, 2, … N/2 – номер гармоники, T – период первой гармоники, φn – начальная фаза n-й гармоники.
Спектральные составляющие, полученные в результате разложения исходной временной последовательности в ряд Фурье, могут быть использованы при моделировании процессов функционирования пелагической системы.
Количественная обработка выполнена с использованием пакетов программ Microsoft Excel 7.0, MathCAD 14.0, Statistica 6.0, SigmaPlot 12.5 and Surfer 13.0.
Результаты
На рис. 1 приведены средние значения интенсивности свечения организмов в течение темного времени суток.
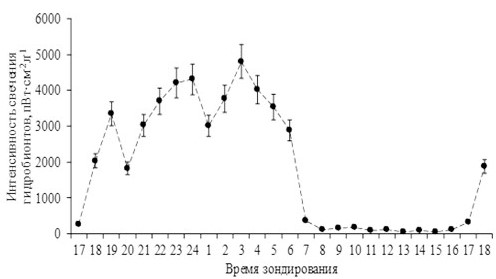
Рис. 1. Средние значения интенсивности свечения организмов
Fig. 1. Diurnal changes in the intensity of bioluminescence of planktonic communities
Из рис. 1 видно, что интенсивность свечения организмов на протяжении темного времени суток подвержена флюктуациям. Во-первых, с наступлением темного времени суток наблюдается нарастание интенсивности свечения организмов, которая уменьшается (падает) к утру. Во-вторых, наблюдается изменение интенсивности свечения гидробионтных сообществ в темное время суток. В 19, 23–24 и 3 часа наблюдаются увеличения интенсивности свечения обитателей пелагиали, а в 20 часов, а также к 1 часу ночи и к 6 часам утра – уменьшения интенсивности свечения гидробионтных сообществ.
Синхронизирующим фактором, дающим старт темновым процессам, является смена светлого и темного времени суток. Однако наблюдаемые уменьшения интенсивности свечения в 20 часов и к 1 часу ночи свидетельствуют о том, что кроме циркадного ритма, синхронизируемого сменой светлого и темного периода суток, на изменения интенсивности свечения планктонного сообщества влияют также некоторые другие ультрадианные ритмы.
В результате разложения в ряд Фурье исходного временного ряда значений интенсивности свечения гидробионтных сообществ (см. рис. 1) было получено, что наибольшие амплитуды имеют первая, третья и пятая гармонические составляющие. Амплитуды этих гармонических составляющих соответственно равны: 931, 725 и 656 пВт∙см-2л-1.
Вклад каждой гармоники (биологического ритма) в суммарные изменения интенсивности свечения планктонных сообществ определяется ее амплитудой. Чем больше амплитуда гармоники, тем существеннее ее вклад, и наоборот: вклад гармоник с малыми амплитудами незначителен. Вследствие этого можно считать, что первая, третья и пятая гармоники являются существенными и вносят основной вклад в изменения интенсивности свечения гидробионтных сообществ. Влиянием второй, четвертой, шестой и седьмой гармоник при моделировании функционирования пелагической системы будем пренебрегать, считая их амплитуды малыми. Эти три существенных гармонических колебания (три биологических ритма) вносят основной вклад в изменения интенсивности свечения планктонных сообществ в темное время суток. Остальными гармоническими колебаниями (вторая, четвертая, шестая и седьмая гармоники) при моделировании происходящих процессов будем пренебрегать, считая их амплитуды малыми и незначительно влияющими на изменение интенсивности свечения организмов.
Для существенных гармонических колебаний получено:
– период основного гармонического колебания равен длине временного ряда – 14 часов, он характеризует циркадный ритм изменения интенсивности свечения гидробионтных сообществ;
– период третьей гармонической составляющей равен 4.7 часа;
– период пятой гармонической составляющей равен 2.8 часа.
При этом процессы, формирующие первую спектральную составляющую с периодом 14 часов, ответственны за медленные изменения интенсивности свечения организмов и характеризуют циркадный ритм, а процессы, формирующие третью и пятую спектральные составляющие, – за быстрые изменения, которые характеризуют ультрадианные биологические ритмы (рис. 2).
Уравнения для основных гармонических составляющих (первая, третья и пятая), характеризующихся наибольшими амплитудными значениями, полученные в результате разложения в ряд Фурье, запишем в тригонометрическом виде:
y1(t) = 930.6 · sin(0.449t – 1.3882);
y3(t) = 725.1 · sin(1.337t – 0.5482); (2)
y5(t) = 655.7 · sin(2.244t – 1.5252).
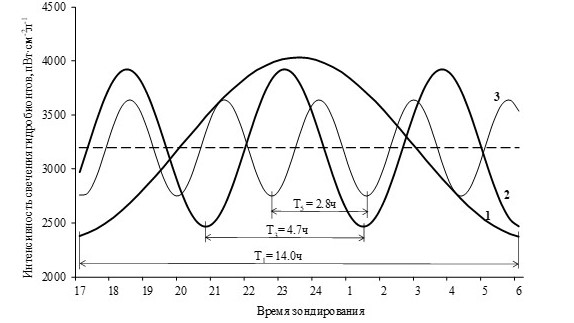
Рис. 2. Вклад основных биологических ритмов (1 – с периодом 14 часов; 2 – с периодом 4.7 часа; 3 – с периодом 2.8 часа) в изменение интенсивности свечения гидробионтных сообществ в темное время суток. Постоянная составляющая обозначена пунктирной линией
Fig. 2. The contribution of basic biological rhythms to the change in the intensity of the luminescence of hydrobiont communities in the dark (1 – with a period of 14 hours; 2 – with a period of 4.7 hours; 3 – with a period of 2.8 hours). The constant component is indicated by the dotted line
Тогда с учетом принципа суперпозиции и принятых предположений относительно малости амплитуд второй, четвертой, шестой и седьмой гармонических составляющих интенсивность свечения гидробионтных сообществ в темное время суток на юго-западном шельфе Крыма может быть рассчитана по формуле:
Iрасч(t) = a0 + y1(t) + y3(t) + y5(t) , (3)
где а0 = 3147 пВт·см–2·л–1 – постоянная составляющая; y1(t), y3(t), y5(t) – значения первой, третьей и пятой гармоник, определяемые из выражений (2).
На рис. 3 изображены изменения интенсивности свечения организмов в темное время суток, построенные суммированием всех семи гармонических составляющих в соответствии с уравнением (1) (сплошная линия), суммированием трех наибольших гармонических составляющих (пунктирная линия), а также экспериментальные данные и погрешности их определения.
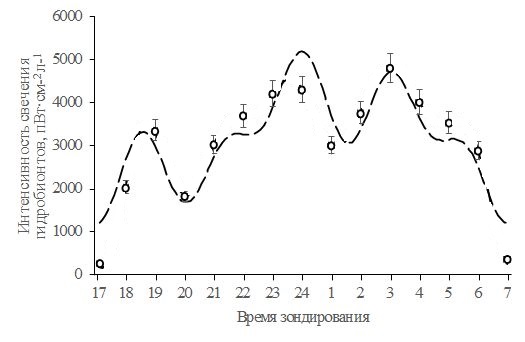
Рис. 3. Моделирование процессов функционирования пелагической системы на основе расчета изменения интенсивности свечения гидробионтов
Fig. 3. Modeling the processes of functioning of the pelagic system based on the calculation of changes in the luminescence intensity of hydrobiont communities
Из рис. 3 видно, что рассчитанная теоретическая кривая изменения интенсивности свечения гидробионтных сообществ в пределах погрешности эксперимента совпадает с измеренными значениями.
Обсуждение
Анализ литературных источников свидетельствует, что одним из факторов суточного изменения интенсивности свечения морских организмов является интенсивность солнечной радиации. Анализ значений интенсивности дневной и ночной биолюминесценции планктона на различной глубине показал, что свечение гидробионтных сообществ ночью значительно выше, чем днем (Gitel’son and Levin, 1989; Токарев, 2006; Заворуев и др., 2012). Так, Ю. Н. Токарев отмечал, что вследствие изменения освещенности в течение суток интенсивность биолюминесценции в темное и светлое время суток изменяется в 30–100 раз (Токарев, 2006). Вследствие этого можно установить, что в наших исследованиях первая гармоника характеризует процесс нарастания интенсивности свечения организмов в течение темного времени суток и падения в утренние часы. Этот цикл обусловлен сменой и продолжительностью светового и темного периодов. Из выражения (2) для y1(t) видно, что амплитуда первой гармонической составляющей равна 931 пВт∙см-2л-1, это характеризует ее вклад в изменение интенсивности свечения гидробионтного сообщества в течение темного времени суток.
Причиной появления высокочастотных колебаний (третья и пятая гармонические составляющие) с периодом 4.7 и 2.8 часа являются биологические процессы, связанные с количественным развитием фитопланктона в течение суток и взаимоотношениями в пищевой цепи обитателей пелагиали.
В ряде работ, посвященных развитию фитопланктона (Ланская, 1967; White, 1979; Sullivan and Swift, 1994; Akimoto et al., 2004; Titlyanov et al., 2004), отмечено, что количество и биомасса фитопланктонных организмов в пелагиали зависит прежде всего от скорости деления клеток и интенсивности выедания их зоопланктоном.
В работе С. А. Пионтковского и Т. С. Петипа, посвященной изучению суточного изменения в интенсивности питании у копеподиты Acartia (Acartiura) clausi (Giesbrecht, 1889), показано, что интенсивность питания ночью и днем у рачков разного возраста различна, что связано с их различной способностью к интенсивности миграции (Пионтковский, Петипа, 1975). При увеличении интенсивности миграции, которая наблюдается ночью, интенсивность их питания возрастает. Так, например, половозрелые самцы и самки вне периода размножения, а также Acartia clausi стадии V мигрируют активнее других стадий, совершая большие перемещения по глубине и придерживаясь в дневное время более глубоких водных слоев. Ночью, поднимаясь из глубинных водных слоев к поверхности, эти группы рачков питаются со значительно большей интенсивностью по сравнению с остальными группами. Младшие копеподиты и науплиусы, наоборот, совершают небольшие перемещения на глубине, амплитуда их миграций невелика, они постоянно обитают в самых верхних слоях воды и питаются с наибольшей интенсивностью в дневное время. Существование различных суточных интенсивностей и ритмов питания обусловливается, вероятно, различной приспособленностью возрастных групп к солнечной радиации. Также отмечено, что самцы при высокой солнечной радиации выживают хуже, чем при слабом солнечном освещении (Пионтковский, Петипа, 1975).
На суточный ритм интенсивности питания влияет также вид пищи, потребляемой зоопланктоном. Так, полный процесс прохождения пищи по кишечнику у всех возрастных стадий Acartia clausi, а также у многих других видов копепод при преобладании в пище фитопланктона длится в среднем 3 часа, при питании дополнительно животной пищей продолжительность процесса пищеварения увеличивается в среднем до 5 часов (Пионтковский, Петипа, 1975). Следовательно, периоды нарастания интенсивности питания рачков зависят от вида пищи и близки к трем или пяти часам.
В отношении темпа деления клеток планктонных организмов на протяжении суток существуют разные мнения. Исследованием скорости деления клеток черноморского фитопланктона в культурах занималась Л. А. Ланская. В результате исследований она пришла к выводу, что деление большинства видов динофлагеллят происходит круглосуточно, но максимальное количество делящихся клеток приходится на вечерние часы (18–19) и ночное время (Ланская, 1967). А. В. Ковалев и Н. Г. Столбова с соавторами для максимальной репродукции планктонных водорослей также выделяли ночные часы (Ковалев, 1993; Столбова и др., 1982)
Изложенные особенности деления клеток фитопланктона на протяжении темного времени суток позволяют предположить, что наблюдаемые в наших исследованиях нарастания интенсивности свечения гидробионтных сообществ в 19, 23–24 и к 3 часам утра являются результатом превалирования скорости деления светящихся клеток динофлагеллят над интенсивностью их выедания зоопланктоном в это время.
Циклический характер изменчивости интенсивности свечения гидробионтных сообществ с амплитудами 725 и 656 пВт∙см-2л-1 и, соответственно, периодами 4.7 и 2.8 часа свидетельствует о том, что третья и пятая спектральные составляющие разложения в ряд Фурье являются существенными и обусловлены ультрадианными эндогенными суточными ритмами обитателей пелагиали.
Моделирование процессов функционирования пелагической системы, приводящее к изменению интенсивности свечения гидробионтных сообществ, проводили по уравнениям (2) и (3).
Коэффициент корреляции между теоретическими значениями, рассчитанными по трем гармоникам, и измеренными значениями интенсивности свечения гидробионтов составляет r = 0.906.
Заключение
Показано, что на изменения интенсивности свечения гидробионтных сообществ пелагической системы в темное время суток оказывают влияние циркадный и ультрадианные биологические ритмы обитателей пелагиали с периодами 14, 4.7 и 2.8 часа. Эти биологические ритмы приводят к периодическому изменению интенсивности свечения, создаваемого пелагическими сообществами, с амплитудами 931, 725 и 656 пВт∙см-2∙л-1. Использование метода преобразования Фурье позволило определить характеристики циркадного и ультрадианных биологических ритмов пелагического сообщества. Изменение солнечной радиации является синхронизирующим фактором, дающим начало как циркадным, так и ультрадианным биологическим ритмам планктонного сообщества.
Библиография
Дженкинс Г. М., Ваттс Д. Г. Спектральный анализ и его приложения : В 2 т. Т. 2. М.: Мир, 1972. 287 с.
Заворуев В. В., Заворуева Е. Н., Крум С. П. Распределение планктона в районах фронтальных зон водных экосистем . Красноярск: СФУ, 2012. 292 c.
Ковалев А. В. Мезозоопланктон // Планктон Черного моря / Под. ред. А. В. Ковалева и З. З. Фененко. Киев: Наукова думка, 1993. С. 144–165.
Кривошеев В. И. Современные методы цифровой обработки сигналов (цифровой спектральный анализ) . Н. Новгород, 2006. 117 с.
Ланская Л. А. Суточный ход деления некоторых видов планктонных водорослей Черного моря в культурах // Биология и распределение планктона южных морей / Под ред В. Н. Грезе. М.: Наука, 1967. С. 16–21.
Марпл-мл. С. Л. Цифровой спектральный анализ и его приложения / Пер. с англ. О. И. Хабарова, Г. А. Сидоровой; Под ред. И. С. Рыжака. М.: Мир, 1990. 584 с.
Пионтковский С. А., Петипа Т. С. Элективность в питании Acartia clausi (Giesbr.) // Биология моря. 1975. № 33. С. 3–10.
Столбова Н. Г., Ведерников В. И., Микаэлян А. С. Суточный ритм деления динофлагеллят в Черном море // Океанология. 1982. Т. 22, № 3. P. 492–495.
Токарев Ю. Н. Основы биофизической экологии гидробионтов . Севастополь: ЭКОСИ-Гидрофизика, 2006. 342 с. URL: https://repository.marine-research.org/handle/299011/9076.
Токарев Ю. Н., Василенко В. И., Жук В. Ф. Новый гидробиофизический комплекс для экспрессной оценки состояния прибрежных экосистем // Современные методы и средства океанологических исследований: Материалы XI междунар. науч.-техн. конф., 25–27 нояб. 2009 г., Москва. М.: Изд-во РАН, 2009. С. 23–27.
Черепанов О. А., Левин Л. А., Утюшев Р. Н. Связь биолюминесценции с биомассой и численностью светящегося и всего планктона. 2. Черное море // Морской экологический журнал. 2007. T. 6, № 3. C. 84–89.
Akimoto H. Wu. C., Kinumi T. and Ohmiya Y. Biological rhythmicity in expressed proteins of the marine dinoflagellate Lingulodinium polyedrum demonstrated by chronological proteomics // Biochem. Biophys. Res. Commun. 2004. Vol. 315, No 2. P. 306–312.
Gitel’son I. I. and Levin L. A. Bioluminescence in oceanology // J. Biolumin Chemilumin. 1989. Vol. 4, No 1. P. 555–562.
Hamman J. P., Biggley W. H. and Seliger H. H. Photoinhibition of stimulable bioluminescence in marine dinoflagellates // Photochem. Photobiol. 1981. No 33. P. 909–914.
Hastings J. W. The Gonyaulax clock at 50: Translational control of circadian expression // Cold Spring Harbor Symp. Quant. Biol. 2007. No 72. P. 141–144.
Krasnow R., Dunlap J. C., Taylor W., Hastings J. W., Vetterling W. and Gooch V. J. Circadian spontaneous bioluminescent glow and flashing of Gonyaulax polyedra // Comp. Physiol. 1980. Vol. 138, No 1. P. 19–26.
Lapota D., Geiger M. L., Stiffey A. V., Rosenberger D. E. and Young D. K. Correlations of planktonic bioluminescence with other oceanographic parameters from a Norwegian fjord // Mar. Ecol. Prog. Ser. 1989. No 55. P. 217–227. DOI: 10.3354/MEPS055217.
Li Y. Q., Swift E. and Buskey E. J. Photoinhibition of mechanically stimulable bioluminescence in the heterotrophic dinoflagellate Protoperidinium depressum (Pyrrophyta) // J. Phycol. 1996. No 32. P. 974–982.
Meeson B. M. Circadian rhythmicity in the marine dinoflagellate Ceratium furca // J. Phycol. 1977. Vol. 13, No 2. Р. 45–50.
Moline M. A., Blackwell S. M., Case J. F., Haddock S. H. D., Herren C. M., Orrico C. M., and Terrill E. Bioluminescence to reveal structure and interaction of coastal planktonic communities // Deep Sea Res. Part II. 2009. No 56. P. 232–245. DOI: 10.1016/j.dsr2.2008.08.002.
Ondercin D., Atkinson C. A., Kiefer D. A. The distrtbution of bioluminescence and chlorophyll during the late summer in the north Atlantic: maps and a predictive model // J. Geophys Res. 1996. No 10. P. 6575–6590.
Polonsky A. B., Mel’nikova E. B., Serebrennikov A. N. and Tokarev Yu. N. Regional Peculiarities of Hydrobiont Bioluminescence Intensity and Chlorophyll a Concentration in Black Sea Waters // Atmospheric and Oceanic. 2018. Vol. 31, No 4. P. 365–371.
Sullivan J. M. and Swift E. Photoinhibition of mechanically stimulated bioluminescence in the autotrophic dinoflagellate, Ceratium fusus (Pyrrophyta) // J. Phycol. 1994. No 30. P. 633–637.
Tett P. B. The relation between dinoflagellates and the bioluminescence of Sea water // J. Mar. Biol. Assoc. U. K. 1971. Vol. 51, No 1. Р. 183–206.
Titlyanov E. A., Titlyanova T. V., Kalita T. L. and Yakovleva I. M. Rhythmicity in division and degradation of symbiotic dinoflagellates in the hermatypic coral stylophora pistillata // Symbiosis. 2004. No 36. P. 211–224.
Tokarev Yu. N., Melnikova E. B. The influence of hydrophysical parameters on intensity of bioluminescence field in the Black Sea // Hydrobiological journal. 2012. Vol. 48, No. 4. P. 93–99. DOI: 10.1615/HydrobJ.v48.i4.70
White H. H. Effects of dinoflagellate bioluminescence on the ingestion rates of herbivorous zooplankton // J. Exp. Mar. Biol. Ecol. 1979. № 36. P. 217–224.
Widder E. A. Bioluminescence and the pelagic visual environment. Mar. freshw // Behav. Physiol. 2002. No 35. P. 1–26.
Widder E. A. Bioluminescence in the ocean: Origins of biological, chemical, and ecological diversity // Science. 2010. No 328. P. 704–708.






 © 2011 - 2026
© 2011 - 2026