Введение
Изменчивость организмов – сложный биологический феномен, играет важную роль в поддержании жизнеспособности природных популяций и служит материалом естественного отбора (Тимофеев-Ресовский и др., 1978). Поливариантность онтогенеза отдельных особей, увеличивая внутрипопуляционный полиморфизм, способствует формированию целостной и устойчивой популяционной структуры (Шварц, 1980; Яблоков, 1987). При этом пространственная структура – важная характеристика популяции, от которой зависит сценарий микроэволюционных событий. Основные представления о типах популяционной структуры и их теоретические модели подробно разработаны, имеют прочную фундаментальную основу (Wright, 1951; Kimura, Weiss, 1964; Malécot, 1975). Однако характер эволюционных преобразований в континуальных и дискретных популяциях до сих пор принадлежит к числу мало изученных вопросов. В современной широкой трактовке изменчивость объектов живой природы определяется термином «биологическое разнообразие», которое включает в себя разнообразие в рамках вида, между видами, как на фенотипическом, так и на генотипическом уровнях. Морфологическое разнообразие – одно из фундаментальных свойств живой материи и неотъемлемая часть феномена биологического разнообразия (Пузаченко, 2009). Анализ факторов и форм разнообразия биоты, включая морфологический (структурный) полиморфизм, – важная задача, стоящая перед исследователем, изучающим сложные биологические системы в контексте их непрерывного эволюционного развития. Рассматривая краниометрическую изменчивость отдельных особей как элементов системы в качестве наименьшей единицы анализа, изучение ансамбля элементов дает статистическую характеристику популяции (Пузаченко, 2016).
Для европейской территории страны волк Canis lupus и лисица обыкновенная Vulpes vulpes – аборигенные виды сем. Canidae, филогенетически длительное время населяющие эту местность. В рамках рассматриваемого участка ареала популяции ведут начало от животных, реколонизировавших восточно-европейскую равнину после максимума последнего Валдайского оледенения, закончившегося 17–20 тыс. лет назад (Пузаченко и др., 2016). Согласно данным палеореконструкций, растительный покров запада Тверской области (территория Центрально-Лесного заповедника) состоял из елового и сосново-березового редколесья уже 11800–11000 лет назад, подобная типология сообществ была характерна для обширных пространств Восточно-Европейской равнины и Прибалтики (Динамика лесных экосистем…, 2011). Это позволяет предполагать активное заселение территории фитофагами и хищниками, а общность формирования населения Canis lupus Европы подтверждается результатами филогеографических исследований (Pilot et al., 2010). Сходной филогеографической историей характеризуются и популяции лисицы обыкновенной, занимающей близкую экологическую нишу, однако, в отличие от волка, лисица, по-видимому, могла населять арктические степные районы Северной и Центральной Европы во время последнего максимума оледенения (Kutschera et al., 2013).
Енотовидная собака Nyctereutes procyonoides – инвазионный вид, интродуцированный на территории Тверской области в 1934 г. Источником современных популяций послужил выпуск 50 особей на севере региона, относящихся к подвиду N. p. ussuriensis, автохтонные популяции которого населяют юг Дальнего Востока. Последовавший вскоре стремительный рост численности («акклиматизационный взрыв») привел к формированию обширной метапопуляции – объединению с животными, расселяющимися из соседних регионов, где также осуществлялись интродукции. Современное население енотовидной собаки в Европе характеризуется значительной генетической гомогенностью и несет следы множественных интродукций (Кораблёв и др., 2011; Drygala et al., 2016).
Собранные на ограниченной территории и временном масштабе промысловые выборки из популяций являются удобным объектом для изучения различных форм изменчивости и послужили отправной точкой для изучения половой и пространственно-временной динамики размерного полиморфизма хищных млекопитающих сем. Canidae. В Тверской области, которая послужила центром сбора краниологических коллекций, численность псовых за три последних десятилетия характеризуется следующим соотношением: волк – 375 (минимально 80, максимально 950) особей; лисица – 8.5 тыс. особей (минимально 5.5 тыс.; максимально 12.8 тыс.). Численность енотовидной собаки превышает суммарную численность аборигенных Canidae и в последнем десятилетии составляет в среднем 12.3 тыс. особей (минимально 10.1 тыс.; максимально 14.7 тыс.) (данные уполномоченных региональных органов Росприроднадзора).
Априорные знания биологии объектов исследования, наличие морфологических и генетических данных позволяют принять исходную гипотезу существования единой популяции каждого из рассматриваемых видов в пределах географического региона исследований. Эта работа дополняет и обобщает серию публикаций, посвященных морфологической изменчивости черепа хищных млекопитающих, населяющих центр европейской части России (Кораблёв и др., 2012, 2013, 2014, 2015, 2016, 2018).
Цель работы – изучить в сравнительном межвидовом аспекте масштаб и факторы краниометрической изменчивости симпатричных для европейской территории России представителей Canidae (Canis lupus; Vulpes vulpes; Nyctereutes procyonoides) на внутрипопуляционном уровне.
Материалы
Объекты изучения – краниологические коллекции трех симпатричных для рассматриваемой территории представителей сем. Canidae: волк Canis lupus, лисица обыкновенная Vulpes Vulpes, енотовидная собака Nyctereutes procyonoides, – общим объемом 1010 экз., выборки черепов каждого вида дифференцированы по полу и возрасту (табл. 1).
Регион исследования включает в себя несколько административных областей: Тверскую, Смоленскую, Вологодскую; представляет Восточно-Европейскую равнину, частично охватывает южные отроги Валдайской возвышенности, служащей Каспийско-Балтийским водоразделом, с максимальными отметками высот около 300 м н. у. м., где сохранились первичные южнотаежные экосистемы (рис. 1). В целом территория сбора материала слабо урбанизирована, покрыта преимущественно вторичными лесами и экосистемами с высокой мозаичностью, в ее границах отсутствуют географические барьеры, нарушающие панмиксию изучаемых хищников.
Таблица 1. Характеристика и распределение по видам исследованного материала
| Характеристика выборки | Canis lupus | Vulpes vulpes | Nyctereutes procyonoides |
| Объем; самцы/самки | 326; 177/149 | 403; 183/157 | 281; 143/138 |
| Период сбора; лет | 1950–2016; 66 | 1958–2008; 50 | 1947–2015; 68 |
| Количество признаков | 15 | 17 | 13 |
| Административная область сбора | Тверская, Смоленская, Вологодская | Тверская | Тверская, Вологодская |
| Количество локалитетов | 7 | 4 | 4 |
| Расстояние, км (лимиты) | 80–430 | 100–450 | 60–400 |
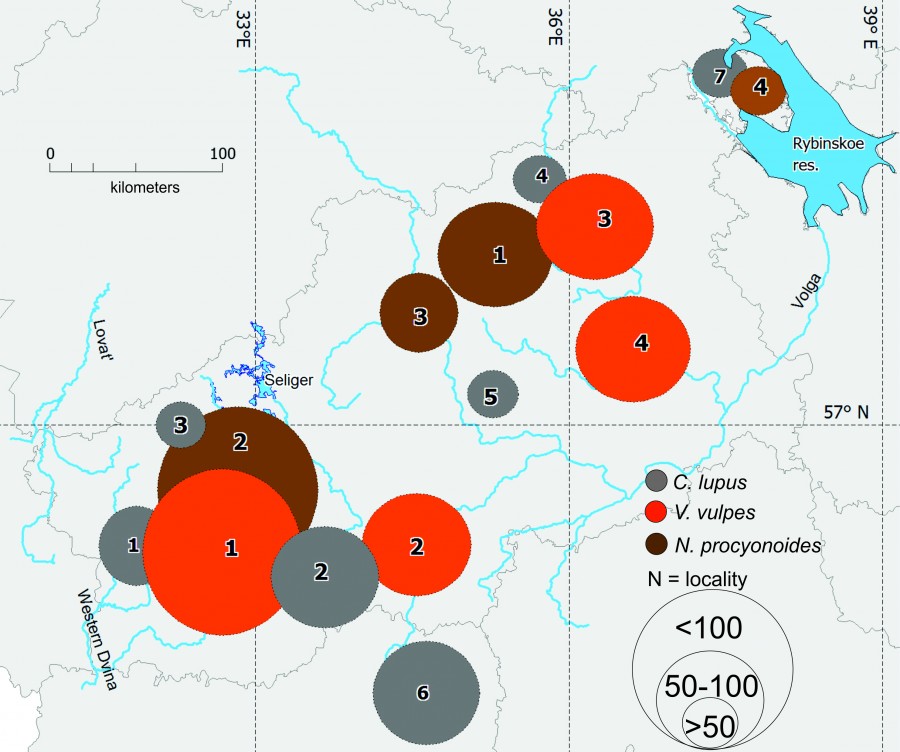
Рис. 1. Карта районов сбора материала. Номера локалитетов для каждого вида изученных Canidae показаны в эллипсах
Fig. 1. Map of collection areas. Locality numbers for each species of Canidae are shown in ellipses
В качестве тестируемых факторов полиморфизма использована половая принадлежность животных и их возраст, период добычи, расстояние между локалитетами и их географические координаты, полученные как центроиды между выборками в системе настольной картографии – геоинформационной системе. Выделение локалитетов основано на объеме поступления краниологического материала из отдельных административных районов, объединение которых осуществлялось по территориальному принципу – максимальной близости и протяженным общим границам.
Методы
Особенностью методического подхода стало применение стандартизированной методики оценки размерного морфологического разнообразия животных, занимающих в существенной мере перекрывающиеся экологические ниши в пределах единого географического пространства.
Первичная информация о размерной изменчивости получена путем измерения черепов цифровым штангенциркулем с точность до 0.01 мм. Подробное изложение используемой схемы измерений представлено в ранее опубликованных работах: для N. procyonoides (Кораблёв и др., 2012); V. vulpes (Кораблёв и др., 2018); C. lupus. Подготовка цифрового материала для статистического анализа осуществлялась в рамках стандартных процедур: заполнение пропусков в измерениях поврежденных черепов методом линейной регрессии, элиминация аутлаеров, проверка на соответствие нормальному распределению и, при необходимости, его трансформация перед осуществлением параметрического многомерного анализа. Визуализация изменчивых анатомических областей черепа выполнена на 3D-моделях объектов, полученных с помощью трехмерного сканера RangeVision Smart и программного обеспечения, поставляемого с оборудованием.
Для статистической обработки результатов измерения краниометрических признаков использовали параметрические методы многомерной статистики – общую модель двухфакторного дискриминантного анализа для изучения внутривидовой изменчивости. В качестве тестируемых факторов для определения гендерных различий учитывали пол и возраст животных, для оценки пространственной (географической) изменчивости факторами выступали географическое положение локалитета и половая принадлежность животных. В качестве непараметрического аналога использована пермутационная процедура перестановок с анализом множественного отклика (MRPP) (McCune, Grace, 2002).
С целью снижения размерности морфологического пространства проведено многомерное неметрическое шкалирование всего массива измерений отдельно для каждого вида хищников. Предикторами выступали тестируемые факторы, во всех случаях использована метрика Евклида, количество итераций составляло от 300 до 999. В дальнейшем работали с полученными осями многомерного шкалирования, которые обобщали изменчивость всех краниометрических признаков и достоверно коррелировали с предикторами. Для интерпретации результатов, количественного и качественного учета влияния факторов на полученные в ходе процедуры многомерного шкалирования макропеременные использованы ранговый коэффициент корреляции Спирмена и модели многофакторного линейного регрессионного анализа.
Для оценки влияния фактора изоляции расстоянием на морфологическую изменчивость животных применяли тест Мантеля (1000 итераций) с натуральными и логарифмированными значениями географических расстояний между локалитетами и морфологическими, оцениваемыми как квадрат дистанций Махаланобиса. Расчеты выполнены в программах: MS Excel, MapInfo, PC-ORD, IBD, Statistica 12.0, статистической среде R (R Core Team..., 2018).
Результаты
Размерный половой диморфизм
Обобщенная характеристика размерного полового диморфизма изученных представителей сем. Canidae представлена в табл. 2.
Таблица 2. Характеристика полового диморфизма псовых
| Показатель | Canis lupus | Vulpes vulpes | Nyctereutes procyonoides |
| Коэффициент вариации (♂/♀) | 5.09 ± 0.49/4.93 ± 0.54 | 4.37 ± 0.39/4.62 ± 0.38 | 4.98 ± 0.38/4.70 ± 0.41 |
| Средний индекс полового диморфизма (ИПД)* | 3.55 | 3.01 | 1.65 |
| Критерий Вилкоксон-ламбда (W-λ)** | 0.93 | 0.99 | 0.96 |
| Критерий Фишера (F)** | 31.7; p < 0.001 | 4.8–5.46; p ≤ 0.03 | 10.6; p < 0.001 |
| Квадрат дистанции Махаланобиса (D2) ** | 2.38; p < 0.00001 | 2.02; р < 0.001 | 0.57; р < 0.01 |
| Средний % верной классификации (♂/♀)** | 80.0 (91.7/56.3) | 76.9 (73.4/80.5) | 66.4 (67.6/65.2) |
| Значимо дискриминирующие признаки** | Ширина головки суставного отростка нижней челюсти | Кондилобазальная длина черепа; расстояние от заднего края барабанных камер до переднего края резцовой кости; ширина верхнего клыка у основания | Ширина верхнего клыка у основания |
Примечание. * – индекс полового диморфизма рассчитывали по формуле: ИПД = 100 × (X♂ - X♀) / X♀, где ИПД – величина полового диморфизма в процентах; X♂ и X♀ – средние величины признаков для самцов и самок, отражает масштаб различий в процентах. ** – результаты дискриминантного анализа.
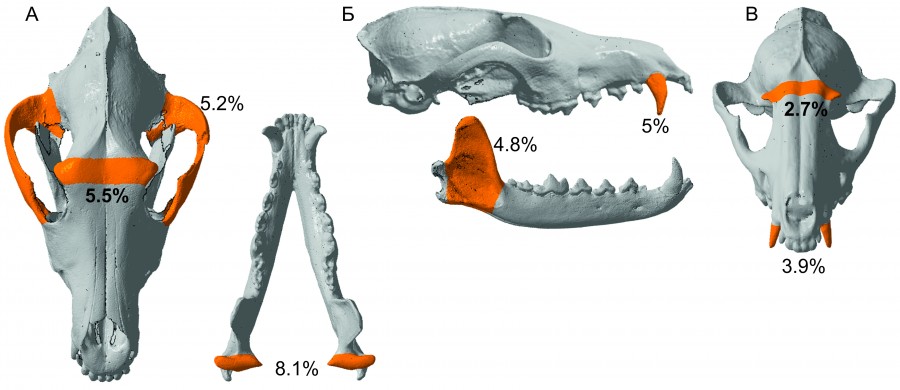
Рис. 2. Анатомические области черепа псовых с максимальным проявление размерного полового диморфизма, % – значения ИПД. А – C. lupus, Б – V. vulpes, B – N. procyonoides
Fig. 2. Anatomical areas of the skull of canids with the maximum manifestation of dimensional sexual dimorphism, % – value of ISD. А – C. lupus, Б – V. vulpes, B – N. procyonoides
Среднее значение ИПД краниометрических признаков волка составило 3.55. В группе неполовозрелых животных ИПД был ниже – 2.88. По всем используемым в исследовании краниометрическим переменным размеры самцов превосходят размеры самок. Максимальные проявления полового диморфизма найдены для признака «ширина головки суставного отростка нижней челюсти» (ИПД = 8.1); высокие значения индекса также характерны для признаков «скуловая ширина» (ИПД = 5.5) и «ширина заглазничных отростков» (ИПД = 5.2) (рис. 2А). Минимальные межполовые различия отмечены для признаков зубной системы («длина коронки первого премоляра» (ИПД = 0.36)). Средние значения коэффициента вариации в группе взрослых самцов и самок близки, достоверные различия между ними отсутствуют (p < 0.05). Пол волков репродуктивного возраста корректно распознается дискриминантным анализом лучше для самцов, чем самок. На протяжении всего возраста особей, включенных в исследование, значимо дискриминирующей пол переменной служит лишь один признак – «ширина головки суставного отростка нижней челюсти».
Среднее значение ИПД по всем краниометрическим признакам взрослых особей лисицы обыкновенной составило 3.01, в то время как для неполовозрелых животных существенно меньше – 1.04. За исключением заглазничного сужения самцы по всем признакам превосходят размерами самок. Максимальные значения ИПД = 5.02 характерны для ширины клыка и высоты венечного отростка ИПД = 4.80 (рис. 2Б). Средние значения коэффициента вариации самок и самцов различаются недостоверно (p < 0.05). Корректная классификация половой принадлежности самцов и самок в рамках дискриминантного анализа осуществляется с равной вероятностью. Наибольшей разрешающей способностью для распознавания пола обладают два признака черепа и один признак зубной системы.
Средний индекс полового диморфизма енотовидной собаки в группе взрослых животных составил 1.65, в то время как у животных предрепродуктивного возраста был незначительно ниже – 1.57. Самцы крупнее самок по всем признакам, но максимальные проявления различий характерны для ширины клыка (ИПД = 3.94) и ширины заглазничных отростков (ИПД = 2.68) (рис. 2В). Минимальные половые различия отмечены для признаков: «заглазничное сужение» (ИПД = -0.12), «длина верхнего зубного ряда» (ИПД = 0.69) и «длина нижнего зубного ряда» (ИПД = 0.86). Несмотря на близкие средние значения коэффициента вариации, достоверные различия между самцами и самками по этому показателю существуют (p = 0.01). Дискриминантный анализ определяет лишь один значимый для выявления пола признак – «ширина клыка у основания». Корректная классификация с равной долей вероятности определяет пол самца и самки.
Как следует из приведенных данных, максимально выраженным половым диморфизмом характеризуется череп волка, несколько меньшими гендерными различиями обладает лисица и минимально выраженным половым диморфизмом – енотовидная собака. Общая тенденция для всех изученных видов – прогрессирующее увеличение размерного полового диморфизма с возрастом животных, максимальных величин этот показатель достигает у взрослых особей. Следует отметить, что наибольший половой диморфизм признаков ассоциирован с зубочелюстным аппаратом хищников и отчасти анатомическими областями черепа – местами прикрепления жевательной мускулатуры.
Пространственная изменчивость
Популяции симпатричных видов псовых на ограниченной географической территории характеризуются достоверной пространственной морфологической структурированностью, но с различной степенью проявления этого феномена (табл. 3).
Таблица 3. Характеристика пространственной изменчивости псовых
| Показатель | Canis lupus | Vulpes vulpes | Nyctereutes procyonoides |
| Критерий Вилкоксон-ламбда (W–λ) | 0.84–0.91 | 0.83–0.97 | 0.82–0.97 |
| Критерий Фишера (F) | 2.24–4.42 | 3.12–22.6 | 2.78–18.91 |
| Количество значимо дискриминирующих признаков | 6 | 6 | 4 |
| Квадрат дистанции Махаланобиса (D2) (ср. значение, лимиты) | 5.21 (1.9–12.6) | 1.65 (0.78–3.33) | 1.65 (0.85–2.66) |
| Средний % верной классификации (лимиты) | 63.5 (33.3–91.8) | 54.6 (30.9–73.9) | 60 (15.4–80.3) |
| MRPP/a-posteriori парно различающиеся локалитеты, количество | Т = -6.16...-6.5; А = 0.06; р > 0.0001/2 | T = -4.79; A = 0.01; p > 0.001/2 |
Т = -6.5... -4.41; А = 0.04–0.06; р > 0.0001/3 |
| Различающиеся признаки, % максимальных различий | Максимальная длина коронки Р1 верхней челюсти 12.7 %;
коронарная длина второго моляра 12.2 %; кондилобазальная длина черепа 6.8 %; длина верхней челюсти 9.9 %; общая длина зубного ряда нижней челюсти 4.9 %; альвеолярная длина ряда коренных зубов нижней челюсти 2.1 % |
Кондилобазальная длина черепа 2.0 %; коронарная длина P4 1.2 %;
скуловая ширина 1.5 %; длина нижней челюсти 0.8 %; ширина рострума 6.9 %; ширина на уровне яремных отростков 2.2 % |
длина верхнего ряда коренных зубов 1.4 %; коронарная длина Р4 3.7 %;
ширина верхней челюсти над клыками 3.4 %; длина нижней челюсти 2.8 %
|
| Оценка изоляции расстоянием (тест Мантеля) | Z = 31.8–31708.6; r = -0.1–0.03; p ≤ 0.38 | Z = 7589.56; r = 0.54; p ≤ 0.16 | Z = 2.26–1876.1; r = -0.33...-0.42; р ≤ 0.57 |
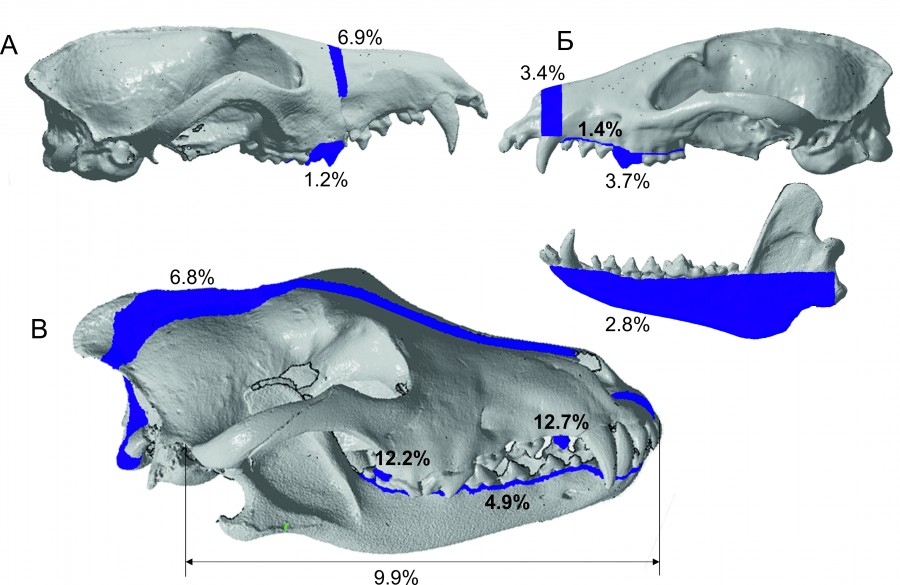
Рис. 3. Доля варьирования пространственной изменчивости краниометрических признаков псовых. А – V. vulpes,
Б – N. procyonoides, В – C. lupus
Fig. 3. The proportion of variation in spatial variability of craniometric signs of canids. А – V. vulpes, Б – N. procyonoides,
В – C. lupus
Рассматривая эту форму морфологической изменчивости в сравнительном межвидовом аспекте, следует констатировать наиболее выраженную пространственную структурированность в популяции волка. Об этом свидетельствуют результаты дискриминантного анализа и масштаб изменчивости значимо различающихся признаков, максимальных различий среди которых достигали признаки зубной системы и линейные размеры черепа (рис. 3В). Использование пермутационной процедуры и многомерного параметрического анализа показывает сходные результаты: с точки зрения большего морфологического своеобразия волка можно выделить два локалитета – 2 и 6, представляющие собой выборки из популяции с минимальной географической дистанцией (не более 80 км), в то время как остальные локалитеты характеризуются высокой степенью подобия.
Используемые методы статистического анализа указывают, что пространственная краниометрическая изменчивость лисицы обыкновенной менее выражена, чем у волка. В частности, об этом свидетельствует меньший диапазон изменчивости признаков, меньшая доля корректно классифицированных особей в априори определенные локалитеты, более низкие значения D2. У лисицы в большей степени пространственной изменчивости подвержена ширина рострума на уровне подглазничных отверстий, коронарная длина Р4 и ширина клыка у основания (рис. 3А). Двухфакторный дискриминантный и пермутационный анализы подтверждают наиболее выраженные отличия у животных репродуктивного возраста из двух локалитетов – 1 и 4, разделенных максимальной географической дистанцией в 450–500 км.
Пространственная изменчивость енотовидной собаки выражена для четырех краниометрических признаков, определяемых с помощью дискриминантного анализа. Однако максимальный масштаб изменчивость проявили всего два признака: «коронарная длина Р4» и «ширина верхней челюсти над клыками» (рис. 3Б). Критерии статистического анализа указывают на соотносимую степень проявления пространственной изменчивости енотовидной собаки и лисицы. Различия заключаются в большем количестве локалитетов, различающихся морфологическим своеобразием у интродуцированного вида. Дискриминантный анализ и MRPP позволяют выделить три локалитета, достоверно различающихся в большинстве парных апостериорных сравнений и характеризующихся максимальным значением корректной классификации особей, – 1, 2 и 3.
Фактор изменчивости в соответствии с моделью «изоляция расстоянием» для изученных хищников в рамках географического пространства, ограниченного дистанцией 500 км, не обнаруживает достоверной изменчивости краниометрических признаков. Иными словами, упорядоченная расстоянием изменчивость в изученных локалитетах отсутствует, поскольку сопоставление матриц морфологических и географических дистанций не выявило значимой корреляции между ними.
Хронографическая изменчивость
Для изученных видов псовых характерно проявление хронографической изменчивости краниометрических признаков (табл. 4).
Таблица 4. Характеристика хронографической изменчивости псовых
| Показатель | Canis lupus | Vulpes vulpes | Nyctereutes procyonoides |
| Изменчивые признаки, % изменчивости | Максимальная длина черепа 2.2 %; длина верхней челюсти 2.4 %; максимальная длина коронки Р1 верхней челюсти 8.7 %; максимальная длина коронки М2 верхней челюсти 11.8 %; длина нижней челюсти 2.2 % |
Ширина рострума 9.6 %; коронарная длина четвертого премоляра 2 %; ширина клыка 7.9 % |
Кондилобазальная длина черепа 2.7 %; расстояние от заднего края барабанных камер до переднего края резцовой кости 3.0 %; расстояние от заднего края барабанных камер до заднего края подглазничных отверстий 2.8 %; коронарная длина Р4 5.4 %; ширина верхнего клыка у основания 3.5 %; ширина рострума 4.3 %; ширина по заглазничным отросткам 3 %; длина нижней челюсти 2.9 %; длина нижнего ряда коренных зубов 2.4 %; высота венечного отростка 3.2 % |
| Тренд изменчивости | Слабо выраженное увеличение размеров на фоне флуктуации | Флуктуация без выраженного тренда | Увеличение длины черепа на фоне флуктуации признаков, характеризующих линейные продольные размеры |
| Статистика изменчивых признаков Краскела – Уоллеса (K–W) | H = 8.72–49.8; p = 0.03–0.001 | H = 7.1–57.6; p < 0.001 | H = 10.9–42.5; p ≤ 0.01 |
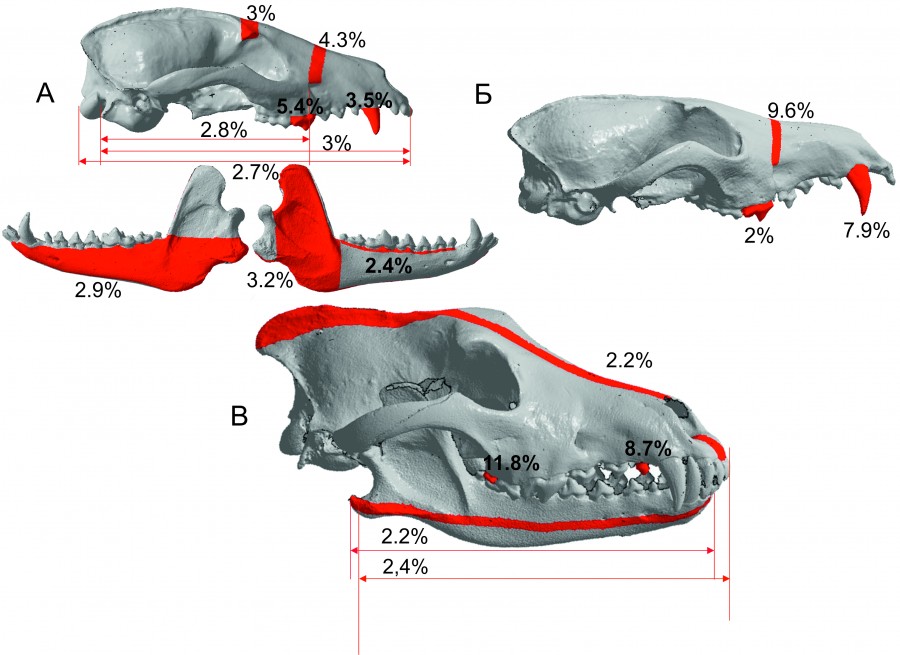
Рис. 4. Доля варьирования хронографической изменчивости краниометрических признаков псовых.
А – N. procyonoides, Б – V. vulpes, В – C. lupus
Fig. 4. The proportion of variation in the chronographic variability of craniometric signs of canids. А – N. procyonoides,
Б – V. vulpes, В – C. lupus
Изучение динамики морфологической изменчивости во временном аспекте позволяет выделить у волка пять переменных, характеризующих вариабельность отдельных элементов зубной системы и черепа (рис. 4В). Масштаб варьирования размеров выше у одонтологических признаков, чем краниометрических. Характер временной изменчивости имеет тренд увеличения краниометрических и уменьшения одонтологических признаков на фоне выраженной флуктуации по периодам сбора.
Анализ краниометрических признаков лисицы обыкновенной за период сбора коллекции определил достоверную и более выраженную изменчивость одного краниометрического и несколько менее появляющуюся изменчивость двух одонтологических признаков (рис. 4Б). Характер варьирования признаков не позволяет отметить выраженную тенденцию в изменчивости их размеров – они флуктуируют без определенной направленности.
Хронографическая изменчивость енотовидной собаки достоверно проявляется на двух одонтологических и восьми краниометрических признаках (рис. 4А). Несмотря на большее количество изменчивых переменных, масштаб их варьирования ниже, чем у волка и лисицы. Однако характер хронографической изменчивости имеет более выраженную тенденцию укрупнения размеров, характеризующих длину черепа, что особенно отчетливо проявлялось до середины 1980-х гг., с начала 1990-х гг. наступила стабилизация размеров, а на рубеже 2010-х гг. присутствует тренд снижения размеров отдельных краниометрических переменных.
Приоритетность факторов полиморфизма
Для оценки приоритетности тестируемых предикторов-факторов, оказывающих влияние на размерную морфологическую изменчивость изученных Canidae, использован многофакторный линейный регрессионный анализ зависимых макропеременных осей многомерного шкалирования.
Краниометрическая изменчивость волка воспроизводится тремя ОМШ (96.4 %). Доля объясняемой осями изменчивости составила: ОМШ-1 = 57.8 %; ОМШ-2 = 30.4 %; ОМШ-3 = 8.2 %, значение стресса – 0.07. ОМШ-1 коррелирует с географическим положением локалитета (rSpearman = 0.28), в большей мере описывает изменчивость кондилобазальной длины черепа (rSpearman = -0.50) и коронарной длины М2 (rSpearman = 0.32). ОМШ-2 коррелирует с полом (rSpearman = 0.21) и возрастом (rSpearman = -0.49), а также двенадцатью краниометрическими переменными: максимально выражены для скуловой ширины (rSpearman = -0.77) и заглазничных отростков (rSpearman = -0.74). ОМШ-3 коррелирует с периодом добычи животных (rSpearman = 0.14) и всеми краниометрическими признаками, наибольшие корреляции характерны для длины черепа (rSpearman = -0.55), длины верхней (rSpearman = -0.47) и нижней (rSpearman = -0.45) челюсти, признаков, характеризующих длину зубного ряда (rSpearman = -0.43...-0.44).
Размерный полиморфизм черепа лисицы обыкновенной удовлетворительно описывается (93.9 %) тремя осями: ОМШ-1 = 65.3 %; ОМШ-2 = 16.5 %; ОМШ-3 = 12.1 %. Значение стресса составило 0.108. ОМШ-1 коррелирует с полом (rSpearman = 0.50) и возрастом животных (rSpearman = -0.52); ОМШ-3 – с периодом добычи (rSpearman = -0.34) и географическим положением локалитета (долгота rSpearman = -0.45; широта rSpearman = -0.27). При этом ОМШ-1 воспроизводит изменчивость длины церебральной и висцеральной частей черепа (rSpearman ≥ |0.70|), а ОМШ-3 – ширину рострума, коронарную длину Р4 и ширину коронки клыка у основания.
Краниометрический полиморфизм енотовидной собаки описывается (98.1 %) двумя ОМШ: ОМШ-1 = 91 %; ОМШ-2 = 7.1 %. Значение стресса – 0.07. ОМШ-1 коррелирует со всеми тестируемыми факторами полиморфизма, в большей мере с районом добычи (rSpearman = -0.21) и полом животных (rSpearman = -0.23), в меньшей – с возрастом (rSpearman = -0.18) и периодом добычи (rSpearman = -0.12). Наряду с этим данная макропеременная характеризуется наибольшими значениями корреляции rSpearman = |0.70 – 0.98| с краниометрическими признаками, описывающими длину черепа (кондилобазальная длина, длина от барабанных камер до резцовой кости и подглазничного отверстия, межорбитальным промежутком), и одонтологическими признаками: длиной верхнего ряда коренных зубов, коронарной длиной Р4.
Поскольку в анализ включены черепа всех особей выборки, был добавлен фактор возрастной индивидуальной аллометрической изменчивости, который, как очевидно следует из результатов анализа, доминирует над остальными факторами размерного полиморфизма.
Как показали результаты изучения, размерный половой диморфизм выступает видовой характеристикой изученных Canidae. Поэтому он стал вторым по значимости после возрастной изменчивости фактором размерного полиморфизма.
Результаты проведенного анализа в отношении волка (рис. 5) показали абсолютное преобладание фактора индивидуальной аллометрической изменчивости над размерным половым диморфизмом. Наряду с этим пространственная изменчивость превосходит по мощности проявления хронографическую. 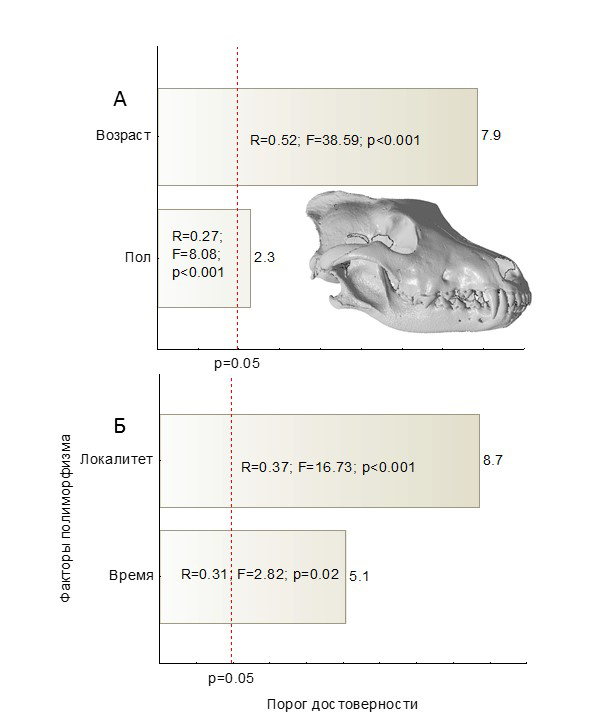
Рис. 5. Гистограммы коэффициентов Парето, характеризующие размерную морфологическую изменчивость Canis lupus, обобщенную с помощью макропеременных – ОМШ. Здесь и далее в столбцах показаны значения параметров регрессионной модели. А – ОМШ-2, 30.4 % изменчивости; Б – ОМШ-1, 57.8% изменчивости
Fig. 5. Pareto charts characterizing the dimensional morphological variability of Canis lupus generalized using macro variables - axes of non-metric multidimensional scaling (NMS). Hereinafter in columns the values of the regression model parameters are shown. А – The second axe of NMS, 30.4 % of variability, Б – The first axe of NMS, 57.8 % of variability
Результаты регрессионного анализа выявили сходное соотношение факторов полиморфизма у лисицы (рис. 6). Однако, в отличие от волка, факторы возрастной и половой изменчивости лисицы характеризуются близким по силе влиянием. В соотношении пространственно-временной изменчивости доминирует принадлежность к локалитету больше, чем время сбора, что свидетельствует о преобладании пространственной изменчивости над временной.
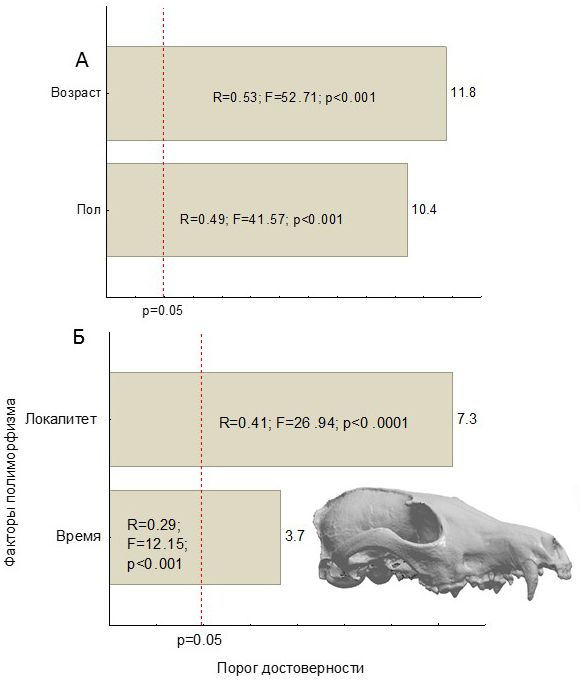
Рис. 6. Гистограммы коэффициентов Парето и характеризующие размерную морфологическую изменчивость Vulpes vulpes, обобщенную с помощью макропеременных – OМШ. А – ОМШ-1, 65.3 % изменчивости; Б – ОМШ-3, 12.1 % изменчивости
Fig. 6. Pareto charts characterizing dimensional morphological variability of Vulpes vulpes generalized using macro variables - axes of non-metric multidimensional scaling (NMS). А – The first axe of NMS, 65.3 % of variability, Б – The third axe of NMS, 12.1 % of variability
Влияние тестируемых факторов размерного морфологического полиморфизма енотовидной собаки несколько отличается от аборигенных Canidae (рис. 7).
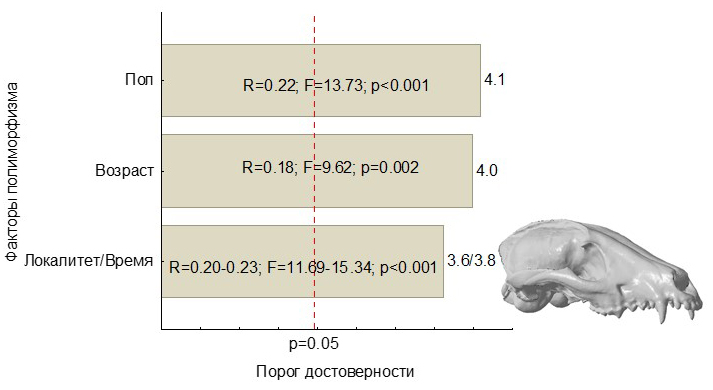
Рис. 7. Гистограммы коэффициентов Парето, характеризующие размерную морфологическую изменчивость Nyctereutes procyonoides, обобщенную с помощью одной макропеременной – оси многомерного шкалирования, объясняет 91 % изменчивости
Fig. 7. Pareto charts characterizing dimensional morphological variability of Nyctereutes procyonoides generalized using one macro variable – axis of non-metric multidimensional scaling, it explaines 91 % of variability
Превалирующая доля дисперсии краниометрических признаков описывается одной осью многомерного шкалирования, что позволяет использовать эту макропеременную для характеристики соотношения факторов полиморфизма. Ведущую роль в проявлении краниометрической изменчивой играет половая принадлежность, а не возрастная составляющая, что, скорее, можно объяснить относительной гомогенностью выборки по возрастному составу, представленной черепами практически взрослых животных. На втором месте по силе влияния в паритетном соотношении выступает пространственная и временная изменчивости, по мощности лишь немногим уступающие возрастному и половому полиморфизму.
Обсуждение
Половой диморфизм
В ряду хищных млекопитающих, населяющих европейскую территорию страны, Canidae демонстрируют менее выраженные межполовые различия, чем Mustelidae (Кораблёв и др., 2014). Будучи фундаментально обусловленным половым отбором, половой диморфизм связан с социальной организацией видов, которая у псовых отличается от таковой куньих. Волк, лисица и енотовидная собака проявляют более или менее выраженные черты моногамной стратегии размножения, являясь «облигатными моногамами», поскольку часто самец активно участвует в поимке и доставке добычи кормящей самке и ее детенышам (Kleiman, 1977). В ряду рассматриваемых видов наиболее выраженные размерные половые различия характерны для волка, половозрелые самцы которого в среднем на 3.6 % крупнее самок. Для обыкновенной лисицы также отмечены относительно высокие межполовые различия – средний размер самцов превосходит самок на 3 %. Наименее диморфна енотовидная собака, самцы которой крупнее самок лишь на 1.7 %. Такие соотношения межполовых различий подтверждаются и результатами дискриминантного анализа. Еще одну особенность проявления размерного полового диморфизма можно отметить, обратив внимание на тот факт, что максимальные различия между самцами и самками обнаруживаем среди признаков, характеризующих зубной и челюстной аппараты, но не общие размеры черепа. Учитывая преимущественно моногамный образ жизни псовых рассматриваемой области, такие морфологические различия между полами призваны снизить внутривидовую конкуренцию за счет некоторой сегрегации их трофических ниш, что в большей мере выражено у волка и лисицы. Слабо выраженный половой диморфизм енотовидных собак может отражать их широкую пищевую специализацию, которая снижает не только меж-, но и внутривидовую конкуренцию. Отсутствие достоверных различий коэффициентов вариации краниометрических признаков самцов и самок указывает на сходство ширины их экологической ниши, однако различия этого показателя у енотовидной собаки заставляют с осторожностью трактовать результаты и полагать существование незначительной внутривидовой специализации обоих полов псовых, что не противоречит известным биологическим особенностям этих видов.
Пространственная изменчивость
Волк. Большинством авторов при изучении краниологических коллекций вида, собранных на территориях разного масштаба, подтверждается существенная изменчивость как краниометрических, так и одонтологических признаков (Россолимо, Долгов, 1965; Юдин, 2013; Milenkovič et al., 2010). Наши результаты указывают на достоверную пространственную изменчивость четырех признаков (кондилобазальной длины черепа, длины верхней челюсти, коронарной длины первого премоляра, коронарной длины второго моляра), наибольших масштабов различия достигали между локалитетами, расположенными на минимальной географической дистанции. При этом упорядоченная географическая изменчивость в соответствии с моделью «изоляция расстоянием» отсутствовала, что может быть вызвано как единообразием экологических факторов и спектра питания на изучаемой территории, так и панмиксией, определяемой биологическими особенностями волка. Пространственная структурированность популяции этого представителя Canidae может быть интерпретирована с учетом биологических особенностей. Волк – вид с ярко выраженной социальной организацией (Овсяников и др., 1985). Стая занимает определенное пространственное положение с выраженным территориальным зонированием, описываемым посредством буферных зон (Mech, 1994) или более дифференцированных пространственных субъединиц (Эрнандес-Бланко и др., 2005; Мельник и др., 2007). Волчьи семьи могут в течение длительного времени занимать определенную местность, а их расселяющееся потомство формирует семейные пары и нередко занимает соседние участки (Mech, Boitani, 2003). Территориальный консерватизм волка (Эрнандес-Бланко и др., 2005; Мельник и др., 2007) при определенных условиях приводит к формированию внутрипопуляционных демов – семейных групп, характеризующихся определенным генотипическим и фенотипическим родством. Подобная социальная организация способствует проявлению эффекта Валунда, когда в результате нарушения панмиксии в мелких неравночисленных семейных группах происходит близкородственное скрещивание, и формируются временные инбредные линии, характеризующиеся морфологическим своеобразием. Однако постоянный охотничий пресс, нарушающий родственные связи и стимулирующий иммиграцию и эмиграцию особей, не позволяет этим фенотипическим различиям принять дальнейший дивергентный характер.
Лисица обыкновенная. Изменчивость краниометрических признаков вида на минимальной географической дистанции, не превышающей 150 км, обнаруживалась и ранее, в частности такие сведения известны для животных, населяющих британские острова (Huson, Page, 1980). Отмеченная нами пространственная изменчивость затрагивает ширину рострума и коронарную длину Р4 – признаки, ассоциированные с зубочелюстным аппаратом. Функциональная обусловленность признаков позволяет предполагать влияние на них как трофических, так и социальных факторов. Известно, что внутри- и межвидовые взаимодействия в рамках гильдий экологических ниш хищников могут оказывать влияние на вариабельность признаков черепа и зубной системы (Van Valen, 1965; Meiri et al., 2005). В пределах рассматриваемой территории плотность популяции лисицы не высока, в среднем составляет 0.1 особи на км2, что в значительной мере нивелирует остроту внутривидовой конкуренции. Кроме того, среди симпатричных Canidae хищник не имеет прямых конкурентов и, за исключением антагонистических отношений с волком, может вступать в агрессивные межвидовые контакты c енотовидной собакой при совместном использовании нор (Kowalczyk et al., 2008; Сидорчук, Рожнов, 2010). В изменчивости зубной системы лисицы значительную роль играют особенности рациона в различных частях ареала и на различных этапах филогенеза (Szuma, 2008; Szuma, Germonpré, 2020). Цикличные колебания численности мелких млекопитающих – основных объектов питания лисицы связаны с динамичными параметрами среды Каспийско-Балтийского водораздела (Истомин, 2008), что создает предпосылки к изменению рациона хищника в масштабах территории исследования, характеризующейся высокой мозаичностью. Отсутствие упорядоченной географической изменчивости по принципу «изоляция расстоянием» в рамках изученного фрагмента ареала обусловлено биологическими особенностями вида – протяженными индивидуальными участками и высокой территориальной мобильностью. Поэтому следует предполагать комплементарное влияние на размерную вариабельность черепа лисицы обсуждаемых причин изменчивости, что в совокупности приводит к пространственной внутрипопуляционной структурированности.
Енотовидная собака. Пространственная структурированность вида связана с четырьмя признаками, но степень проявления этой формы изменчивости выражена в меньшей мере, чем у аборигенных хищников. Новейшая история популяций енотовидной собаки включает интродукцию и последующие процессы освоения территории по мере естественного расселения. Поэтому механизм возникновения пространственной структурированности может быть связан с адаптациями к новым условиям обитания, а также определяться демографическими особенностями, зависящими от путей освоения территории. Выраженная изменчивость одонтологических признаков енотовидной собаки может свидетельствовать об адаптивном характере, демонстрируя приспособление к изменившемуся спектру питания. Как показали исследования изменчивости окклюзивной поверхности зубной системы вида, фиксируются достоверные отличия в контрастном сравнении животных, интродуцированных в Европе, по отношению к популяциям автохтонного ареала (Korablev et al., 2017). В целом обнаруженная внутрипопуляционная пространственная изменчивость согласуется с биологическими особенностями енотовидной собаки. Таковыми выступают отсутствие территориального консерватизма, склонность к широким перемещениям. Поэтому обширная метапопуляция енотовидной собаки в европейской части страны с учетом стабильно высокой численности и эврибионтности определяет слабую внутрипопуляционную структурированность.
Отсутствие упорядоченной географической изменчивости по принципу «изоляция расстоянием» у изученных представителей Canidae не стало сюрпризом. Обширные территориальные участки семейных групп волка, в европейской части страны составляющие от 200 до 280 км2, индивидуальные участки лисицы порядка 30 км2, годовые перемещения енотовидной собаки на расстояние до 80 км, а также относительно стабильная численность создают предпосылки для панмиксии на подобного масштаба площадях. Способствуют этому и отсутствие градиента факторов среды, а также географических барьеров, поэтому влияние подобных биологических и географических особенностей нивелирует эту модель изменчивости.
Хронографическая изменчивость
Хронографическая динамика морфологического разнообразия присутствует у всех трех изученных видов, но характеризуется различными тенденциями. При всем многообразии факторов, обсуждаемых в отношении феномена временной изменчивости животных, их можно свести к трем группам и рассмотреть в качестве гипотез.
Во-первых, внутривидовая временная изменчивость размеров млекопитающих объясняется исходя из природно-климатического контекста – глобальных климатических процессов и опосредованного антропогенного влияния. Механизм, описываемый этой концепцией, складывается из двух взаимосвязанных процессов: глобального потепления, приводящего к увеличению первичной продуктивности экосистем (еNPP Rule) (Huston, Wolverton, 2011), и прямого влияния температурного фактора, действующего на гомойотермных животных в соответствии с биогеографическим правилом Бергмана (Yom-Tov, 2003; Yom-Tov, Geffen, 2011). Частным случаем выступает антропогенное влияние, проявляющееся в формировании агроландшафтов, характеризующихся высокой продуктивностью, что часто приводит к увеличению размеров консументов высших порядков (Yom-Tov, 2003; Yom-Tov, Yom-Tov, 2012).
Во-вторых, объясняется фундаментальным правилом Копа – Депере, определяющим укрупнение размеров организмов в ходе филогенеза, и, как показали недавние исследования, этот процесс также зависит от совокупности биотических и абиотических факторов, менявшихся в физиографической истории континентов (Smith et al., 2010).
В-третьих, хронографическая изменчивость определяется биотическими взаимодействиями, формирующимися в природных сообществах в рамках системы «хищник – жертва»: размеры хищников коррелируют с размером жертвы (Mech, Paul, 2008; Yom-Tov, Geffen, 2011).
Рассмотрим более подробно обсуждаемые гипотезы в отношении хронографической изменчивости волка. Изученный участок ареала за 50-летний период характеризуется приращением температуры +2.08 ºС (Пузаченко, 2012). Однако не климатические сдвиги, а депопуляция сельского населения и усиление лесопользования привели к сукцессиям и увеличению мозаичности угодий, что повлекло увеличение численности основной добычи волка – лося Alces alces и кабана Sus scrofa. Поэтому тенденцию укрупнения отдельных краниометрических признаков волка на ограниченном пространственно-временном интервале мы склонны объяснять биотическими причинами межвидового взаимодействия в системе «хищник – жертва» при регулярной охоте на лося и кабана на фоне устойчивой тенденции увеличения плотности популяции жертвы. В пользу этого свидетельствуют и проявившие хронографическую изменчивость функционально важные в добыче крупной жертвы признаки челюстного аппарата. Реалистичность гипотезы подтверждают и тренды численности крупных млекопитающих, которые доминируют в рационе волка на рассматриваемой территории.
Влияние правила Копа – Депере необходимо анализировать на достаточно больших временных периодах филогенетического масштаба, однако подобные эмпирические обобщения применялись к новейшей истории популяций волка ранее (Раменский и др., 1985).
У лисицы этот тип изменчивости носит флуктуирующий характер без определенного тренда. Изменения климатической обстановки в районе исследования не привели к глубоким трансформациям экосистем, однако хозяйственная деятельность человека в связи с усилением лесопользования и упадком сельского хозяйства вызвала масштабные сукцессионные изменения и повысила мозаичность экосистем. Осцилляцию размеров можно связать, учитывая их функциональную обусловленность, с доминирующим типом питания в рационе хищника, например пульсационной динамикой численности преобладающей жертвы – микромаммалия, демографическая и видовая структура мелких млекопитающих, как показали мониторинговые исследования А. В. Истомина (2008) в Тверской области, характеризуется нестационарной динамикой.
Временная изменчивость интродуцированной в Европе енотовидной собаки, на наш взгляд, может быть связана с заполнением естественной экологической емкости экосистем при отсутствии напряженной внутри- и межвидовой конкуренции, т. е. объясняется тем, что животные осваивали вакантную экологическую нишу. Это заключение согласуется с высказанным С. С. Шварцем (1980) мнением об укрупнении размера тела акклиматизированных видов вследствие заполнения свободных экологических ниш в местах интродукции. Однако присутствует и функциональная причина – одонтологические признаки также претерпевают хронографическую изменчивость, что можно рассматривать сквозь призму влияния трофического фактора.
Также полагаем, что возможной причиной хронографической изменчивости псовых может быть интенсивная ненаправленная элиминация вследствие суммарной гибели, как из-за добычи человеком, так и в результате естественных причин. Доля гибели молодых зверей Canis lupus в течение первых двух лет жизни достигает 60–80 % (Данилов и др., 1985). Выживаемость лисицы в отдельных популяциях (районы Урала) составляет от 33 % у сеголетков до 56 % у взрослых животных (Кorytin, 2002). Для сеголетков енотовидной собаки смертность достигает 61 % только за три первых месяца жизни (Kowalczyk et al., 2009). Высокая суммарная гибель особей может приводить к отклонениям от «среднего» фенотипа в большую или меньшую сторону, вызывая ненаправленные (стохастические) осцилляции размеров. Таким образом, временная изменчивость псовых в этой части ареала может быть вызвана комплементарным действием ряда факторов, среди которых трофическая обстановка и стохастические факторы, вызванные интенсивной элиминацией животных в результате суммарной гибели.
Соотношение факторов полиморфизма
Общей тенденцией полиморфизма трех видов хищных млекопитающих является приоритетность влияния индивидуальной онтогенетической изменчивости. Вторым по значимости вклада служит размерный половой диморфизм. Пространственная изменчивость преобладает над хронографической, их совокупный эффект определяет пространственно-временную изменчивость животных в изученных промысловых сборах.
Результаты изучения внутрипопуляционной изменчивости хищных млекопитающих позволяют рассматривать морфологическую структурированность на минимальной географической шкале как общую закономерность. Степень наблюдаемых различий не высока, не упорядочена в географическом отношении и определяется, очевидно, сочетанием эндогенных и внешних факторов. Отмеченные морфологические различия могут не иметь адаптивных качеств, но, повышая полиморфизм, формируют сложную внутрипопуляционную систему, устойчивую к дестабилизирующим факторам, а также служат материалом для адаптациогенеза, позволяя динамично реагировать на изменяющиеся в пространственно-временном континууме параметры среды.
Заключение
Морфологическая структурированность популяций крупных и средних хищных млекопитающих на микрогеографической шкале вызвана биологическими особенностями этих видов. Самые сильные проявления наблюдаемого феномена в пространственном отношении обнаружены у волка. Это может быть связано с групповым семейным размещением и образом жизни хищника. Строгая территориальность и тесные родственные связи формируют демы, которые нарушают равновесную численность генотипов, уклоняются от распределения Харди – Вайнберга в силу эффекта Валунда. Ситуация с лисицей может складываться по похожему сценарию. Однако менее выраженная пространственная изменчивость вида определяется и иной жизненной стратегией: варьированием репродукции от облигатной моногамии до факультативной полигамии, т. е. менее выраженной социальной организацией. Пространственная популяционная структура енотовидной собаки наименее выражена, что вполне ожидаемо, учитывая отсутствие территориальности, склонность вида к кочевому образу жизни, подобные биологические особенности предопределяют панмиксию.
В случае географического микро(мезо)масштаба пространственная структурированность популяции этих видов может не являться адаптацией к среде обитания, а носит отчасти стохастический и эфемерный характер. Демы существуют несколько поколений и исчезают, что нивелирует морфологическую структурированность. Кроме того, высокая суммарная смертность видов вносит дестабилизирующее влияние, способствуя динамичному изменению популяционной структуры. Тем не менее в отдельных случаях следует полагать и адаптивную природу селективно значимых признаков, в первую очередь одонтологических, находящихся под более сильным контролем со стороны генотипа. Этот вывод соответствует сущности синтетической теории эволюции, постулирующей преимущественное размножение определенных фенотипов (генотипов) и передачу их потомкам применительно к селективно значимым функционально обусловленным признакам.
Библиография
Данилов П. И., Гурский И. Г., Кудактин А. Н. Размножение и структура популяции // Волк. Происхождение, систематика, морфология, экология. М.: Наука, 1985. С. 378–389.
Динамика лесных экосистем юга Валдайской возвышенности в позднем плейстоцене и голоцене / Отв. ред. Е. Ю. Новенко. М.: ГЕОС, 2011. 112 с.
Истомин А. В. Мелкие млекопитающие в региональном экологическом мониторинге (на примере Каспийско-Балтийского водораздела) . Псков: Псковский гос. пед. ун-т, 2008. 278 с.
Кораблёв Н. П., Кораблёв М. П., Рожнов В. В., Кораблёв П. Н. Полиморфизм контрольного региона митохондриальной ДНК енотовидной собаки (Nyctereutes procyonoides Gray, 1834), интродуцированной в бассейне Верхней Волги // Генетика. 2011. Т. 47. № 10. С. 1378–1385.
Кораблёв Н. П., Кораблёв М. П., Кораблёв П. Н. Краниометрическая изменчивость енотовидной собаки (Nyctereutes procyonoides Grаy, Carnivora, Canidae) Тверской области: от интродуцентов до современных популяций // Бюллетень Московского общества испытателей природы. Отд. биол. 2012. Т. 117. № 1. С. 16–25.
Кораблёв М. П., Кораблёв Н. П., Кораблёв П. Н. Популяционные аспекты полового диморфизма в гильдии куньих Mustelidae, на примере четырех видов: Mustela lutreola, Neovison vison, Mustela putorius, Martes martes // Известия РАН. Сер. биол. 2013. № 1. С. 70–78.
Кораблёв М. П., Кораблёв П. Н., Кораблёв Н. П. Внутрипопуляционное разнообразие и внутрипопуляционная дифференциация (на примере пяти видов отряда Carnivora) // Вестник Тверского государственного университета. Сер. биология и экология. 2014. № 4. С. 114–122.
Кораблёв М. П., Кораблёв П. Н., Кораблёв Н. П., Туманов И. Л. Внутрипопуляционный полиморфизм лесного хоря (Mustela putorius, Carnivora, Mustelidae) // Зоологический журнал. 2015. Т. 94. № 5. С. 580–592.
Кораблёв М. П., Кораблёв Н. П., Кораблёв П. Н., Туманов И. Л. Внутрипопуляционный полиморфизм лесной куницы (Martes martes, Carnivora, Mustelidae) Тверской области // Зоологический журнал. 2016. Т. 95. № 1. С. 80–93.
Кораблёв Н. П., Кораблёв М. П., Кораблёв А. П., Кораблёв П. Н., Зиновьев А. В., Жагарайте В. А., Туманов И. Л. Факторы полиморфизма краниометрических признаков лисицы обыкновенной (Vulpes vulpes, Carnivora, Canidae) в центре Европейской части России // Зоологический журнал. 2018. Т. 97. № 9. С. 1175–1188.
Мельник К. С., Эрнандес-Бланко Х. А., Литвинова Е. М., Чистополова М. Д., Огурцов С. В., Поярков А. Д. Биотопическая избирательность и характер передвижения волка Canis lupus (Mammalia, Canidae) в пределах его семейного участка в заповеднике Калужские Засеки // Бюллетень Московского общества испытателей природы. Отд. биол. 2007. Т. 112. № 6. С. 3–14.
Овсяников Н. Г., Поярков А. Д., Бологов В. П. Коммуникация и социальная организация // Волк. Происхождение, систематика, морфология, экология. М.: Наука, 1985. С. 295–310.
Пузаченко Ю. Г. Биологическое разнообразие в биосфере: системологический и семантический анализ // Биосфера. 2009. Т. 1. № 1. С. 25–38.
Пузаченко Ю. Г. Вековые изменения климата в районе заповедника // Труды Центрально-Лесного государственного природного биосферного заповедника. Вып. 6. Великие Луки, 2012. С. 6–32.
Пузаченко Ю. Г., Желтухин А. С., Козлов Д. Н., Кораблёв Н. П., Федяева М. В., Пузаченко М. Ю., Сиунова Е. В. Центрально-Лесной государственный природный биосферный заповедник: Научно-популярный очерк . Изд. 2-е. Тверь: ООО «Печатня», 2016. 79 с.
Пузаченко А. Ю. Количественные закономерности морфологического разнообразия черепа млекопитающих // Сборник трудов Зоологического музея МГУ им. М. В. Ломоносова. 2016. Т. 54. C. 229–268.
Раменский С. Е., Смирнов В. С., Гурский И. Г., Павлов М. П. Увеличение размеров одновозрастных волков в XX веке // Волк. Происхождение, систематика, морфология, экология. М.: Наука, 1985. С. 261–266.
Россолимо О. Л., Долгов В. А. Закономерности изменчивости черепа волка (Canis lupus Linnaeus, 1758) на территории СССР // Acta Theriologica. 1965. Vol. 10. № 12. Р. 195–207.
Сидорчук Н. В., Рожнов В. В. Европейский барсук в Дарвинском заповеднике. Традиционные и новые методы в изучении экологии и поведения норных хищников . М.: Т-во научных изданий КМК, 2010. 123 с.
Тимофеев-Ресовский Н. В., Воронцов Н. Н., Яблоков А. В. Краткий очерк теории эволюции . М.: Наука, 1978. 407 с.
Шварц С. С. Экологические закономерности эволюции . М.: Наука, 1980. 277 с.
Эрнандес-Бланко Х. А., Поярков А. Д., Крутова В. И. Организация семейной группы волков (Canis lupus lupus) в Воронежском биосферном заповеднике // Зоологический журнал. 2005. Т. 84. № 1. С. 80–83.
Юдин В. Г. Волк Дальнего Востока России . 2-е изд., перераб. и доп. Владивосток: Дальнаука, 2013. 412 с.
Яблоков А. В. Популяционная биология . М.: Высш. шк., 1987. 303 с.
Drygala F., Korablev N., Ansorge H., Fickel J., Isomursa M., Elmeros M., Kowalczyk R., Baltrunaite L., Saarma U., Schulze C., Borkenhagen P., Frantz C. A. Homogenous population genetic structure of the invasive raccoon dog (Nyctereutes procyonoides) in Europe as a result of rapid population expansion // PLoS ONE. 2016. Vol. 11. № 4. DOI: 10.1371/journal.pone.0153098.t001.
Huson L. W., Page R. J. C. Multivariate geographical variation of the Red fox (Vulpes vulpes) in Wales // Journal of Zoology. 1980. Vol. 191. P. 453–459.
Huston M. H., Wolverton S. Regulation of animal size by eNPP, Bergmann’s rule and related phenomena // Ecological Monographs. 2011. Vol. 81. Р. 349–405.
Kimura M., Weiss G. H. The Stepping Stone Model of Population Structure and the Decrease of Genetic Correlation with Distance // Genetics. 1964. Vol. 49. № 4. P. 561–576.
Kleiman D. G. Monogamy in mammals // The Quarterly Review of Biology. 1977. Vol. 52. P. 39–68.
Korablev N. P., Szuma E., Korablev P. N., Zinoviev A. V. Dental polymorphism of the raccoon dog in indigenousand invasive populations: internal and external causation // Mammal Research. 2017. Vol. 62. Р. 163–177.
Korytin N. S. Analysis of Survival of the Red Fox (Vulpes vulpes L.) at the Phases of Population Growth and Decline // Russian Journal of Ecology. 2002. Vol. 33. № 3. P. 186–193.
Kowalczyk R., Jędrzejewska B., Zalewski A., Jędrzejewski W. Facilitative interactions between the Eurasian badger (Meles meles), the red fox (Vulpes vulpes), and the invasive raccoon dog (Nyctereutes procyonoides) in Bialowieza Primeval Forest, Poland // Can. J. Zool. 2008. Vol. 86. P. 1389–1396.
Kowalczyk R., Zalewski A., Jędrzejewska B., Ansorge H., Bunevich A. N. Reproduction and Mortality of Invasive Raccoon Dogs (Nyctereutes procyonoides) in the Białowieża Primeval Forest (Eastern Poland) // Annales Zoologici Fennici. 2009. Vol. 46. № 4. P. 291–301.
Kutschera V., Lecomte N., Janke A., Selva N., Sokolov A., Haun T., Steyer K., Nowak C., Hailer F. A range-wide synthesis and timeline for phylogeographic events in the red fox (Vulpes vulpes) // BMC Evolutionary Biology. 2013. Vol. 13. P. 114.
Malécot G. Heterozygosity and relationship in regularly subdivided populations // Theoretical Population Biology. 1975. Vol. 8. № 2. P. 212–241.
McCune B., Grace J. B. Analysis of Ecological Communities. Oregon, Gleneden Beach: MjM Software Design, 2002. 300 p.
Mech L. D. Buffer Zones of Territories of Gray Wolves as Regions of Intraspecific Strife // Journal of Mammalogy. 1994. Vol. 75. № 1. P. 199–202.
Mech L. D., Boitani L. Wolf Social Ecology. USGS Northern Prairie Wildlife Research Center, 2003. 318 p.
Mech L. D., Paul W. J. Wolf body mass cline across Minnesota related to taxonomy? // Can. J. Zool. 2008. Vol. 86. № 8. Р. 933–936.
Milenkovič M., Ipetic V. J. S., Blagoevic J., Tatovic S., Vujosevic M. Skull variation in Dinaric–Balkan and Carpathian gray wolf populations revealed by geometric morphometric approaches // Journal of Mammalogy. 2010. Vol. 91. № 2. Р. 376–386.
Meiri S., Dayan T., Simberloff D. Variability and Sexual Size Dimorphism in Carnivores: Testing the Niche Variation Hypothesis // Ecology. 2005. Vol. 86. № 6. P. 1432–1440.
Pilot M., Branicki W., Jędrzejewski W., Goszczyński J., Jędrzejewska B., Dykyy I., Shkvyrya M., Tsingarska E. Phylogeographic history of grey wolves in Europe // BMC Evolutionary Biology. 2010. Vol. 10. P. 104.
R Core Team, R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL: https://www.R-project.org/2018.
Smith F. A. et al. The Evolution of Maximum Body Size of Terrestrial Mammals // Science. 2010. Vol. 330. P. 1216–1219. DOI: 10.1126/science.1194830.
Szuma E. Evolutionary and climatic factors affecting tooth size in the red fox Vulpes vulpes in the Holarctic // Acta Theriologica. 2008. Vol. 53. P. 289–332.
Szuma E., Germonpré M. Size of the lower carnassial in the arctic and the red fox from Late Pleistocene in Belgium compared to other ancient and extant populations // Mammal Research. 2020. Vol. 65. P. 127–139.
Yom-Tov Y. Body sizes of carnivores commensal with humans have increased over the past 50 years // Functional Ecology. 2003. Vol. 17. P. 323–327.
Yom-Tov Y., Yom-Tov S. Observations on variation in skull size of three mammals in Israel during the 20th century // Zoologischer Anzeiger. 2012. Vol. 251. P. 331–334.
Yom-Tov Y., Geffen E. Recent spatial and temporal changes in body size of terrestrial vertebrates: probable causes and pitfalls // Biological Reviews. 2011. Vol. 86. P. 531–541.
Van Valen L. M. Morphological variation and the width of the ecological niche // Am. Nat. 1965. Vol. 99. P. 377–390.
Wright S. The genetic structure of populations // Ann. Eugen. 1951. Vol. 15. P. 323–354.
Благодарности
Исследования поддержаны РФФИ и Правительством Тверской области 14-04-97510; 18-44-690001. Авторы искренне благодарны профессору А. В. Зиновьеву за предоставленную возможность работать с краниологическими коллекциями Тверского государственного университета. Выражаем признательность рецензентам, замечания которых позволили улучшить качество публикации, и организаторам Чтений за приглашение участвовать в работе встречи.






 © 2011 - 2025
© 2011 - 2025