Введение
В условиях меняющегося климата и антропогенного пресса актуально понимание путей предотвращения негативного влияния урбанизации на видовое разнообразие, численность и распределение животных и растений (Sassen, Dotan, 2011). Несмотря на свойственные им сложности, города и почвы под ними представляют собой полезные уже созданные лаборатории для расширения наших знаний о функционировании почвы, ее биоразнообразии и устойчивости к разнообразным стрессорам и практике землепользования (Ossola et al., 2016). Одной из индикаторных групп антропогенной трансформации считаются почвенные беспозвоночные – мезофауна (Cameron, Leather, 2012). Это очень разнообразная группа (дождевые черви, жуки, личинки других насекомых), по которой можно судить об общем биоразнообразии на исследуемой территории. Они быстро реагируют на кратковременные изменения антропогенного характера в почве или растительности в силу быстрой смены поколений, а также отличаются простотой сбора, что не выглядит необычным в глазах общественности. Большое количество работ по структуре почвенной мезофауны выполнено в агроценозах или лесонасаждениях, поскольку ее роль в поддержании плодородия почвы бесспорна (Santos et al., 2017; Pontégnie et al., 2005; Tantachasatid et al., 2017). Оценке почвенной мезофауны в городах посвящено гораздо меньшее количество работ (Beninde, 2015), хотя почвенная биота оказывает самое непосредственное действие на функционирование экосистем урбанизированных территорий. Более того, почвенные беспозвоночные служат пищевым ресурсом для представителей более высоких уровней в трофических цепях, и изменение их обилия может повлиять как на эти организмы, так и на растения (McIntyre et al., 2001).
Таким образом, целью работы была оценка состояния почвенных беспозвоночных в градиенте урбанизации в крупном промышленном городе.
Материалы
Исследования проводили во второй декаде июня 2015 г. на 16 участках в различных растительных ассоциациях: разнотравно-злаковые луга, сосняки, липняки и березняк в санитарно-защитной зоне (СЗЗ) ОАО «Нижнекамскнефтехим» (промышленная зона), в г. Нижнекамске Республики Татарстан (селитебная зона) и его окрестностях (рекреационная или зеленая зона, вблизи пос. Красный Ключ и Корабельной рощи).
Методы
Учеты численности педобионтов (почвенных беспозвоночных, или мезофауны) вели стандартным почвенно-зоологическим методом: почвенные пробы на площадках 25 х 25 см2 глубиной 15 см (по 8 проб). Взято 128 почвенных проб, отловлено 1813 особей. Обработку данных проводили в ПП Excel и Statistica-7. При анализе данных использован многомерный дискриминантный анализ (Боровиков, 2001).
Результаты
Фауна почвенных беспозвоночных селитебной зоны г. Нижнекамска разнообразна и включает в себя представителей 3 типов, 7 классов и 13 отрядов: Haplotaxida, Pulmonata, Isopoda, Araneae, Opiliones, Julida, Polydesmida, Geophilomorpha, Lithobiomorpha, Hemiptera, Coleoptera, Lepidoptera, Diptera (21 таксон) (табл. 1). В промышленной зоне таксономическое разнообразие несколько меньше, отсутствуют мокрицы, клопы, жуки мертвоеды (Silphidae) и чернотелки (Tenebrionidae) (19 таксонов). В рекреационной зоне в таксономическом составе не обнаружены моллюски, клопы, мертвоеды, чернотелки, мягкотелки (Cantharidae), листоеды (Chrysomelidae), кожееды (Dermestidae) (15 таксонов) (табл. 2).
Численность почвенной мезофауны в г. Нижнекамске варьировала в довольно широких пределах, от 52 особей/м2 на лугу рекреационной зоны до 518 особей/м2 в липняке селитебной зоны. На лугах и в лесных биоценозах селитебной зоны отмечена наибольшая численность педобионтов (рис. 1, табл. 1). Однако она статистически значимо отличается только на открытых участках города, где доминируют насекомые (70.4 %), значительно им уступают многоножки (16.8 %) и дождевые черви (10.1 %). В лесах преобладают дождевые черви (71.1 %) и многоножки (22 %), среди которых многочисленны хищные землянки (12.3 %) и костянки (8.9 %). Высокая численность многоножек, отмеченная в селитебной зоне, и низкая в промышленной согласуется с литературными данными (Вершинина, 2011).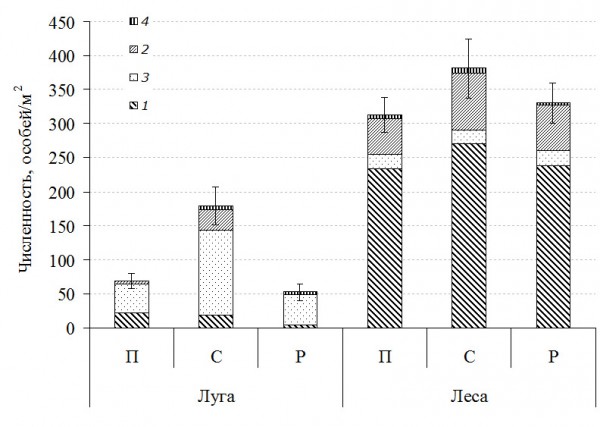
Рис. 1. Обилие мезофауны в луговых и лесных биоценозах промышленной (П), селитебной (С) и рекреационной (Р) зон: 1 – дождевые черви, 2 – многоножки (все), 3 – насекомые (все), 4 – прочие беспозвоночные
Fig. 1. Soil macrofauna abundance in meadow and forest biocenosis of industrial (П), residential (С) and recreational (Р) areas: 1 – Lumbricidae, 2 – Millipedes, 3 – Insecta, 4 – other invertebrates
В липняке селитебной зоны увеличивается обилие дождевых червей, что свидетельствует о благоприятных условиях обитания. По-видимому, замусоренность территории (бытовые и пищевые отходы, продукты жизнедеятельности человека) увеличивает количество потенциального пищевого субстрата люмбрицид, особенно инвазивных видов. Тем самым снижается негативное воздействие рекреации (уплотнение почвы, иссушение верхних ее слоев), а загрязнение лесных участков города не является критическим. Увеличение обилия является распространенной реакцией беспозвоночных на урбанизацию. Рекреация при этом играет не самую значительную роль (Zolotarev, Belskaya, 2015).
Обилие педобионтов мезофауны в промышленной зоне в среднем ниже, чем в селитебной, независимо от типа фитоценоза. В целом этот показатель на лугах в 5 раз ниже, чем в лесных ассоциациях. Несмотря на высокое обилие проволочников по сравнению с лесами, в луговых ассоциациях обилие мезофауны снижалось в основном за счет уменьшения количества дождевых червей в почве.
Биомасса почвообитающих беспозвоночных варьирует в больших пределах – от 4.4 г/м2 на лугах до 149.3 г/м2 в липняках. Такие колебания обусловлены низкой численностью дождевых червей в открытых биотопах (0.7–5.1 г/м2), а на лесных участках они составляют основу всей биомассы мезофауны (96.5–98.7 %, или 46.6–144.3 г/м2). В луговых фитоценозах доминируют насекомые (16.8–79.5 %). Биомасса педобионтов в селитебной зоне несколько выше, чем в промышленной и рекреационной зонах (рис. 2), т. е. наблюдается сходная тенденция с колебаниями их обилия.
Определен видовой состав доминирующих групп мезофауны – дождевых червей и жуков-щелкунов. Разнообразие дождевых червей выше в лесных местообитаниях, в то время как число видов проволочников несколько возрастает в луговых ассоциациях, где к луговым растительноядным видам присоединяются типичные лесные. В лесах промышленной зоны встречаемость дождевых червей не превышает 4 видов (всего отмечено 6 видов), в рекреационной зоне – 6 видов. В лесных биотопах селитебной зоны города она уступает промышленной и рекреационной – 3 вида (всего 4 вида). На открытых участках г. Нижнекамска и его пригорода отмечен лишь один вид люмбрицид – пашенный червь Apporectodea caliginosa Sav.
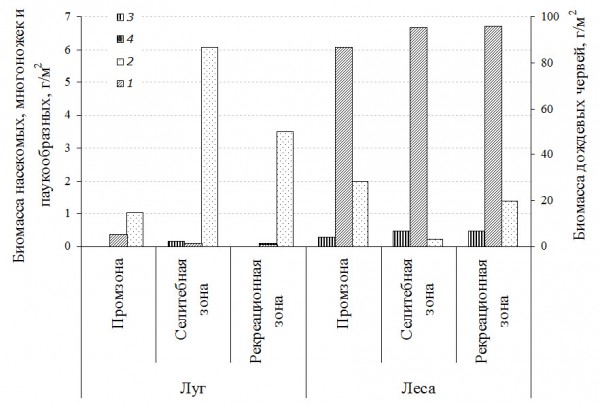
Рис. 2. Биомасса педобионтов открытых и лесных местообитаний по зонам: 1 – дождевые черви, 2 – насекомые (все), 3 – многоножки, 4 – паукообразные
Fig. 2. Biomass of pedobionts of opened and forest habitats by zones: 1 – Lumbricidae, 2 – Insecta, 3 – Millipedes, 4 – Aracnidae
Таблица 1
Обилие почвенных беспозвоночных мезофауны в промышленной и селитебной зонах по типам фитоценоза
| Таксономические группы | Промышленная зона | Селитебная зона | Рекреационная зона | |||||||||||||||
| Луг | Сосняк | Липняк | Луг | Березняк | Липняк | Луг | Сосняк | Липняк | ||||||||||
| ос./м2 | % | ос./м2 | % | ос./м2 | % | ос./м2 | % | ос./м2 | % | ос./м2 | % | ос./м2 | % | ос./м2 | % | ос./м2 | % | |
| Lumbricidae | 21.3 | 31.1 | 202.0 | 72.7 | 296.0 | 77.5 | 18.0 | 10.1 | 172.0 | 70.5 | 370.0 | 71.4 | 4.0 | 7.7 | 207.0 | 71.4 | 298.0 | 72.3 |
| Mollusca | 0.0 | 0.0 | 3.0 | 1.1 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 6.0 | 1.2 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| Isopoda | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 2.5 | 1.4 | 2.0 | 0.8 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 6.0 | 1.5 |
| Aranei | 0.7 | 1.0 | 4.0 | 1.4 | 0.0 | 0.0 | 2.5 | 1.4 | 0.0 | 0.0 | 4.0 | 0.8 | 4.0 | 7.7 | 1.0 | 0.3 | 0.0 | 0.0 |
| Opiliones | 0.0 | 0.0 | 1.0 | 0.4 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 2.0 | 0.4 | 0.0 | 0.0 | 1.0 | 0.3 | 0.0 | 0.0 |
| Diplopoda | 0.0 | 0.0 | 1.0 | 0.4 | 0.0 | 0.0 | 3.0 | 1.7 | 0.0 | 0.0 | 6.0 | 1.2 | 0.0 | 0.0 | 0.0 | 0.0 | 14.0 | 3.4 |
| Geophilomorpha | 4.0 | 5.8 | 17.0 | 6.1 | 32.0 | 8.4 | 27.0 | 15.1 | 28.0 | 11.5 | 66.0 | 12.7 | 0.0 | 0.0 | 35.0 | 12.1 | 64.0 | 15.5 |
| Lithobiomorpha | 0.0 | 0.0 | 29.0 | 10.4 | 32.0 | 8.4 | 0.0 | 0.0 | 14.0 | 5.7 | 54.0 | 10.4 | 0.0 | 0.0 | 19.0 | 6.6 | 14.0 | 3.4 |
| Insecta (все) | 42.7 | 62.1 | 21.0 | 7.6 | 22.0 | 5.8 | 126.0 | 70.4 | 28.0 | 11.5 | 10.0 | 1.9 | 44.0 | 84.6 | 27.0 | 9.3 | 16.0 | 3.9 |
| Hemiptera | 2.7 | 3.9 | 0.0 | 0.0 | 0.0 | 0.0 | 3.0 | 1.7 | 12.0 | 4.9 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| Carabidae | 6.7 | 9.7 | 8.0 | 2.9 | 10.0 | 2.6 | 13.0 | 7.3 | 0.0 | 0.0 | 6.0 | 1.2 | 4.0 | 7.7 | 15.0 | 5.2 | 0.0 | 0.0 |
| Silphidae | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.5 | 0.3 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| Staphilinidae | 3.3 | 4.9 | 6.0 | 2.2 | 2.0 | 0.5 | 9.5 | 5.3 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 5.0 | 1.7 | 8.0 | 1.9 |
| Tenebrionidae | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 2.5 | 1.4 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| Melolonthidae | 1.3 | 1.9 | 0.0 | 0.0 | 0.0 | 0.0 | 10.5 | 5.9 | 0.0 | 0.0 | 0.0 | 0.0 | 6.0 | 11.5 | 1.0 | 0.3 | 0.0 | 0.0 |
| Cantharidae | 1.3 | 1.9 | 0.0 | 0.0 | 0.0 | 0.0 | 0.5 | 0.3 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| Elateridae | 13.3 | 19.4 | 4.0 | 1.4 | 4.0 | 1.0 | 67.5 | 37.7 | 8,0 | 3.3 | 4.0 | 0.8 | 20.0 | 38.5 | 2.0 | 0.7 | 0.0 | 0.0 |
| Chrysomelidae | 5.3 | 7.8 | 0.0 | 0.0 | 0.0 | 0.0 | 1.0 | 0.6 | 0,0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| Curculionidae | 4.0 | 5.8 | 0.0 | 0.0 | 2.0 | 0.5 | 8.0 | 4.5 | 4.0 | 1.6 | 0.0 | 0.0 | 0.0 | 0.0 | 2.0 | 0.7 | 2.0 | 0.5 |
| Dermestidae | 1.3 | 1.9 | 0.0 | 0.0 | 0.0 | 0.0 | 1.5 | 0.8 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| прочие жуки | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.5 | 0.3 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| Lepidoptera | 0.7 | 1.0 | 0.0 | 0.0 | 0.0 | 0.0 | 1.5 | 0.8 | 2.0 | 0.8 | 0.0 | 0.0 | 6.0 | 11.5 | 0.0 | 0.0 | 0.0 | 0.0 |
| Hymenoptera | 0.0 | 0.0 | 1.0 | 0.4 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 2.0 | 3.8 | 0.0 | 0.0 | 0.0 | 0.0 |
| Diptera | 1.3 | 1.9 | 1.0 | 0.4 | 2.0 | 0.5 | 2.5 | 1.4 | 2.0 | 0.8 | 0.0 | 0.0 | 4.0 | 7.7 | 1.0 | 0.3 | 2.0 | 0.5 |
| Прочие Insecta | 1.3 | 1.9 | 1.0 | 0.4 | 2.0 | 0.5 | 4.0 | 2.2 | 0.0 | 0.0 | 0.0 | 0.0 | 2.0 | 3.8 | 1.0 | 0.3 | 4.0 | 1.0 |
| Всего беспозвоночных | 68.7 | 100.0 | 278.0 | 100.0 | 382.0 | 100.0 | 179.0 | 100.0 | 244.0 | 100.0 | 518.0 | 100.0 | 52.0 | 100.0 | 290.0 | 100.0 | 412.0 | 100.0 |
| Сапрофаги | 24.0 | 35.0 | 204.0 | 73.4 | 298.0 | 78.0 | 28.0 | 15.6 | 176.0 | 72.1 | 376.0 | 72.6 | 8.0 | 15.4 | 208.0 | 71.7 | 320.0 | 77.7 |
| Фитофаги | 24.7 | 35.9 | 8.0 | 2.9 | 6.0 | 1.6 | 91.0 | 50.8 | 14.0 | 5.7 | 10.0 | 1.9 | 34.0 | 65.4 | 5.0 | 1.7 | 2.0 | 0.5 |
| Хищники | 16.0 | 23.3 | 65.0 | 23.4 | 76.0 | 19.9 | 52.5 | 29.3 | 42.0 | 17.2 | 132.0 | 25.5 | 8.0 | 15.4 | 76.0 | 26.2 | 86.0 | 20.9 |
| Смешанная группа | 4.0 | 5.8 | 1.0 | 0.4 | 2.0 | 0.5 | 7.5 | 4.2 | 12.0 | 4.9 | 0.0 | 0.0 | 2.0 | 3.8 | 1.0 | 0.3 | 4.0 | 1.0 |
В составе проволочников селитебной зоны города возрастает доля растительноядных видов и отсутствуют хищные виды, их небольшое количество есть на лугах рекреационной зоны. В лесных фитоценозах уменьшается количество видов элатерид за счет исчезновения луговых растительноядных. На газонах и луговых биотопах селитебной зоны доминируют щелкуны рода Agriotes. Сходные данные получены для зоны многоэтажной застройки г. Екатеринбурга (Вершинина, 2011; Воробейчик и др., 2012) и для г. Кемерово (Еремеева, 2011). В зональном аспекте видовое разнообразие щелкунов практически не меняется, немного уменьшается в рекреационной зоне.
Структуру сообществ педобионтов оценивали многомерным методом. Дискриминантный анализ показал, что мезофауна по зонам антропогенного воздействия статистически значимо различается (Wilks' Lambda: 0.55, approx. F (42.210) = 1.760471, p < 0.0052) (рис. 3). Однако когезивность распределения в пространстве слабая (табл. 3).
Расстояние Махаланобиса между центроидами выборок небольшое (рис. 3, табл. 3). Статистически значимые различия отмечены между сообществом педобионтов города и промышленной зоны, а структура и обилие мезофауны промышленной и зеленой зон не различаются.
Таблица 3. Описательная статистика результатов дискриминантного анализа при оценке влияния загрязнения среды на структуру сообществ педобионтов
| Зоны | Квадрат расстояния Махаланобиса | ||
| Промзона | Город | Зеленая зона | |
| Промзона | 0 | 2.66* | 1.5 |
| Город | 2.66* | 0 | 2.2 |
| Зеленая зона | 1.5 | 2.2 | 0 |
Примечание. * – уровень значимости p < 0.01.
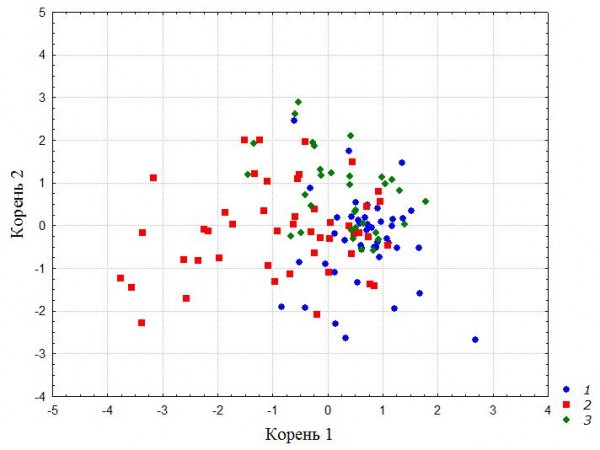
Рис. 3. Распределение выборок педобионтов в плоскости двух дискриминантных осей в зависимости от зональности города: 1 – промышленная зона, 2 – селитебная, 3 – рекреационная
Fig. 3. Discriminant analysis biplot showing relationship between mesofauna communities structure and city zoning: 1 – industrial zone, 2 – residential zone, 3 – recreational zone
Обсуждение
Согласно последним исследованиям, разные таксоны беспозвоночных реагируют на урбанизацию и рекреацию неодинаково (Воробейчик, Ермаков, 2013). Численность дождевых червей и пауков, к примеру, практически не меняется. Для некоторых групп отмечено перераспределение обилия из подстилки в минеральные почвенные горизонты. Трофическая структура педобионтов при урбанизации и рекреации заметно не меняется (Вершинина, 2011; Воробейчик, Ермаков, 2013; Гордиенко и др., 2016). При помощи многомерного анализа выявлены различия видового состава кивсяков в градиенте урбанизации. В пригородной зоне обилие и разнообразие оказалось выше (Bogyó et al., 2015).
По мнению других авторов, степень загрязнения участка является параметром, формирующим пространственную структуру сообществ почвенной мезофауны (Филимонова, Гонгальский, 2011; Воробейчик и др., 2012). Е. Л. Воробейчик с соавторами (Воробейчик и др., 2012) отмечает положительное влияние урбанизации на мезофауну (из-за роста эвтрофикации, снижения колебаний сезонных температур).
Структура и население почвенной мезофауны находятся в тесной зависимости от целого ряда как растительных, так и почвенных показателей (Вершинина, 2011; Воробейчик, Ермаков, 2013; Ge et al., 2005). Недавними исследованиями установлено, что размер коридора и участков растительности в городе оказывает самый сильный эффект на биоразнообразие почвенных беспозвоночных (Beninde et al., 2015). В парках разнообразие членистоногих выше, чем в аллеях. Видовой состав и тип биотопов имеют большее индикационное значение (Youngsteadt et al., 2015). Редкоземельные элементы оказывают негативное влияние на почвенную мезофауну. Наиболее чувствительны к редкоземельным элементам жужелицы и уховертки (Jinxia et al., 2010).
Наиболее глубоким дифференцирующим признаком сообществ почвенных беспозвоночных является тип растительности. Тип и степень антропогенной нагрузки являются менее значимыми факторами и влияют опосредованно через изменение биогеохимических показателей (Дегтярева, 2011). Эти данные согласуются с нашими результатами многомерного анализа – наблюдается четкое различие структуры и населения мезофауны по типу растительности и значительно меньшее по зонам антропогенного воздействия (Суходольская и др., 2015).
По данным Н. И. Еремеевой (Еремеева, 2006), в условиях крупного промышленного центра Сибири происходит снижение обилия педобионтов мезофауны по сравнению с естественными биоценозами в основном за счет представителей герпетобия. Численность педобионтов в г. Нижнекамске значительно выше, чем в среднем по физико-географической провинции (Суходольская и др., 2015). Данный показатель в сосняках как промышленной, так и рекреационной зон значительно превышает средние ее показатели для естественных сосновых лесов лесостепи Республики Татарстан. Это обусловлено, по-видимому, нехарактерным для сосняков типом почвы (серая лесная) и произрастающей в подросте и подлеске растительностью (липа обыкновенная, клен остролистный, клен ясенелистный). В связи с этим обилие сапротрофного компонента в хвойных лесах высокое и сопоставимо с широколиственными лесами. Кроме того, нашими исследованиями на территории г. Казани подтверждены значительные колебания численности мезофауны почвы из года в год (Гордиенко и др., 2016).
Заключение
Таким образом, урбанизация и промышленное загрязнение Нижнекамским промышленным комплексом не оказывают существенного негативного влияния на структуру и население сообщества почвообитающих беспозвоночных г. Нижнекамска. Защитная реакция организмов на антропогенное воздействие проявляется в увеличении численности почвообитающих беспозвоночных мезофауны. При этом лесные фитоценозы играют роль буфера, где сохраняется биоразнообразие почвенных животных и их обилие.
Библиография
Боровиков Б. STATISTICA: Искусство анализа данных на компьютере . СПб., 2001. 656 с.
Вершинина С. Д. Структура почвенной мезофауны в градиенте урбанизации // Вестник Удмуртского университета. 2011. Вып. 2. С. 84–89.
Воробейчик Е. Л., Ермаков А. И., Золотарев М. П., Тунева Т. К. Изменение разнообразия почвенной мезофауны в градиенте промышленного загрязнения // Русский энтомологический журнал. 2012. Т. 21. Вып. 2. С. 203–218.
Воробейчик Е. Л., Ермаков А. И. Почвенная мезофауна лесных экосистем в условиях крупного промышленного города // Евразиатский энтомологический журнал. 2013. Т. 12. № 6. С. 519–528.
Гордиенко Т. А., Вавилов Д. Н., Суходольская Р. А. Влияние рекреации на сообщества почвенной мезофауны лесопарковой зоны г. Казани // Поволжский экологический журнал. 2016. № 2. С. 144–154.
Дегтярева Т. В. Состояние почвенной мезофауны в урбанизированной среде города Ставрополя // Известия ПГПУ им. В. Г. Белинского. 2011. № 25. С. 345–349.
Еремеева Н. И. Структура и экологические механизмы формирования мезофауны членистоногих урбанизированных территорий: на примере г. Кемерово: Дис. ... д-ра биол. наук . Кемерово, 2006. 306 с.
Еремеева Н. И. Формирование мезофауны членистоногих в условиях урбанизации // Известия ЮФУ. Технические науки. 2011. № 9 (122). С. 186–191.
Суходольская Р. А., Гордиенко Т. А., Сабанцев Д. Н. Оценка состояния почвенной биоты в зоне влияния Нижнекамского промышленного комплекса // Охрана природной среды и эколого-биологическое образование: Материалы междунар. научно-практ. конф. Елабуга, 2015. С. 268–275.
Филимонова Ж. В., Гонгальский К. Б. Сообщества крупных почвенных животных на границе участков слабого и сильного загрязнения от Косогорского металлургического комбината (Тульская область) // Известия Пензенского государственного педагогического университета им. В. Г. Белинского. 2011. № 25. С. 472–477.
Beninde J., Veith M., Hochkirch A. Biodiversity in cities needs space: A meta‐analysis of factors determining intra‐urban biodiversity variation // Ecology letters. 2015. Vol. 18 (6). P. 581–592.
Bogyó D., Magura T., Simon E., Tóthmérész B. Millipede (Diplopoda) assemblages alter drastically by urbanization // Landscape and Urban Planning. 2015. Vol. 133. P. 118–126.
Cameron K. H., Leather S. R. How good are carabid beetles (Coleoptera, Carabidae) as indicators of invertebrate abundance and order richness? // Biodiv. Conserv. 2012. Vol. 21. P. 763–779.
Ge B., Cheng H., Zheng X., Kong J., & Bao Y. Community structure and diversity of soil macrofauna from different urban greenbelts in Jinhua City, Zhejiang Province // Chinese Biodiversity. 2005. Vol. 13 (3). P. 197–203.
Jinxia L., Mei H., Xiuqin Y. I. N., Jiliang L. I. U. Effects of the accumulation of the rare earth elements on soil macrofauna community // Journal of Rare Earths. 2010. Vol. 28 (6). P. 957–964.
McIntyre N. E., Rango J., Fagan W. F., Faeth S. H. Ground arthropod community structure in a heterogeneous urban environment // Landsc. Urban Planning. 2001. Vol. 52. P. 257–274.
Ossola A., Hahs A. K., Nash M. A., Livesley S. J. Habitat complexity enhances comminution and decomposition processes in urban ecosystems // Ecosystems. 2016. Vol. 19 (5). P. 927–941.
Pontégnie M., de Warnaffe G. D. B., Lebrun P. Impacts of silvicultural practices on the structure of hemi-edaphic macrofauna community // Pedobiologia. 2005. Vol. 49 (3). P. 199–210.
Santos D. P., Schossler T. R., Santos I. L. D., Melo N. B., Santos G. G. Soil macrofauna in a Cerrado / Caatinga ecotone under different crops in Southwestern Piauí State, Brazil // Ciência Rural. 2017. Vol. 47 (10). P. 1–9.
Sassen S., Dotan N. Delegating, not returning, to the biosphere: How to use the multi-scalar and ecological properties of cities // Global Environmental Change. 2011. Vol. 21. P. 823–834.
Tantachasatid P., Boyer J., Thanisawanyankura S., Séguy L., & Sajjaphan K. Soil macrofauna communities under plant cover in a no-till system in Thailand // Agriculture and Natural Resources. 2017. Vol. 51 (1). P. 1–6.
Youngsteadt E., Henderson R. C., Savage A. M., Ernst A. F., Dunn R. R., Frank S. D. Habitat and species identity, not diversity, predict the extent of refuse consumption by urban arthropods // Global change biology. 2015. Vol. 21 (3). P. 1103–1115.
Zolotarev M. P., Belskaya E. A. Ground-dwelling invertebrates in a large industrial city: Differentiation of recreation and urbanization effects // Contemporary problems of ecology. 2015. Vol. 8 (1). P. 83–90.
Благодарности
Работа выполнена при финансовой поддержке договора «Оценка и прогноз негативного техногенного воздействия Нижнекамского промышленного узла на состояние окружающей среды и здоровье населения с целью управления экологическими рисками в условиях интенсификации промышленного производства».






 © 2011 - 2026
© 2011 - 2026