Введение
Трематода О. ranae – обычный паразит кишечника 35 видов земноводных Евразии (Скрябин, 1971; Рыжиков и др., 1980). В Казахстане этот вид отмечен у лягушек Rana temporaria и Pelophylax ridibundus (Pallas, 1771) в южных и западных частях (р. Урал) республики, в северо-восточных районах – у R. arvalis, в Казахстанском Алтае – у P. ridibundus (Исайчиков, 1926; Соболева, 1975; Ваккер, Тарасовская, 1988). Систематика, развитие и многие другие стороны биологии O. ranae изучены достаточно хорошо (Yamaguti, 1958; Гинецинская, 1968; Grabda-Kasubska, 1969, 1976; Галактионов, Добровольский, 1998). Первым промежуточным хозяином трематоды являются водные моллюски (Lymnaea stagnalis, Galba truncatula, Radix ovata, R. auricularia, Stagnicola palustris) (Скрябин, 1971; Рыжиков и др., 1980). Из проглоченных яиц со сформированными мирацидиями паразита в полости тела моллюсков последовательно развиваются материнские и дочерние спороцисты, процессы заканчиваются выделением церкарий (Добровольский, 1965). Последние констатированы у L. stagnalis и R. peregra из Коргалжынских озер в Акмолинской области Казахстана (Белякова, 1981). Церкарии O. ranae с помощью стилета проникают во второго промежуточного хозяина (головастики, взрослые амфибии, моллюски сем. Limnaeidae), в котором развиваются метацеркарии (Гинецинская, 1968). Дальше развитие может идти по обычному для дигеней триксенному (треххозяинному) или диксенному (двуххозяинному) жизненному циклу. Триксенный путь онтогенеза заканчивается развитием половозрелой стадии O. ranae (мариты) после того, как второй промежуточный хозяин, зараженный метацеркариями гельминта, будет съеден окончательным хозяином. При диксенной форме цикла церкарии O. ranae активно нападают на личинок земноводных, проникают через однослойный покровный эпителий в полость тела и большей частью накапливаются в богатом кровеносными сосудами хвосте. В местах локализации церкарии инцистируются и под защитой капсулой развиваются до метацеркарий. В ходе метаморфоза, перед или уже при резорбции хвоста, метацеркарии эксцистируются, перемещаются в кишечный тракт головастиков и развиваются до марит. Перкутанное заражение взрослых земноводных невозможно, так как их многослойный кожный покров для личинок дигенеи непроницаем (Grabda-Kasubska, 1969; Smyth, 1994). Однако, попав с водой в ротовую полость амфибии, церкарии успешно внедряются в эпителий глотки или пищевода и там инцистируются. Через 1–3 дня цисты отделяются, проглатываются, в кишечнике хозяина из эксцистированных метацеркарий развиваются мариты. Опытным путем установлено, что молодые половозрелые трематоды появляются в кишечной трубке дефинитивного хозяина через сутки после заражения церкариями (Grabda-Kasubska, 1969). Таким образом, при диксенном онтогенезе O. ranae происходит совмещение роли второго промежуточного и окончательного хозяина в одном, убыстренное развитие церкарий, метацеркарий и марит (Гинецинская, 1968; Grabda-Kasubska, 1976; Poulin, Gribb, 2002).
Так как морфологических различий между маритами с разным типом развития не установлено, работ по осуществлению циклов развития O. ranae в естественных условиях проведено недостаточно. Цель исследования: установить зараженность O. ranae остромордой лягушки (R. arvalis) в биотопах степной зоны Казахстана; изучить инвазированность и сезонную динамику инвазии внутрипопуляционных групп маритами трематоды; на этой основе определить, какие группы хозяина охватываются трематодами с диксенным и триксенным циклами развития; с какой длительностью существуют в природных условиях поколения марит О. ranae с диксенной и триксенной историей образования; установить в популяциях R. arvalis количественное соотношение марит О. ranae, возникших по диксенному и триксенному вариантам цикла развития.
Материалы
Гельминтологический материал получен от R. arvalis, собранных на территории Павлодарской области Республики Казахстан. Пункты ручного отлова лягушек охватывают три ландшафтные провинции: Западносибирскую, Предалтайскую и Казахстано-мелкосопочную, и две природные зоны Северной Евразии: лесостепную и степную (Чибилёв, 1998). Многолетние выборки амфибии сделаны в пунктах Усолка, Карьер и Яблонька (Среднее Прииртышье), в остальных учетных точках взяты разовые пробы (табл. 1). Биотоп Усолка находится в 15 км от г. Павлодар, в правобережной пойме р. Иртыш, на правом берегу протоки Усолка (52 12' 32.15 СШ и 77 01' 05.70 ВД). Лягушек собирали на площадке размером 500 х 0.5–7.0 м, которая включает нерестовый водоем, заросший хвощем (Equisetum sp.), а по берегу – тростником (Phragmites communis Trinius). Нерестилище и мелкие скопления воды вдоль правого берега протоки промываются холодными родниковыми водами, изливающимися на неогеновых глинах ложа реки. На площадке с 1984 по 1997 г. осуществляли гельминтологический мониторинг остромордой лягушки, являющейся в районе исследования единственным массовым окончательным хозяином О. ranae (Ваккер, Тарасовская, 1988). Для изучения сезонной динамики зараженности R. arvalis в 1985–1988 гг. с мая по сентябрь делали по одной ежемесячной выборке. В остальные годы брали одну-четыре пробы в сезон. Судя по присутствию на берегах протоки аира (Acorus calamus L.), а в самой Усолке кувшинок (Nymphaea candida Presl.) и кубышек (Nuphar luteum Sm.), антропогенное загрязние биотопа не велико. В двух километрах восточнее Усолки, в зеленом поясе г. Павлодара, находится надпойменный пункт Яблонька. Амфибий в нем отлавливали около заполненного водой понижения рельефа, оставшегося от строительства шоссе. В другой надпойменной точке с названием Карьер хозяев собирали на берегу озерца, возникшего на месте отработанного песчаного карьера. Биотоп расположен в промышленной зоне в трех километрах северо-восточнее Яблоньки. Мелкие (0.3–0.8 м) антропогенные водоемы в течение сезона хорошо прогреваются и используются R. arvalis в качестве нерестилищ, там же вырастают головастики.
Методы
Хранение и вскрытие хозяев, сбор и обработку гельминтов проводили по общепринятым в гельминтологии методикам (Боев и др., 1962; Pritchard, Kruse, 1982). Систематическое положение O. ranae соответствует работе Olson et al. (2003). Анализ зараженности R. arvalis трематодой осуществляли в двух группах. К одной, выделенной графическим методом, отнесены сеголетки. Согласно литературным и нашим данным, длина тела лягушек первого года рождения от кончика морды до клоаки равна 13.0–20.0 мм (Банников и др., 1977; Гончаренко, 1983; Ваккер, Тарасовская, 1988). К другой группе причислены остальные лягушки (длина тела ≥ 20.1 мм), условно называемые взрослыми. У последних отдельно рассматривали инвазированность самок и самцов. Экстенсивность инвазии R. arvalis (P, prevalence) и индекс обилия O. ranae (M, mean abundance) определяли по обычным формулам. Экстенсивность инвазии хозяина при нулевой или стопроцентной зараженности подсчитывали по формуле Ван дер Вардена:
Р = (N0 + 1) / (Nj + 2), где – Nj объем j-й выборки R. arvalis, N0 – число особей хозяина в j-й выборке, свободные или стопроцентно зараженные i-м видом гельминтов (Урбах, 1963). Достоверность различий между значениями экстенсивности инвазии амфибии определяли по критерию Фишера путем преобразования долей зараженных особей хозяина в углы φ (Плохинский, 1970; Ивантер, Коросов, 2010). Эмпирические значения критерия Фишера (φэмп), располагающиеся в зоне неопределенности, т. е. между двумя критическими значениями 1.64 (α = 0.05) и 2.61 (α = 0.01), позволяют отклонить нулевую гипотезу H0. Согласно последней, доля зараженных гельминтом особей хозяина в одной выборке не больше, чем во второй. По альтернативной гипотезе Н1 частота встречаемости зараженных хозяев в двух выборках существенно различна. Н1 принимается, если значение φэмп больше φкрит = 2.61. Индексы обилия паразитических организмов при нормальном распределении сравнивают при помощи критерия Стьюдента (tst). Распределение гельминтов обычно отклоняется от нормального, поэтому для сравнения численности паразитов прибегают к другим способам. Например, путем сравнения фактической и теоретической численности гельминта (Песенко, 1982). Подсчет последней производят, исходя из нулевой гипотезы (Н0) о равномерном распределении эмпирического обилия по сравниваемым выборкам хозяина по формуле:
nij* = (ni / N) ∙ Nj, где ni – общее число особей i-го вида гельминтов во всех выборках хозяина, N – общее число хозяев во всех сравниваемых выборках. Отличие между фактическим и теоретическим обилиями гельминта устанавливали при помощи критерия Пирсона (χ²) в соответствии с формулой:
χ²= (nij – nij*)2/nij*, где nij – фактическое обилие сосальщика i-го вида в j-й пробе хозяина. Для совокупности выборок отдельные значения критериев χ² суммируются и сравниваются с критическим при данном числе степеней свободы (df). Последнее определяется по формуле:
df = М – 1, где М – число сравниваемых выборок. Степень смещения численности гельминта относительно выборок хозяина вычисляли с помощью показателя степени относительной приуроченности вида Ю. А. Песенко (1982) по формуле:
Fij = {((nij/Nj – (ni - nij) / (N – Nj))} / {((nij/Nj + (ni - nij) / (N – Nj))}. Значения Fij изменяются в интервале от +1 до -1. При Fij, равном +1, i-й вид гельминтов полностью предпочитает, а при Fij= -1 – полностью избегает j-ю выборку хозяина. При Fij, равном 0, i-й вид относится к j-й выборке нейтрально, т. е. не отвергает, но и не предпочитает ее. Сезонную динамику численности i-го вида во внутрипопуляционных группах хозяина сравнивали при помощи критерия Колмогорова – Смирнова λ (Сидоренко, 2000). Подсчет критерия проводился по формуле:
λ = |∑ n1j/n1 - ∑n2j /n2│√n1∙n2/n1+n2, где n1j, n2j – число особей i-го вида в 1-м и 2-м сравниваемых распределениях, в j-й из всех М выделенных периодов сезона; ∑n1j/n1 и ∑n2j/n2 – доли накопленных чисел гельминта для 1-го и 2-го распределений i-го вида гельминтов к j-му периоду сезона; n1 и n2 – суммарное число особей i-го вида в 1-м и 2-м распределениях, собранных за все М периодов сезона; |х| – абсолютное (без учета знака, по модулю) максимальное значение для переменной х; √ – квадратный корень (Песенко, 1982; Сидоренко, 2000). Нулевая гипотеза предполагает, что между двумя сравниваемыми распределениями различий нет, например, сезонная динамика численности i-го вида у самок и самцов хозяина не отличается. Если максимальное значение λ превышает одно из трех стандартных значений, принимается противоположная гипотеза (Н1) о различном характере изменений численности i-го вида гельминтов в двух сравниваемых распределениях, например, о различии в сезонных изменениях численности трематоды у самок и самцов хозяина.
Результаты
А. Ювенильные R. arvalis, сеголетки (длина тела ≤ 20.0 мм)
Таблица 1. Зараженность сеголеток и взрослых Rana arvalis трематодой Opisthioglyphe ranae
| Ландшафты, биотопы | Cеголетки (длина тела ≤ 20.0 мм) | Взрослые лягушки (длина тела ≥ 20.1 мм) | ||||
| N1, экз. | Параметры заражения | N1, экз. | Параметры заражения | |||
| М2, экз. | Р3, % | М2, экз. | Р3, % | |||
| Пойменно-луговой ландшафт р. Иртыш | ||||||
| Усолка | 9 | 1.8 ± 0.3 | 77.8 ± 13.9 | 1282 | 2.0 ± 0.1 | 50.5± 1.3 |
| Антропогенный ландшафт (г. Павлодар) | ||||||
| Карьер | 44 | 19.7 ± 2.3 | 97.7 ± 2.2 | 301 | 6.7 ± 0.4 | 79.1 ± 2.3 |
| Яблонька | 88 | 9.1 ± 1.2 | 72.7 ± 4.7 | 196 | 7.3 ± 0.8 | 71.9 ± 3.2 |
| Правобережная сухая степь (Предалтайская ландшафтная провинция) | ||||||
| Оз. Тлеуберды | 24 | 12.7 ± 1.4 | 96.7 ± 3.7 | 11 | 4.7 ± 0.8 | 92.3 ± 7.1 |
| Оз. Борли | 3 | 0.3 ± 0.3 | 33.3 ± 27.2 | 15 | 5.9 ± 1.6 | 66.7 ± 12.2 |
| Оз. Малыбай | 24 | 0.2 ± 0.1 | 20.8 ± 8.3 | 15 | 11.5 ± 4.8 | 60.0 ± 12.6 |
| Левобережная сухая степь (Казахстано-мелкосопочная ландшафтная провинция) | ||||||
| Оз. Сабандыколь | 1 | 0.0 ± 0.0 | 33.3 ± 23.64 | 67 | 0.3 ± 0.1 | 10.6 ± 3.8 |
| Баянаул | 49 | 0.0 ± 0.0 | 2.0 ± 1.9 | |||
| Лесостепь (Западносибирская ландшафтная провинция) | ||||||
| Фёдоровка | 5 | 1.2 ± 1.2 | 20.0 ± 17.9 | 20 | 1.3 ± 0.3 | 50.0 ± 11.2 |
| Всего | 198 | 10.1 ± 0.9 | 73.6 ± 3.1 | 1956 | 3.2 ± 0.1 | 54.9 ± 1.1 |
| Примечание. 1 – объем выборок хозяина, экз., 2 – индекс обилия, экз., 3 – экстенсивность инвазии, %, 4 – подсчет сделан по формуле Ван дер Вардена. | ||||||
Во всех учетных точках у сеголеток R. arvalis обнаружены половозрелые O. ranae (табл. 1). В пунктах, расположенных на Баянаульском горном поднятии Казахского мелкосопочника (оз. Сабандыколь и Баянаул), ювенильные хозяева (длина тела ≤ 20.0 мм) представлены одной незараженной особью. Самая высокая инвазированность обсуждаемой внутрипопуляционной группы хозяина отмечена в правобережном оз. Тлеуберды и антропогенных пунктах Карьер и Яблонька. В биотопах с многолетними сборами наибольшие значения показателей инвазии отмечены у сеголеток из Карьера. Здесь частота зараженных O. ranae лягушат (≤ 20.0 мм) достоверно выше, чем в Усольском биотопе (φэмп = 1.85) и в Яблоньке (φэмп = 4.31). В первом случае критерий превышает критическое значение при α = 0.05, во втором – при α = 0.01. Экстенсивность инвазии сеголеток R. arvalis из Усолки и Яблоньки статистически не отличается (φэмп = 0.24). На Карьере индекс обилия трематоды почти в 11 раз больше, чем на Усолке (tst = 7.72), и в 2.2 раза, чем в Яблоньке (tst = 4.09). Среднее число марит у сеголеток из Яблоньки в 5.1 раза превышает таковое на Усолке (tst = 5.90). Параметры заражения ювенильных лягушат из Карьера значимо выше, чем у взрослых особей (φэмп = 4.00, tst = 5.57). В пойме р. Иртыш, несмотря на небольшую выборку, экстенсивность инвазии сеголеток также больше, чем у взрослых амфибий (φэмп = 1.73). В Яблоньке зараженность двух возрастных групп R. arvalis не различаются (φэмп = 0.14, tst = 1.25).
Массовый метаморфоз головастиков R. arvalis, по данным К. И. Искаковой (1959) и нашим наблюдениям, начинается в середине июня. Экстенсивность инвазии отловленных к этому времени сеголеток наиболее высокая (табл. 2). В последней декаде июня частота зараженных O. ranae лягушат (длина тела ≤ 20.0 мм) достоверно снижается. В последущие периоды сезона вектор данного показателя инвазии у них сохраняется. Экстенсивность заражения сеголеток O. ranae в августе меньше в сравнении с начальной величиной показателя в июне (φэмп = 2.00). Снижение величины экстенсивности заражения ювенильных R. arvalis маритами трематоды к концу сезона описывается отрицательным линейным уравнением y = -12.66x + 105.64 (R² = 0.8346). Величина коэффициента детерминации (R2), превышающая 0.80, говорит о том, что сезонная динамика частоты встречаемости зараженных O. ranae сеголеток R. arvalis приемлемо моделируется приведенным уравнением (Плохинский, 1970; Ивантер, Коросов, 2010).
Теоретическое число сосальщиков в выборке сеголеток за 15 июня равняется 171.6 (1999/198)∙17) (см. табл. 2). Значение критерия хи-квадрат равняется (327 – 171.6)2/171.6 = 140.6. Сумма χ2 для пяти пар эмпирических и ожидаемых значений обилия трематод равна 199.6, что больше критической величины χ2, равной 9.49 при df = 4. Следовательно, Н0 о равномерном, случайном распределении числа O. ranae отвергается и принимается Н1 о неравномерном размещении гельминта по пробам сеголеток. В первой июньской выборке хозяина ожидаемая по нуль-гипотезе численность O. ranae достоверно меньше фактической в 1.9 раза. Показатель степени приуроченности относительного обилия сосальщика, рассчитанный для первой июньской выборки сеголеток, равен: Fij = (327/17 – (1999-327/198-17)) / (327/17 + (1999-327/198-17)) = (19.23-9.23) / (19.23+9.23) = 9.99/28.5 = +0.35. Судя по положительному знаку при Fij, обилие трематод достоверно смещено к этой выборке хозяина. Во второй июньской пробе отрицательное значение показателя приуроченности указывает на значимое, но очень небольшое уменьшение фактической численности по сравнению с теоретической. В июле, видимо, каких-либо смещений численности не произошло, так как Fij практически равен нулю, а χ² меньше критического значения, равного 3.84 при одной степени свободы. В августовской пробе теоретическое обилие превышает эмпирическое в 2.3 раза. Отрицательный знак Fij свидетельствует о том, что O. ranae избегает данную совокупность сеголеток, так же как и сентябрьскую. Полученные данные говорят о том, что фактическая численность трематоды в течение сезона изменяется от наибольшей приуроченности к самой ранней выборке хозяина (15 июня) до наименьшей к наиболее поздним выборкам сеголеток в августе и сентябре. Интересно отметить, что динамика индекса обилия O. ranae у сеголеток остромордой лягушки сходна по своей тенденции с сезонными изменениями их экстенсивности инвазии. После массового метаморфоза головастиков остромордой лягушки в середине июня индекс обилия трематоды в 4.7 раза больше, чем в августе. Изменение данного параметра инвазии описывается линейным уравнением: y = –4.56x + 22.52 (R² = 0.8852).
Сезонная динамика инвазии сеголеток другими видами гельминтов совершенно иная, чем O. ranae. В середине июня, т. е. сразу после метаморфоза, у сеголеток встречаются только O. ranae. В конце месяца отмечены единичные случаи заражения нематодами Rhabdias bufonis и Oswaldocruzia filiformis. В июле значения экстенсивности инвазии и индекса обилия R. bufonis повышаются (39.1 ± 5.6 %, 0.8 ± 0.2 экз.). Частота лягушат (длина тела ≤ 20.0 мм), зараженных Os. filiformis в этом месяце, равна 30.4 ± 5.5 %, а индекс обилия – 0.6 ± 0.2 экз. В августе величина показателей инвазии сеголеток первым видом возрастает до 75.0 ± 12.5 % (2.4 ± 0.7 экз.), вторым – до 50.0 ± 1.4 % (1.4 ± 0.7 экз.). Эти данные подчеркивают сезонную направленность зараженности сеголеток – освобождение от O. ranae и отсутствие новых заражений сосальщиком. Если бы наблюдались новые заражения сеголеток маритами O. ranae, то эти процессы также должны быть похожи на сезонные изменения экстенсивности инвазии хозяина и численности зараженности другими видами гельминтов.
Таблица 2. Сезонная динамика зараженности сеголеток Rana arvalis трематодой Opisthioglyphe ranae
| Время взятия проб | N1 | Численность, экз. | χ² | Fij3 | Параметры инвазии | φэмп6 | tst6 | ||
| nij2 | nij* | P4 | M5 | ||||||
| 15 июня | 17 | 327 | 171.6 | 140.6 | +0.35 | 94.4 ± 5.3 | 20.4 ± 3.6 | 2.45 | 2.98 |
| 20–30 июня | 99 | 905 | 999.5 | 8.9 | -0.09 | 71.7 ± 4.5 | 9.1 ± 1.2 | 0.11 | 0.68 |
| 10–13 июля | 69 | 715 | 696.6 | 0.5 | +0.02 | 72.5 ± 5.4 | 10.4 ± 1.5 | 0.40 | 2.44 |
| 02–17 августа | 12 | 52 | 121.2 | 39.5 | -0.45 | 66.7 ± 13.6 | 4.3 ± 2.0 | ||
| 20 сентября | 1 | 0 | 10.1 | 10.1 | -1.00 | 33.3 ± 23.67 | |||
| Итого | 198 | 1999 | 1999.0 | 199.6 | |||||
| Примечание. 1 – объем проб хозяина, экз.; 2 – фактическая и * – теоретическая численности гельминта, экз.; 3 – показатель степени относительной приуроченности вида; 4 – экстенсивность инвазии, %; 5 – индекс обилия, экз.; 6 – значения критериев получены при сравнении показателей инвазии в выше- и нижележащей строке; 7 – подсчитано по формуле Ван дер Вардена. | |||||||||
Зараженность ювенильных R. arvalis дигенеей также зависит от их возраста (длины тела). Наибольшая величина экстенсивности инвазии установлена в первой линейновозрастной группе сеголеток, длина тела 13.0–14.9 мм (рис. 1). По сравнению с последними значение показателя у самых крупных особей (длина 20.0 мм) в 1.6 раза достоверно меньше. Критерий φэмп = 2.26. Линейное уравнение, отражающее отрицательную зависимость между возрастом (длиной тела) и экстенсивностью инвазии сосальщиком ювенильных R. arvalis, приведено на графике 2. Тенденция уменьшения средней численности марит O. ranae с возрастом сеголеток описывается линейным уравнением: y = -1.3857x + 16.229 (R² = 0.8197), величина коэффициента детерминации свидетельствует о хорошем соответствии модели с фактическими данными.
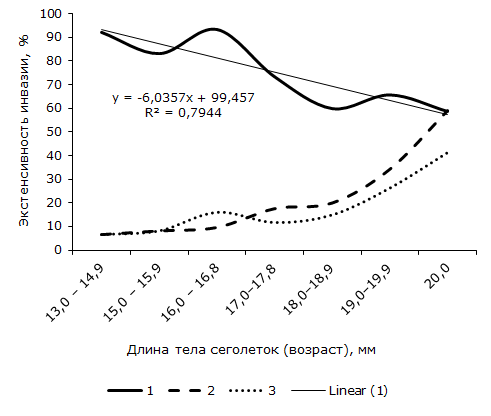
Рис. 1. Возрастная динамика зараженности сеголеток остромордой лягушки гельминтами Opisthioglyphe ranae (1), Rhabdiasbufonis (2) и Oswaldocruzia filiformis (3), %
Fig. 1. Age-related dynamics of infestation of moor frog froglets with helminthsOpisthioglyphe ranae (1), Rhabdiasbufonis (2) и Oswaldocruzia filiformis (3), %
Из рис. 1 видно, что если с возрастом экстенсивность инвазии сеголеток O. ranae понижается, то у других видов гельминтов величина этого показателя, наоборот, повышается. Так, у лягушат первой размерной группы (длина тела 13.0–14.9 мм.) кроме O. ranae другие виды гельминтов не отмечены. Нематоды R. bufonis и Os. filiformis впервые появляются у сеголеток длиной 15.0 мм. Доля зараженных нематодами самых крупных ювенильных R. arvalis (длина тела 20.0 мм) довольно высока и равна соответственно 58.8 ± 11.9 и 41.2 ± 11.9 %. Полученные данные свидетельствуют о том, что сообщества гельминтов с возрастом сеголеток перестраиваются: на фоне исчезновения трематоды возрастает роль нематод. Нарастание доли последних к концу сезона и уменьшение доли дигенеи указывают на отсутствие в течение первого года жизни новых заражений сеголеток маритами O. ranae.
Личинки R. arvalis питаются зелеными, диатомовыми и высшими водорослями, детритом, к концу развития мелкими беспозвоночными (Банников и др., 1977; Вершинин, 2007). В пищевом рационе сеголеток остромордой лягушки указываются клещи, колемболы и другие мелкие членистоногие. Отсутствие в составе пищи моллюсков исключает участие названных внутрипопуляционных групп остромордой лягушки в триксенном цикле развития O. ranae. Очевидно, что головастики R. arvalis напрямую заражаются церкариями трематоды в выростных водоемах, так как это характерно для диксенного варианта жизненного цикла сосальщика (Галактионов, Добровольский, 1998). Молодые мариты, найденные нами у сеголеток в середине июня, сразу после метаморфоза, являются наследием, полученным от головастиков, и, следовательно, тоже имеют диксенное происхождение. B Польше В. Grabda-Kasubska (1969) в июле находила у R. terrestris и R. temporaria сразу после метаморфоза многочисленные экземпляры O. rastellus.
Экстенсивность инвазии сеголеток R. arvalis в наших сборах в 1.3 раза превышает таковую взрослых особей (φэмп = 5.27). Каждый лягушонок первого года рождения в среднем содержит в 3.2 раза больше O. ranae, чем одна взрослая особь остромордой лягушки (длина тела ≥ 20.1 мм). Во всех выборках сеголеток, по нашим данным, сосредоточен 24.1 ± 3.1 % O. ranae, собранных у всех вскрытых R. arvalis. Следовательно почти четвертая часть данного вида гельминтов представлена в популяциях остромордой лягушки у сеголеток маритами, образовавшимися по диксенному циклу развития. Черты сезонной и возрастной динамики параметров зараженности лягушат R. arvalis (длина ≤ 20.0 мм) O. ranae указывают на то, что: 1) они получили марит от личинок остромордой лягушки; 2) после метаморфического климакса новых заражений сеголеток трематодой не происходит, 3) сосальщики диксенного происхождения относительно быстро заканчивают свое развитие к концу текущего сезона. Последний процесс связан, вероятно, не только с ускоренным развитием марит с диксенной историей образования, но и с повышенной внутривидовой конкуренцией в инфрапопуляциях гельминта – эффект скученности, по К. Кеннеди (1978). Эта форма конкуренции имеет, видимо, наибольшее значение сразу же после метаморфического климакса, когда у сеголеток отмечена самая высокая численность марит. Ближе к концу сезона, возможно, добавляется отрицательное влияние на O. ranae нематоды Os. filiformis, которая с течением времени заселяет кишечник R. arvalis в нарастающем количестве. У данных видов установлены конкурентные межвидовые отношения (Ваккер, 1991).
В работе Т. М. Будаловой с соавт. (1984) моллюски и водные насекомые регистрируются ими в желудках лягушек из антропогенных биотопов почти в три раза чаще, чем в естественных. Очевидно, прирост численности трематод в Костромском разливе произошел за счет марит триксенного генезиса. В собранных нами материалах различий в пищевом рационе R. arvalis из пойменного и надпойменных местообитаний не отмечено (Ваккер, Тарасовская, 1988). Поэтому мы полагаем, что значения параметров инвазии хозяина в антропогенных биотопах и некоторых степных озерах Казахстана повышены за счет более высокой зараженности сеголеток и самцов остромордой лягушки маритами O. ranae с диксенной историей возникновения.
Таким образом, в ходе работы установлено, что в степной зоне Казахстана трематода O. ranae реализует диксенную форму жизненного цикла, используя для этого головастиков и сеголеток R. arvalis. Наибольшая зараженность обнаружена у ювенильных лягушат (длина тела ≤ 20.0 мм), обитающих на побережье правобережных степных озер и антропогенных водоемов. Максимальные значения параметров инвазии в данной внутрипопуляционной группе остромордой лягушки зарегистрированы сразу после метаморфоза и у самых молодых особей (длина тела 13.0–14.9 мм). Сосальщики, обнаруженные у сеголеток и образовавшиеся по диксенному варианту цикла развития O. ranae, представляют почти четвертую часть от всех марит данного вида, найденных в популяциях остромордой лягушки. К концу сезона количество зараженных сеголеток и численность у них марит снижаются, что свидетельствует об окончании существования трематод с диксенной историей возникновения. Это, возможно, облегчает сеголеткам перенесение первой в их жизни зимовки.
Б. Взрослые R. arvalis (длина тела ≤ 20.0 мм)
Взрослые R. arvalis (длина ≥ 20.1 мм), отловленные около антропогенных водоемов и правобережных степных озер, имеют самый высокий уровень зараженности O. ranae, средний отмечен в пойме р. Иртыш и колочной лесостепи, минимальный – в пунктах из Казахского мелкосопочника (см. табл. 1). Так, по биотопам с многолетними данными, экстенсивность инвазии R. arvalis в Яблоньке и Карьере превышает таковую на Усолке, эмпирические значения критерия Фишера равны соответственно 5.78 и 9.54 и находятся в зоне значимости. Встречаемость зараженных трематодой лягушек, обитающих около водоема Карьер, выше (φэмп = 1.83), чем у амфибий из Яблоньки. Параметры инвазии взрослых лягушек из побережий правобережных озер, несмотря на разовые выборки, по величине показателей заражения хозяина близки к пробам из Карьера и Яблоньки (см. табл. 1).
Установлено, что у амфибий, ведущих наземный образ жизни (Bufo bufo, R. arvalis, R. temporaria), самцы заражены гельминтами, в том числе O. ranae, больше и чаще, чем самки (Plasota, 1969; Кудинова с соавт., 1985; Frandsen, 1974; Spieler, 1990). Реже встречаются сообщения о преобладании зараженности у самок земноводных (Марков, Рогоза, 1949; Lees, Bass, 1960) или об отсутствии межполовых различий, как, например, по O. ranae у сибирской лягушки в Якутии (Однокурцев, Седалищев, 2008). На подопытной притеррасной площадке р. Иртыш зараженность O. ranae половых групп остромордой лягушки статистически не отличается (ϕэмп = 1.03), так же как на Карьере и в Яблоньке (φэмп, соответственно 0.83 и 0.74).
Таблица 3 Сезонная динамика зараженности самок остромордой лягушки (длина тела ≥ 20.1 мм) Opisthioglyphe ranae
| Биотопы, периоды сезона | N1 | nij2 | nij* | χ² | Fij3 | P4 | ±5 | M6 | ±5 |
| Усолка | |||||||||
| V | 121 | 127 | 222.5 | 41.0 | -0.31 | 38.0 | 4.3 | 1.0 | 0.2 |
| VI | 132 | 108 | 242.7 | 74.8 | -0.44 | 29.5 | 3.7 | 0.8 | 0.2 |
| VII | 156 | 313 | 286.8 | 2.38 | +0.06 | 53.8 | 3.5 | 2.0 | 0.3 |
| VIII | 143 | 328 | 262.9 | 16.1 | +0.14 | 60.1 | 4.1 | 2.3 | 0.2 |
| IX | 124 | 367 | 228.0 | 84.7 | +0.30 | 62.1 | 4.1 | 3.0 | 0.4 |
| Итого | 676 | 1243 | 1243.0 | 219.0 | 47.2 | 1.8 | 1.7 | 0.1 | |
| Карьер | |||||||||
| V | 20 | 54 | 133.1 | 47.0 | -0.46 | 60.0 | 8.9 | 2.7 | 0.7 |
| VI | 14 | 76 | 93.2 | 3.16 | -0.11 | 78.6 | 12.1 | 5.4 | 2.3 |
| VII | 17 | 130 | 113.1 | 2.52 | +0.08 | 88.2 | 12.1 | 7.6 | 1.4 |
| VIII | 41 | 345 | 272.8 | 19.1 | +0.17 | 73.2 | 7.7 | 8.4 | 1.6 |
| IX | 47 | 320 | 312.8 | 0.17 | +0.02 | 83.0 | 7.3 | 6.8 | 0.9 |
| Итого | 139 | 925 | 925.0 | 71.9 | 77.0 | 4.2 | 6.7 | 0.6 | |
| Яблонька | |||||||||
| V | 26 | 135 | 157.0 | 3.07 | -0.10 | 69.2 | 6.3 | 5.2 | 1.1 |
| VI | 5 | 47 | 30.2 | 9.37 | +0.23 | 85.7 | 12.4 | 9.4 | 4.4 |
| VII | 9 | 87 | 54.3 | 19.6 | +0.26 | 66.7 | 13.9 | 9.7 | 4.6 |
| VIII | 47 | 304 | 283.7 | 1.45 | +0.06 | 74.5 | 7.2 | 6.5 | 1.0 |
| IX | 21 | 79 | 126.8 | 18.0 | -0.27 | 76.2 | 10.6 | 3.8 | 0.8 |
| Итого | 108 | 652 | 652.0 | 51.5 | 74.1 | 4.7 | 6.0 | 0,7 | |
| Примечание. 1 – объем проб хозяина, экз.; 2 – фактическая и * – теоретическая численности гельминта, экз.; 3 – показатель степени относительной приуроченности вида; 4 – экстенсивность инвазии, %; 5 – ошибка параметра инвазии; 6 – индекс обилия, экз. | |||||||||
Таблица 4 Сезонная динамика зараженности самцов остромордой лягушки (длина тела ≥ 20.1 мм) Opisthioglyphe ranae
| Биотопы, периоды сезона | N1 | nij2 | nij* | χ² | Fij3 | P4 | ±5 | M6 | ±5 |
| Усолка | |||||||||
| V | 109 | 216 | 228.8 | 0.72 | -0.03 | 56.9 | 4.1 | 2.0 | 0.3 |
| VI | 95 | 100 | 199.4 | 49.6 | -0.37 | 41.1 | 4.5 | 1.1 | 0.2 |
| VII | 129 | 251 | 270.8 | 1.44 | -0.05 | 45.0 | 3.8 | 1.9 | 0.3 |
| VIII | 131 | 341 | 275.0 | 15.9 | +0.14 | 64 | 4.1 | 2.6 | 0.3 |
| IX | 142 | 364 | 298.1 | 14.6 | +0.13 | 50 | 3.4 | 2.6 | 0.3 |
| Итого | 606 | 1272 | 1272.0 | 82.2 | |||||
| Карьер | |||||||||
| V | 40 | 209 | 272.8 | 14.9 | -0.17 | 82.5 | 7.8 | 5.2 | 0.8 |
| VI | 31 | 273 | 211.5 | 17.9 | +0.16 | 93.5 | 8.7 | 8.8 | 2.2 |
| VII | 5 | 32 | 34.1 | 0.13 | -0.03 | 80.0 | 0.0 | 6.4 | 2.6 |
| VIII | 43 | 345 | 293.3 | 9.11 | +0.11 | 83.7 | 7.5 | 8.0 | 1.1 |
| IX | 43 | 246 | 293.3 | 7.63 | -0.12 | 67.4 | 7.5 | 5.7 | 1.0 |
| Итого | 162 | 1105 | |||||||
| Яблонька | |||||||||
| V | 29 | 352 | 253.8 | 38.0 | +0.26 | 82.8 | 8.8 | 12.1 | 3.5 |
| VI | 4 | 5 | 35.0 | 25.7 | -0.76 | 50 | 25.0 | 1.3 | 0.9 |
| VII | 12 | 53 | 105.0 | 25.8 | -0.36 | 41.7 | 12.5 | 4.4 | 1.7 |
| VIII | 31 | 287 | 271.3 | 0.91 | +0.04 | 71 | 8.4 | 9.3 | 2.0 |
| IX | 12 | 73 | 105.0 | 9.75 | -0.20 | 66.7 | 13.6 | 6.1 | 2.7 |
| Итого | 88 | 770 | 770.0 | 100.2 | 69.3 | 5.2 | 8.8 | 1.4 | |
| Примечание. 1 – объем проб хозяина, экз.; 2 – фактическая и * – теоретическая численности гельминта, экз.; 3 – показатель степени относительной приуроченности вида; 4 – экстенсивность инвазии, %; 5 – ошибка параметра инвазии; 6 – индекс обилия, экз. | |||||||||
Анализ сезонной динамики зараженности O. ranae половых групп остромордой лягушки указывает на достоверно неравномерное распределение трематоды у самок и самцов хозяина, как в пойменном, так и в надпойменных биотопах. Суммы критериев χ2, полученные при сравнении пяти пар значений фактической и теоретической численностей O. ranae, у обеих половых групп R. arvalis в каждом биотопе превышают критическое, равное 9.49 при df = 4 и α = 0.05 (табл. 3, 4). Так, у самок из Усолки и Карьера мариты избегают май и июнь, предпочитая август и сентябрь. В Яблоньке май также относится к периоду, в котором показатель приуроченности паразита имеет знак минус. Июнь и июль относятся к месяцам, предпочитаемым трематодой. У самцов в Усольской популяции июнь является наиболее избегаемым cосальщиком, август и сентябрь – наиболее предпочитаемыми. На Карьере характер размещения численности марит в данной группе хозяина носит двухвершинный характер – гельминт отдает предпочтение июньской и августовской выборкам самцов (Fij положителен), а пробы за остальные месяцы гельминт избегает. В Яблоньке численность дигенеи распределена так, что обилие гельминта у самцов R. arvalis приурочено к маю, O. ranae заметно сторонится трех проб хозяина – июньской, июльской и сентябрьской. Данные табл. 3 и 4 показывают, что размещение обилия O. ranae в половых группах в каждом из биотопов имеет свои особые черты.
Наибольшие межполовые расхождения выявляются при сравнении экстенсивности инвазии R. arvalis трематодой весной (май) и осенью (сентябрь). Так, во-первых, величина показателя у самок в каждом биотопе в мае меньше, чем в сентябре. На Усолке и Карьере различия достоверны. Значения критерия ϕэмп равны соответственно 3.81 и 1.95 и превышают критическое при α = 0.05 (ϕкрит = 1.64). В Яблоньке ϕэмп = 0.54. Во-вторых, весной экстенсивность инвазии самцов O. ranae выше, чем самок. На Усолке и Карьере отличия достоверны, ϕэмп равны соответственно 2.88 и 1.86. В Яблоньке ϕэмп = 1.19. В-третьих, если весной по сравнению с осенью доля зараженных O. ranae самок R. arvalis достоверно уменьшается, то экстенсивность инвазии самцов хозяина в каждом биотопе повышается. Однако этот рост проявляется только на качественном уровне, а статистически не подтверждается.
Сравнение сезонных изменений численности O. ranae у самок с таковыми у самцов R. arvalis, проведенное при помощи критерия «лямбда» Колмогорова – Смирнова, свидетельствует о том, что максимальные значения критерия в трех биотопах приурочены к маю или июню (табл. 5). Например, в Усольской выборке R. arvalis в июне 1987 г. доля накопленного числа O. ranae у самок остромордой лягушки (распределение 1) равна ∑n1j/n1 = 190/272 = 0.70, где 190 = n1j, a 272 = n1. У самцов (распределение 2) ∑n2j/n2 = 163/302 = 0.52, где 163 = n2j, a 302 = n2. Разница между полученными величинами равна 0.17. Выражение √n1n2/n1 + n2 равняется √(272 х 302)/(272+302) = 12.02. Умножение последней величины на разницу между долями накопленных чисел дает максимальное значение критерия Колмогорова – Смирнова – 2.04 (см. табл. 5). В Яблоньке наибольшая величина λ равна 2.697 (май, 1988), на Карьере – 5.766 (июнь, 1987). Как известно, максимальное значение λ берется по модулю и оценивается по трем постоянным стандартным значениям критерия: 1.36 при α = 0.05, 1.63 при α = 0.01, 1.95 при α = 0.001 (Песенко, 1982). В каждом из биотопов значение критерия превосходит критическое при α = 0.001, что указывает на значимые различия в сезонном движении численности O. ranae в половых группах остромордой лягушки, особенно в мае или июне.
Неравномерность распределения обилия O. ranae в половых группах хозяина, несовпадение сезонных движений численности O. ranae у самок относительно таковых у самцов, выявленные с помощью критерия Колмогорова – Смирнова, так же как приведенные выше осенне-весенние различия в экстенсивности инвазии представителей половых группировок R. arvalis, с одной стороны, иллюстрируются, а с другой – конкретизируются периодическими колебаниями параметров заражения самок и самцов в пойменном (Усолка, см. рис. 2, 3) и надпойменном биотопах (Карьер, рис. 4, 5). Малое число самок в сборах из Яблоньки за июнь и июль 1987 г. и отсутствие в этих выборках самцов не позволили провести подобный анализ в этом биотопе.
Таблица 5. Сезонная динамика фактических и накопленных чисел Opisthioglyphe ranae у самцов и самок Rana arvalis в пойме р. Иртыш (Среднее Прииртышье, Республика Казахстан)
| Год | Месяцы | N1/N21 | N1j2 | N2j3 | ∑n1j4 | ∑n2j5 | ∑n1j/n16 | ∑n2j/n27 | λ8 |
| 1985 | V | 21/19 | 6 | 7 | 6 | 7 | 0.02 | 0.02 | -0.01 |
| VI | 14/14 | 0 | 13 | 6 | 20 | 0.02 | 0.06 | -0.52 | |
| VII | 9/18 | 4 | 16 | 10 | 36 | 0.04 | 0.12 | -0.96 | |
| VIII | 15/14 | 17 | 31 | 27 | 67 | 0.10 | 0.22 | -1.42 | |
| IX | 33/37 | 60 | 27 | 87 | 94 | 0.32 | 0.31 | 0.18 | |
| 1986 | V | 15/11 | 8 | 9 | 95 | 103 | 0.35 | 0.33 | 0.18 |
| VI | 18/8 | 8 | 9 | 103 | 112 | 0.38 | 0.36 | 0.18 | |
| VII | 11/7 | 2 | 2 | 105 | 114 | 0.39 | 0.37 | 0.19 | |
| VIII | 18/14 | 21 | 18 | 126 | 132 | 0.46 | 0.43 | 0.42 | |
| IX | 14/10 | 37 | 8 | 163 | 140 | 0.60 | 0.45 | 1.74 | |
| 1987 | V | 18/12 | 17 | 18 | 180 | 158 | 0.66 | 0.51 | 1.79 |
| VI | 20/7 | 10 | 5 | 190 | 163 | 0.70 | 0.53 | 2.04 | |
| VII | 8/16 | 3 | 15 | 193 | 178 | 0.71 | 0.58 | 1.58 | |
| VIII | 10/15 | 17 | 22 | 210 | 200 | 0.77 | 0.65 | 1.47 | |
| IX | 8/18 | 10 | 24 | 220 | 224 | 0.81 | 0.73 | 0.98 | |
| 1988 | V | 8/7 | 5 | 21 | 225 | 245 | 0.83 | 0.80 | 0.38 |
| VI | 15/12 | 0 | 2 | 225 | 247 | 0.83 | 0.80 | 0.30 | |
| VII | 16/10 | 11 | 2 | 236 | 249 | 0.87 | 0.81 | 0.71 | |
| VIII | 13/19 | 11 | 41 | 247 | 290 | 0.91 | 0.94 | -0.40 | |
| IX | 12/12 | 25 | 18 | 272 | 308 | 1 | 1 | 0 | |
| 272 | 308 | ||||||||
| Примечание. 1 – число самок хозяина N1 в распределении 1 и самцов N2 в распределении 2, экз.; 2 – фактическое число трематод в распределении 1, экз.; 3 – фактическое число трематод в распределении 2, экз.; 4 – накопленное число трематод в распределении 1, экз.; 5 – накопленное число трематод в распределении 2, экз.; 6 – доли накопленных чисел в распределении 1; 7 – доли накопленных чисел в распределении 2; 8 – значения критерия Колмогорова – Смирнова. | |||||||||
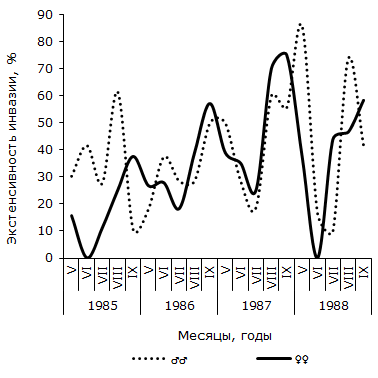
Рис. 2. Сезонная динамика экстенсивности инвазии самцов и самок остромордой лягушки трематодой Opisthioglyphe ranae (Усолка)
Fig. 2. Seasonal dynamics of invasion of trematodes Opisthioglyphe ranae (Ussolka) in males and females of moor frogs
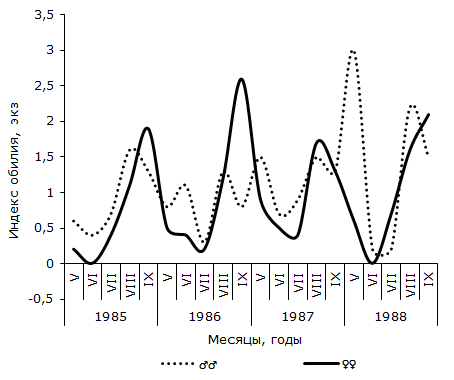
Рис. 3. Сезонная динамика индекса обилия Opisthioglyphe ranae у самцов и самок остромордой лягушки (Усолка)
Fig. 3. Seasonal dynamics of abundance index of Opisthioglyphe ranae in males and females of moor frogs (Ussolka)
Как следует из графика 2, в пойменной популяции R. arvalis экстенсивность инвазии самок трематодой в течение четырех сезонов изменяется волнообразно – от минимальной в июне или июле (1986 и 1987 гг.), до максимальной – в сентябре каждого сезона. Отличия между наименьшим и наибольшим значениями показателя в каждом сезоне достоверны. Величина критерия Фишера изменяется от 2.06 до 3.22. В данной половой группе R. arvalis в течение каждого сезона наблюдается одна волна заражения с осенним максимумом. Весной или в начале лета следующего активного периода хозяина инвазированность этой группы хозяина спадает до минимума. Значения индекса обилия O. ranae колеблются синфазно с сезонными флуктуациями экстенсивности заражения лягушек, оптимум численности отмечается осенью одного сезона, а пессимум – после зимнего периода, весной или в начале лета следующего сезона (см. рис. 3). Изменения среднего числа сосальщиков на самку хозяина на Карьере сходны с таковыми на Усолке (см. рис. 4). В течение двух лет минимум численности отмечен в мае, а максимум – в августе (1987) или сентябре (1988). Критерии различий между наименьшими и наибольшими значениями показателя существенны, как в 1987 г. (tst = 2.27, df = 24), так и в 1988 г. (tst = 3.60, df = 65). Сезонные колебания экстенсивности заражения самок R. arvalis в 1987 г. напоминают таковые в Усольской популяции (см. рис. 5). Отличия между меньшим майским и большим августовским значениями достоверны (φэмп = 1.76). В 1988 г. в августе заметен спад величины параметра (57.1 ± 13.2 %) по сравнению с июлем (83.3 ± 14.1 %) и сентябрем (84.6 ± 10.0 %), что создает впечатление о наличии двух волн заражения самок хозяина. Пик одной из них приурочен к майской, а второй к сентябрьской выборке обсуждаемой половой группы R. arvalis. Интересно, что это падение частоты встречаемости зараженных O. ranae самок совпадает с таковым, наблюдаемым в августе у представителей другого пола (см. рис. 5). Следует, однако, подчеркнуть, что различия между величинами экстенсивности инвазии в августе и июле, августе и сентябре не достоверны (φэмп = 1.03 и φэмп = 1.08 соответственно).
В отличие от самок, у самцов остромордой лягушки в Усольской популяции в течение сезона наблюдается по два повышения и снижения экстенсивности инвазии (см. рис. 2). Отличия между минимальными и максимальными значениями показателя достоверны не в каждый период сезона. Однако можно отметить, что в августе 1985 г. экстенсивность инвазии самцов лягушек трематодой достоверно выше, чем в июле (φэмп = 1.90), и ниже, чем в сентябре (φэмп = 3.51), т. е. в 1985 г. второе повышение экстенсивности инвазии подтверждается не только на качественном, но и на количественном уровне. Летне-осенний подъем зараженности представителей мужского пола достоверен и в 1987 г. (φэмп = 2.43). В июле 1988 г. частота зараженных O. ranae самцов минимальна и существенно меньше по сравнению с максимальной в мае (φэмп = 3.20). Повышение величины показателя в августе также достоверно (φэмп = 3.64). Таким образом, в 1988 г. наблюдалось два всплеска заражения самцов, отделенные друг от друга достоверным снижением в июле. Согласно графику 5, у самцов R. arvalis из Карьера в течение двух сезонов также наблюдалось по два всплеска и спада зараженности. В 1987 г. один всплеск и падение величины экстенсивности инвазии охватывает май и июнь, второй – август и сентябрь, в июле частота заражения самцов хозяина минимальна. В 1988 г. черты изменений параметра сходны, но отличаются меньшими абсолютными значениями. Из-за недостаточного объема сезонных выборок наличие на Карьере двух волн заражения трематодой самцов остромордой лягушки проявляются только на качественном уровне.
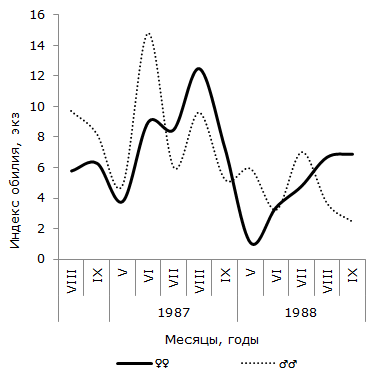
Рис. 4. Сезонная динамика экстенсивности инвазии самцов и самок остромордой лягушки трематодой Opisthioglyphe ranae (Карьер)
Fig. 4. Seasonal dynamics of invasion of trematodes Opisthioglyphe ranae (Karjer) in males and females of moor frogs
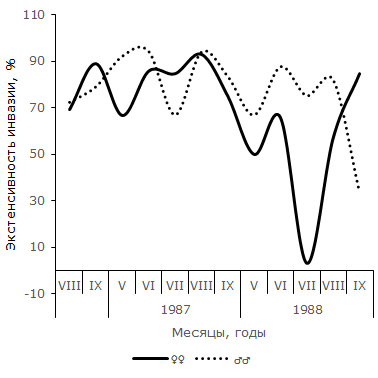
Рис. 5. Сезонная динамика индекса обилия Opisthioglyphe ranae у самцов и самок остромордой лягушки (Карьер)
Fig. 5. Seasonal dynamics of abundance index of Opisthioglyphe ranae in males and females of moor frogs (Karjer)
Обсуждение
Особенности зараженности половых групп взрослых особей остромордой лягушки маритами O. ranae предоставляют возможность разобраться в том, как трематода реализует оба своих цикла развития в природных условиях. Межполовые особенности в зараженности O. ranae взрослых особей остромордой лягушки (длина тела ≥ 20.1 мм) мы связываем, с одной стороны, с различиями в поведении самцов и самок хозяина в период размножения. С другой стороны, с тем, что трематода способна реализовывать у взрослых лягушек обе формы жизненного цикла. Известно, что миграция половозрелых R. arvalis к нерестилищам, спаривание и икрометание происходят в мае и начале июня (Искакова, 1959; Банников и др., 1977; наши наблюдения). Самцы остромордой лягушки появляются в местах нереста раньше самок и находятся там до 25 дней. В это время у них наблюдается «брачный пост» и они почти не питаются. Поэтому установленный по нашим материалам весенне-раннелетний подъем экстенсивности инвазии самцов нельзя объяснить поступлением инвазионного начала с пищей, как это происходит при триксенном цикле развития. Мы полагаем, что относительно длительная экспозиция самцов в нерестовом водоеме приводит к их прямому заражению церкариями O. ranae и тем самым вовлечению в диксенную форму развития гельминта. Очевидно, что всплеск зараженности самцов R. arvalis в мае – июне вызывается поколением марит, образовавшихся по диксенному варианту цикла развития O. ranae. По данным Т. А. Гинецинской (1968), при диксенном цикле темпы развития личинок и марит O. ranae повышены. Быстрое (к середине лета, в июле) снижение показателей инвазии у представителей мужского пола R. arvalis указывает на завершение развития у них марит диксенного поколения. С окончанием размножения и «брачного поста» самцы начинают усиленно питаться. Это создает условия для реализации трематодой и в этой группе амфибии триксенного цикла развития. Мы считаем, что вторая, летне-осенняя волна инвазии самцов R. arvalis вызывается поколением марит с триксенной историей образования. По сведениям Y. Manga-Gonzаlez et al. (1994), наибольшая масса церкарий O. ranae, выделяемая моллюском Lymnaea truncatula = Galba truncatula, приходится на май. В июле, сентябре и октябре зараженность первого промежуточного хозяина невысока, а в остальные месяцы года он вообще свободен от спороцист и церкарий сосальщика. Вполне возможно, что и в условиях Среднего Прииртышья в июле – сентябре церкарии сосальщика в водоемах отсутствуют или встречаются в очень незначительном количестве, поэтому прямое заражение амфибий церкариями в эти периоды сезона не может играть заметной роли.
Половозрелые самки R. arvalis, в отличие от самцов, присутствуют в нерестилище всего несколько суток и после откладки икры покидают его (Банников и др., 1977). В связи с кратковременным пребыванием в водоеме вероятность прямого заражения самок церкариями O. ranae мала, поэтому их зараженность в мае по сравнению с сентябрем не растет, как у самцов, а наоборот, падает. Это снижение мы связываем с постепенным окончанием существования прошлогодних сосальщиков. Совершив икрометание, самки остромордой лягушки приступают к активному питанию, что приводит к их заражению новым поколением марит, образующихся по триксенному варианту жизненного цикла. Они, очевидно, составляют основу инфрапопуляций трематоды в этой половой группе амфибии. Однако полностью участие самок остромордой лягушки в диксенном онтогенезе O. ranae исключать, видимо, нельзя. По ряду причин, например недостаток убежищ, давление хищников, засушливый сезон, пребывание в водоемах в мае и июне представителей данного пола R. arvalis может удлиняться. В результате увеличивается вероятность контакта с инфективными церкариями O. ranae и самки остромордой лягушки могут статистически заметно вовлекаться в диксенный цикл развития гельминта. Скорее всего, именно эти процессы отразились в виде небольших всплесков величины показателей инвазии самок R. arvalis в июне 1986 и 1987 гг. на Усолке и в июне 1987 г. и августе 1988 г. на Карьере, которые заметны на графиках (см. рис. 2, 4, 5). Включение в диксенный цикл развития трематоды лягушек (длина тела ≥ 20.1 мм), не участвующих в размножении, также может иметь место при их длительном нахождении в водоемах с инвазионными личинками O. ranae.
Особые черты заражения самцов R. arvalis приводят к тому, что у них инфрапопуляции O. ranae весной и в начале лета имеют смешанный состав. С одной стороны, как было показано выше, в них входят сосальщики, образовавшиеся по диксенной форме жизненного цикла. С другой стороны, присутствуют перезимовавшие в хозяине прошлогодние дигенеи второй, летне-осенней волны заражения. Поскольку они возникли по триксенному варианту цикла развития гельминта, то, очевидно, так же как у самок, после зимнего периода заканчивают существование. Сборный характер инфрапопуляций трематоды у самцов в мае – июне позволяет очень приблизительно подсчитать долю марит с диксенной историей возникновения, паразитирующих у самцов R. arvalis. Так, в объединенной выборке взрослых лягушек (длина тела ≥ 20.1 мм) из трех биотопов число O. ranae у самцов в мае – июне на 605 экз. больше, чем у самок (см. табл. 4, 5). Эти «дополнительные» особи, как мы полагаем, имеют, скорее всего, диксенное происхождение. Они составляют 10.1 % от суммарного числа трематод, собранных у остромордой лягушки.
У сеголеток доля марит с диксенной историей возникновения равна 24.1 % от всех O. ranae. Если учитывать носительство диксенных марит самцами и реально возможное – самками, то в названных внутрипопуляционных группах R. arvalis, по приблизительным оценкам, сосредоточено 30–35 % O. ranae, образующихся по диксенной форме жизненного цикла гельминта. Остальные 65–70 % сосальщиков, паразитирующих у остромордой лягушки из степной и лесостепной зон Казахстана, представлены трематодами триксенного происхождения. Наши расчеты не расходятся с распространенным мнением о том, что триксенный цикл развития играет ведущую роль в экологии сосальщика (Grabda-Kasubska, 1976; Галактионов, Добровольский, 1998; Poulin, Gribb, 2002).
В работе О. В. Минеевой, И. А. Евланова (2009) морфометрическим методом показана смена двух генераций O. ranae у P. ridibundus из Саратовского водохранилища. С учетом полученных нами данных о механизмах заражения внутрипопуляционных групп R. arvalis маритами разного генезиса можно предположить, что первая генерация сосальщиков в работе названных авторов имеет диксенное происхождение. В пользу такого вывода говорит то, что поедание головастиков (внутривидовой каннибализм) является главным способом заражения озерной лягушки (Галактионов, Добровольский, 1998). Вполне возможно, что после метаморфоза личинок и расселения сеголеток база для каннибализма сокращается и создаются условия для вовлечения озерной лягушки в триксенный цикл развития трематоды. В таком случае вторая генерация марит в работе названных выше авторов, вероятнее всего, соответствует O. ranae с треххозяинной историей образования.
Согласно исследованию R. Poulin, T. Gribb (2002), возникновение диксенного жизненного цикла из триксенного путем совмещения роли второго промежуточного и окончательного хозяина в одном, кроме Opisthioglyphe, характерно для трематод, относящихся к родам Haplometra, Glypthelmis, Cephalogonimus и Alaria. Мы надеемся, что проведенный нами анализ может помочь в планировании объема выборок при полевых исследованиях механизмов реализации двух форм цикла развития у видов из названных родов гельминтов.
Заключение
Половозрелые O. ranae обнаружены в популяциях R. arvalis, населяющих колочную лесостепь, правобережную и левобережную степь, пойму р. Иртыш и антропогенные биотопы Республики Казахстан. Самая высокая зараженность O. ranae отмечена у R. arvalis, обитающих около антропогенных водоемов и некоторых правобережных степных озер. Средние по величине параметры заражения трематодой характерны для амфибии из поймы р. Иртыш и лесостепи. Невысокие значения показателей инвазии дигенеей характерны для выборок из Казахского мелкосопочника.
O. ranae в условиях лесостепной и степной зоны Казахстана реализует обе формы своего жизненного цикла. Различия в механизмах осуществления двух типов циклов развития трематоды и особенности экологии внутрипопуляционных групп дефинитивного хозяина являются в природных условиях причиной структурирования маритного блока паразитарной системы O. ranae. Совокупность O. ranae в популяциях окончательного хозяина слагается из двух поколений половозрелых особей. Одно поколение O. ranae состоит из трематод, образующихся по треххозяинному (триксенному) циклу развития. Оно охватывает всех R. arvalis, кроме головастиков и сеголеток. Образование этого поколения связано к кормовыми участками дефинитивного хозяина. Пик экстенсивности инвазии лягушек и оптимум численности гельминта в каждом сезоне достигается в августе – сентябре. После зимнего периода, в мае – июне другого сезона, триксенная генерация O. ranae заканчивает свое существование, и начинает формироваться следующая за ней. Трематоды триксенного происхождения составляют около 65 % от общего числа O. ranae, паразитирующих у R. arvalis из Среднего Прииртышья.
Маритное поколение диксенного (двуххозяинного) происхождения закладывается ежегодно в мае – июне в нерестовых водоемах, где церкарии O. ranae заражают головастиков и взрослых лягушек. Образовавшиеся у личинок R. arvalis молодые мариты после метаморфоза переходят к сеголеткам. Заметная доля диксенных марит паразитирует самцов остромордой лягушки. Из-за относительно длительного нахождения в нерестовых водоемах данная половая группа хозяина подвергается прямому заражению церкариями O. ranae. Мариты с диксенной историей образования вызывают всплеск зараженности самцов хозяина весной и в начале лета каждого сезона. Церкариоз самок и неполовозрелых особей лягушки, как и дальнейшее развитие в этих группах R. arvalis трематод с диксенной формой жизненного цикла, полностью зависит от длительности пребывания в мае – июне в нерестовых или других водоемах с инфективными церкариями сосальщика. Паразитические особи O. ranae, образующиеся по двуххозяинному варианту жизненного цикла, заканчивают свое развитие еще в текущем сезоне, до наступления зимнего периода. В популяциях остромордой лягушки из Казахстана доля марит с диксенной историей возникновения составляет 30–35 % от общего числа O. ranae.
Диксенный цикл развития расширяет видовую, популяционную и организменную экологические ниши O. ranae по трофическому, пространственному и временному измерениям. Этим достигается более тонкая адаптация паразита к внутрипопуляционной структуре и другим чертам биологии дефинитивного хозяина. Данный способ индивидуального развития, являясь проявлением r-стратегии, позволяет гельминту дополнительно и в короткие сроки наращивать численность марит у окончательного хозяина и, следовательно, инвазионных яиц в биоценозах. Реализация обеих форм цикла развития обеспечивает не только более интенсивное, но и равномерное насыщение биотопов яйцами O. ranae в течение всего активного сезона дополнительных и окончательного хозяев.
Повышенная зараженность сосальщиками диксенного генезиса сеголеток и самцов R. arvalis в биотопах антропогенного происхождения свидетельствует о том, что эта форма жизненного цикла развития способствует успешному освоению O. ranae вновь формирующихся биотопов. Вполне возможно, что в эволюционном прошлом диксенный онтогенез облегчил выход гельминта из экологических желобов (речных систем Урала и Иртыша) в бессточные водоемы лесостепной и степной зон Казахстана.
Библиография
Банников А. Г., Даревский И. С., Ищенко В. Г., Рустамов А. К., Щербак Н. Н. Определитель земноводных и пресмыкающихся фауны СССР . М.: Просвещение, 1977. 415 с.
Белякова Ю. В. Церкарии Кургальджинских озер // Паразиты – компоненты водных и наземных биоценозов Казахстана / Ред. Е. В. Гвоздев. Алма-Ата: АН Казахской ССР, 1981. С. 28–58.
Боев С. Н., Панин В. Я., Соколова И. Б. Гельминты копытных животных Казахстана . Алма-Ата: АН Казахской ССР, 1962. Т. 1. 271 с.
Будалова Т. М., Радченко Н. М., Марков Г. С. Влияние антропогенных факторов на состав гельминтоценоза и зараженность озерной и прудовой лягушек гельминтами // Фауна и экология амфибий и рептилий / Ред. Л. С. Шалдыбин. Горький, 1984. С. 78–84.
Ваккер В. Г. Разделение и перекрывание пространственно-временной ниши у имагинальных форм пяти видов гельминтов в популяциях остромордой лягушки в Среднем Прииртышье // Эволюция паразитов: Материалы 1 Всесоюзн. симпозиума / Ред. Г. П. Краснощёков, В. А. Ройтман, М. Д. Сонин, Л. В. Чеснова. Тольятти, 1991. С. 83–88.
Ваккер В. Г., Тарасовская Н. Е. Биология Opisthioglyphe ranae (Froelich, 1791) (Plagiorchidae) в Среднем Прииртышье . Деп. в ВИНИТИ 1988. № 4148-в88. анн. в РЖБ, 6к-121, 1988. 21 с.
Вершинин В. Л. Определитель земноводных и рептилий Среднего Урала . Екатеринбург, 2007. 125 с.
Галактионов К. В., Добровольский А. А. Происхождение и эволюция жизненных циклов трематод . СПб.: Наука, 1998. 404 с.
Гинецинская Т. А. Трематоды. Их жизненные циклы, биология и эволюция . Л.: Наука, 1968. 411 с.
Гончаренко А. Е. Экология и закономерности размножения лягушки (Rana arvalis) в условиях бассейна реки Южный Буг // Вид и его продуктивность в ареале / Ред. В. Е. Соколов. М.: Наука, 1983. С. 82–88.
Добровольский А. А. Некоторые новые данные о жизненном цикле сосальщика Opisthioglyphe ranae (Froelich, 1791) (Plagiorchidae) // Helminthologia. 1965. YI. 3. 205–221.
Ивантер Э. В., Коросов А. В. Элементарная биометрия . Петрозаводск: Изд-во ПетрГУ, 2010. 104 с.
Исайчиков И. М. К фауне паразитических червей Омской губернии // Известия Западно-сибирского отделения Русского географического общества. 1926. № 5. С. 219–224.
Искакова К. И. Земноводные Казахстана . Алма-Ата: АН Казахской ССР, 1959. 145 с.
Кеннеди К. Экологическая паразитология . М.: Мир, 1978. 230 с.
Кудинова М. А., Жерихова Г. В., Петрова О. Е. Гельминтофауна лягушки травяной в Южной Карелии // Гельминты и их промежуточные хозяева / Ред. Л. С. Шалдыбин. Горький, 1985. С. 24–27.
Марков Г. С., Рогоза М. Л. Паразитофауна самцов и самок травяной лягушки // Доклады АН СССР. 1949. T. 65. № 3. С. 417–420.
Минеева О. В., Евланов И. А. Возрастная структура и динамика численности гемипопуляции трематоды Opisthioglyphe ranae (Plagiorchidae) у озерной лягушки из Саратовского водохранилища // Паразитология. 2009. Т. 43. № 6. С. 473–477.
Однокурцев В. А., Седалищев В. Г. Гельминтофауна сибирской лягушки Якутии, ее половозрастная и сезонная изменчивость // Поволжский экологический журнал. 2008. № 2. С. 112–119.
Плохинский Н. А. Биометрия . М.: Изд-во МГУ, 1970. 359 с.
Рыжиков К. М., Шарпило В. П., Шевченко Н. Н. Гельминты амфибий фауны СССР . М.: Наука, 1980. 276 с.
Скрябин К. И. Подсемейство Opisthioglyphinae Dolfus, 1949. Трематоды животных и человека . М.: Наука, 1971. Т. 24. С. 25–67.
Соболева Т. Н. К гельминтофауне водных амфибий и рептилий Казахстана // Экология водных животных / Ред. Е. В. Гвоздев. Алма-Ата: АН Казахской ССР, 1975. С. 186–192.
Чибилёв А. А. Степи северной Евразии (Эколого-географический очерк и библиография) . Екатеринбург, 1998. URL: http://artlib.osu.ru/web/books/chibilev/book0115.pdf.
Frandsen F. A study of Danisch amphibians parasitic fauna // Acta Parasitol. Pol. 1974. Vol. 22. P. 49–66.
Grabda-Kazubska B. Studies on abbreviation of the life-cycle in Opisthioglyphe ranae (Froelich, 1791) and O. rastellus (Olsson, 1876) (Trematoda: Plagiorchidae) // Acta Parasitol. Pol. 1969. Vol. XVI. Fasc. 27. Р. 249–269.
Grabda-Kazubska B. Abbreviation of the life cycles in plagiorchid trematodes. General remarks. // Acta Parasit. Pol. 1976. Vol. 26. Fasc. 3. Р. 125–141.
Manga-Gonzalez Y., Gonzales-Lanza C., Kanev I. Lymnaea truncatula, intermediate host of some Plagiochiidaevand Notocotylidae species in Leon, NW Spain // J. of Helminthology. 1994. Vol. 68. P. 135–141.
Lees E., Bass L. Sex gormones as a possible factor influencing the level of parasitation in frogs. // Nature (L.). 1960. P. 1207–1208.
Plasota K. The effect of some ecological factors on the parasitofauna of frogs // Acta Parasit. Pol. 1969. Vol. XVI. Fasc. 6. P. 47–60.
Poulin R., Gribb T. H. Trematode life cycles: short is sweet? // Trends in Parasitology. 2002. Vol. 18. No 4. P. 176–183.
Pritchard M. H., Kruse G. O. W. The Collection and Preservation of Animal Parasites // Tech. Bull. No 1. The Harold W. Manter Laboratory. University of Nebraska Press., 1982. P. 19–30, 41–44.
Olson P. D., Gribb T. H., Tkach V. V., Bray R. A., Littlwood D. T. J. Phylogeny and classification of the Digenea (Platyhelminths: Trematoda) // Intern. J. for Parasitology. 2003. Vol. 33. P. 733–755.
Smyth J. D. Introduction to Animal Parasitology. Cambridge University Press, 1994. P. 219–224.
Spieler M. Parasitologische Untersuchungen an einheimischen Moorfroschlurchen // Duisburg. Jahrbuch f. Feldherpetologie, 1994. Beiheft 2. S. 25–112.
Благодарности
Автор сердечно благодарит зав. кафедрой зоологии Prof. S. Berking, доцента кафедры Dr. F. Fedder, ст. лаборанта кафедры I. Brockhaus (Кёльнский университет), профессора, д. б. н. И. Б. Кнора и к. б. н. Н. И. Юрлову (ИСиЭЖ СО РАН, Новосибирск), профессора, д. б. н. Н. Е. Тарасовскую (Павлодарский педагогический институт), ведущего инженера фирмы Yazaki А. М. Бурчакова за помощь в подготовке материалов к публикации.






 © 2011 - 2026
© 2011 - 2026