Введение
Известны различные способы для отлова и сбора некрофильных насекомых, данные о которых необходимы для проведения судебно-медицинских экспертиз с целью решения вопроса продолжительности постмортального интервала (Anderson, VanLaerhoven, 1996; Davies, 1999; Matuszewski et al., 2008).
Задачей данной работы является описание метода изучения состава комплекса некробионтов, особенностей их биологии и участия в разложении трупа крупного животного в естественных условиях. Данные сведения необходимы для разработки методики проведения комплексных судебно-энтомологических экспертиз.
Традиционные методы исследований
Одно из первых приспособлений для изучения разложения трупов было предложено Дж. Пейном (Payne, 1965). Автор укладывал трупы небольших животных (поросята) в специально изготовленные клетки для наблюдения за их разложением. Клетки предназначались для защиты приманки от крупных хищников.
П. Шубек (Shubeck, 1976), изучая некробионтов, предлагал для защиты трупной приманки от кормящихся падалью позвоночных животных использовать деревянный короб с крышкой, фиксированный к платформе, твердо закрепленной на земле (рис. 1). Этот способ позволяет сохранить трупную приманку, но ограничивает воздействие всех факторов внешней среды и искажает естественный процесс разложения, т. к. отсутствует контакт трупа с растительным покровом и почвенным слоем.

Рис. 1. Короб для изучения насекомых-некробионтов (из: Shubeck, 1976)
Fig. 1. The box for studying insects on a carcase (from: Shubeck, 1976)
Оригинальную ловушку для насекомых с приманкой предлагает М. Н. Цуриков (Цуриков, 2006; Голуб и др., 2012). Она представляет собой картонную коробку произвольной длины и ширины высотой не менее 60 мм, с плотно подогнанной крышкой, отверстиями для проникновения насекомых внутрь и их дезориентации.
Существуют и другие оригинальные ловушки для изучения фауны трупов мелких животных. А. И. Ермаков (Ермаков, 2013) предлагает для отлова летающих некрофильных насекомых использовать подвесную ловушку, которая представляет собой две пластиковые бутылки, соединенные горловинами с помощью муфты (рис. 2).
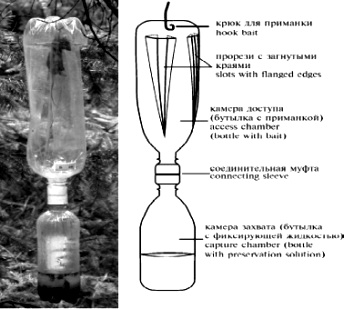
Рис. 2. Схема и внешний вид установленной ловушки (из: Ермаков, 2013)
Fig. 2. Scheme and appearance of the installed trap (from: Ermakov, 2013)
Оконная ловушка с приманкой, описанная В. А. Кащеевым и др. (Кащеев и др., 1998), представляет собой стекло 60 х 70 см, закрепленное на стойках и погруженное основанием в корыто, заполненное фиксирующей жидкостью; на стекло с обеих сторон подвешивается приманка.
В. К. Зинченко (Зинченко, 2007) в качестве ловушки использует прозрачный пластиковый сосуд (бутылку) с приманкой, лежащий на боку (рис. 3). Рядом с ловушкой вкопана почвенная банка для сбора насекомых, привлеченных запахом разлагающейся приманки. При этом все ловушки пригодны для отлова некрофильных насекомых, но имеют ряд недостатков (Псарев, 2012).

Рис. 3. Внешний вид установленной ловушки (из: Зинченко, 2007)
Fig. 3. Appearance of the installed trap (from: Zinchenko, 2007)
Приманки также можно выкладывать на поверхность земли. Однако есть большая вероятность того, что до конца исследования не закончатся и их утащат позвоночные-падальщики. В этом случае необходимо создавать специальные условия. Например, располагать их в местах, где доступ для падальщиков закрыт (Šuláková, Barták, 2013).

Рис. 4. Экспериментальный труп свиньи под пирамидальной ловушкой (из: Šuláková, Barták, 2013)
Fig. 4. Experimental pig carcase beneath the pyramidal trap (from: Šuláková, Barták, 2013)
Оригинальные методы исследований
Для использования полученных экспериментальных данных в повседневной судебно-медицинской практике, исследования необходимо проводить на трупах крупных животных, массой более 30 кг. Только такие трупы могут быть использованы как модели разложения трупа человека, например, трупы крупных собак и свиней (Марченко, Кононенко, 1991; Matuszewski et al., 2008; Šuláková, Barták, 2013 и др.). Умерщвление животного должно быть произведено так, чтобы не нарушить анатомическую целостность кожных покровов трупа.
Устройство для изучения некрофильных насекомых на трупах крупных животных
Для изучения комплекса некрофильных насекомых использовалось разработанное нами устройство (рис. 4), состоящее из следующих частей:
- Клетка железная с крышкой и ушками для замка. Размеры клетки 120 х 80 х 60 см, размер ячеи сверху и сбоку 10 см и снизу 20 см. После установки на месте исследования клетка фиксируется металлическими прутьями, вбитыми в землю на глубину до 1 м. Затем внутрь клетки помещается крупная приманка, закрывается крышкой и замком.
- Пирамидальная ловушка из тонкого светлого капрона. Размеры (длина и ширина) превышают в 1.5–2 раза размер клетки. Ловушка устанавливается над клеткой на высоту 1–1.5 м с помощью шеста, зафиксированного в землю (высота установки определяется возможностью беспрепятственного изъятия материала). В верхней части ловушки находится округлое отверстие, через которое насекомые попадают в ловчий стакан (можно использовать полупрозрачную полиэтиленовую бутылку). К ловчему стакану крепится при помощи полиэтиленовой крышки другая полупрозрачная бутылка с фиксатором. В качестве фиксатора обычно применяют этиловый спирт 96 % концентрации или уксусную эссенцию. Емкость заполняют на 1/3. Концы капрона натягиваются и фиксируются колышками. Нижний край капрона располагается на высоте 30–35 см от поверхности земли. Используют почвенную ловушку для отлова летающих некрофильных насекомых.
- Почвенная ловушка. Пол-литровую банку вкапывают в землю по горлышко. Ловушки располагают по краю ложа трупа. После установки их заполняют на 1/3 жидкостью (уксусной эссенцией, или мыльным раствором, или этиленгликолем). Либо почвенную ловушку можно заполнить опилками или песком, тогда отползающие с трупа личинки двукрылых для окукливания попадают внутрь. Такие ловушки устанавливаются в количестве не менее четырех штук. Используют почвенную ловушку для отлова почвенных некрофильных насекомых.

Рис. 5. Внешний вид устройства для изучения некрофильных насекомых на трупах крупных животных
Fig. 5. Device for studying necrophilic insects on the corpses of large animals
На cхеме изображены основные детали устройства для изучения некрофильных насекомых на трупах крупных животных (рис. 6). После установки металлической клетки (1) в месте исследования ее фиксируют прутьями (4), внутрь клетки укладывают трупную приманку (5), крышку (2) закрывают замком (3). Пирамидальную ловушку из капрона (6) располагают над клеткой и закрепляют с помощью шеста (7), внизу концы натягивают с помощью колышек (10), оставляя доступное открытое пространство для пролета некробионтов от края капрона до поверхности земли 30–35 см. В верхней части этой ловушки делают округлое отверстие, равное (или меньше) по диаметру ловчему стакану (8), который соединяется с помощью крышки с емкостью (или бутылкой) с фиксатором (9). Летающие насекомые попадают под капрон и под влиянием положительного фототаксиса двигаются в сторону ловчего стакана, где остаются в емкости с фиксирующей жидкостью.
Почвенные банки-ловушки (11) вкапываются в землю по краю ложа трупа с возможностью их перемещения по отношению к трупу. В качестве почвенных ловушек можно использовать, например, пол-литровые банки. После установки их заполняют фиксатором или опилками. В случае заполнения опилками отползающие с трупа личинки двукрылых будут попадать внутрь и там окукливаться. Используют почвенную ловушку для отлова почвенных некрофильных насекомых.
Данное устройство позволяет провести исследование до полного разложения (например, костной ткани, шерсти, копыт), на которое затрачивается несколько лет.
В условиях севера Европейской части сбор материала осуществляется через три-четыре дня в период активной фазы разложения и два раза в неделю в стадии скелетирования трупа. Извлечение собранного материала из устройства не вызывает трудностей и не занимает много времени. Материал с почвенной ловушки собирают, не вынимая банку, с пирамидальной – меняют бутылку с фиксирующей жидкостью на новую и разбирают собранный материал в лабораторных условиях. Использование разного типа ловушек позволяет производить раздельный сбор напочвенных и почвенных некробионтов. Наибольшая эффективность отлова для имаго и личинок Coleoptera, Diptera, также попадают Lepidoptera, Hymenoptera, Hemiptera. Среди двукрылых это представители семейств Calliphoridae, Fanniidae, Sepsidae, Piophilidae. Из жуков встречаются представители семейств Silphidae, Histeridae, Staphylinidae, Scarabaeidae, Nitidulidae, Hydrophilidae, многочисленны виды из родов Ontholestes, Creophilus, Philonthus, Aleochara, Atheta.
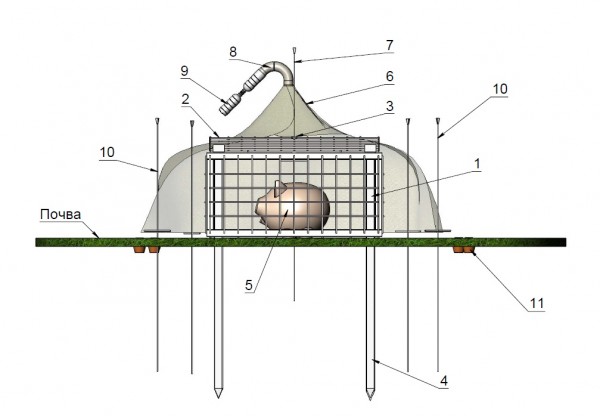 Рис. 6. Схема устройства для изучения некрофильных насекомых на трупах крупных животных, вид спереди (рисунок © В. А. Маркианова): 1 – металлическая клетка, 2 – крышка, 3 – ушки для замка, 4 – прутья для фиксации клетки, 5 – приманка, 6 – пирамидальная ловушка из капрона, 7 – шест для крепления пирамидальной ловушки, 8 – ловчий стакан, 9 – емкость с фиксатором, 10 – колышки для натягивания пирамидальной ловушки, 11 – почвенные банки-ловушки
Рис. 6. Схема устройства для изучения некрофильных насекомых на трупах крупных животных, вид спереди (рисунок © В. А. Маркианова): 1 – металлическая клетка, 2 – крышка, 3 – ушки для замка, 4 – прутья для фиксации клетки, 5 – приманка, 6 – пирамидальная ловушка из капрона, 7 – шест для крепления пирамидальной ловушки, 8 – ловчий стакан, 9 – емкость с фиксатором, 10 – колышки для натягивания пирамидальной ловушки, 11 – почвенные банки-ловушки
Fig. 6. Scheme of device for studying insects on large corpses, front view (Figure © V. A. Markianov): 1 – metal cage, 2 – lid, 3 – hole to the padlock, 4 – rods for fixing the cage, 5 – carcass, 6 – pyramidal trap of nylon, 7 – pole for fixing the pyramidal trap, 8 – adapter, 9 – the capacity with the fixator, 10 – pegs to stretch pyramidal trap, 11 – soil traps
Большинство собранного материала составляют личинки и пупарии некрофильных двукрылых. Живой материал сразу (в день его забора) помещается в термостат с регулируемым освещением и температурой. Для достижения лучшего результата по выведению имаго необходимо создать определенные условия: естественное освещение (12:12), влажность и комфортную температуру. Оптимальная температура для развития двукрылых 20–25 °С (Марченко, Кононенко 1991). Выборку личинок и пупариев легче всего проводить глазным пинцетом или кисточкой.
Содержание личинок, пупариев (или куколок) и выведение имаго в лабораторных условиях
Для точного выяснения видовой принадлежности личинок (особенно двукрылых) необходимо выведение до имаго. Собранный материал находится в термостате в садках, контейнерах или банках (0.5–1.0 л). В качестве субстрата в них используют песок, опилки или сфагнум, который заполняет емкость наполовину, сверху ее закрывают марлей или легкой тканью и плотно зажимают резинкой.
Личинок в банке не должно быть много, оптимальное количество 20–30 особей. Их докармливают субстратом из мяса, печени или рыбы. По данным Н. А. Тамариной (Тамарина, 1958), для развития одной личинки синей мясной мухи требуется 0.3 г мяса. В банку кладут несколько кусочков питательного субстрата и немного прикрывают мхом. В случае избытка мяса начинаются процессы гниения, что неблагоприятно влияет на развитие личинок. Хорошим показателем нормального развития личинок служит появление запаха аммиака при полном отсутствии гниющего мяса (Виноградова, 1984). Перед окукливанием большинство личинок перемещаются вглубь.
Пупарии и куколок лучше содержать отдельно от личинок, т. к. их не надо докармливать. Собранные куколки и пупарии переносят в банку с песком и слегка прикрывают мхом. Сверху банку накрывают тканью и оставляют в лаборатории до выведения имаго. Если пупарии мух одного вида и собраны в одном месте, то имаго появляются почти одновременно в течение двух-трех дней.
Подготовка личинок для фиксации
Для идентификации вида насекомого или определения возраста личинки, которое также имеет важное значение для определения времени заселения трупа двукрылыми, личинок фиксируют. Для этого их аккуратно снимают с трупа, промывают в теплой воде с целью очищения от продуктов разложения, а после ошпаривают крутым кипятком или горячим спиртом (60°), в которых оставляют на несколько секунд. Далее умерщвленных личинок помещают в спиртовой раствор (70° спирт + 1/5 глицерина) в банки с притертой крышкой. Весь материал этикетируют, указывая дату, место и время забора.
Заключение или выводы
Использование предложенного нами устройства позволяет защитить трупную приманку от крупных хищников, что позволяет проследить весь процесс разложения, а также повысить эффективность отлова некрофильных насекомых за счет использования двух видов ловушек (пирамидальной и почвенной).
Библиография
Виноградова Е. Б. Мясная муха Calliphora erythrocephala модельный объект физиологических и экологических исследований // Труды Зоологического института. 1984. Т. 118. С. 1–271.
Голуб В. Б., Цуриков М. Н., Прокин А. А. Коллекции насекомых: сбор, обработка и хранение материала . М.: Товарищество научных изданий КМК, 2012. 339 с.
Ермаков А. И. Подвесная ловушка для отлова некрофильных насекомых // Евразиатский энтомологический журнал. 2013. Т. 12. № 3. С. 405–406.
Зинченко В. К. Простая и эффективная ловушка для отлова жуков-некрофагов // Евразиатский энтомологический журнал. 2007. Т. 6. № 4. С. 410–411.
Кащеев В. А., Чильдебаев М. К., Псарёв А. М. К методике изучения почвенной мезофауны членистоногих. Сообщение III // Известия Министерства науки — Академии наук Республики Казахстан. Сер. биологическая и медицинская. 1998. № 2. С. 65–71.
Марченко М. И., Кононенко В. И. Практическое руководство по судебной энтомологии / Под ред. А. Ф. Рубежанского. Харьков, 1991. 70 c.
Псарёв А. М. К методике изучения некрофильных жесткокрылых: сравнительная оценка трех типов ловушек // Евразиатский энтомологический журнал. 2012. Т. 11. № 3. С. 236–238.
Тамарина Н. А. Методика разведения синей мясной мухи Calliphora erythrocephala // Зоологический журнал. 1958. Т. 37. № 6. С. 946–948.
Цуриков М. Н. Три ловушки с приманками для сбора беспозвоночных // Зоологический журнал. 2006. Т. 85. № 5. С. 656–658.
Anderson G. S., VanLaerhoven S. L. Initial studies on insect succession on carrion in southwestern British Columbia // J. Forensic Sci. 1996. Vol. 41 P. 617–625.
Davies L. Seasonal and spatial changes in blowfly production from small and large carcasses at Durham in lowland northeast England // Medical and Veterinary Entomology. 1999. Vol. 13. № 3. P. 245–251.
Matuszewski S., Bajerlein D., Konwerski S., Szpila K. An initial study of insect succession and carrion decomposition in various forest habitats of Central Europe // Forensic Science International. 2008. Vol. 180. Р. 61–69.
Payne J. A. A summer carrion study of the baby pig Sus scorofa L. // Ecology. 1965. Vol. 46. P. 592–602.
Shubeck P. P. An alternative to pitfall traps in carrion beetle studies (Coleoptera) // Entomol. News. 1976. Vol. 87. № 5. P. 176–178.
Šuláková H., Barták M. Forensically important Calliphoridae (Diptera) associated with animal and human decomposition in the Czech Republic: preliminary results // Čas. Slez. Muz. Opava. 2013. Vol. 62. P. 255–266.
Благодарности
Работа выполнена при финансовой поддержке Программы стратегического развития ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской (или образовательной) деятельности на 2012–2016 гг.
Авторский коллектив благодарит В. А. Маркианова (ООО «Геосервис») за помощь в создании изображений.






 © 2011 - 2026
© 2011 - 2026