Введение
Лишайники – комплексные организмы, состоящие из гетеротрофного и автотрофного компонентов, связанных между собой трофическими связями. Взаимоотношения генетически и экологически разных симбионтов определяют адаптивные стратегии организма к условиям местообитания, а также положение и роль лишайников в экосистемах. Вопрос взаимоотношений бионтов в талломе лишайника в современной литературе активно изучается (Gorbushina, Beck, Schulte, 2005; Павлова, Маслов, 2008; Lutzoni, Miadlikowska, 2009; Тарасова и др., 2012; Pickard et. al., 2013), особенно в биохимических исследованиях, где показана роль вторичных метаболитов в регуляторных механизмах, обеспечивающих существование симбиотического организма. Однако в работах не показана роль отдельных бионтов в реакции лишайника на факторы окружающей среды, а, следовательно, и на адаптацию лишайника как комплексного организма к этим условиям. На территории Карелии в эпилитном покрове открытых местообитаний часто встречаемыми являются виды лишайников сем. Umbilicariaceae.
Цель исследования – выявление адаптивных структурных (анатомических) и функциональных (физиологических) возможностей у лишайников Umbilicaria deusta (L.) Baumg. и U. hyperborea (Ach.) Hoffm., в скальных типах обитания на территории Карелии.
Материалы
Материалом для анатомо-физиологических исследований послужили талломы лишайников рода Umbilicaria. Род Umbilicaria представлен на территории Карелии 12 видами (Фадеева и др., 2007). В исследование были включены два вида U. deusta и U. hyperborea семейства Umbilicariaceae. Семейство Umbilicariaceae Cheval. – хорошо изолированная группа лихенизированных аскомицетов (лишайников) с неясным положением в системе. Большинство видов обитает на скалах, в основном в приполярных и горных районах России (Давыдов, 2007). Виды являются облигатными эпилитами, имеют умбиликатный таллом из класса листоватых, их морфологическая особенность – наличие гомфа (структуры нижнего корового слоя) для прикрепления к субстрату. Фототрофный бионт – зеленые одноклеточные водоросли рода Trebouxia (Purvis et al., 1992).
По сходству характера распространения видов этого семейства по биогеографическим областям Л. Г. Бязров (2013) выделил 19 групп. Виды, анализируемые в нашей работе, отнесены к разным группам в зависимости от широты распространения. Наиболее широко распространенным видом является U. hyperboreа, которая характеризуется палеарктическим, неарктическим, австралазийским и океаническим распространением. U. deusta также довольно широко распространена в пределах суши, указана в палеарктической, неарктической, неотропической и австралазийской провинциях.
Анализируемым видам свойственен широкий экологический спектр: они встречаются от сухих широколиственных субтропических лесов до тундровых сообществ высоких широт (Бязров, 2013). В связи с широкими экологическими характеристиками данные виды должны обладать структурно-функциональным разнообразием. Это положение и легло в основу нашего исследования.
Методы
Исследование проводилось на территории Карелии, в пределах Петрозаводского городского округа, на скальном выходе урочища «Чертов Стул» и на территории отработанного кварцитного карьера в п. Кварцитный, Прионежского административного района Республики Карелия (рис. 1).
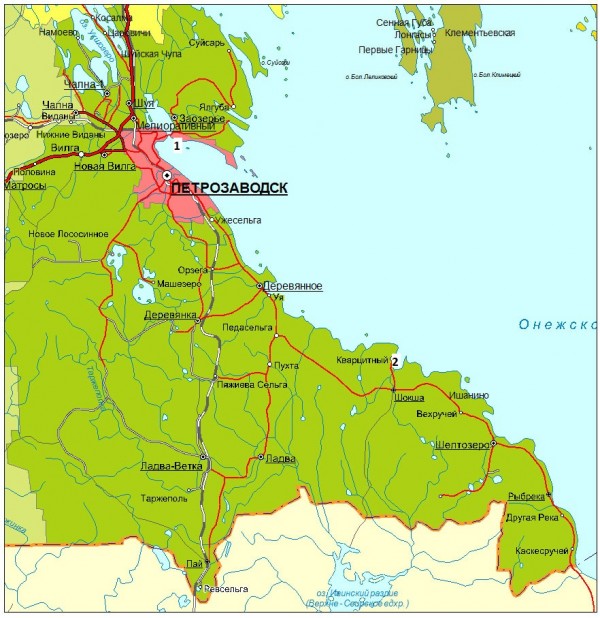
Рис. 1. Карта Республики Карелия. 1 – Ботанический сад ПетрГУ (место исследования – урочище Чертов Стул), 2 – пос. Кварцитный (место исследования – кварцитный карьер)
Fig. 1. The map of the Republic of Karelia. 1 – The Botanical garden of PetrSU (the place of studying - the Devil's Chair tract), 2 – vil. Kvartsitny (the place of studying - waste crimson quartzite quarry)
В естественных условиях обитания исследованных видов были оценены параметры среды: тип растительного сообщества, угол наклона поверхности субстрата и экспозиция склона (с помощью горного компаса). Измеренные параметры среды отражают световое довольствие местообитания.
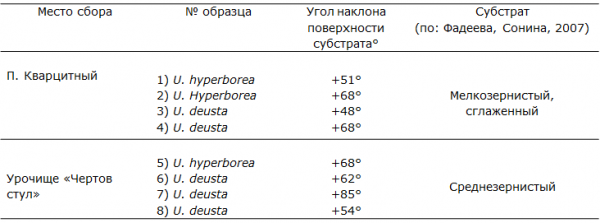
Урочище «Чертов Стул» – уникальное место выхода на дневную поверхность вулканических пород – базальтов (Куликов, Куликова, 2001), расположенное на территории ботанического сада Петрозаводского государственного университета (рис. 2). Экспозиция скального выхода - южная, скалы не затенены или слабо затенены из-за близости сосняка черничного разнотравного, сформированного на поверхности скального выхода. Участок, на котором были собраны талломы U. deusta и U. hyperborea, представляет собой открытые более или менее горизонтальные поверхности с углом наклона +51°…+68°. Виды произрастают совместно, занимая одни и те же участки скал. В данном местообитании было выделено четыре точки с 80-100% покрытием этих видов, в пределах каждой собрано по 10–20 талломов, которые представляли собой 1 образец.

Рис. 2. Общий вид урочища «Чертов Стул», Петрозаводский городской округ.
Fig. 2. General view of the Devil's Chair tract in Petrozavodsk urban district.
Вторым местом отбора образцов был заброшенный карьер в пос. Кварцитный. Добыча малинового кварцита здесь была завершена в 30-х годах XX века. Образцы собраны с более или менее горизонтальных скальных поверхностей (угол наклона от +48° до +85°) с большой давностью нарушения, на самом верху карьера, вблизи сосняка черничного зеленомошного. Скалы не затенены лесом, имеют южную экспозицию. Виды U. deusta и U. hyperborea произрастают в практически одинаковых условиях, образуя скопления талломов на одном и том же скальном выступе (рис. 3).
Отбор талломов лишайников производился в местах с высоким обилием исследованных видов (80-100 % покрытия). Талломы старались отбирать одного размера и со схожими морфологическими признаками (одного онтогенетического состояния).

Рис. 3. Общий вид кварцитного карьера, п. Кварцитный, Прионежский административный район.
Fig. 3. General view of the crimson quartzite quarry in vil. Kvartsitny of Prionezhsky region.
Всего было собрано 8 образцов талломов лишайников (в каждом по 10-20 талломов): 4 образца в кварцитном карьере (2 – U. deusta, 2 – U. hyperborea) и 4 образца в пределах урочища «Чертов Стул» (3 – U. deusta, 1 – U. hyperborea).
Местообитания талломов лишайников имеют ряд характерных особенностей (табл. 1).
Таблица 1. Параметры местообитаний исследуемых видов лишайников
В лабораторных условиях выполнено определение видов лишайников стандартными лихенологическими методами (Сонина и др., 2006), проведены анатомические и физиологические исследования. Анатомические исследования включали измерение толщины анатомических слоёв: верхнего и нижнего корового, альгального, сердцевинного, а также толщины среза. Для каждого образца измерено по 60 значений толщины каждого анатомического слоя. В общей сложности сделано более 540 срезов и 3150 измерений. Для работы были использованы бинокуляр МСП-2 и микроскоп МИКМЕД-6, измерение выполнено с помощь окуляр-микрометра.
Определение фотосинтетических пигментов выполнено методом спиртовой экстракции (Сапожников и др., 1978; Lichtenthaler, Wellburn, 1983; Maslova, Popova, 1993) спектрофотометрически (UNICO SPECTROPHOTOMETER 2800). Пигменты определяли в образцах в трехкратной биологической повторности и девятикратной химической.
Предварительный анализ распределения признаков талломов лишайников (ширины анатомических слоев) выявил отсутствие нормального распределения в отдельных сравниваемых образцах. После преобразования значений с помощью логарифмирования получено распределение признака близкое к нормальному. Анализировалось распределение логарифмов анатомических показателей талломов лишайников. В таблице 2 приведены медианы (Ме) ширины анатомических слоев в талломах лишайников и средние значения (М) логарифмов ширины слоев. Обработка данных выполнена на основе однофакторного дисперсионного, корреляционного и регрессионного анализов (Ивантер, Коросов, 2010) в среде Excel.
Результаты
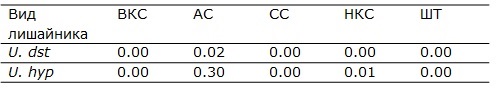
В результате проведенного исследования анатомических структур талломов отмечается значительное варьирование ширины слоёв у U. deusta в обоих местах сбора. Варьируют значения всех анатомических структур грибного компонента (образцы 3, 4, 6, 7, 8 в табл. 2, рис. 4): коровые слои и ширина сердцевины, а также в целом ширина таллома. Более узкий диапазон варьирования ширины отмечен для альгального слоя, сложенного клетками фотобионта. Если ширина слоев, сформированных грибным компонентом, изменяется в разных образцах в 1.5–3 раза, то ширина водорослевого слоя - менее, чем в 2 раза. Такой диапазон варьирования характерен для обоих мест сбора образцов: и для кварцитного карьера, и для урочища «Чертов Стул» (рис. 4).
Таблица 2. Анатомическое строение исследованных талломов лишайников*
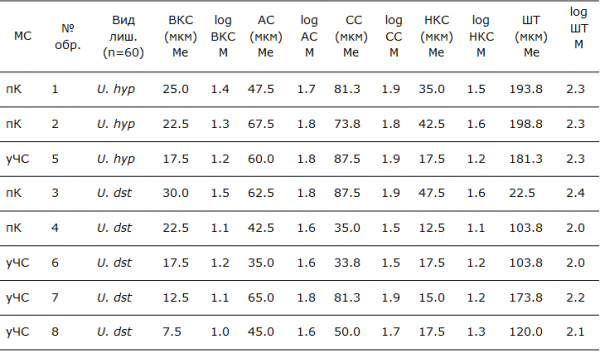 *Обозначения: МС – место сбора, пК – пос. Кварцитный, уЧС – урочище «Чертов Стул»; U. hyp – Umbilicaria hyperborea, U. dst – Umbilicaria deusta; ВКС- верхний коровый слой, АС – альгальный слой, СС – сердцевинный слой, НКС – нижний коровый слой, ШТ – ширина таллома, мкм - микрометры; М – средняя арифметическая (n=60), Ме - медиана
*Обозначения: МС – место сбора, пК – пос. Кварцитный, уЧС – урочище «Чертов Стул»; U. hyp – Umbilicaria hyperborea, U. dst – Umbilicaria deusta; ВКС- верхний коровый слой, АС – альгальный слой, СС – сердцевинный слой, НКС – нижний коровый слой, ШТ – ширина таллома, мкм - микрометры; М – средняя арифметическая (n=60), Ме - медиана
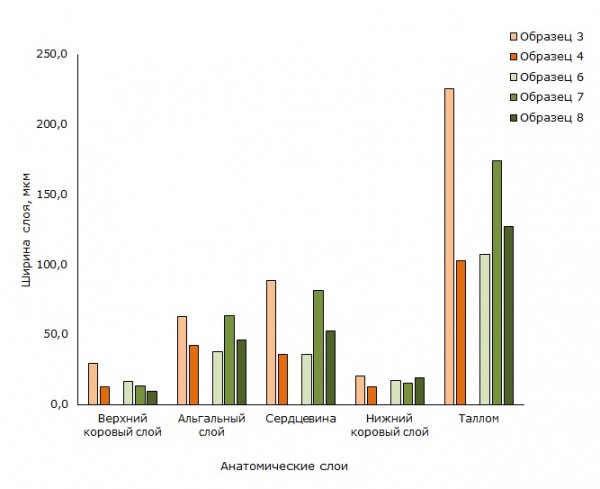
Рис. 4. Анатомические слои в талломах вида Umbilicaria deusta. Образцы 3, 4 (оранжевые столбцы) – кварцитный карьер, образцы 6, 7, 8 (зеленые столбцы) – урочище «Чертов Стул»
Fig. 4. Anatomic layers in thalli of species Umbilicaria deust. Samples 3, 4 (orange columns) - crimson quartzite quarry, samples 6, 7, 8 (green columns) - the tract "Devil's Chair"
Все выявленные различия между измеренными параметрами анатомических слоев у вида U. deusta из двух мест сбора статистически значимы (табл. 3). Также значимы различия по всем анатомическим показателям между отдельными образцами в пределах одного местообитания: между образцами (3 и 4) в кварцитном карьере и между образцами (6, 7 и 8) в урочище «Чертов Стул» (р < 0.001).
Таблица 3. Результаты дисперсионного анализа различий между образцами двух видов лишайников из разных местообитаний (приведены значения уровня значимости – р)
Анатомические показатели талломов у U. hyperborea в трех образцах (1, 2, 5) изменяются в более узком диапазоне (табл. 2, рис. 5). При сравнении талломов этого вида из двух местообитаний статистически значимо различаются показатели ширины слоев, сформированных грибным симбионтом: верхний коровый слой, сердцевина, нижний коровый слой и в целом ширина таллома (р < 0.01) (табл. 3). По значениям ширины альгального слоя между образцами U. hyperborea из двух местообитаний различий не было выявлено (р = 0.3) (табл.3). Альгальный слой во всех образцах имеет близкие значения, ширина варьирует в узком диапазоне от 54.3 до 65.8 мкм.
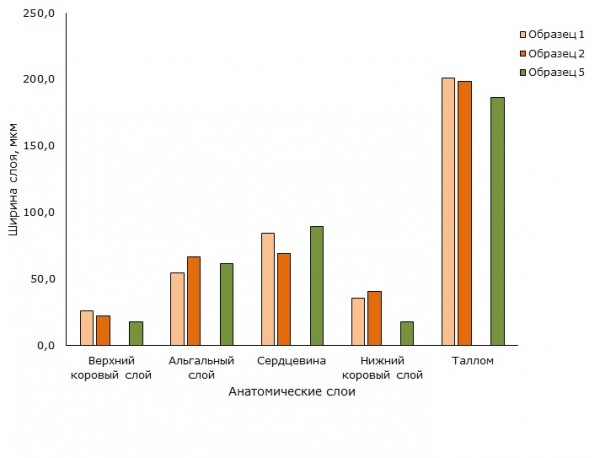
Рис. 5. Анатомические слои в образцах талломов вида Umbilicaria hyperborea. образцы 1, 2 (оранжевые столбцы) – кварцитный карьер, образец 5 (зеленый столбец) – урочище «Чертов Стул»
Fig. 5. Anatomic layers in thalli of species Umbilicaria huperborea. Samples 1, 2 (orange columns) - crimson quartzite quarry, sample 5 (green column) - the tract "Devil's Chair"
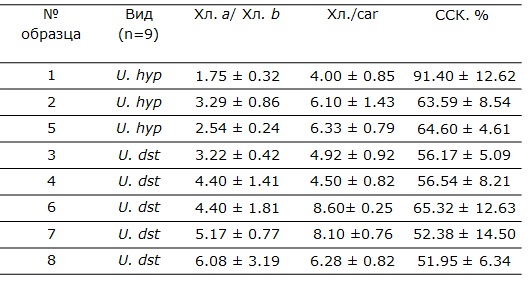
При относительной стабильности значений ширины альгального – фотосинтезирующего слоя, количественные показатели фотосинтетических пигментов именно у U. hyperborea (Хл a – основной пигмент реакционного центра, Хл b и каротиноиды – пигменты светособирающего комплекса) изменяются в достаточно широком диапазоне - в 2 раза. Объем светособирающего комплекса (ССК) изменяется в диапазоне от 65 до 91 % (табл. 4). Расчетные показатели такие, как отношение Хл а/b изменяется в 2 раза, меньше варьирует отношение каротиноидов к хлорофиллам от 4 до 6 (табл. 5).
У Umbilicaria deusta в исследованных местообитаниях значительно варьирует количество хлорофилла b, кол-во каротиноидов и отношение хлорофиллов а/b, которые изменяются в 2 и более раз, тогда как количество Хл а изменяется в образцах незначительно: от 0,26 до 0,34 мг*г-1 сух. массы. Объем светособирающего комплекса у всех образцов двух местообитаний изменяется в узком диапазоне от 52 до 56 % (табл. 4, 5).
Таблица 4. Содержание фотосинтетических пигментов в образцах талломов лишайников
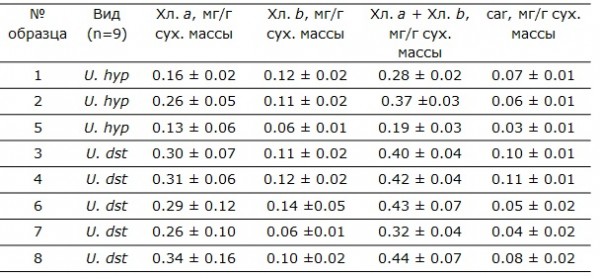
Таблица 5. Соотношения фотосинтетических пигментов в образцах талломов лишайников
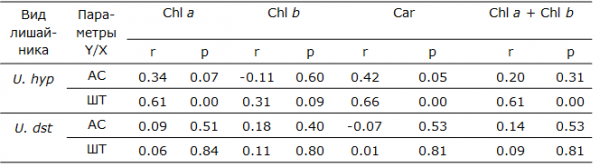
Изучение связи между параметрами фотосинтетического аппарата (содержанием фотосинтетических пигментов) и шириной анатомических слоев талломов двух видов лишайников выполнено с помощью корреляционного и регрессионного анализов. Для вида U. hyperborea установлено, что с изменением ширины альгального слоя, сложенного клетками фототрофного симбионта, значимо изменяется только содержание каротиноидов (р = 0.05) – выявлена прямая связь средней силы (r = 0.42). Тогда как, с изменением ширины таллома значимо изменяются содержание хлорофилла а, каротиноидов и сумма хлорофиллов (р < 0.001). Между этими параметрами выявлена прямая сильная связь (r = 0.6–0.7). У вида U. deusta не обнаружено зависимости между содержанием исследованных фотосинтетических пигментов и шириной как альгального слоя, так и таллома в целом (табл. 6).
Таблица 6. Результаты корреляционного и регрессионного анализа связей между шириной анатомических слоев лишайников и количественными характеристиками фотосинтетических пигментов (приведены значения коэффициента корреляции – r, уровня значимости – p)
Обсуждение
В анатомическом строении талломов лишайников с гетеромерным типом характерно четкое пространственное разделение бионтов. Грибной симбионт формирует коровые слои, контактирующие с окружающей средой, и сердцевинный слой – рыхло лежащие грибные гифы, расположенные под альгальным слоем и обеспечивающие условия газообмена для водорослевого бионта. Клетки фототрофного компонента формируют альгальный слой, лежащий между верхним коровым и сердцевинным слоями (Зенова, 1999; Тарасова и др., 2012). Многие работы указывают на то, что в отношениях между бионтами в талломе ведущая роль отводится микобионту. Известно, что микобионт контролирует рост и деятельность фотобионта, создавая для него порой дефицит питательных веществ. Специфические фенольные соединения, расположенные на стенках грибных гиф (лишайниковые кислоты), могут ингибировать рост фотобионта (Palmqvist et al., 2002) и стимулировать отток фотоассимилятов к грибу (Вайнштейн, 1990). Именно грибной компонент образует слои, контактирующие с внешней средой, тем самым создавая микроусловия для фотобионта. Это ведет к тому, что часть воды и воздуха поступают к клеткам фотобионта опосредованно, и грибной компонент способен влиять на питание фотобионта (Павлова, Маслов, 2008).
В настоящем исследовании у вида U. deusta варьируют значения всех анатомических структур как грибного компонента: коровые слои и толщина сердцевины, так и водорослевого – альгальный слой и в целом толщина таллома. Такая вариабельность микологических структур, а, кроме того, варьирование в широком диапазоне показателя – соотношение альгального слоя к толщине таллома от 1:2.5 до 1:4, который в ряде работ (Greenhalgh, Anglesea, 1979; Сонина и др., 2011) отмечается, как наиболее стабильный, может быть объяснена ведущей ролью микобионта в адаптации эпилитных лишайников к условиям среды. Так как микобионт, формируя покровы таллома, защищает фотобионт от неблагоприятных факторов среды, таких как избыточное освещение и недостаточное увлажнение, которые характерны для открытых скал, где обитают исследованные виды. Известно, что нефотосинтезирующие темные пигменты, в том числе меланин, эффективно снижают стресс фотобионта при избыточном освещении. Находясь в верхнем коровом слое, они играют роль экрана, защищая светособирающие комплексы водорослевого бионта от избытка радиации (Водоросли, 1978; Färber et al., 2014). У вида U. hyperborea значимо изменяются анатомические слои между образцами, образованные микобионтом: коровые слои, сердцевинный слой и ширина таллома, в то время как ширина альгального слоя, сложенного клетками фотобионта, значимо не различима между образцами и остается наиболее стабильной структурой в талломе симбиотического организма (табл. 3). Это еще раз подтверждает, что микобионту отводится ведущая роль в адаптации этих лишайников к условиям среды.
Хотя микобионт и играет большую роль в приспособлении вида к условиям местообитания, о чем свидетельствует и наше исследование для видов U. deusta и U. hyperborea, фотобионт может вносить свой вклад в адаптацию симбиотического организма. Так, в исследовании значительное варьирование всех показателей фотосинтетического пигментного аппарата в талломах вида U. hyperborea (табл. 4, 5.) при относительной стабильности в структуре альгального слоя указывает на важную функциональную роль фотобионта при адаптации данного вида к условиям обитания. Предположение о ведущей роли фотобионта аргументированно высказывается в ряде работ по изучению адаптаций эпилитных (Сонина. Марковская. 2013) и эпигейных (Андросова и др.. 2015) лишайников к разнообразным условиям освещенности местообитаний. В данной работе значительное варьирование количества основных пигментов фотосинтетического аппарата в образцах вида U. hyperborea и значимая связь содержания фотосинтетических пигментов со структурой таллома (ширина таллома) (табл. 6) свидетельствует об иной стратегии. В этом случае адаптивные возможности реализует фототрофный организм в талломе лишайника, он изменяется функционально для оптимального использования светового ресурса в среде. Интересно отметить прямую значимую связь между содержанием каротиноидов и шириной альгального слоя в талломах U. hyperborea (табл. 6). Функции каротиноидов, которые обладают большим разнообразием в талломах лишайников и являются компонентом светособирающего комплекса фотосинтетического аппарата, заключаются в участии в светопоглощении и защите хлорофилла реакционного центра от фотоокислительного повреждения на ярком свету (Шапиро, 2009). В данном случае с увеличением числа фотосинтезирующих клеток содержание каротиноидов значимо увеличивается, что вероятно отражает реакцию именно фототрофного компонента на условия среды. Тогда как у вида U. deusta, для которого такой связи не выявлено благоприятствование условий для функционирования фототрофного компонента достигается за счет изменения структур грибного симбионта.
Заключение
Выполненное исследование показало, что вид U. deusta проявляет морфологическую изменчивость и функциональную стабильность параметров пигментного фотосинтетического аппарата. Это свидетельствует о значительной и достаточной вариабельности микобионта для поддержания симбиотического организма в нормально функциональном состоянии: микобионт создает условия для оптимальной и относительно стабильной работы фотосинтетического аппарата альгального бионта. Для вида U. hyperborea в настоящем исследовании выявлена морфологическая и функциональная вариабельность за счет значительного варьирования анатомических структур таллома, всех показателей фотосинтетического аппарата; установлены связи между структурными и функциональными параметрами таллома.
Это дает нам основание рассматривать у исследованных видов рода Umbilicaria два пути адаптации к факторам окружающей среды, прежде всего к высокому уровню инсоляции, характерному для открытых местообитаний в условиях высоких широт. Один путь связан с изменением структуры микобионта, проявляющимся в варьировании анатомических слоев, что обеспечивает приспособление симбиотического организма к данным условиям среды. Структурный путь адаптации выявлен у вида U. deusta. Другой путь связан с варьированием, наряду со структурой микобионта, функциональной составляющей таллома (с количественными показателями фотосинтетического аппарата фотобионта) и может быть назван как структурно-функциональный. Этот путь адаптации отмечен у вида U. hyperborea, для которого приспосабливаемость к факторам среды обеспечивают оба симбионта.
Библиография
Андросова В. И., Марковская Е. Ф., Семенова Е. В. Фотосинтетические пигменты лишайников рода Cladonia скальных лесных сообществ горы Оловгора (Архангельская область) // Успехи Современного Естествознания. 2015. № 2. С. 120–125.
Бязров Л. Г. Формулы ареалов лихенизированных грибов семейства Umbilicariaceae из Монголии на основе общемировой карты экорегионов суши //Новости систематики низших растений. СПб, 2013. Т. 47. С. 179–199.
Вайнштейн Е. А. Регуляторные механизмы лишайникового симбиоза // Успехи совр. биол. 1990. Т. 109. Вып. 2. С. 311–320.
Водоросли, лишайники и мохообразные СССР / Под ред. Л. В. Гарибова, Ю. К. Дундин, Т.Ф. Коптяева и др. М., 1978. С. 366
Давыдов Е. А. Систематика и филогения лишайников семейства Umbilicariaceae. I. Обзор существующих систем // IV Международная научно-практическая конференция: Проблемы ботаники Южной Сибири и Монголии. Барнаул, 2007. С. 287–289.
Зенова Г. М. Лишайники. Биология // Соросовский образовательный журнал . 1999. № 8. C. 30–34 .
Ивантер Э.В., Коросов А.В. Элементарная биометрия . Петрозаводск: Изд-во ПетрГУ, 2010. 104 с.
Куликов В. С., Куликова В. В. Докембрийская геология территории Ботанического сада // Hortus Botanicus, 2001. № 1. С. 19–24.
Павлова Е. А., Маслов А. И. Поглощение нитрата бионтами, выделенными из лишайника Parmelia sulcata // Институт фундаментальных проблем биологии Российской академии наук Пущино, 2008. Т. 55. № 4. С. 529–534.
Сапожников Д. И., Маслова Т. Г., Попова О. Ф. и др. Метод фиксации и хранения листьев для количественного определения пигментов пластид // Ботан. журн. 1978. Т. 63. № 11. С. 1586–1592.
Сонина А. В., Марковская Е. Ф., Урбанавичене И. Н., Ханин В. А. Видовой состав эпилитных лишайников и некоторые экологические особенности Lecanora intricata (Ach.) Ach. и Lecanora polytropa (Ehrh. ex Hoffm.) Rabenh. в условиях Мурманского побережья Баренцева моря // Естественные и технические науки. М.: Изд-во «Спутник», 2011. № 3. С. 114–121.
Сонина А. В., Марковская Е. Ф. Видовое разнообразие прибрежных эпилитных лишайников и эколого-физиологические особенности отдельных видов в условиях острова Большого Соловецкого (Архангельская область) // Фундаментальные исследования. 2013. № 10
(ч. 6). С. 1275–1279.
Сонина А. В., Степанова В. И., Тарасова В. Н. Лишайники: Учеб. пособие. Ч. I: Морфология, анатомия, систематика. Петрозаводск: Изд-во ПетрГУ, 2006. 216 с.
Тарасова В. Н., Сонина А. В., Андросова В. И. Лишайники: физиология, экология, лихеноиндикация. Часть 2. Учебное пособие. Петрозаводск: Изд-во ПетрГУ, 2012. 296 с.
Фадеева М. А., Голубкова Н. С., Витикайнен О., Ахти Т. Конспект лишайников и лихенофильных грибов Республики Карелия. Петрозаводск: Карельский НЦРАН, 2007. 192 с.
Шапиро И. А. Эколого-физиологические особенности газообмена у лишайников // Успехи современной биологии. 2009. Т. 129. № 4. С. 392–398.
Färber L., Solhaug K., Esseen P., Bilger W., Gauslaa Y. Sunscreening fungal pigments influence the vertical gradient of pendulous lichens in boreal forest canopies // Ecology. 2014. Vol. 95. № 6. Р.1464–1471.
Gorbushina A., Beck A., Schulte A. Microcolonial rock inhabiting fungi and lichen photobionts: evidence for mutualistic interactions // Mycological Research. 2005. Vol. 109/ № 11. Р.1288–1296.
Greenhalgh G., Anglesea D. The Distribution of Algal Cells in Lichen Thalli. LIC, 1979. Vol. 11. № 3. 283 р.
Lichtenthaler H. K., Wellburn A. R. Determination of total carotenoids and chlorophylls a and b of leaves extracts in different solvents // Biochem. Soc. Trans. 1983. Vol. 11. № 5. P. 59–92.
Lutzoni F., Miadlikowska J. Lichens // Current Biology. 2009. Vol. 19. № 13. P. 502–503.
Maslova T. G., Popova I. A. Adaptive properties of the plant pigment systems // Photosynthetica. 1993. Vol. 29. N 2. P. 195-203.
Palmqvist K., Dahlman L., Valladares F., Tehler A., Sancho L. G., Mattsson J.-E. CO2 exchange and thallus nitrogen across 75 contrasting lichen associations from different climate zones // Oecologia. 2002. Vol. 133. P. 295–306.
Picard K., Letcher P., Powell M. Evidence for a facultative mutualist nutritional relationship between the green coccoid alga Bracteacoccus sp. (Chlorophyceae) and the zoosporic fungus Rhizidium phycophilum (Chytridiomycota) // Fungal Biology. 2013. Vol. 117. № 5. P. 319–328.
Purvis O. W. Coppins B. J., Hawksworth D. L., James P. W., Moore D. M. The Lichen flora of Great Britain and Ireland. London: Natural History Museum Publications in association with the British Lichen Society. 1992. P. 710.
Благодарности
Работа выполнена при финансовой поддержке Программы стратегического развития ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской (или образовательной) деятельности на 2012-2016 гг.
Авторы выражают благодарность за консультации профессору Е. Ф. Марковской и за предоставление иллюстративного материала М. А. Шредерс и А. Пахоменко.






 © 2011 - 2026
© 2011 - 2026