Введение
Голарктический вид Calodium hepaticum (Bancroft 1893) Moravec 1982 (син.: Capillaria hepatica, Hepaticola hepatica) – паразит с прямым циклом развития и широким кругом хозяев (Spratt, Singleton, 2001; Fuehrer, 2014). В организме дефинитивного хозяина личинки достигают половозрелости через три недели. Самки откладывают яйца в соединительную ткань печени, хищники, поедая зараженных грызунов, рассеивают яйца со своими экскрементами. Во внешней среде яйца могут оставаться жизнеспособными несколько лет (Spratt, Singleton, 2001). Роль депонирующих хозяев могут выполнять дождевые черви и некоторые жесткокрылые (некрофаги), в пищеварительном тракте которых яйца развиваются и достигают инвазионности за 26–30 дней (Ромашов, 1983).
В Карелии C. hepaticum регистрировался в 1960-х гг. у водяной полевки (Мозговой и др., 1966), в настоящее время этот вид распространен в районе Кижского архипелага, при этом на некоторых небольших островах зараженность полевок составляла более 50 % с высокой интенсивностью инвазии (Бугмырин и др., 2015). Сходная ситуация – гиперинвазия островных популяций мелких млекопитающих – ранее отмечалась и другими исследователями (Herman, 1981; Resendes et al., 2009). Специфика ситуации, наблюдаемой в Карелии, заключается в локальном распространении этой нематоды, когда вид отсутствует в регионе, но при этом многочислен в островных биоценозах.
Цель работы – изучение особенностей распространения C. hepaticum и поиск факторов, определяющих высокую зараженность островных популяций мышевидных грызунов.
Материалы
Материал собран в августе 2005–2007, 2012–2014 гг. Мелкие млекопитающие были отловлены на 18 островах и материковой части (д. Подъельники) Кижского шхерного района (рис. 1). Методом неполного гельминтологического вскрытия обследовано 346 особей мышевидных грызунов, относящихся к двум видам – рыжая полевка Myodes glareolus Schreber 1780 (301 экз.) и темная полевка Microtus agrestis Linnaeus 1761 (45 экз.). Количество учтенных нематод C. hepaticum составило 334 экз.
Методы
При сборе и обработке материала применяли стандартные зоологические и паразитологические методики (Коросов, 1994; Аниканова и др., 2007).
Отловы мелких млекопитающих на каждом острове выполнялись ловушками Геро, выставленными в линию по 25–100 шт. на 1–4 суток. Кратность отловов на каждом острове различалась: от однократных (в какой-то один год) до шестикратных (в каждый год исследования).
По степени развития генеративной системы выделяли 2 класса зрелости рыжей полевки: молодые и взрослые животные. Молодые (неполовозрелые) самки имеют нитевидную матку, влагалище – без пробки; у самцов – мелкие семенники (3 мм) и придатки (1 мм). У взрослых (половозрелых) самок матка утолщена, во влагалище после оплодотворения появляется хрящевая пробка, на поздних стадиях беременности видны эмбрионы, у рожавших на рогах матки остаются плацентарные пятна. У самцов увеличиваются семенники (11–12 мм) (Коросов, 1994).
Основной объем работы по определению и подсчету C. hepaticum выполнялся в полевых условиях. Печень мелких млекопитающих просматривалась компрессорным методом, с использованием стереомикроскопа (увеличение 14х). Заключение о заражении грызунов нематодами делалось по наличию в паренхиме печени взрослых червей (их останков) и (или) яиц. Количество нематод в одной печени, в большинстве случаев, – число локальных (от разных самок) «кладок». Живые нематоды отмечались единично, фиксировались в 70° спирте, последующее видовое определение (Рыжиков и др., 1976) выполнялось в лаборатории после изготовления временных глицериновых препаратов.
Для оценки относительной численности паразитов рассчитывались следующие показатели: экстенсивность инвазии (ЭИ, %), индекс обилия (ИО, экз.), интенсивность инвазии (ИИ, экз.), отношение дисперсии к индексу обилия (степень агрегированности), константа негативно биномиального распределения (k) и вероятность согласования наблюдаемого распределения с моделью негативного бинома (p) (Аниканова и др., 2007). Расчеты всех показателей заражения и их сравнение проводились в программе Quantitative Parasitology 3.0 (Rozsa et al., 2000).
При изучении распространения нематод по островам применяли однофакторный дисперсионный анализ, корреляционный анализ (коэффициенты Пирсона и Спирмена) и множественную регрессию (Коросов, Горбач, 2010). В анализ брались по 11 характеристик для каждого острова (табл. 1): наличие нематод (1 или 0) в островной популяции мышевидных грызунов; экстенсивность инвазии; индекс обилия; наличие личинок цестод (0 или 1) как показатель присутствия хищных животных (диссеминаторов) на острове; общее количество обнаруженных видов гельминтов; логарифм площади острова (га); изолированность (минимальное расстояние (в км) до материка или крупного острова Б. Леликовский или Клименецкий); число вскрытых и средний вес рыжих полевок; относительная численность рыжей полевки и мелких млекопитающих.
Исследования проводились c использованием оборудования «Центра коллективного пользования научным оборудованием ИБ КарНЦ РАН».
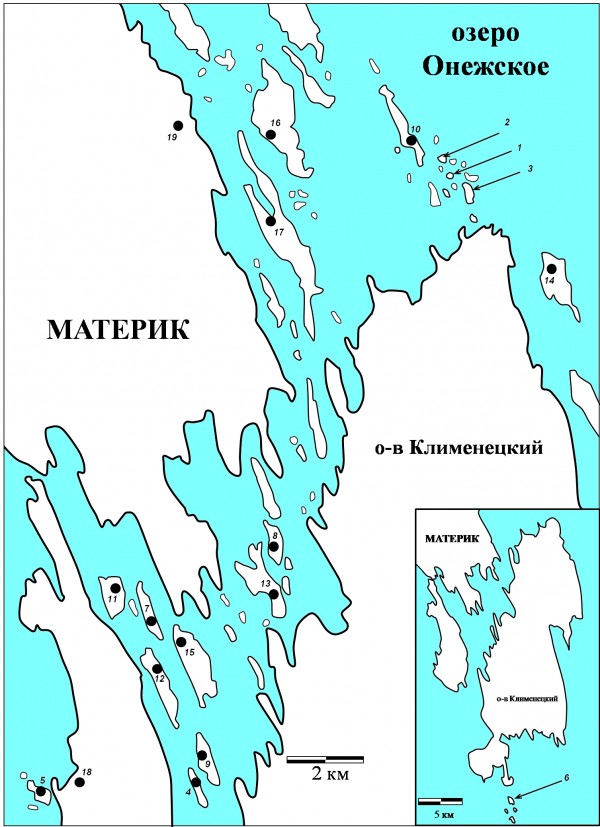
Рис. 1. Карта-схема района исследования: 1. Грибной, 2. Сато, 3. Яблонь, 4. Куйвохда, 5. Ламбинский, 6. Лесной, 7. Мяль, 8. Карельский, 9. Людской, 10. Долгий, 11. Колгов, 12. М. Леликовский, 13. Букольников, 14. С. Олений, 15. Ерницкий, 16. Волков, 17. Кижи, 18. Б. Леликовский, 19. Подъельники
Fig. 1. The map of the studied region.
Таблица 1. Характеристики изучаемых островов*
Table 1. Characteristics of the studied islands*
| Остров | Ct | Sp | lg S | Isol | N Mgl | W | числ. Mgl | числ. мм |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Б. Леликовский | 0 | 3 | 3.26 | 0 | 19 | 20.2 | 9.5 | 18.5 |
| Букольников | 0 | 2 | 1.81 | 0.4 | 5 | 16.9 | 2.5 | 11.5 |
| Волков | 0 | 1 | 2.3 | 1.3 | 1 | 24 | 0.8 | 0.8 |
| Грибной | 1 | 5 | 0.3 | 1.4 | 21 | 18.9 | 14 | 19.3 |
| Долгий | 1 | 5 | 1.63 | 2 | 11 | 25.1 | 2.2 | 2.6 |
| Ерницкий | 0 | 2 | 2.01 | 0.2 | 10 | 18 | 2 | 5.6 |
| Карельский | 0 | 6 | 1.5 | 0.8 | 19 | 17.6 | 9.5 | 15.5 |
| Кижи | 0 | 2 | 2.31 | 0.6 | 4 | 19 | 0.3 | 0.9 |
| Колгов | 0 | 1 | 1.69 | 0.3 | 5 | 23.2 | 2.5 | 8.5 |
| Куйвохда | 0 | 8 | 1.18 | 0.5 | 98 | 17.4 | 32.7 | 42 |
| Ламбинский | 0 | 0 | 1.18 | 0.1 | 1 | 17 | 0.5 | 9 |
| Лесной | 0 | 1 | 1.18 | 1.3 | 13 | 20.4 | 3.7 | 4.3 |
| Людской | 0 | 0 | 1.6 | 0.4 | 2 | 28 | 0.8 | 1.6 |
| М. Леликовский | 0 | 1 | 1.76 | 0.1 | 33 | 17.8 | 7.8 | 15.1 |
| Мяль | 0 | 1 | 1.49 | 0.5 | 18 | 23.8 | 4.1 | 8.4 |
| Подъельники | 1 | 10 | 3.3 | 0 | 21 | 18.6 | 7.1 | 10.9 |
| С. Олений | 0 | 3 | 1.87 | 0.7 | 7 | 25.7 | 2.3 | 5.7 |
| Сато | 0 | 4 | 0.38 | 1.8 | 4 | 24.6 | 3.2 | 5.6 |
| Яблонь | 0 | 1 | 0.59 | 1.1 | 9 | 24 | 6 | 6 |
* – значения экстенсивности инвазии и индекса обилия C. hepaticum приведены таблице 3. Ct – наличие личинок цестод; Sp – общее количество обнаруженных видов гельминтов; lg S – логарифм площади острова (га); Isol – изолированность (минимальное расстояние (в км) до материка или крупного острова); N Mgl – число вскрытых рыжих полевок; W – средний вес рыжих полевок (гр); числ. Mgl – относительная численность рыжей полевки; числ. мм – относительная численность мелких млекопитающих (экз. на 100 ловушко-суток).
* Values of prevalence and abundance of C. hepaticum are shown in Table 3. Note: 1 – presence of larval cestodes; 2 – total number of detected helminth species ; 3 – logarithm of the island area (ha); 4 – isolation ( minimum distance (km) to the mainland or large island); 5 – number of bank voles; 6 – mean weight of bank voles (c); 7 – relative abundance of bank vole; 8 – relative abundance of small mammals (spm. per 100 trap-days).
Результаты
Распределение Calodium hepaticum в популяции хозяина
Нематоды C. hepaticum были отмечены у двух видов мышевидных грызунов рыжей и темной полевки. Показатели заражения для каждого вида хозяина приведены в табл. 2. Значения индекса обилия, экстенсивности и интенсивности инвазии C. hepaticum выше у рыжей полевки, вместе с тем значимые различия (р ≤ 0.05) получены только при сравнении индексов обилия. Распределение нематод в популяции обоих видов носит выраженный агрегированный характер (низкие значения константы k) и согласуется с моделью негативного биномиального распределения (табл. 2).
Анализ зависимости численности нематоды от степени зрелости рыжей полевки показал, что наибольшая зараженность характерна для половозрелых особей (см. табл. 2). Эта тенденция прослеживается как у самцов, так и у самок. Во всех случаях различия экстенсивности инвазии, интенсивности и индекса обилия значимы (p ≤ 0.05). Степень агрегированности нематод (отношение дисперсии к средней численности) у неполовозрелых особей низкая вследствие отсутствия гиперинвазий, а распределение не согласуется с моделью негативного бинома. Низкая зараженность молодых животных по сравнению со зрелыми отмечается и при анализе полевок разного веса (рис. 2). Все наблюдаемые различия зараженности между самками и самцами рыжей полевки разных возрастных/весовых групп были незначимыми.
Таблица 2. Показатели встречаемости и относительной численности Calodium hepaticum в популяциях 2 видов полевок
Table 2. Parameters of the prevalence and abundance of Calodium hepaticum in the populations of 2 species of voles
| N | ЭИ, %
[I ЭИ] |
ИО, экз
[I ИО] |
ИИ, экз
[I ИИ] |
Дис/ИО | k | p | |
| хозяева | |||||||
| рыжая полевка | 301 | 16.6 [13–21] | 1.1 [0.7–1.5] | 6.4 [4.9–8.4] | 12.3 | 0.06 | * |
| темная полевка | 45 | 11.1 [4–24] | 0.3 [0.04–1.1] | 2.6 [1–4.2] | 6.4 | 0.07 | * |
| половозрастные группы рыжей полевки | |||||||
| ювенильные самцы | 81 | 11.1 [5.7–20.2] | 0.21 [0.09-0.38] | 1.9 [1.2-2.3] | 2.1 | - | ns |
| ювенильные самки | 62 | 6.5 [2.2-15.9] | 0.21 [0.06-0.48] | 3.2 [1-4] | 3.6 | - | ns |
| зрелые самцы | 27 | 41 [23–60] | 3.7 [1.8 –7] | 9.2 [5.3 – 15] | 11.4 | 0.18 | ** |
| зрелые самки | 76 | 33 [23– 44] | 2.5 [1.5– 3.9] | 7.6 [5.2–10.6] | 12.4 | 0.14 | * |
Примечание. N – объем анализируемой выборки хозяев; ЭИ – экстенсивность инвазии, ИО – индекс обилия, I – доверительный интервал 95 %; Дис/ИО – отношение дисперсии и индекса обилия; k – константа НБ распределения; р – уровень значимости НБ распределения (ns – не согласуется с НБР (p < 0.05); * – 0.05 ≤ p < 0.25; ** – 0.25 ≤ p < 0.75).
Note: N – host sample size; ЭИ – prevalence, ИО – abundance, I – 95 % confidence interval; Дис/ИО – Variance/Abundance ratio; р – NB distribution significance level (ns – is inconsistent with NBD (p < 0.05); * – 0.05 ≤ p< 0.25; ** – 0.25 ≤ p < 0.75); k – NB distribution constant.
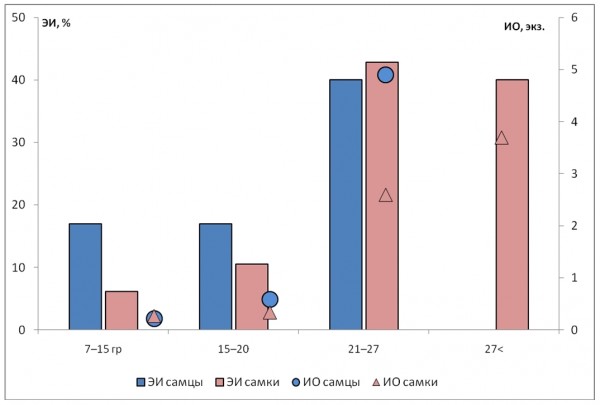
Рис. 2. Зараженность C. hepaticum самцов и самок рыжей полевки разных весовых групп
Fig. 2. Prevalence and abundance of C. hepaticum in male and female bank voles of different weight
Распределение Calodium hepaticum по островам
Из 19 мест (18 островов и материк), где проводились отловы мелких млекопитающих, C. hepaticum была отмечена в 12 (табл. 3). Наиболее высокие значения экстенсивности инвазии и индекса обилия из островов, где выборка животных была более 15 особей, наблюдались на о. Грибной (ЭИ = 57 %; ИО = 2.7) и о. Мяль (44 %; ИО = 5.8). Только в двух случаях распределение паразитов согласовывалось с моделью негативного бинома.
Таблица 3. Встречаемость C. hepaticum на разных островах
Table 3. Prevalence and abundance of C. hepaticum in small rodent populations from 18 islands and the mainland (№ 19)
| № | Название острова | S, га | Вскрыто грызунов n | C. hepaticum | |||
| ЭИ, % | ИО | k | p | ||||
| 1 | Грибной | 2 | 21 | 57 | 2.7 | 0.46 | ** |
| 2 | Сато | 2.4 | 4 | 50 | 0.8 | - | - |
| 3 | Яблонь | 3.9 | 9 | 0 | 0 | - | - |
| 4 | Куйвохда | 15 | 99 | 5 | 0.1 | - | - |
| 5 | Ламбинский | 15 | 9 | 0 | 0 | - | - |
| 6 | Лесной | 15 | 14 | 0 | 0 | - | - |
| 7 | Мяль | 31 | 18 | 44 | 5.8 | - | ns |
| 8 | Карельский | 32 | 24 | 12 | 0.1 | - | ns |
| 9 | Людской | 40 | 2 | 0 | 0 | - | - |
| 10 | Долгий | 43 | 11 | 64 | 4.9 | - | - |
| 11 | Колгов | 49 | 6 | 0 | 0 | - | - |
| 12 | М. Леликовский | 57 | 48 | 17 | 1.0 | 0.07 | *** |
| 13 | Букольников | 65 | 10 | 30 | 0.3 | - | - |
| 14 | С. Олений | 74 | 7 | 14 | 0.3 | - | - |
| 15 | Ерницкий | 102 | 10 | 0 | 0 | - | - |
| 16 | Волков | 198 | 1 | 100 | 5.0 | - | - |
| 17 | Кижи | 203 | 6 | 67 | 4.7 | - | - |
| 18 | Б. Леликовский | 1800 | 21 | 0 | 0 | - | - |
| 19 | Подъельники | > | 22 | 5 | 0.7 | - | - |
Примечание. № – соответствует обозначению на рис. 1; S – площадь острова (га); ЭИ, % – экстенсивность инвазии; ИО – индекс обилия; k – константа НБ распределения; р – уровень значимости НБ распределения (- – недостаточно данных для расчетов; ns – не согласуется с НБ распределением (p < 0.05); ** – 0.25 ≤ p < 0.75; *** – p ≥ 0.75).
Note: № of notation corresponds to Fig. 1; S – area of the island (ha); n – host sample size; ЭИ, % – prevalence, ИО – abundance, k – NB distribution constant; p – significance level of NB distribution (- – not enough data for calculations; ns – not consistent with the negative binomial distribution (p < 0.05); ** – 0.25 ≤ p < 0.75; *** – p ≥ 0.75).
Значимые положительные коэффициенты корреляции (Спирмена и Пирсона) между показателями численности нематод и выбранными характеристиками островов (из табл. 1) получены для пар «Экстенсивность инвазии – изолированность» (минимальное расстояние до материка) и «наличие нематод – количество обнаруженных видов гельминтов» (табл. 4).
Многофакторный регрессионный анализ (множественная регрессия) зависимости численности нематод (зависимыми переменными брались присутствие нематод, экстенсивность инвазии или индекс обилия) от характеристик острова не выявил значимых регрессионных связей (коэффициент детерминации регрессионного уравнения R2 < 0.3, а коэффициенты регрессии факторов не значимы (p >>> 0.05)).
По результатам однофакторного дисперсионного анализа (табл. 5) определенное влияние на экстенсивность инвазии и индекс обилия нематод оказывает площадь острова (lgS). Действие остальных характеристик на численность нематод не выявлено (p ≥ 0.05).
Таблица 4. Значения коэффициентов корреляции Пирсона (верху справа) и Спирмена (внизу слева)
Table 4. Pearson correlation coefficients (top right) and Spearman (bottom left)
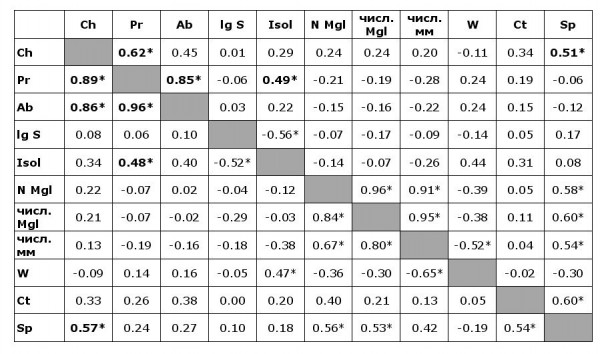
Примечание. * – значимые корреляции (p < 0.05); Ch – наличие C. hepaticum на острове, Pr – экстенсивность инвазии C. hepaticum, Ab – индекс обилия C. hepaticum. Остальные обозначение − как в табл. 1.
Note: * – significant correlations (p < 0.05); Ch – presence of C. hepaticum on the island, Pr – prevalence of C. hepaticum, Ab – abundance of C. hepaticum. The rest of the notations as in Table 1.
Таблица 5. Результаты однофакторного дисперсионного анализа
Table 5. Results of single-factor analysis of variance
| SS | df | MS | F | P-значение | |
| ЭИ – lgS | |||||
| Между группами | 20807.1 | 16 | 1300.45 | 156 | 0.0064 |
| Внутри групп | 16.7 | 2 | 8.3 | ||
| Итого | 20823.8 | 18 | |||
| ИО – lgS | |||||
| Между группами | 163.08 | 16 | 10.2 | 3058 | 0.0003 |
| Внутри групп | 0.006 | 2 | 0.003 | ||
| Итого | 163.086 | 18 |
Обсуждение
Основной результат работы – обнаружение высокой численности C. hepaticum (максимальные значения для Европейского Севера) и широкого распространения этого вида в островных популяциях мышевидных грызунов.
На исследованной территории первостепенным хозяином нематод служит массовый вид мелких млекопитающих рыжая полевка. По величине экстенсивности инвазии, составившей около 17 %, C. hepaticum является самым многочисленным в компонентном гельминтогостальном сообществе Myodes glareolus в Кижском шхерном районе (Бугмырин и др., 2015). Именно полигостальность этих нематод (отсутствие узкой хозяинной специфичности) при наличие благоприятных абиотических условий позволяет паразиту постоянно поддерживать свою высокую численность за счет самого многочисленного хозяина в конкретном регионе и временном периоде (Ромашова, 2003; Чечулин и др., 2011).
Агрегированный тип распределения C. hepaticum в популяциях рыжей и темной полевок и согласование с моделью негативного биномиального – типично для большинства паразитов и свидетельствует о стабильности паразито-хозяинных отношений (Павлов, Иешко, 1986; Иешко и др., 2009). В этом случае большая часть животных имеют небольшое число паразитов, а единичные особи имеют высокую зараженность. Ведущими механизмами, формирующими агрегированное распределение, можно назвать гетерогенность хозяев по восприимчивости к заражению и мозаичность нахождения инвазий во внешней среде.
Отчасти одним из таких фактор может быть возраст животного. В нашем исследовании показано значительное увеличение зараженности с возрастом рыжей полевки, когда наибольшую паразитарную нагрузку несут половозрелые самцы и самки, а встречаемость нематод у молодых животных носит случайный характер. Мы не располагаем данными, чтобы разбить группу половозрелых животных на зимовавших и прибылых и сравнить их зараженность. По аналогии с имеющимися сведениями по Карелии (Ивантер, 1975) можно утверждать, что значительное большинство половозрелых полевок в наших сборах − это животные первого помета текущего года, родившиеся в конце весны − начале лета. По-видимому, в этот период преимущественно происходит заражение C. hepaticum и основные предпосылки для этого – бедная кормовая база, преобладание животного корма (дождевые черви, жесткокрылые), каннибализм (массовая гибель в зимний период). Отсутствие связи экстенсивности и интенсивности инвазии нематод с полом животного позволяет говорить, что имеющиеся различия самцов и самок рыжей полевки (в двигательной активности, иммунореактивности, поведении и др.) не становятся решающими факторами, влияющими на зараженность C. hepaticum. Положительные возрастные тренды интенсивности инвазии C. hepaticum и отсутствие связи с полом животного ранее были показаны для разных видов хозяев (Herman, 1981; Childs et al., 1988; Ромашова, 2003; Чечулин и др., 2011).
Наблюдаемая картина – распространение C. hepaticum в островных биоценозах, вроде бы, логичная и предсказуемая. Перед нами типичные изолированные популяции животных, что предполагает преимущественное заражение паразитами с простым циклом развития. Однако возникает вопрос – почему именно этот вид получил такие преференции, а не другие более многочисленные в Карелии типичные паразиты рыжей полевки (например, нематоды сем. Heligmosomidae)?
Сходная ситуация – высокая численность C. hepaticum − была отмечена на оз. Мичиган, где на отдельных островах зараженность грызунов достигала 100 %, в то время как на материке встречаемость нематоды была невысокой (Herman, 1981). В качестве ведущего фактора называется возросший уровень каннибализма в изолированных популяциях оленьего хомячка Peromyscus maniculatus, приводящий к поддержанию высоких значений инвазий (Herman, 1981). О высоком адаптивном потенциале C. hepaticum к длительному существованию в изолированных популяциях свидетельствуют и данные о зараженности животных в зоопарках (Redrobe et al., 2005) и городах (Childs et al., 1988). Во втором случае было показано, что крысы, отловленные в жилых помещениях, имели более высокий уровень экстенсивности и интенсивности инвазии по сравнению с крысами из парков и скверов.
Важную роль в рассеивании яиц C. hepaticum и агрегации инвазионного начала во внешней среде играют хищники. В некоторых случаях именно с ними связывают широкое распространение C. hepaticum в природных популяциях мелких грызунов (Spratt, Singleton, 2001). Специальные исследования по изучению численности хищных млекопитающих в районе Кижского архипелага не проводились, вместе с тем одним из показателей их присутствия на острове можно считать встречаемость у грызунов личинок цестод сем. Taeniidae. По результатам корреляционного и дисперсионного анализов связь между зараженностью полевок личинками цестод и нематодами не выявлена.
Одним из ключевых факторов непрерывной циркуляции паразитов является численность хозяина. Возможно, высокая (по сравнению с материком) плотность популяции грызунов, периодически отмечаемая на небольших островах Кижского архипелага (Коросов, 2005), создает благоприятные условия для поддержания локальной численности C. hepaticum и распространения нематод на соседние биотопы (пассивный перенос яиц с водой между островами).
Вместе с тем решающим фактором существования этого вида в условиях Карелии, по-видимому, выступает абиотический. Гигротермический режим, необходимый для сохранения яиц, складывается только в хорошо увлажненных прибрежных биотопах. Выраженный гигрофильный преферендум биотопического распределения C. hepaticum отмечался и в других географических частях ареала (Canning et al., 1973; Singleton et al., 1991; Resendes et al., 2009; Чечулин и др., 2011). По нашим данным, косвенно это может подтверждаться результатами проведенного дисперсионного анализа, выявившими зависимость численности нематод от площади острова, а отсутствие значимых регрессионных связей рассмотренных характеристик островов и численности нематод может быть следствием равновероятной возможности существования C. hepaticum на любом из них.
Заключение
Ключевыми факторами в поддержании высокой численности C. hepaticum в островных экосистемах севера могут быть:
1) благоприятный гидротермический режим почвы береговой (прибрежной) зоны;
2) возможность пассивного переноса между островами;
3) возможность длительного существования вне организма хозяина (яйцо во внешней среде может сохранять инвазивность до трех лет);
4) каннибализм как основной путь циркуляции инвазии в изолированных популяциях.
Библиография
Аниканова В. С., Бугмырин С. В., Иешко Е. П. Методы сбора и изучения гельминтов мелких млекопитающих: Учебное пособие . Петрозаводск: КарНЦ РАН, 2007. 145 с.
Бугмырин С. В., Коросов А. В., Беспятова Л. А., Иешко Е. П. Гельминтофауна рыжей полевки Myodes glareolus (Schreber, 1780) Кижского архипелага // Паразитология. 2015. Т. 49. № 1. C. 61–71.
Ивантер Э. В. Популяционная экология мелких млекопитающих таежного Северо-Запада СССР . Л.: Наука, 1975. 240 с.
Иешко Е. П., Бугмырин С. В., Аниканова В. С., Павлов Ю. Л. Особенности динамики и распределения численности паразитов мелких млекопитающих // Труды Зоологического института РАН. 2009. Т. 313. № 3. C. 319–328.
Коросов А. В. Организация летней практики по зоологии позвоночных животных : Учебное пособие. Петрозаводск, 1994. 67 с.
Коросов А. В. Островное население мелких млекопитающих // 10 лет экологическому мониторингу музея-заповедника «Кижи». Итоги, проблемы, перспективы (материалы научно-практического семинара). Петрозаводск: Карельский научный центр РАН, 2005. C. 141–147.
Коросов А. В., Горбач В. В. Компьютерная обработка биологических данных : Методическое пособие. Петрозаводск: Изд-во ПетрГУ, 2010. 84 с.
Мозговой А. А., Семенова М. К., Мищенко Р. И., Цыбатова С. В. К гельминтофауне грызунов и зайцев Карелии // Труды ГЕЛАН АН СССР. 1966. Т. 17. С. 95–103.
Павлов Ю. Л., Иешко Е. П. Модель распределения численности паразитов // Доклады академии наук СССР. 1986. Т. 289. С. 746–748.
Ромашов Б. В. Особенности жизненного цикла Hepaticola hepatica (Nematoda, Capillariidae) // Паразитологические исследования в заповедниках: Сб. тр. М.: ЦНИЛ Главохоты, 1983. С. 49–58.
Ромашова Н. Б. Экология и биоразнообразие гельминтов мышевидных грызунов в условиях островных лесов Центрального Черноземья : Автореф. дисс. ... канд. биол. наук. Воронеж, 2003. 23 с.
Рыжиков К. М., Гвоздев Е. В., Токобаев М. М., Шалдыбин Л. С., Мацаберидзе Г. В., Меркушева И. В., Надточий Е. В., Хохлова И. Г., Шарпило Л. Д. Определитель гельминтов грызунов фауны СССР. Нематоды и акантоцефалы . М.: Наука, 1979. 272 с.
Чечулин А. И., Карпенко С. В., Панов В. В. Экологические особенности заражения нематодой Hepaticola hepatica (Bancroft, 1893), Hall, 1916 (Nematoda, Capillariidae) грызунов юга Западной Сибири // Сибирский экологический журнал. 2011. Т. 18. № 4. С. 563–569.
Canning E. U., Cox F. E. G., Croll N. A., LyonsK. M. The natural history of Slapton Ley Nature Reserve: VI studies on the parasites // Field Studies. 1973. Vol. 3. № 5. P. 681–718.
Childs J. E., Glass G. E., Korch G. W. The comparative epizootiology of Capillaria hepatica (Nematoda) in urban rodents from different habitats ofBaltimore,Maryland // Canadian Journal of Zoology. 1988. Vol. 66. № 12. P. 2769-2775.
Fuehrer H.-P. An overview of the host spectrumand distribution of Calodium hepaticum (syn. Capillaria hepatica): part 1 – Muroidea // Parasitology Research. 2014. Vol. 113. № 2. P. 619–640.
Herman T. B. Capillaria hepatica (Nematoda) in insular population of the deer mouse Peromyscus maniculatus: cannibalism or competition for carcasses? // Canadian Journal of Zoology. 1981. Vol. 59. № 5. P. 776–784.
Redrobe S. P., Patterson-Kane J. C. Calodium hepaticum (syn. Capillaria hepatica) in Captive Rodents in a Zoological Garden // Journal of Comparative Pathology. 2005. Vol. 133. № 1. P. 73–76
Resendes A. R., Amaral A. F. S., Rodrigues A., Almeria S. Prevalence of Calodium hepaticum (Syn. Capillaria hepatica) in house mice (Mus musculus) in the Azores archipelago // Veterinary Parasitology. 2009. Vol. 160. № 3−4. P. 340–343.
Rozsa L., Reiczigel J., Majoros G. Quantifying parasites in samples of hosts // Journal of Parasitology. 2000. Vol. 86. P. 228−232.
Singleton G. R., Spratt D. M., Barker S. C. Hodgson P. F. The geographic distribution and host range of Capillaria hepatica (Bancroft) (Nematoda) inAustralia // International Journal for Parasitology. 1991. Vol. 21. № 8. P. 945–957.
Spratt D. M., Singleton G. R. Hepatic Capillariasis / Samuel W. M., Pybus M. J., Kocan A. A. (Eds.). Parasitic Diseases of Wild Mammals. Iowa State University Press, Ames, IA, 2001. P. 365–379.
Благодарности
Автор выражает благодарность профессору ПетрГУ А. В. Коросову за организацию экспедиций и всестороннее участие в проведении многолетних исследований; с. н. с. ИБ КарнЦ РАН Л. А. Беспятовой и студентам эколого-биологического факультета ПетрГУ Ю. М. Коросовой, С. А. Коросову, Т. Э. Гриценко, В. В. Амозовой за помощь при сборе полевого материала; заведующему лабораторией паразитологии животных и растений ИБ КарНЦ РАН Е. П. Иешко за общее руководство работой.
Финансовое обеспечение исследований в разные годы осуществлялось из средств федерального бюджета на выполнение государственного задания (№ темы 51.4, № г. р. 01201358738); грантов РФФИ (№ 05-04-97506-р_север_а) и Министерства образования и науки России (соглашение № 8101).






 © 2011 - 2025
© 2011 - 2025