Введение
Внутриклеточные гемопаразиты рода Haemogregarina встречаются в крови у черепах по всему миру (Siddall, Desser, 1992; Adl et al., 2012), имеют сложные жизненные циклы, включающие мерогонию и образование гаметоцитов в хозяине – позвоночном животном (черепахе), гамогонию и спорогонию в кишечнике переносчика – беспозвоночного животного (пиявки) (Hawkey, Dennet, 1989; Telford, 2008). Биология, векторы и пути передачи гемогрегарин в основном неизвестны (Desser, 1993); еще недостаточно данных о таксономии, эволюционных связях, биогеографии и влиянии гемогрегарин на организм хозяина (Dvořáková et al., 2014).
Эритроциты рептилий вследствие их интенсивной метаболической активности за счет наличия ядра служат на клеточном уровне прекрасным модельным объектом для изучения взаимоотношений в системе «паразит – хозяин» (Бейер, Сидоренко, 1972). В опубликованной нами ранее работе при анализе зараженности внутриэритроцитарными гемопаразитами Haemogregarina spр. средиземноморских черепах Никольского Testudo graeca nikolskii Ckhikvadze et Tuniyev, 1986, содержащихся в питомнике пос. Супсех (Краснодарский край), выявлены высокие показатели экстенсивности и интенсивности инвазии, свидетельствующие о большей склонности самок к инфицированию гемогрегаринами по сравнению с самцами (Романова и др., 2024). С целью изучения влияния Haemogregarina spр. на организм хозяина была проведена оценка линейных параметров и доли морфологических и ядерных аномалий эритроцитов T. g. nikolskii при заражении гемогрегаринами.
Материалы
Исследованные особи T. g. nikolskii (6 самцов и 16 самок) содержались в питомнике пос. Супсех, расположенном в 2 км на юго-восток от центра г. Анапы, и доставлены сюда из окрестностей Анапы в 2023–2024 гг. Забор крови у черепах проведен в один день (19.04.2024) путем прокола яремной вены. Мазки крови (по два от каждой особи) готовили с помощью гематологического штапеля, высушивали на воздухе, затем фиксировали в спиртоэфирной смеси (1:1). Зафиксированные мазки хранили до окрашивания при комнатной температуре. Мазки окрашивали в течение 20 минут красителем Гимза азур-эозин по Романовскому (10–12-кратный раствор, фирма «Биолот», Россия), приготовленном на фосфатном буфере (рН 6.8–7.2). Готовые мазки просматривали на микроскопе Meiji Techno серии МТ 4000 с иммерсией (Meiji Techno, Japan), при увеличении ×1500, с дифференцированным подсчетом размерных характеристик неинфицированных и инфицированных эритроцитов T. g. nikolskii.
Методы
Учет морфологических аномалий клеток и их ядер проводили на 500 эритроцитов у каждой особи. Определение величины большой и малой оси клеток и их ядер (в мкм) проводили с помощью окуляр-микрометра cross-line (0.1 mm). Площадь поверхности клеток Sк и ядер Sя (в мкм2) рассчитывали по формуле эллипса: S = π × a × b, где π = 3.14; a – длина большой полуоси эллипса, мкм; b – длина малой полуоси эллипса, мкм. Индекс удлинения клеток (Е) и их ядер (е) рассчитывали как частное от деления длинного диаметра на короткий. Ядерно-цитоплазматическое отношение (ЯЦО) определяли как отношение площади ядра к площади клетки.
Цифровые изображения морфологических аномалий ядер эритроцитов выполняли камерой Vision САМ (Vision, Japan) для тринокулярного микроскопа Meiju Techno (увеличение ×1500).
Оценку нормальности распределения размеров клеток осуществляли с помощью критерия Шапиро – Уилка. С учетом вида распределения центральные тенденции и рассеяние изученных показателей описывали медианой (Ме) и интерквартильным размахом (IQR) (значения 25-го и 75-го процентилей). При сравнении двух групп применяли непараметрический критерий Манна – Уитни (u). Для сравнения долей использовали z-критерий. Корреляцию морфометрических показателей клеток с видами клеточных и ядерных аномалий оценивали коэффициентом корреляции Спирмена (ρ) в пакете прикладных программ «STATISTICA v.8». За величину уровня статистической значимости принимали α = 0.05.
Результаты
Основные размерные характеристики эритроцитов незараженной средиземноморской черепахи Никольского (длина большой, u = 0.49, p = 0.61 и малой, u = 0.04, p = 0.96 осей), а также интегральные показатели (индекс удлинения клеток, Е, u = 0.31, p = 0.56; ядерно-цитоплазматическое отношение, ЯЦО, u = 0.92, p = 0.35) у самцов и самок были сопоставимы. Но выявлены значимые различия по длине малой оси ядра и по индексу удлинения ядра, е, u = 3.36, p < 0.001 (табл. 1).
Таблица 1. Морфометрические показатели (Me/IQR) эритроцитов средиземноморской черепахи Никольского
| Показатели | Пол | Статистические показатели | ||
| самки | самцы | критерий Манна – Уитни (u) | р-значение | |
| А, мкм | 18.0/2.0 | 18.0/3.0 | 0.49 | 0.61 |
| В, мкм | 10.0/1.0 | 10.0/1.0 | 0.04 | 0.96 |
| Е, отн. ед | 1.7/0.3 | 1.8/0.2 | 0.31 | 0.56 |
| а, мкм | 8.0/1.0 | 8.0/2.0 | 1.35 | 0.17 |
| в, мкм | 5.4/1.0 | 5.1/1.0 | 2.30 | 0.02 |
| е, отн. ед. | 1.4/0.3 | 1.6/0.3 | 3.36 | 0.0007 |
| Sк., мкм2 | 149.2/36.1 | 155.5/22.7 | 0.56 | 0.74 |
| Sя., мкм2 | 32.9/10.2 | 31.4/10.2 | 3.36 | 0.35 |
| ЯЦО | 0.2/0.07 | 0.2/0.04 | 0.92 | 0.35 |
Примечание. А – большая ось клетки, мкм; В – малая ось клетки, мкм; Е – индекс удлинения клетки, отн. ед.; а – большая ось ядра, мкм; в – малая ось ядра, мкм; е – индекс удлинения ядра, отн. ед.; Sк. – площадь клетки, мкм2; Sя. – площадь ядра, мкм2; ЯЦО – ядерно-цитоплазматическое отношение.
Анализ размерных показателей показал увеличение длины малой оси ядра, но уменьшение индекса удлинения ядра самок средиземноморской черепахи по сравнению с самцами (рис. 1).
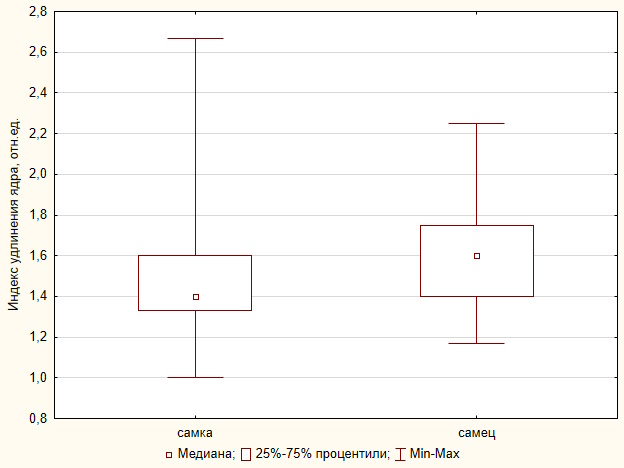
Рис. 1. Индекс удлинения ядра эритроцитов самцов и самок T. g. nikolskii
Fig. 1 Index of elongation of the erythrocyte nucleus in males and females of T. g. nikolskii
Сравнительный анализ размерных характеристик непораженных и пораженных гемогрегаринами эритроцитов проводили по гематологическим препаратам самок средиземноморской черепахи, зараженных Haemogregarina spр. Индексы удлинения клеток и их ядер непораженных и пораженных эритроцитов не различались, как и линейные размеры клеток (табл. 2). Площадь ядра (u = 3.71, p = 0.0002), длина его малой оси (u = 3.44, p = 0.0005) и ядерно-цитоплазматическое отношение (u = 2.80, p = 0.004) пораженных гемопаразитами клеток были меньше по сравнению с непораженными эритроцитами (рис. 2).
Таблица 2. Сравнительный анализ морфометрических показателей (Me/IQR) непораженных и пораженных эритроцитов самок средиземноморской черепахи Никольского, зараженных Haemogregarina spр.
| Параметры | Эритроциты | Статистические показатели | ||
| непораженные | пораженные | критерий Манна – Уитни (u) | р-значение | |
| А, мкм | 18.0/3.0 | 18.0/3.0 | 0.66 | 0.50 |
| В, мкм | 12.0/1.0 | 11.0/2.0 | 0.78 | 0.44 |
| Е, отн. ед. | 1.5/0.2 | 1.6/0.3 | 0.47 | 0.63 |
| а, мкм | 7.0/1.0 | 7.0/2.0 | 1.25 | 0.21 |
| в, мкм | 5.0/1.0 | 4.6/1.0 | 3.44 | 0.0005 |
| е, отн. ед. | 1.5/0.2 | 1.5/0.3 | 1.73 | 0.08 |
| Sк., мкм2 | 169.6/6.9 | 160.2/24.3 | 1.23 | 0.21 |
| Sя., мкм2 | 27.4/6.6 | 25.1/7.8 | 3.71 | 0.0002 |
| ЯЦО | 0.17/0.04 | 0.15/0.04 | 2.80 | 0.004 |
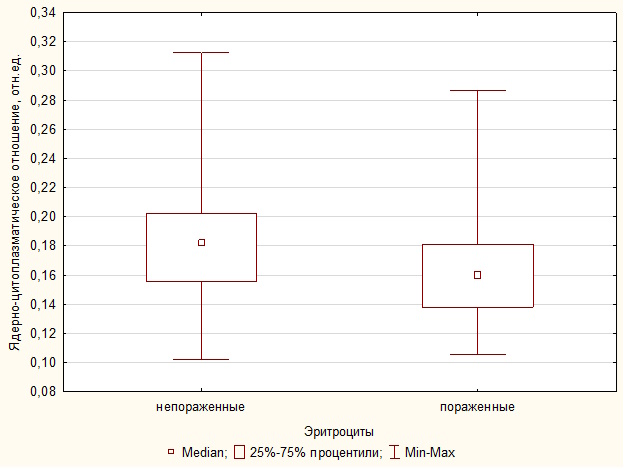
Рис. 2. Ядерно-цитоплазматическое отношение непораженных и пораженных гемопаразитами эритроцитов самок T. g. nikolskii
Fig. 2. Nuclear-cytoplasmic ratio of uninfected and hemoparasite-affected erythrocytes of female T. g. nikolskii
Как известно, при воздействии на организм различных внутренних и внешних стрессовых факторов отмечаются аномалии морфологии как самих клеток, так и их ядер (Крюков, 2023). Нормальные эритроциты средиземноморской черепахи имели овальную форму с округлым несегментированным ядром, расположенным в центре клетки (рис. 3А). Распространенным видом цитогенетических аномалий считаются микроядра, которые возникают в анафазе митоза в результате отставания ацентрических фрагментов или целых хромосом. В эритроцитах средиземноморской черепахи чаще встречались микроядра каплевидной формы (рис. 3Б), хвостатые (рис. 3В) и прикрепленные (рис. 3Г). Другим видом аномалий являлись морфологические изменения клеток: эритроциты вытянутой формы (рис. 3Д) и со смещенным ядром (рис. 3Ж).

Рис. 3. Эритроциты средиземноморской черепахи Никольского с морфологическими и ядерными аномалиями: А – нормальный эритроцит; Б – эритроцит с примыкающим микроядром каплевидной формы; В – эритроцит с хвостатым микроядром; Г – эритроцит с прикрепленным микроядром; Д – эритроцит вытянутой формы; Ж – эритроцит со смещенным ядром; З – эритроцит с лопастным ядром; И – ядро эритроцита с впадиной; К – эритроцит с зазубренным ядром; Л – эритроцит с почкующимся ядром; М – эритроцит с пузырящимся ядром; Н – ядро эритроцита в форме восьмерки
Fig. 3. Erythrocytes of T. g. nikolskii with morphological and nuclear abnormalities: A – normal erythrocyte; B – erythrocyte with an adjacent teardrop-shaped micronucleus; C – erythrocyte with a caudate micronucleus; D – erythrocyte with an attached micronucleus; E – elongated erythrocyte; F – erythrocyte with a displaced nucleus; G – erythrocyte with a lobed nucleus; H – erythrocyte nucleus with a depression; I – erythrocyte with a serrated nucleus; K – erythrocyte with a budding nucleus; L – erythrocyte with a vesicular nucleus; M – the figure-of-eight erythrocyte nucleus
Морфологические аномалии ядер в эритроцитах средиземноморской черепахи были представлены лопастными ядрами с обособленным перетяжкой участком гетерохроматина, сохранившим связь с основной его частью (рис. 3З); ядрами с впадинами, обусловленными нарушением правильной эллипсовидной формы ядра и представляющими собой явно различимую вогнутость (инвагинацию) ядерной оболочки со сравнительно пологими скатами (рис. 3И); зазубренными ядрами, имеющими клинообразную инвагинацию ядерной оболочки (рис. 3К); почкующимися ядрами, у которых имелись характерные выпячивания ядерной оболочки, заполненные хроматином, сохраняющим тесную связь с хроматином ядра (рис. 3Л), и пузырящимися ядрами, часть оболочки которых имела множественные мелкие выпячивания (рис. 3М). Реже встречались двухлопастные ядра, или ядра в форме восьмерки с перетяжкой (рис. 3Н).
Частота встречаемости микроядер у незараженных и инфицированных особей была одинаковой, доли морфологических аномалий клеток и их ядер были выше в эритроцитах здоровых особей (табл. 3).
Таблица 3. Доля эритроцитов (на 500 клеток) с аномалиями в крови незараженных и зараженных гемопаразитами средиземноморских черепах
| Виды аномалий | Незараженные особи | Зараженные особи | Статистические показатели: | |
| z-критерий | р-значение | |||
| Морфологические аномалии клеток | 0.06 | 0.196 | 6.25 | p < 0.001 |
| Морфологические аномалии ядер | 0.207 | 0.325 | 4.22 | p = 0.00001 |
| Микроядра | 0.02 | 0.03 | 1.16 | p = 0.12 |
Примечание. Жирным выделены значимые различия.
Выявлена взаимосвязь возрастания морфологических аномалий клеток (ρ = 0.38, p < 0.001) и их ядер (ρ = 0.51, p < 0.001) при увеличение ядерно-цитоплазматического отношения в эритроцитах. Уравнение регрессии, аппроксимирующее линейную зависимость числа ядерных аномалий от величины ядерно-цитоплазматического отношения в клетках, имело вид∶ y = 0.129 + 0.7153x (R2 = 0.20, r = 0.45, p < 0.001). Результат анализа зависимости показал, что примерно на 20 % (показатель детерминации R2 = 0.20) дисперсия числа морфологических аномалий ядер объясняется дисперсией показателя ядерно-цитоплазматического отношения в эритроцитах, с увеличением которого количество ядерных аномалий в клетке возрастает (рис. 4).
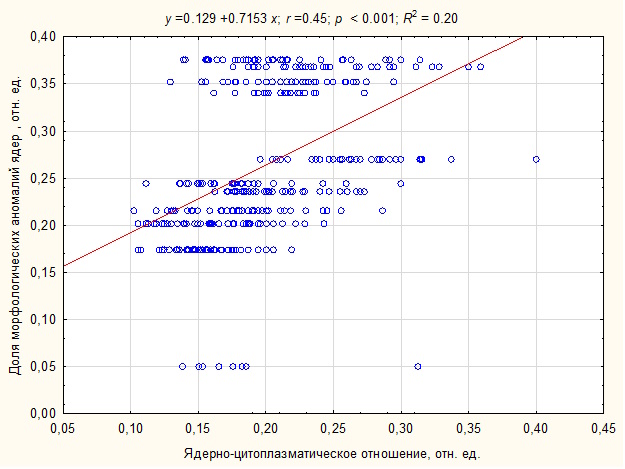
Рис. 4. Зависимость возрастания морфологических аномалий ядер эритроцитов T. g. nikolskii при увеличении ядерно-цитоплазматического отношения клеток
Fig. 4. Dependence of the increase in morphological anomalies of the erythrocyte nuclei of T. g. nikolskii with an increase in the nuclear-cytoplasmic ratio of cells
Для визуализации различий по совокупности изученных показателей между незараженными и зараженными средиземноморскими черепахами мы воспользовались методом главных компонент. Участие главных компонент, выделенных при помощи графика каменистой осыпи, с общим качеством репрезентации 99.43 %, в дифференциации было неодинаково. Первая главная компонента (факторная ось), соответствующая собственному значению 27.39, описывала приблизительно 71.54 % общей дисперсии, и ее роль выше других по информационной насыщенности. Вторая компонента (факторная ось), соответствующая собственному значению 10.67, описывала 27.89 % оставшейся дисперсии, ее роль меньше по сравнению с первой компонентой. Первая факторная ось коррелировала с размерными показателями клеток и имела сильные положительные корреляции с длиной малой оси клеток (0.88), с площадью клеток (0.87), ядерно-цитоплазматическим отношением (0.79) и сильные отрицательные корреляции с индексом удлинения клеток (-0.85) и площадью ядра (-0.81). Вторая факторная ось имела сильную положительную корреляцию с морфологическими аномалиями клеток (0.71). График наблюдений в пространстве главных компонент визуализировал полученный результат (рис. 5).
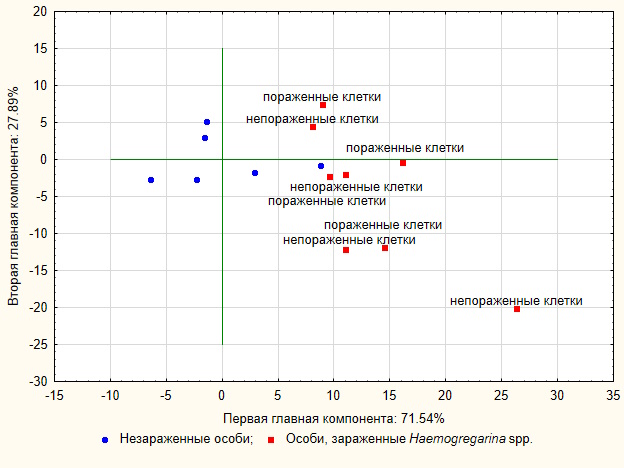
Рис. 5. График рассеивания данных об эритроцитах T. g. nikolskii в пространстве двух главных компонент
Fig. 5. A graph of the scattering of erythrocyte data T. g. nikolskii in the space of the first two main components
Незараженные и зараженные гемогрегаринами черепахи по совокупности изученных показателей разошлись как по первой, так и по второй главным компонентам. Зараженные особи сгруппировались в первом и четвертом квадрантах, т.е. имели положительные значения по первой главной компоненте. Незараженные занимали второй, третий и четвертый квадранты и имели как отрицательные, так и положительные значения по первой главной компоненте, объединяясь в области переменных «площадь ядра» и «площадь клетки». По второй главной компоненте незараженные черепахи группировались относительно близко друг к другу в области переменных «морфологические аномалии клеток и их ядер». Пораженные эритроциты по совокупности изученных показателей располагались ближе друг к другу по сравнению со здоровыми клетками и заметно разошлись по второй главной компоненте, которая, как уже отмечалось, дает объяснение более чем вдвое меньшей дисперсии (27.89 %) по сравнению с первой главной компонентой.
Обсуждение
Известно, что микроядерные образования в эритроидных клетках существуют практически у всех видов рептилий, в т.ч. и не являющихся носителями простейших (Крюков, 2023), что подтверждается полученными данными об отсутствии значимых различий по частоте встречаемости микроядер у незараженных и зараженных гемопаразитом черепах. Ядерно-цитоплазматическое отношение – объективный показатель оценки прижизненного состояния клетки и важная морфологическая характеристика, позволяющая получить определенное представление об уровне метаболизма и компенсаторных реакциях клеток крови. У незараженных самок и самцов средиземноморской черепахи этот показатель был сопоставимым. Хорошо известно, что ядро несет наследственный материал, его размер и форма являются отражением состояния клетки и позволяют судить об особенностях протекания формообразовательных и регуляторных процессов в клетке как во времени, так и в пространстве. Эта функция осуществляется посредством ядерно-цитоплазматических взаимодействий: из ядра в цитоплазму поступают различные РНК, а из цитоплазмы в ядро – регуляторные молекулы (индукторы и супрессоры) (Ченцов, 2004). При этом количество ДНК в ядре не является фактором, определяющим его размеры и форму, но на ядерную морфологию могут влиять структура и модификация хроматина (Арешидзе, 2022), в частности, приобретение ядрами неправильной формы рассматривается как показатель высокой интенсивности метаболизма (Singla et al., 2013).
У незараженных особей размерные показатели ядер и ядерных структур эритроцитов определяются функциональным состоянием клетки за счет повышенного клеточного метаболизма (Струков, Серов, 2020), более высокое ядерно-цитоплазматическое отношение свидетельствует об активации клеток гемопоэтического ростка в красном костном мозге (Донкова, Рубай, 2017). Анализ полученных данных показал, что внедрение и жизнедеятельность внутриэритроцитарных гемопаразитов в здоровые клетки с высоким уровнем метаболизма и синтетической активностью ядер приводит к уменьшению площади ядра и снижению процессов метаболизма, о чем свидетельствует уменьшение их ядерно-цитоплазматического отношения. Аномальные по форме и размерам эритроциты не способны полноценно выполнять основную функцию переноса кислорода (Song et al., 2021), что впоследствии может привести к развитию анемии и воспалительных заболеваний в организме черепах, инфицированных Haemogregarina spp.
Заключение
Выявлены межполовые различия кариометрических показателей эритроцитов здоровых средиземноморских черепах, проявляющиеся у самок увеличением длины малой оси ядра и более низким значением индекса удлинения ядра по сравнению с самцами. Установлено уменьшение малой оси ядер, площади ядер и снижение ядерно-цитоплазматического отношения пораженных эритроцитов по сравнению с незараженными клетками инфицированных самок средиземноморских черепах. Выявлена корреляционная связь (ρ = 0.38, p < 0.001; ρ = 0.51, p < 0.001) и зависимость возрастания морфологических изменений ядер (R2 = 0.20, r = 0.45, p < 0.001) при увеличение ядерно-цитоплазматического отношения в эритроцитах, свидетельствующая о возрастании числа аномалий при нарушении регуляции формообразовательных процессов в клетке.
Следует обратить внимание на высокую долю морфологических и ядерных аномалий в эритроцитах незараженных особей, что требует дальнейшего изучения для выявления факторов, вызывающих морфологические и цитогенетические патологии клеток организма подвида средиземноморской черепахи, который находится в России под угрозой исчезновения (Туниев, Островских, 2017; Туниев, 2021). Кроме Краснодарского края Российской Федерации, подвид T. g. nikolskii сохранился только в Республике Абхазия (Пестов и др., 2009), где еще сравнительно недавно (Туниев, Туниев, 2006) считался исчезнувшим.
Библиография
Арешидзе Д. А. Механизмы поддержания и изменений формы и размеров клеточного ядра // Морфологические ведомости. 2022. Т. 30, вып. 3. С. 73–80. DOI: 10.20340/mv-mn.2022.30(3).670
Бейер Т. В., Сидоренко Н. В. Цитохимическое исследование гемогрегарин из рептилий Армении. II. Сдвиги в содержании гемоглобина и общих белков в эритроцитах скальных ящериц, зараженных гемогрегаринами // Паразитология. 1972. Т. VI, № 4. С. 385–390.
Донкова Н. В., Рубай А. А. Цитологические и морфометрические особенности клеток крови тритона до и после тотальной резекции конечностей // Вестник КрасГАУ. 2017. № 6. С. 57–64.
Крюков В. И. Анализ микроядер и ядерных аномалий в эритроцитах рыб, амфибий, рептилий и птиц: критерии выявления и типирования . Красноярск: Научно-инновационный центр, 2023. 94 с. DOI: 10.12731/978-5-907608-05-4
Пестов М. В., Маландзия В. И., Мильто К. Д., Дбар Р. С., Пестов Г. М. Средиземноморская черепаха Никольского (Testudo graeca nikolskii) в Абхазии // Современная герпетология. 2009. Т. 9, вып. 1/2. С. 41–51.
Романова Е. Б., Бакиев А. Г., Горелов Р. А. Адаптивные реакции крови средиземноморской черепахи Никольского Testudo graeca nikolskii Ckhikvadze et Tuniyev, 1986 (Testudinidae, Reptilia) // Современная герпетология. 2024. Т. 24, вып. 3/4. С. 163–170. DOI: 10.18500/1814-6090-2024-24-3-4-1-1
Струков А. Л., Серов. В. В. Патологическая анатомия . М.: Литера, 2020. 880 с.
Туниев Б. С. Cредиземноморская черепаха Никольского Testudo graeca nikolskii Ckhikvadze et Tuniyev, 1986 // Красная книга Российской Федерации. Том «Животные». М.: ФГБУ «ВНИИ Экология», 2021. С. 429–430.
Туниев Б. С., Островских С. В. Черепаха Никольского (средиземноморская черепаха) Testudo graeca nikolskii Ckhikvadze et Tuniyev, 1986 // Красная книга Краснодарского края. Животные. Краснодар: Адм. Краснодар. края, 2017. С. 486–487.
Туниев Б. С., Туниев С. Б. Герпетофауна Сочинского национального парка // Инвентаризация основных таксономических групп и сообществ, зоологические исследования Сочинского национального парка – первые итоги первого в России национального парка. М.: Престиж, 2006. С. 195–204.
Ченцов Ю. С. Введение в клеточную биологию . М.: ИКЦ «Академкнига», 2004. 495 с.
Adl S. M., Simpson A. G. B., Lane C. E., Lukes J., Bass D., Bowser S. S., Brown M. W., Burki F., Dunthorn M., Hampl V., Heiss A., Hoppenrath M., Lara E., Le Gall L., Lynn D. H., McManus H., Mitchell E. A. D., Mozley-Stanridge S. E., Parfrey L. W., Pawlowski J., Rueckert S., Shadwick L., Schoch C. L., Smirnov A., Spiegel F. W. The revised classification of eukaryotes // J. Eukaryot. Microbiol. 2012. Vol. 59. P. 429–514.
Desser S. S. The Haemogregarinidae and Lankesterellidae // Parasitic Protozoa. 2nd Edn. Vol. 4. (ed. J. P. Kreier). New York: Academic Press, 1993. P. 247–272.
Dvořáková N., Kvičerová J., Papoušek I., Javanbakht H., Ghoulem T. G., Kami H., Siroky P. Haemogregarines from western Palaearctic freshwater turtles (genera Emys, Mauremys) are conspecific with Haemogregarina stepanowi Danilewsky, 1885 // Parasitology. 2014. Vol. 141, Issue 4. P. 522–530. DOI: 10.1017/S0031182013001820
Hawkey C. M., Dennet T. B. A colour atlas of comparative veterinary haematology. London, UK: Wolfe Publishing, 1989. 192 p.
Siddall M. E., Desser S. S. Prevalence and intensity of Haemogregarina balli (Apicomplexa: Adeleina: Haemogregarinidae) in three turtle species from Ontario, with observations on intraerythrocytic development // Canadian Journal of Zoology. 1992. Vol. 70. P. 123–128.
Singla A., Griggs N. W., Kwan R. et al. Lamin aggregation is an early sensor of porphyria-induced liver injury // J. Cell Sci. 2013. Vol. 126. P. 3105–3112. DOI: 10.1242/jcs.123026
Song W., Huang P., Wang J. Red Blood Cell Classification Based on Attention Residual Feature Pyramid Network // Front Med (Lausanne). 2021. Vol. 8. P. 741407. DOI: 10.3389/fmed.2021.741407
Telford Jr. S. R. Hemoparasites of the Reptilia: Color Atlas and Text. New York: CRC Press, 2008. 376 p.






 © 2011 - 2026
© 2011 - 2026