Введение
Земноводные являются наиболее уязвимой группой позвоночных, страдающей от масштабного сокращения видового разнообразия (Stuart et al., 2004; Beebee, Griffiths, 2005). Такое сокращение может быть связано с рядом факторов, начиная от антропогенного разрушения и загрязнения среды обитания, изменения климата до воздействия спектра различных патогенов (вирусов, бактерий, простейших, гельминтов). Амфибии являются хозяевами самых разных гемопаразитов (Малышева, 2009; Readel, Goldberg, 2010; Du Preez, Carruthers, 2009; Netherlands et al., 2015), включая внутриэритроцитарные (Davies, Johnston, 2000; Davis et al., 2009; Sailasuta et al., 2011; Netherlands et al., 2014a, b; Rajabi et al., 2017; Pavľáková et al., 2024) и внеклеточные (Baker, 2008; Acosta et al., 2013) виды. Внутриклеточные паразиты крови представляют собой наиболее распространенную и изученную группу кокцидий (Apicomplexa: Adeleorina) (Davies, Johnston, 2000). В настоящее время гемопаразитов разделяют на четыре семейства: Dactylosomatidae, Haemogregarinidae, Hepatozoidae и Karyolysidae. Часто встречающихся у бесхвостых амфибий внеклеточных гемопаразитов рода Trypanosoma, которые отличаются большим полиморфизмом (Leal et al., 2009), относят к классу кинетопластид (Kinetoplastida или Kinetoplastea). Жизненные циклы этих паразитов сложны, включают переносчиков (двукрылых, пиявок), которые являются важными компонентами водных экосистем (Ferreira et al., 2015; Bjelić-Čabrilo et al., 2009).
В литературе встречаются отдельные работы, посвященные морфологии эритроцитов амфибий при инвазии гемопаразитами (Гаибова, Мамедова, 2010; Peskova et al., 2018); практически не исследованы реакции адаптивного иммунитета и до конца не ясны последствия инфицирования для системы крови амфибий. С учетом вышеизложенного целью данного исследования являлась сравнительная оценка гемопаразитарной нагрузки, функционирования иммунной системы и морфофизиологических показателей самцов и самок озерной лягушки Pelophylax ridibundus (Pallas, 1771), добытых в Нижнем Поволжье.
Материалы
Озерные лягушки (n = 24, 13 самцов и 11 самок) собраны с помощью сети в прибрежной зоне р. Берекет (окрестности пос. Степной, Красноярский район, Астраханская обл., 46.672874º N, 48.237771º E) 30.08.2024 г. Течение в реке слабое, грунт состоит из песка с глинами.
Методы
Массу тела лягушек определяли на электронных лабораторных весах серии Highland (HCB 123, фирма ADAM Eguipment Co., Ltd), предел допускаемой погрешности ±0.01 г. Кровь брали из сердца с помощью инсулинового шприца с фиксированной иглой объемом 1 мл. Готовили тонкие мазки крови, высушивали на воздухе, фиксировали в абсолютном спирте и окрашивали красителем Гимза в течение 20 мин (Меньшиков и др., 1987). Проводили определение и учет внутриэритроцитарных паразитов на 500 эритроцитов с помощью светового микроскопа Meiji Techno (Япония) серии МТ 4000 с иммерсией (ув. ×1500). Рассчитывали экстенсивности инвазии, Е (%) – количество особей вида, зараженных гемопаразитами, по отношению ко всему числу исследованных особей; среднюю интенсивность инвазии, I (отн. ед.) – количество паразитов, приходящихся в среднем на одну зараженную особь; индекс обилия, ИО (отн. ед.) – количество гемопаразитов, приходящихся на одну особь.
По окрашенным препаратам определяли лейкоцитарную формулу крови и рассчитывали интегральные лейкоцитарные индексы: кровно-клеточный, ККП; реактивный ответ нейтрофилов, РОН; лимфоцитарно-гранулоцитарный, ИЛГ; отношение нейтрофилов к лимфоцитам, ИСНЛ; отношение лимфоцитов к эозинофилам, ИСЛЭ; отношение нейтрофилов к эозинофилам, ИСНЭ; сдвиг лейкоцитов, ИСЛ; ядерный сдвиг нейтрофилов, ИЯСН и интоксикации, ЛИИ. В сыворотке крови оценивали содержание циркулирующих иммунных комплексов (ед. опт. плотности / 10 мл сыворотки) методом селективной преципитации на спектрофотометре СФ-2000 (ООО «ОКБ Спектр», Россия) при длине волны 200, 280, 350 и 450 нм, в растворе полиэтиленгликоля (ПЭГ) (Гриневич, Алферов, 1981; Khokhlova et al., 2004). Определяли крупные (ПЭГ, 3.75 %) и мелкие (ПЭГ, 7.0 %) иммунные комплексы и их отношение (индекс укрупнения). Индексы внутренних органов (сердце, печень, селезенка, почки, гонады) лягушек (отношение массы органа к массе тела) вычисляли в промилле (‰) (Ивантер и др., 1985), для этого у обездвиженных животных выделяли органы и взвешивали на торсионных весах Waga Torsyjna – WT с ценой деления 0.1 мг (погрешность измерения ±0.03 мг).
С учетом вида распределения центральные тенденции и рассеяние изученных показателей описывали медианой (Ме) и интерквартильным размахом (IQR) (значения 25-го и 75-го процентилей). Для оценки силы и значимости влияния факторов (пол, зараженность гемопаразитами) применяли многомерный дисперсионный анализ с использованием лямбды Уилкса (λWilks) в качестве критериальной статистики. Анализ данных проводили непараметрическими критериями: Краскела – Уоллиса (при множественном сравнении групп по одному признаку), Данна (множественный критерий при попарном сравнении групп), z-критерий (для сравнения долей), гамма (γ) – корреляции (для анализа взаимосвязи). За величину уровня статистической значимости принимали α = 0.05. Расчеты реализовывали с помощью пакета программ Statistica 8 (StatSoft Inc., OK, USA).
Результаты
Жизненный цикл гемопаразитов состоит из основных четырех стадий: мерогония и гамогония у позвоночного хозяина, а также оплодотворение и спорогония у беспозвоночного хозяина (комара или пиявки). На основе морфологии внутриэритроцитарных гаметоцитов, имеющих различную форму, в мазках крови P. ridibundus были идентифицированы гемопаразиты, относящиеся к трем родам Hepatozoon, Dactylosoma и Trypanosoma. Из 24 особей P. ridibundus гемопаразиты выявлены у 14, при этом Dactylosoma sp. обнаружены у всех инфицированных особей (100 %), Hepatozoon sp. встречался у 7 особей (50 %), а Trypanosoma sp. – у 5 (35.71 %) инфицированных особей (табл. 1).
Таблица 1. Распределение гемопаразитов родов Hepatozoon, Dactylosoma и Trypanosoma sp. у исследованных особей P. ridibundus
| Пол | Hepatozoon sp. | Dactylosoma sp. | Trypanosoma sp. |
| ♂ | - | + | - |
| ♀ | + | + | + |
| ♀ | + | + | + |
| ♀ | - | + | + |
| ♀ | - | + | - |
| ♀ | - | + | - |
| ♂ | + | + | - |
| ♀ | + | + | - |
| ♂ | - | + | + |
| ♀ | - | + | + |
| ♀ | + | + | - |
| ♂ | + | + | - |
| ♀ | + | + | - |
| ♂ | - | + | - |
Выявлено одновременно наличие гемопаразитов трех родов у двух самок (14.28 %); представителей двух родов – у 8 особей: 3 самцов и 5 самок (57.14 %) и у четырех особей, 2 самцов и 2 самок, обнаружен только один вид (21.42 % от всей выборки) гемопаразита.
Высокий процент экстенсивности инвазии (81.8 %) и индекса обилия (5.90 отн. ед.) свидетельствовал о предпочтительном поражении самок, для которых и доля инфицированных эритроцитов в периферической крови была значимо выше по сравнению с самцами (z = 3.09, р = 0.001) (табл. 2). При этом количество паразитов, приходящееся в среднем на одну зараженную особь у самцов и самок (интенсивность инвазии), не различалось.
Таблица 2. Зараженность озерных лягушек внутриклеточными гемопаразитами
| Пол | Число зараженных особей | Число паразитов на 500 эритроцитов | Доля клеток с паразитами | E, % | I, отн. ед. | ИО, отн. ед. |
| Самки (n = 11) | 9 | 65 | 0.13 | 81.80 | 7.22 | 5.90 |
| Самцы (n = 13) | 5 | 34 | 0.068 | 38.46 | 6.8 | 2.61 |
| Всего (n = 24) | 14 | 99 | 0.198 | 58.33 | 7.07 | 4.12 |
Факторный дисперсионный анализ показал значимое влияние фактора «пол» (λWilks = 0.0021, р < 0.001), фактора «зараженность лягушек» (λWilks = 0.09, р = 0.0002), а также значимое взаимодействие этих факторов (λWilks = 0.0005, р < 0.001) на совокупность изученных иммуногематологических и морфофизиологических показателей лягушек.
Межполовые различия лейкоцитарного профиля отмечены у здоровых особей. Так, самки имели более высокое значение кровно-клеточного показателя, КПП и индекса сдвига лейкоцитов, ИСЛ, а также пониженное значение лимфоцитарно-гранулоцитарного индекса ИЛГ за счет изменения соотношения гранулоцитов в периферической крови (табл. 3).
Таблица 3. Лейкоцитарный профиль крови (Me / IQR) здоровых и инфицированных озерных лягушек
| Показатель, % | Самцы | Самки | Статистические показатели | ||
| Здоровые (n = 8) | Инфициро-ванные (n = 5) | Здоровые (n = 2) | Инфициро-ванные (n = 9) | ||
| 1 | 2 | 3 | 4 | ||
| Миелоциты | 7.5/4.0 | 6.0/4.0 | 14.0/16.0 | 7.2/2.0 | Н = 1.29, р = 0.73 |
| Юные нейтрофилы | 8.0/1.5 | 7.0/2.0 | 8.0/0.0 | 9.0/1.0 | Н = 6.10, р = 0.08 |
| Палочкоядерные нейтрофилы | 3.5/2.5 | 6.0/4.0 | 5.0/2.0 | 6.0/1.0 | Н = 2.14, р = 0.54 |
| Сегментоядерные нейтрофилы | 3.0/0.5 | 6.0/1.0 | 6.5/1.0 | 3.0/4.0 | Н = 11.4, р = 0.009 D1-2 = 2.79, p = 0.03 |
| Сумма нейтрофилов | 16.0/5.5 | 18.0/7.0 | 19.5/3.0 | 20.0/5.0 | Н = 2.89, р = 0.40 |
| Эозинофилы | 7.0/1.5 | 10.0/5.0 | 13.5/1.0 | 7.0/2.0 | Н = 6.64, р = 0.08 |
| Базофилы | 7.0/1.0 | 5.0/4.0 | 6.5/1.0 | 7.0/5.0 | Н = 1.98, р = 0.57 |
| Моноциты | 10.0/3.5 | 10.0/3.0 | 6.5/1.0 | 7.0/1. 0 | Н = 20.39, р = 0.0001 D1-4 = 3.40, p = 0.003 |
| Лимфоциты | 52.0/5.0 | 46.0/11.0 | 40.0/12.0 | 52.0/11.0 | Н = 4.76, р = 0.18 |
| ККП | 0.23/0.07 | 0.38/0.09 | 0.54/0.11 | 0.30/0.17 | Н = 9.55, р = 0.02 D1-3 = 2.83, p = 0.03 |
| РОН | 0.02/0.01 | 0.06/0.03 | 0.05/0.02 | 0.04/0.07 | Н = 2.99, р = 0.39 |
| ИЛГ | 37.14/9.66 | 20.9/9.94 | 15.9/3.52 | 29.4/19.85 | Н = 9.36, р = 0.02 D1-3 = 2.76, p = 0.03 |
| ИСНЛ | 0.13/0.03 | 0.26/0.0 | 0.28/0.01 | 0.17/0.10 | Н = 8.23, р = 0.04 |
| ИСЛЭ | 8.14/2.05 | 4.6/8.1 | 2.98/1.11 | 6.71/3.54 | Н = 5.27, р = 0.15 |
| ИСНЭ | 1.0/0.40 | 1.0/0.2 | 0.85/0.29 | 1.13/0.94 | Н = 2.18, р = 0.53 |
| ИСЛ | 0.47/0.12 | 0.5/0.06 | 0.86/0.18 | 0.63/0.19 | Н = 8.42, р = 0.03 D1-3 = 2.67, p = 0.04 |
| ИЯСН | 7.16/3.75 | 3.67/0.79 | 4.26/2.81 | 6.0/4.0 | Н = 15.58, р = 0.001 D1-2 = 3.55, p = 0.002 |
| ЛИИ | 0.29/0.12 | 0.38/0.09 | 0.51/0.29 | 0.35/0.14 | Н = 3.79, р = 0.28 |
| Показатель, % | Самцы | Самки | Статистические показатели | ||
| Здоровые (n = 8) | Инфициро-ванные (n = 5) | Здоровые (n = 2) | Инфициро-ванные (n = 9) | ||
| 1 | 2 | 3 | 4 | ||
| Миелоциты | 7.5/4.0 | 6.0/4.0 | 14.0/16.0 | 7.2/2.0 | Н = 1.29, р = 0.73 |
| Юные нейтрофилы | 8.0/1.5 | 7.0/2.0 | 8.0/0.0 | 9.0/1.0 | Н = 6.10, р = 0.08 |
| Палочкоядерные нейтрофилы | 3.5/2.5 | 6.0/4.0 | 5.0/2.0 | 6.0/1.0 | Н = 2.14, р = 0.54 |
| Сегментоядерные нейтрофилы | 3.0/0.5 | 6.0/1.0 | 6.5/1.0 | 3.0/4.0 | Н = 11.4, р = 0.009 D1-2 = 2.79, p = 0.03 |
| Сумма нейтрофилов | 16.0/5.5 | 18.0/7.0 | 19.5/3.0 | 20.0/5.0 | Н = 2.89, р = 0.40 |
| Эозинофилы | 7.0/1.5 | 10.0/5.0 | 13.5/1.0 | 7.0/2.0 | Н = 6.64, р = 0.08 |
| Базофилы | 7.0/1.0 | 5.0/4.0 | 6.5/1.0 | 7.0/5.0 | Н = 1.98, р = 0.57 |
| Моноциты | 10.0/3.5 | 10.0/3.0 | 6.5/1.0 | 7.0/1. 0 | Н = 20.39, р = 0.0001 D1-4 = 3.40, p = 0.003 |
| Лимфоциты | 52.0/5.0 | 46.0/11.0 | 40.0/12.0 | 52.0/11.0 | Н = 4.76, р = 0.18 |
| ККП | 0.23/0.07 | 0.38/0.09 | 0.54/0.11 | 0.30/0.17 | Н = 9.55, р = 0.02 D1-3 = 2.83, p = 0.03 |
| РОН | 0.02/0.01 | 0.06/0.03 | 0.05/0.02 | 0.04/0.07 | Н = 2.99, р = 0.39 |
| ИЛГ | 37.14/9.66 | 20.9/9.94 | 15.9/3.52 | 29.4/19.85 | Н = 9.36, р = 0.02 D1-3 = 2.76, p = 0.03 |
| ИСНЛ | 0.13/0.03 | 0.26/0.0 | 0.28/0.01 | 0.17/0.10 | Н = 8.23, р = 0.04 |
| ИСЛЭ | 8.14/2.05 | 4.6/8.1 | 2.98/1.11 | 6.71/3.54 | Н = 5.27, р = 0.15 |
| ИСНЭ | 1.0/0.40 | 1.0/0.2 | 0.85/0.29 | 1.13/0.94 | Н = 2.18, р = 0.53 |
| ИСЛ | 0.47/0.12 | 0.5/0.06 | 0.86/0.18 | 0.63/0.19 | Н = 8.42, р = 0.03 D1-3 = 2.67, p = 0.04 |
| ИЯСН | 7.16/3.75 | 3.67/0.79 | 4.26/2.81 | 6.0/4.0 | Н = 15.58, р = 0.001 D1-2 = 3.55, p = 0.002 |
| ЛИИ | 0.29/0.12 | 0.38/0.09 | 0.51/0.29 | 0.35/0.14 | Н = 3.79, р = 0.28 |
Примечание. Н – критерий Краскела – Уоллиса, D – критерий Данна, р – уровень значимости; жирным показаны значимые различия.
При этом инфицированные самцы отличались от здоровых повышенным количеством сегментоядерных форм (D = 2.79, p = 0.03), соответственно, низким значением ядерного сдвига нейтрофилов ИЯСН (D = 3.55, p = 0.002). Лейкограммы инфицированных самцов и самок статистически значимо не различались.
Зараженность внутриклеточными и внеклеточными гемопаразитами коррелировала с возрастанием в крови озерных лягушек количества миелоцитов (γ = 0.44, p = 0.004) и возрастанием индекса интоксикации организма ЛИИ (γ = 0.30, р = 0.04). Выявлена связь снижения общего числа эритроцитов в периферической крови инфицированных особей с общим количеством гемопаразитов (γ = -0.37, р = 0.01) и отдельно с количеством эритроцитов, зараженных Hepatozoon sp. (γ = -0.54, р = 0.001). Присутствие в кровотоке Trypanosoma sp. коррелировало с повышением доли миелоцитов (γ = 0.54, р = 0.008), сегментоядерных нейтрофильных гранулоцитов (γ = 0.56, р = 0.1) и интегральным показателем интоксикации ЛИИ (γ = 0.64, р = 0.002).
Изучение взаимосвязи между интоксикацией организма гемопаразитами и функционированием иммунной системы по уровню циркулирующих иммунных комплексов разного размера выявило возрастание в кровотоке крупных иммунных комплексов (γ = 0.40, р = 0.009) (рис. 1) и снижение индекса укрупнения (γ = -0.30, р = 0.04).
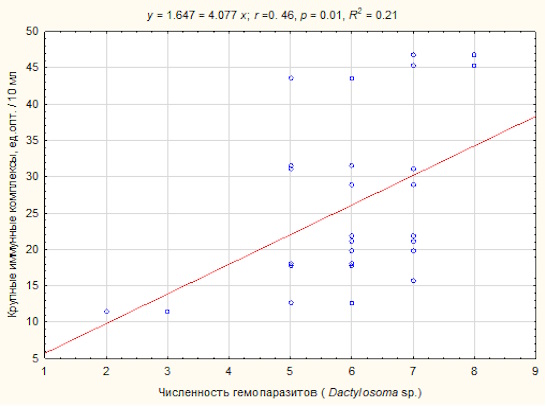
Рис. 1. Зависимость возрастания уровня крупных иммунных комплексов в сыворотке крови озерных лягушек Pelophylax ridibundus при инфицировании внутриэритроцитарными паразитами Dactylosoma sp.
Fig. 1. Dependence of the increase in the level of large immune complexes in the blood serum of Pelophylax ridibundus infected with intraerythrocyte parasites Dactylosoma sp.
Изменение морфофизиологических показателей озерных лягушек коррелировало как с общим количеством внутриклеточных и внеклеточных гемопаразитов, так и с численностью конкретного вида гемопаразита (табл. 4). Показана связь суммарного количества гемопаразитов с увеличением относительного размера печени хозяина.
Таблица 4. Анализ корреляционной взаимосвязи индексов органов инфицированных озерных лягушек с наличием гемопаразитов
| Гемопаразиты | Показатель | Гамма-корреляция | Значение р |
| Hepatozoon sp. | Индекс сердца | 0.53 | 0.001 |
| Индекс печени | 0.47 | 0.005 | |
| Индекс гонад | 0.36 | 0.03 | |
| Trypanosoma sp. | Индекс почек | -0.51 | 0.03 |
| Dactylosoma sp. | Индекс сердца | -0.33 | 0.03 |
| Сумма внутриклеточных паразитов | Индекс печени | 0.37 | 0.01 |
Более выраженная статистическая связь морфофизиологических показателей организма хозяина установлена с локализованными в эритроцитах гаметоцитами Hepatozoon sp., что проявлялось в увеличении индекса сердца, печени и гонад озерных лягушек. Анализ связи выявил умеренную отрицательную корреляцию между содержанием в эритроцитах гамонтов Dactylosoma sp. и снижением индекса сердца у всех инфицированных особей. Подчеркнем, что наличие разнонаправленной корреляции двух признаков (вид гемопаразита и индекс сердца) не может интерпретироваться как доказательство причинно-следственной связи этих признаков. Установлена отрицательная умеренная корреляция между наличием в кровотоке Trypanosoma sp. и снижением индекса почек озерных лягушек.
Обсуждение
В естественной среде паразиты являются важной частью биоразнообразия экосистемы, влияя на такие аспекты, как конкуренция хозяев, миграция, видообразование и стабильность (Combes, 1996), они отражают взаимодействие видов их хозяев с окружающей средой, выявляя пищевое поведение и географические ареалы (Dobson et al., 2008). В стабильном симбиотическом сообществе и сбалансированной экосистеме паразиты и их хозяева коэволюционируют, вызывая минимум патогенных эффектов у здорового хозяина.
Интенсивность заражения гемопаразитами озерных лягушек из нашей выборки, собранной в Астраханской области в конце августа 2024 г., была относительно высокой. Внутриэритроцитарные (Dactylosoma sp., Hepatozoon sp.) и присутствующие в кровотоке Trypanosoma sp. определяли общую паразитарную нагрузку организма хозяина (Satapathy et al., 2021) и вносили вклад в модуляцию иммуногематологических показателей организма хозяина. Следует отметить высокую морфологическую изменчивость (Netherlands et al., 2015) внутриклеточных гемопаразитов, связанную, по-видимому, с большим размером эритроцитов и наличием крупных ядер, что предполагает необходимость проведения при дальнейшем изучении молекулярной идентификации вида.
В некоторых работах отмечается, что размер тела особи с возрастом увеличивается, поэтому, чем старше особь, тем выше обилие паразитов (Comas et al., 2014) и тем больше время воздействия паразитов на организм хозяина (Rubenina et al., 2021). В нашем исследовании масса тела большинства особей была сопоставимой (26.57 ± 1.81 г) (за исключением трех крупных особей с массой тела 123.66 ± 2.33 г), и мы не выявили зависимости массы тела лягушек c паразитарной нагрузкой, что согласуется с результатами других исследователей (Coêlho et al., 2021).
Мощной защитой организма является иммунная система. Сравнительный анализ лейкоцитарного профиля здоровых и инфицированных особей выявляет минимум патогенных эффектов гемопаразитов на организм хозяина. Регулирующей функцией иммунной системы организма при инвазии гемопаразитами можно считать активацию неспецифической защиты (количества нейтрофильных гранулоцитов), а также взаимодействие антиген-антитела с образованием циркулирующих комплексов (Костюченко и др., 2002). Формирование иммунных комплексов имеет регуляторное значение и происходит на стыке биохимического, физиологического и иммунного гомеостаза организма, способствуя модуляции клеточного и гуморального иммунного ответа. Можно полагать, что повышенный уровень крупных (но не мелких) иммунных комплексов в ответ на заражение гемопаразитами способствует развитию воспалительной реакции за счет их связывания с комплементом и взаимодействием с рецепторами на тромбоцитах и нейтрофилах. Результатом такого взаимодействия является секреция ферментов и медиаторов кининовой системы с последующей деградацией иммунных комплексов (Добротина и др., 2012). Выявленные статистические связи численности гемопаразитов со снижением индекса укрупнения (умеренная отрицательная корреляция) и возрастанием в крови доли миелоцитов (умеренная положительная корреляция) иллюстрируют как развитие воспалительной реакции, так и некоторое нарушение иммунорегуляции организма озерных лягушек. Такое состояние симбиотической системы (паразит – хозяин) можно считать относительно устойчивым, но если сосуществование нарушается, например, антропогенным разрушением среды обитания или изменением климата, патогенные эффекты могут стать очевидными, что не только приведет к дестабилизации популяции хозяев (Combes, 1996), но может затронуть и глобальные вопросы биоразнообразия и регуляции численности популяций (Dobson et al., 2008; Readel, Goldberg, 2010).
Заключение
Озерные лягушки Астраханской области инфицированы внутриклеточными (Dactylosoma sp. и Hepatozoon sp.) и внеклеточными (Trypanosoma sp.) гемопаразитами. Самки более склонны к инфицированию, чем самцы. Доля пораженных эритроцитов крови у самок была выше по сравнению с самцами. Проведенный сравнительный анализа адаптивных реакций системы крови, функциональной активности иммунитета и морфофизиологических показателей незараженных озерных лягушек показал, что пути адаптации на уровне системы крови к комплексу факторов среды имеют половые различия, проявляющиеся в первую очередь в изменении соотношения гранулоцитарной составляющей защитной системы крови. Лейкоцитарный профиль здоровых и инфицированных самок не различался. Инфицированные самцы отличались от здоровых повышенным числом сегментоядерных нейтрофилов. Более выраженные изменения в морфофизиологических показателях отмечены при инвазии внутриклеточными паразитами. Оценка функционирования иммунной системы при инфицировании гемопаразитами по уровню циркулирующих иммунных комплексов разного размера выявила напряженность гуморального иммунитета озерных лягушек.
Библиография
Гаибова Г. Д., Мамедова С. О. Кровепаразиты озерной лягушки Pelophylax ridibundus из водоемов Азербайджана // Вестник Харьковского национального университета им. В. Н. Каразина. Серия: биология. 2010. Вып. 12, № 920. С. 5–60.
Гриневич Ю. А., Алферов А. Н. Определение иммунных комплексов в крови онкологических больных // Лабораторное дело. 1981. № 8. С. 493–496.
Добротина Н. А., Копытова Т. В., Борисов В. И. Эндоинтоксикация организма человека: экология и биомедицина . Н. Новгород: Нижегородский госуниверситет, 2012. 135 с.
Ивантер Э. В., Ивантер Т. В., Туманов И. Л. Адаптивные особенности мелких млекопитающих . Л.: Наука, 1985. 320 с.
Костюченко А. Л., Гуревич К. Я., Беляков Н. А. Повышение активности защитных механизмов детоксикации при эндотоксикозе в популяции озерных лягушек Самарской области // Эфферентная терапия. 2002. Т. 8, № 3. С. 3–9.
Малышева М. Н. К фауне кровепаразитов бесхвостых амфибий (Anura) Киргизии // Паразитология. 2009. Т. 43, № 1. С. 32–45.
Меньшиков В. В., Делекторская Л. Н., Золотницкая Р. П. Лабораторные методы исследования в клинике . М.: Медицина, 1987. 368 с.
Acosta I. C. L., Costa A. P., Nunes P. H., Gondim M. F. N., Gatti A., Rossi J.L. Morphological and molecular characterization and phylogenetic relationships of a new species of trypanosome in Tapirus terrestris (lowland tapir), Trypanosoma terrestris sp. nov., from Atlantic Rainforest of southeastern Brazil // Parasites & Vectors. 2013. Vol. 6, Article number 349. URL: https://parasitesandvectors.biomedcentral.com/articles/10.1186/1756-3305-6-349 (дата обращения: 07.03.2025).
Baker D. G. Flynn’s Parasites of Laboratory Animals. John Wiley & Sons, 2008. P. 149–150.
Beebee T. J. C., Griffiths R. A. The amphibian decline crisis. A watershed for conservation biology? // Biological Conservation. 2005. Vol. 125, iss. 3. P. 271–285.
Bjelić-Čabrilo O., Popović E., Paunović A. Helminthofauna of Pelophylax kl. esculentus (Linne, 1758) from Petrovaradinski Rit Marsh (Serbia) // Helminthologia. 2009. Vol. 46. P. 107–111. URL: https://doi.org/10.2478/s11687-009-0021-z (дата обращения: 07.03.2025).
Coêlho T. A., De Souza D. C., Da Costa Oliveira E., Correa L. L., Viana L. A., Kawashita-Ribeiro R. A. Haemogregarine of genus Dactylosoma (Adeleorina: Dactylosomatidae) in species of Rhinella (Anura: Bufonidae) from the Brazilian Amazon // Acta Herpetologica. 2021. Vol. 66. P. 1574–1580. URL: https://europepmc.org/article/med/33997935 (дата обращения: 07.03.2025).
Comas M., Ribas A., Milazzo C., Sperone E., Tripepi S. High levels of prevalence related to age and body condition: host-parasite interactions in a water frog Pelophylax kl. hispanicus // Acta Herpetologica. 2014. Vol. 9, № 1. P. 25–31. URL: https://oaj.fupress.net/index.php/ah/article/view/1702/1702 (дата обращения: 07.03.2025).
Combes C. Parasites, biodiversity and ecosystem stability // Biodiversity and Conservation. 1996. Vol. 5. P. 953–962.
Davies A. J., Johnston M. R. L. The biology of some intraerythrocytic parasites of fishes, amphibians and reptiles // Advances in Parasitology. 2000. Vol. 45. P. 1–107.
Davis A. K., Devore J. L., Milanovich J. R., Cecala K., Maerz J. C., Yabsley M. J. New findings from an old pathogen: intraerythrocytic bacteria (family Anaplasmatacea) in red-backed salamanders Plethodon cinereus // EcoHealth. 2009. Vol. 6. P. 219–228.
Dobson A., Lafferty K. D., Kuris A. M., Hechinger R. F., Jetz W. Homage to Linnaeus: how many parasites? How many hosts? // Proceedings of the National Academy of Sciences of the United States of America. 2008. Vol. 105, suppl. 1. P. 11482–11489.
Du Preez L. H., Carruthers V. C. Complete Guide to the Frogs of Southern Africa. Cape Town: Struik Nature, 2009. 488 p.
Ferreira J. I. G. da S., da Costa A. P., Ramirez D., Roldan J. A. M., D. Saraiva G. F. R. et al. Anuran trypanosomes: phylogenetic evidence for new clades in Brazil // Systematic Parasitology. 2015. Vol. 91, iss. 1. P. 63–70. URL: https://doi.org/10.1007/s11230-015-9558-z (дата обращения: 07.03.2025).
Khokhlova I. S., Spinu M., Krasnov B. R., Degen A. A. Immune responses to fleas in two rodent species differing in natural prevalence of infestation and diversity of flea assemblages // Parasitology Research. 2004. Vol. 94, iss. 4. P. 304–311. DOI: 10.1007/s00436-004-1215-4.
Leal D. D. M., O’Dwyer L. H, Ribeiro V. C., Reinaldo J. S., Ferreira V. L., Rodrigues R. B. Hemoparasites of the genus Trypanosoma (Kinetoplastida: Trypanosomatidae) and hemogregarines in anurans of the Sao Paulo and Mato Grosso do Sul States- Brazil // Anais da Academia Brasileira de Ciências. 2009. Vol. 81, núm. 2. P. 199–206.
Netherlands E. C., Cook C. A., Kruger D. J. D., du Preez L. H., Smit N. J. Biodiversity of frog haemoparasites from sub-tropical northern KwaZulu-Natal, South Africa // International Journal for Parasitology: Parasites and Wildlife. 2015. Vol. 4, iss. 1. P. 135–141. URL: http://dx.doi.org/10.1016/j.ijppaw.2015.01.003 (дата обращения: 07.03.2025).
Netherlands E. C., Cook C. A., Smit N. J. Hepatozoon species (Adeleorina: Hepatozoidae) of African bufonids, with morphological description and molecular diagnosis of Hepatozoon ixoxo sp. nov. parasitising three Amietophrynus species (Anura: Bufonidae) // Parasites & Vectors. 2014a. Vol. 7, article 552.
Netherlands E. C., Cook C. A., Smit N. J., du Preez L. H. Redescription and molecular diagnosis of Hepatozoon theileri (Laveran, 1905) (Apicomplexa: Adeleorina: Hepatozoidae), infecting Amietia quecketti (Anura: Pyxicephalidae) // Folia Parasitologica. 2014b. Vol. 61, iss. 4. P. 293–300.
Pavľáková B., Pipová N., Balogová M., Majláth I., Mikulíček P., Majláthova V. Blood parasites of water frogs (Pelophylax esculentus complex) from the Danube Delta, Romania // Parasitology International. 2024. Vol. 102. Article 102920. DOI: 10.1016/j.parint.2024.102920 (дата обращения: 07.03.2025).
Peskova T. Yu., Bachevskaya O. N., Plotnikov G. K. Hemoparasites of the Lake Frog Pelophylax ridibundus (Pallas, 1771) (Ranidae, Anura) Inhabiting Reservoirs of the North-Western Ciscaucasia // Современная герпетология. 2018. Т. 18, вып. 3/4. С. 146–152. DOI: 10.18500/1814-6090-2018-18-3-4-146-152.
Rajabi F., Javanbakht H., Sajjadi S. S. A preliminary study of haemoparasites in marsh frogs, Pelophylax ridibundus (Ranidae) from Iran // Journal of Entomology and Zoology Studies. 2017. Vol. 5, iss. 4. P. 1314–1317.
Readel A. M., Goldberg T. L. Blood parasites of frogs from an equatorial African montane forest in western Uganda // Journal of Parasitoljgy. 2010. Vol. 96, № 2. P. 448–450.
Rubenina I., Kirjusina M., Ceirans A., Gravele E., Gavarane I., Pupins M., Krasnov B. R. Environmental, anthropogenic, and spatial factors affecting species composition and species associations in helminth communities of water frogs (Pelophylax esculentus complex) in Latvia // Parasitology Research. 2021. Vol. 120, iss. 10. P. 3461–3474. DOI: 10.1007/s00436-021-07303-8 (дата обращения: 08.03.2025).
Satapathy A., Bhatt T. K. In-vitro evaluation of lead molecule // The Design and Development of Novel Drugs and Vaccines. Elsevier. 2021. P. 239–245. DOI: 10.1016/B978-0-12-821471-8.00018-0 (дата обращения: 08.03.2025).
Sailasuta A., Satetasit J., Chutmongkonkul M. Pathological Study of Blood parasites in Rice Field Frogs, Hoplobatrachus rugulosus (Wiegmann, 1834) // Veterinary Medicine International. 2011. Article ID 850568. P. 1–5. URL: https://pmc.ncbi.nlm.nih.gov/articles/PMC3171767/pdf/VMI2011-850568.pdf (дата обращения: 08.03.2025).
Stuart S. N., Chanson J. S., Cox N. A., Young B. E., Rodrigues A. S., Fischman D. L. et al. Status and trends of amphibian declines and extinctions worldwide // Science. 2004. Vol. 306. P. 1783–1786. DOI: 10.1126/science.1103538.






 © 2011 - 2026
© 2011 - 2026