Введение
Обыкновенный бобр (Castor fiber L.) – вид-реинтродуцент на территории Костромской области, практически уничтоженный в ее экосистемах человеком к началу ХХ в. В 1958 г. бобры были завезены из Воронежского заповедника в Костромскую область, где широко распространились по всем подходящим водоемам и водотокам. Бобры успешно освоили и особо охраняемые природные территории, где отсутствует антропогенное влияние и фактор беспокойства (Зайцев и др., 2018). В экосистемах бобры играют средообразующую роль вида-эдификатора и значительно изменяют гидрологический режим водотоков, влияют на гидрохимические свойства природных вод, оказывают формирующее действие на состав и количественные характеристики гидробиоценозов (Крылов, 2005; Завьялов, 2015; Завьялов и др., 2005). Под воздействием зоогенного фактора меняется состав водных экосистем, в них начинают развиваться виды, характерные для лентических гидробиоценозов. Изменения затрагивают и береговые фитоценозы, водную и прибрежно-водную растительность (Завьялов, 2015; Завьялов и др., 2005). Мониторинг этих процессов является особенно актуальным на заповедных территориях, где особое внимание уделяется сохранению уникальных коренных участков леса, которые не подвергались воздействию антропогенного фактора.
На изменения, привносимые бобрами в природные экосистемы, чутко реагируют организмы зоопланктона. При запруживании русел рек, уменьшении скорости течения, как правило, происходит увеличение численности и биомассы зоопланктона, меняется его таксономическая структура и состав экологических групп (Крылов, 2005, 2008, 2012; Czerniawski et al., 2017; Осипов и др., 2017; Grudzinski et al., 2022). Обыкновенный бобр, выступая в качестве средообразующего вида, влияет на параметры среды обитания зоопланктонных организмов. Важной задачей представляется выявление конкретных абиотических факторов, которые изменяются под воздействием зоогенного фактора и составляют экологический спектр параметров, оказывающих влияние на развитие зоопланктоценозов. Организмы зоопланктона могут служить биоиндикаторами состояния гидроэкосистем (Макеев, Гаврилко, 2014; Кадочников, 2014; Голубева, 2016; Ильин и др., 2016; Шурганова и др., 2017; Лобуничева и др., 2023). Сообщества зоопланктона могут быть использованы для мониторинга сукцессионных процессов на заповедных территориях, которые подвергаются зоогенному воздействию, что обусловливает актуальность проведенных исследований.
Целью исследований было выявить влияние Castor fiber на сообщества зоопланктона и абиотические факторы среды, имеющие значение для развития зоопланктона малых рек на заповедной территории.
Материалы
Исследования проводились на территории государственного природного заповедника «Кологривский лес» им. М. Г. Синицына (рис. 1) в июне 2023 г. Заповедник расположен в подзоне южной тайги на территории Костромской области и предназначен для сохранения участка уникальных коренных темнохвойных лесов. Изучен зоопланктон малых рек кологривского участка заповедника (Понга, Лондушка, Сеха, Ломенга, Черная, Талица). Пробы зоопланктона отбирали на участках, не подверженных зоогенной деятельности, и на участках рек, трансформированных Castor fiber.
Река Сеха имеет длину 34 км, ширина на изученных участках составляла 4.0–7.6 м при глубине 0.28–0.7 м. Скорость течения находилась в диапазоне 0.2–0.31 м/с. Исследования проводились в верхнем, среднем и нижнем течении реки. Рипаль р. Сехи во многих местах покрыта макрофитами.
Река Понга имеет длину 73 км, ширину от 8.1 до 18.0 м, образуется при слиянии рек Лондушки и Сехи. Исследования проводились в верхнем и среднем течении реки. На изученных участках глубина реки составляла от 0.15 до 0.30 м на перекатах и до 2 м в плесах. Скорость течения реки колебалась от 0.55 м/с на перекатах до 0.09 м/с в плесах.
Река Лондушка имеет длину 26 км, глубину 0.4–0.6 м на перекатах и до 1.5 м и более в плесах, ширина реки на исследованных участках составляет от 2.0 до 3.5 м в летнюю межень и до 5–10 м в весенний период. Исследования проводились в среднем и нижнем течении реки. Скорость течения изменялась от 0.57 м/с на проточной части реки до нулевых значений на участках, подпруженных бобровыми плотинами. Русло реки в значительной мере зарастает высшей водной растительностью.
Река Черная является притоком р. Сехи, имеет длину около 8 км. Ширина водотока составляла от 2.3 до 6.3 м, скорость течения – 0.33–0.6 м/с. Исследования проводились в среднем и нижнем течении реки.
Река Талица – приток р. Понги. Значительная часть реки преобразована зоогенной деятельностью обыкновенного бобра, однако в период исследования бобровые поселения оказались нежилыми. На исследованном участке средняя глубина реки составила 0.4 м при ширине 4 м.
Река Ломенга является правым притоком реки Лондушки, ее длина составляет 14 км, средняя ширина реки на изученном участке находилась в пределах 4.7–4.9 м, глубина – 0.54 м. Скорость течения составляла 0.03–0.15 м/с. Низкая скорость течения была обусловлена подпруживанием реки бобровой плотиной.
Изученные бобровые пруды – это пруды руслового типа, отгороженные плотинами, они не образовывали больших разливов. Хотя подобные пруды могут существовать в течение нескольких сезонов, но в период весеннего половодья они промываются талыми водами.
Методы
Отбор проб проводился количественной сетью Джеди (размер ячеи 74 мкм) путем процеживания 50 л воды, пробы фиксировались формалином, концентрация доводилась до 4 %. Отобрано 86 количественных и 27 качественных проб, обработку проб проводили с помощью традиционных гидробиологических методик (Салазкин и др., 1982). Оценка видового разнообразия выполнена с помощью информационного индекса Шеннона – Уивера (Нn), бит/экз. (Shannon, Weaver, 1963), выравненность оценивалась по индексу Пиелу (En) (Pielou, 1966), доминирующие виды выделены при помощи индекса Палия – Ковнацки (D) (Шитиков и др., 2003).
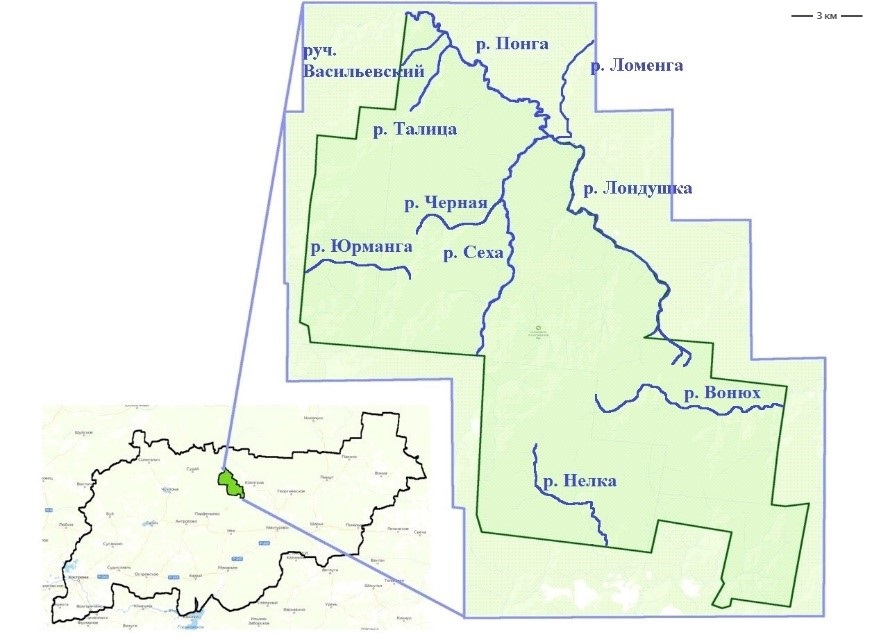
Рис. 1. Основные реки на кологривском участке заповедника «Кологривский лес» с привязкой к территории Костромской области
Fig. 1. The main rivers in the Kologrivsky cluster of the Kologrivsky Forest nature reserve with reference to the territory of the Kostroma region
Одновременно с отбором проб зоопланктона проводили измерения температуры воды, рН измеряли карманным водонепроницаемым pH-метром HI 98127 pHep4 (Hanna Instruments, США). Для расчета БПК5 количество растворенного кислорода измеряли амперометрическим датчиком растворенного кислорода с термоэлектрическим преобразователем ДКТП-02 и комбинированным анализатором жидкости «Эксперт-001-2.0.1». Удельную электропроводность измеряли кондуктометром «Эксперт-002-2-6п» с погружным датчиком УЭП-П-С для водоемов. Статистическую обработку полученных результатов проводили в программах Statistica 12 и Microsoft Excel. Проверку равенства медиан и значимости полученных данных осуществляли при помощи U-критерия Манна – Уитни (Mann, Whitney, 1947), ранговую корреляцию оценивали при помощи теста Спирмена (Кобзарь, 2006).
Результаты
В результате исследований в составе зоопланктона малых рек изученного участка южной тайги выявлено 107 видов, из них к надотряду Cladocera относятся 42 вида (39.2 %), к классу Веслоногие (Copepoda) – 19 видов (17.8 %), к типу Коловратки (Rotifera) – 46 видов (43 %). Для исследованных водотоков и их зарегулированных участков были выделены доминирующие виды. На изученных участках реки Сехи доминировали ювенильные стадии Copepoda (D = 14.91–60.21), Ceriodaphnia megops Sars, 1862 (D = 13.50–16.25), Scapholeberis mucronata (O. F. Müller, 1776) (D = 2.33–12.26), Euchlanis dilatata Ehrenberg, 1832 (D = 7.41–19.62). На р. Понге кроме копеподитов и науплиусов Copepoda в числе доминантов и субдоминантов были взрослые Eucyclops serrulatus (D = 1.43–15.52) и коловратки Euchlanis dilatata (D = 2.73–43.33). На р. Лондушке, кроме ювенильных Copepoda (D = 9.63–26.05), преобладали Acroperus harpae (Baird, 1834) (D = 6.17–11.76) и Euchlanis dilatata (D = 7.23–10.92). Для реки Черной доминантом являлся Polyphemus pediculus (Linnaeus, 1761) при значении индекса D = 80.59–90.15. Копеподиты Cyclopoida находились в числе доминантов и субдоминантов (D = 5.31–12.94). На р. Талице преобладали копеподиты Cyclopoida (D = 16.89–40.90), среди Cladocera доминировали Polyphemus pediculus (D = 11.25–18.12). Также к числу доминантов и субдоминантов относились Euchlanis dilatata (D = 7.93–22.72). На изученном участке р. Ломенги доминировали копеподиты Cyclopoida (D = 22.34–75.87), к числу доминантов и субдоминантов относились науплиусы Cyclopoida (D = 1.10–19.56), Daphnia (Daphnia) longispina (O.F.Müller, 1776) (D = 2.63–12.62) и Scapholeberis mucronata (D = 1.62–10.47).
На участках рек, подверженных зоогенной деятельности, доминантами и субдоминантами являлись ювенильные стадии Copepoda (D = 2.85–40.92), Alona affinis (Leydig, 1860) (D = 2.32–12.18), Ceriodaphnia megops (D = 2.04–43.56) и Chydorus sphaericus (O. F. Müller, 1776) (D = 2.34–24.75), Polyarthra vulgaris Carlin, 1943 (D = 7.31–15.99), Euchlanis dilatata (D = 2.88–12.84) и Conochilus unicornis Rousselet, 1892 (D = 8.24–12.08).
В июне 2023 г. средние показатели численности и биомассы зоопланктона исследованных рек имели невысокие значения (табл. 1). Самая высокая численность зоопланктона отмечена для участков рек, подверженных зоогенному влиянию. Наиболее высокие значения биомассы зоопланктона наблюдались на станциях отбора проб на р. Ломенге, на р. Лондушке и на участках рек, подверженных деятельности обыкновенного бобра.
Таблица 1. Средние показатели численности, биомассы, индекса видового разнообразия (Нn), индекса выравненности (En) зоопланктона исследованных рек в июне 2023 г.
| Название реки | Численность, тыс. экз./м3 | Биомасса, мг/м3 | Нn | En |
| Сеха | 12.23 ± 3.53 | 286.21 ± 91.35 | 2.35 ± 0.11 | 0.78 ± 0.02 |
| Понга | 6.99 ± 1.33 | 128.41 ± 34.60 | 2.07 ± 0.12 | 0.78 ± 0.03 |
| Лондушка | 19.55 ± 4.24 | 625.56 ± 197.24 | 1.70 ± 0.24 | 0.68 ± 0.09 |
| Черная | 4.72 ± 0.94 | 322.91 ± 78.56 | 0.78 ± 0.15 | 0.36 ± 0.09 |
| Талица | 0.44 ± 0.09 | 15.95 ± 3.21 | 2.18 ± 0.12 | 0.84 ± 0.02 |
| Ломенга | 23.80 ± 9.57 | 1171.72 ± 268.25 | 2.98 ± 0.06 | 0.83 ± 0.02 |
| Участки рек, подверженные зоогенной деятельности | 71.39 ± 18.84 | 608.10 ± 133 | 2.44 ± 0.12 | 0.69 ± 0.03 |
Следует отметить, что реки Лондушка и Ломенга в период исследования были в высокой степени зарегулированы бобрами таким образом, что и на участках, достаточно удаленных от бобровых плотин, течение отсутствовало, что отразилось на повышении биомассы зоопланктона. Значения индекса видового разнообразия Шеннона – Уивера были наиболее высокими на исследованных участках р. Ломенги, но на остальных изученных водотоках этот показатель ниже, чем на участках, подверженных зоогенной деятельности. Индекс выравненности по Пиелу на участках рек, подверженных зоогенному влиянию, в среднем ниже большинства аналогичных показателей для участков водотоков, не подверженных влиянию бобра. Однако самый низкий индекс выравненности по Пиелу характерен для р. Черной (см. табл. 1).
Значимость отмеченных закономерностей можно подтвердить с помощью статистических методов, используя коэффициент Манна – Уитни. В результате исследований выявлено, что показатели численности зоопланктона на участках малых рек на территории заповедника «Кологривский лес», подверженных зоогенной деятельности, значимо выше по сравнению с участками рек без влияния обыкновенного бобра (рис. 2А) (р = 0.000033). Также значимым является влияние зоогенного фактора на биомассу зоопланктона (рис. 2Б) (р = 0.000101).
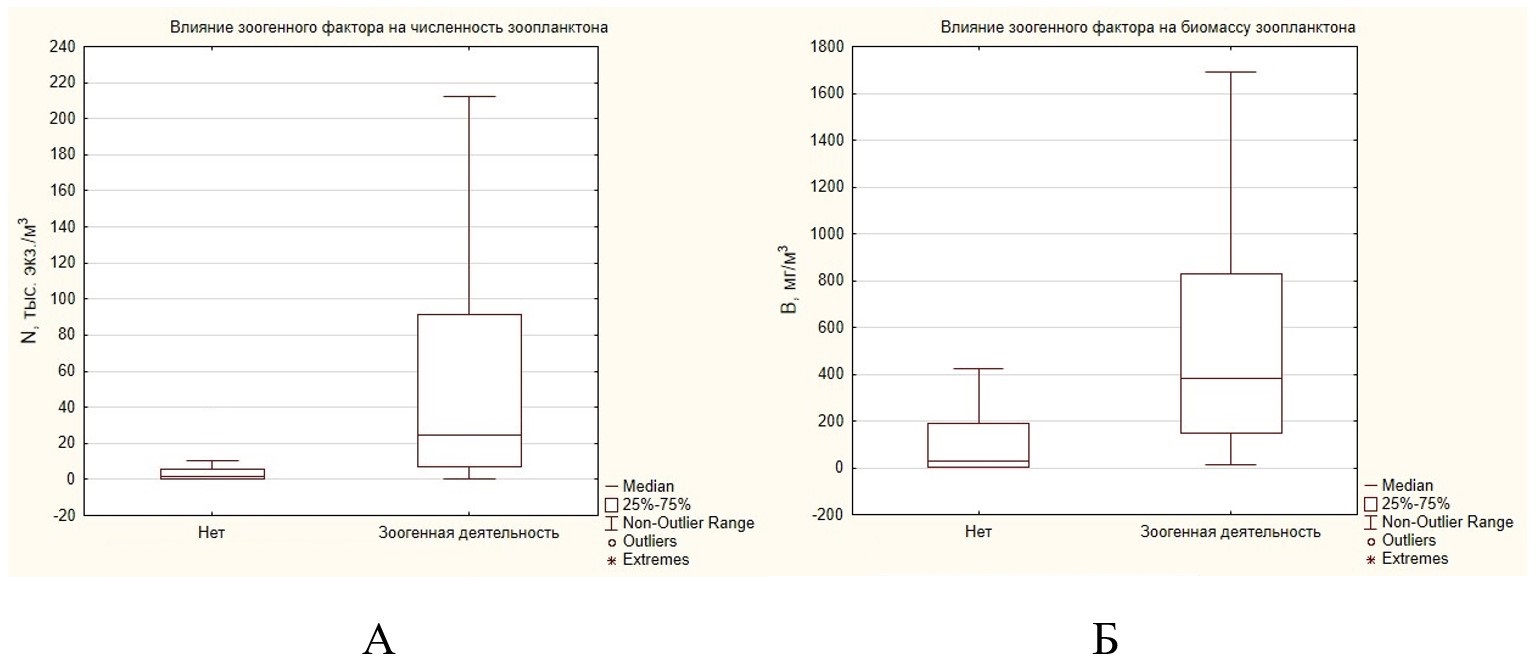
Рис. 2. Влияние зоогенного фактора на численность и биомассу зоопланктона
Fig. 2. The influence of the zoogenic factor on the abundance and biomass of zooplankton
Зоогенный фактор оказывается связанным и с видовым разнообразием в зоопланктоценозах. Анализ с помощью коэффициента Манна – Уитни значений индекса видового разнообразия Шеннона – Уивера (Hn) в условиях зоогенного воздействия и без него показал существующую зависимость (рис. 3А). Видовое разнообразие зоопланктона в условиях зоогенной деятельности повышается. Разница между медианными значениями индексов в условиях зоогенного пресса и без него является значимой (р = 0.021069).
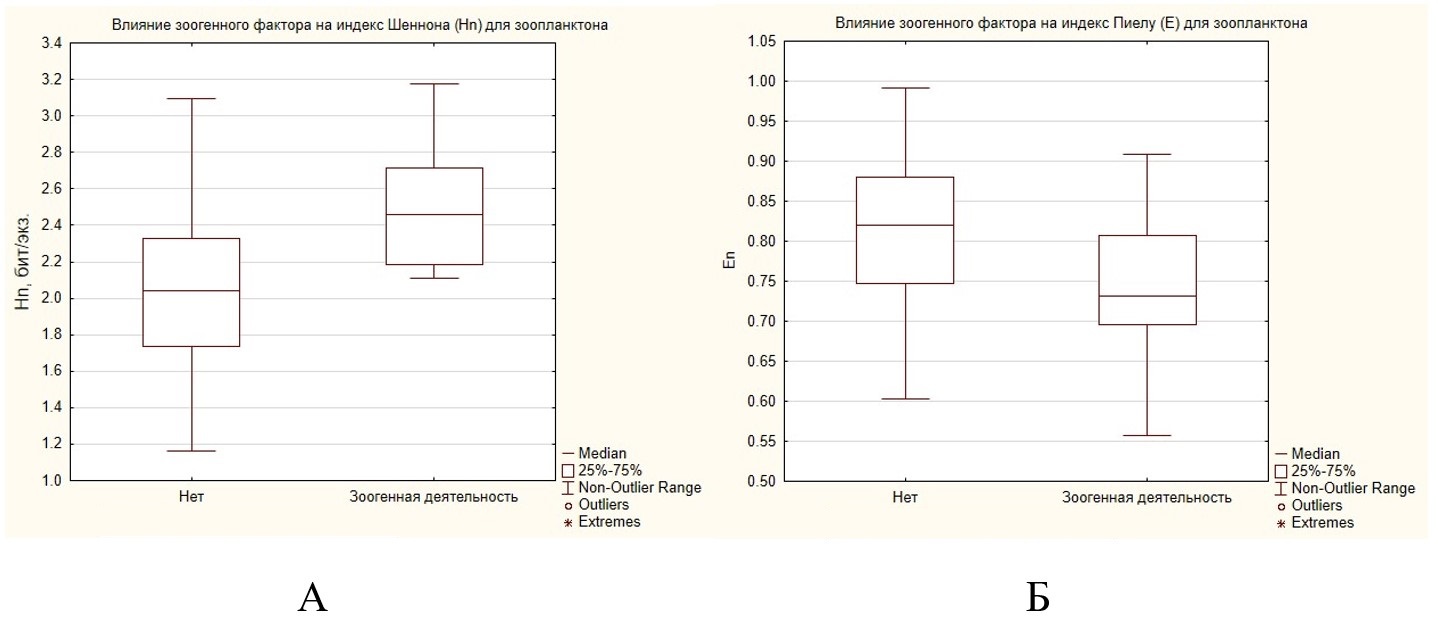
Рис. 3. Влияние зоогенного фактора на индекс видового разнообразия зоопланктона Шеннона – Уивера (Hn) и индекс выровненности по Пиелу (Еn)
Fig. 3. The influence of the zoogenic factor on the Shannon – Weaver index of zooplankton species diversity (Hn) and the Pielou evenness index (En)
Одновременно коэффициент Манна – Уитни позволил найти закономерность между действием зоогенного фактора и индексом выравненности по Пиелу (Еn) (рис. 3Б). При отсутствии зоогенной деятельности значения индекса по Пиелу выше, соответственно, сообщество зоопланктона является более выравненным. Разница между значениями индекса выравненности является существенной при уровне значимости (р = 0.010159), что является значимым. При зоогенном воздействии в бобровых прудах на определенных стадиях сукцессии в массе могут развиваться крупные ветвистоусые (Daphnia longispina, Polyphemus pediculus), что снижает выравненность сообществ.
Обыкновенный бобр как средообразующий вид оказывает опосредованное действие на зоопланктоценозы через изменение значений ряда абиотических факторов, среди которых важнейшую роль играет замедление скорости течения водотоков (Крылов, 2005). Однако зоогенный фактор влияет и на другие абиотические факторы, имеющие важное значение для развития зоопланктона. Нами на станциях отбора зоопланктонных проб фиксировались показатели (табл. 2) и анализировалось влияние зоогенного фактора, который выступал в качестве эдификатора, изменяя ряд характеристик среды обитания зоопланктонных организмов. Значимость влияния зоогенного фактора определялась при помощи коэффициента Манна – Уитни.
Таблица 2. Некоторые абиотические показатели на исследованных участках водотоков
| Название реки | Температура, °С | рН | БПК5 | Удельная электропроводность (ЕС), мкСм/см |
| Сеха | 15.07 ± 0.69 | 7.42 ± 0.09 | 1.06 ± 0.21 | 44.04 ± 5.75 |
| Понга | 11.8 ± 0.19 | 7.37 ± 0.05 | 1.91 ± 0.19 | 63.77 ± 0.78 |
| Лондушка | 12.96 ± 0.80 | 6.95 ± 0.16 | 3.19 ± 0.55 | 54.01 ± 4.64 |
| Черная | 15.65 ± 0.02 | 8.0 ± 0.01 | 2.73 ± 1.48 | 53.16 ± 4.45 |
| Талица | 15.01 ± 0.01 | 7.45 ± 0.15 | -* | 64.11 ± 25.20 |
| Ломенга | 15.00 ± 0.01 | 7.10 ± 0.30 | 1.54 ± 0.53 | 42.9 ± 6.72 |
| Участки рек, подверженные зоогенной деятельности | 16.76 ± 0.68 | 6.32 ± 0.16 | 4.01 ± 0.52 | 12.14 ± 2.45 |
Примечание. * – данные отсутствуют.
Так, в условиях действия зоогенного фактора температура оказалась значительно более высокой по сравнению с незарегулированными участками водотоков (рис. 4А). Разница между значениями является существенной при уровне значимости р = 0.000019. В отсутствии течения бобровые пруды лучше прогреваются солнцем, что обеспечивает более высокую температуру и создает благоприятные условия для развития зоопланктона. Также нами выявлена зависимость между наличием зоогенной деятельности и значениями водородного показателя (рН) (рис. 4Б).
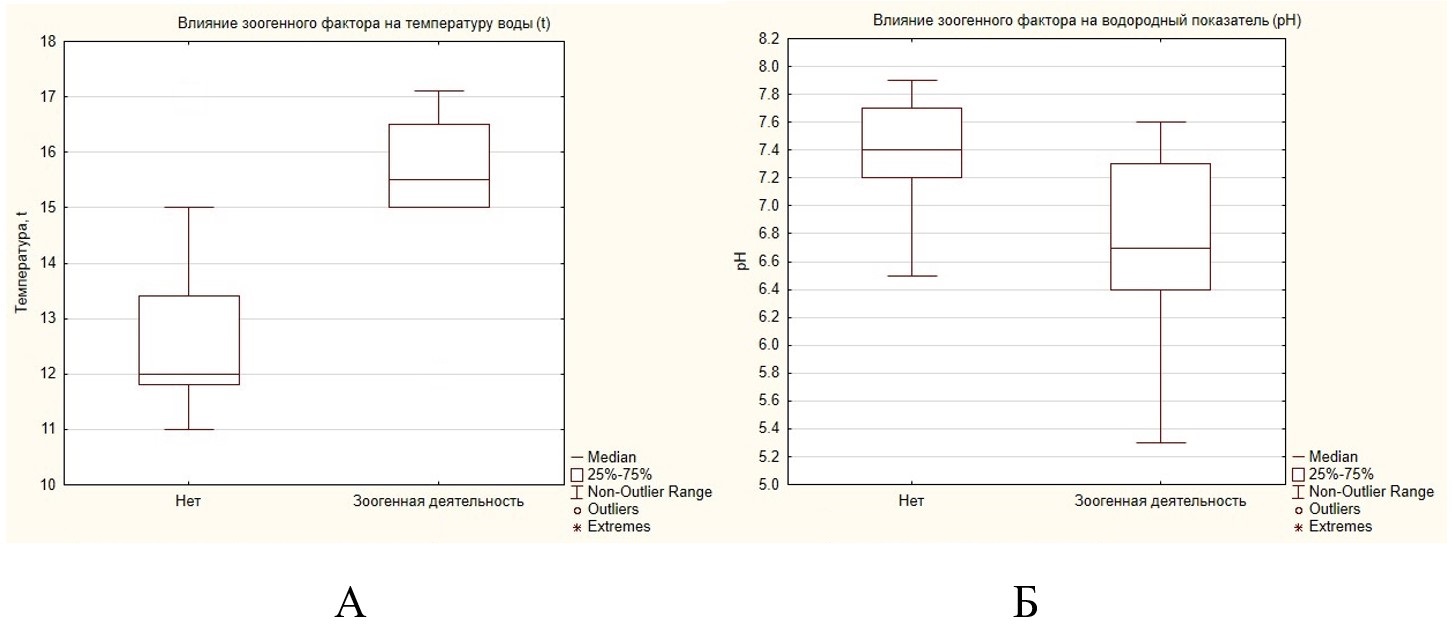
Рис. 4. Влияние зоогенного фактора на температуру и водородный показатель (рН) воды водотоков и водоемов исследованной территории
Fig. 4. The influence of the zoogenic factor on the temperature and pH value of water in watercourses and waterbodies in the studied area
Значения водородного показателя на участках водотоков и водоемов без зоогенной деятельности выше по сравнению с участками, подверженными влиянию обыкновенного бобра. Разница между значениями показателей без зоогенного влияния и с его наличием является существенной при уровне значимости р = 0.000314.
Зоогенный фактор также оказывает влияние на биологическое потребление кислорода (БПК5) (рис. 5А). Биологическое потребление кислорода является одним из важных критериев определения уровня загрязнения водных объектов органическими веществами и отражает содержание легкоокисляющихся органических веществ.
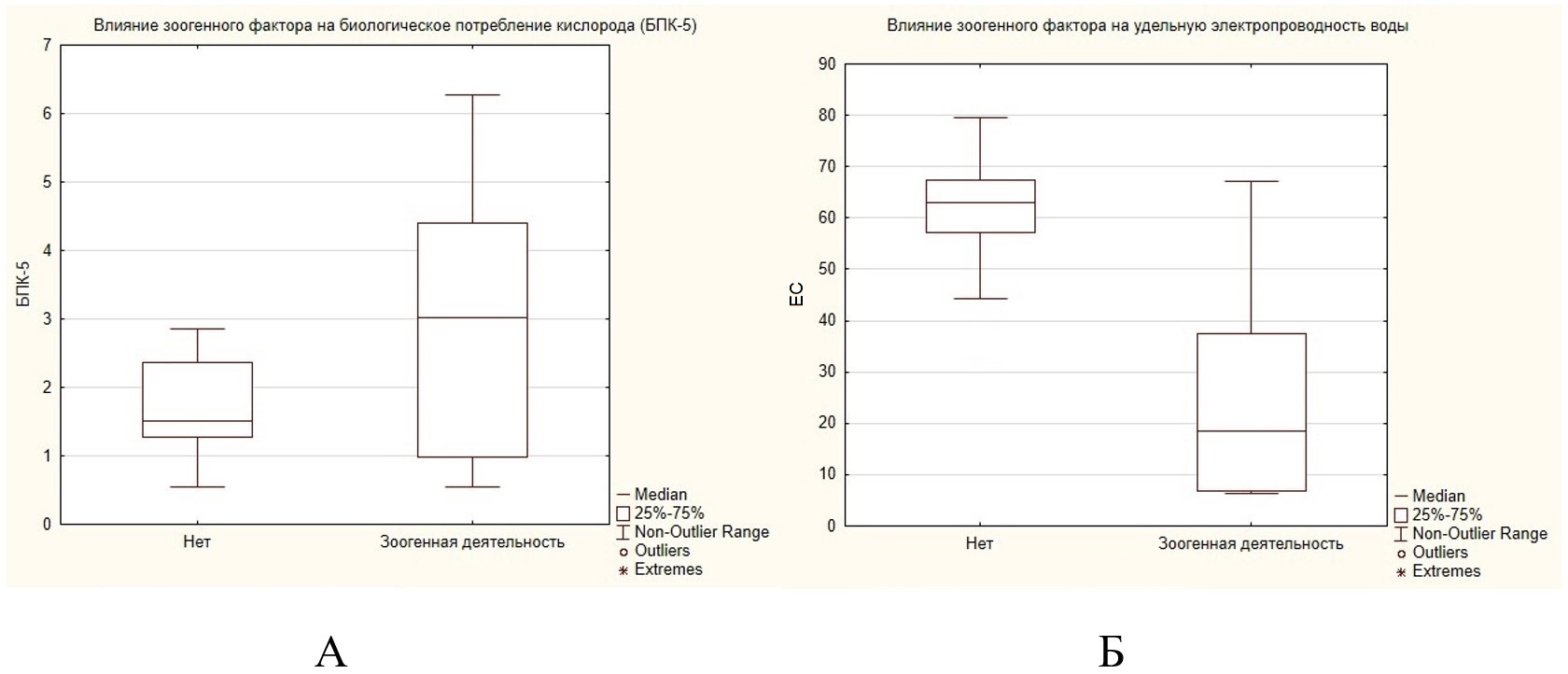
Рис. 5. Влияние зоогенного фактора на значения биологического потребления кислорода (БПК5) и удельной электропроводности (ЕС), мкСм/см
Fig. 5. The influence of the zoogenic factor on the values of biological oxygen demand (BOD5) and specific electrical conductivity (EC), µS/cm
На участках, подверженных зоогенной деятельности, значения БПК5 являются достоверно более высокими по сравнению с участками, не подверженными влиянию обыкновенного бобра. Разница является статистически значимой (p = 0.012125). Повышение значений БПК5 связано с наличием органического загрязнения участков, подверженных влиянию зоогенного фактора. Кроме экскретов и экскрементов бобра органика поступает в воды рек вместе с остатками древесины и макрофитов, наличие которых в водотоках обусловлено трофической и строительной деятельностью бобра.
Действие зоогенного фактора оказывает влияние и на значения удельной электропроводности (ЕС). Значения удельной электропроводности выше на участках, не подверженных зоогенной деятельности, по сравнению с участками, подверженными влиянию обыкновенного бобра. Разница между значениями является существенной при уровне значимости р = 0.000008. Удельная электропроводность поверхностных вод характеризует приблизительную концентрацию в воде неорганических электролитов – катионов и анионов.
Также нами был проведен корреляционный анализ по Спирмену и выявлена корреляционная зависимость и значимость факторов, влияющих на показатели зоопланктона (табл. 3).
Таблица 3. Корреляционная зависимость показателей и факторов исследуемых водоемов (ранговая корреляция Спирмена)
| N | B | Hn | En | pH | t | ЕС | БПК5 | ЗФ* | |
| N | 1.00 | ||||||||
| B | 0.93 | 1.00 | |||||||
| Hn | 0.29 | 0.37 | 1.00 | ||||||
| En | -0.43 | -0.38 | 0.19 | 1.00 | |||||
| pH | -0.53 | -0.43 | -0.35 | 0.26 | 1.00 | ||||
| t | 0.36 | 0.33 | 0.35 | -0.36 | -0.47 | 1.00 | |||
| ЕС | -0.51 | -0.40 | -0.32 | 0.29 | 0.56 | -0.79 | 1.00 | ||
| БПК5 | 0.30 | 0.24 | -0.01 | -0.05 | -0.42 | 0.09 | -0.28 | 1.00 | |
| ЗФ* | 0.62 | 0.58 | 0.35 | -0.38 | -0.54 | 0.64 | -0.67 | 0.38 | 1.00 |
Примечание. ЗФ – зоогенный фактор; значимые коэффициенты (p < 0.05) выделены.
В табл. 3 показана умеренная прямая зависимость (0.3 ≤ p ≤ 0.7) численности, биомассы зоопланктона, индекса Шеннона – Уивера, температуры водотока, значений БПК5 от наличия зоогенного фактора. В отношении рН среды, значений удельной электропроводности, индекса выравненности по Пиелу отмечается умеренная обратная зависимость.
Обсуждение
Количественные и структурные показатели сообществ зоопланктона речных экосистем зависят от комплекса экологических факторов. Среди них для водотоков особенно важными являются гидрологические факторы (Крылов, 2002, 2005). Одновременно биотические факторы обладают значительной эдификаторной ролью, влияя на абиотические характеристики среды. Среди биотических факторов особенно заметное влияние на сообщества зоопланктона имеют высшие водные растения (Крылов, 2005; Мухортова, 2011; Гаврилко, 2019) и деятельность обыкновенного бобра (Крылов, 2005; Завьялов и др., 2005, 2015). Заросли макрофитов в водотоках могут снижать скорость течения, создавать убежища для зоопланктеров, что положительно сказывается на развитии зоопланктона. Но наибольшее влияние на комплекс условий обитания зоопланктона оказывает зоогенный фактор. Под его влиянием значительно снижается (порой до нулевых значений) скорость течения водотока, изменяются значения температуры, водородного показателя, содержания кислорода, удельной электропроводности и др.
Общий видовой состав зоопланктона исследованных участков рек характеризуется доминированием ювенильных стадий Copepoda и широким распространением коловраток Euchlanis dilatata. Доминирование науплиальных и копеподитных стадий веслоногих рачков отмечено как для незарегулированных участков рек, так и для участков, где наблюдалась зоогенная деятельность. Однако на участках, подверженных влиянию обыкновенного бобра, выявлено большее количество ветвистоусых рачков и коловраток в качестве субдоминантов и доминантов (Alona affinis, Ceriodaphnia megops, Chydorus sphaericus, Polyarthra vulgaris, Euchlanis dilatata, Conochilus unicornis). Таким образом, в условиях влияния зоогенного фактора увеличивается доля ветвистоусых, являющихся плавающими и ползающими вторичными фильтраторами и коловраток – вертикаторов, что связано с повышением концентрации питательной взвеси в воде бобрового пруда.
Зоогенный фактор оказывает влияние на количественные показатели зоопланктона – численность и биомассу, по которым мы отмечаем значимо более высокие значения, что подтверждается коэффициентом Манна – Уитни. Также успешное развитие сообществ зоопланктона отражает индекс видового разнообразия Шеннона – Уивера, который в условиях зоогенного фактора является значимо более высоким по сравнению с незарегулированными участками рек. Однако при протекании зоогенных сукцессий в бобровых прудах могут в массе развиваться крупные ветвистоусые ракообразные (Крылов, 2005), что может привести к снижению индекса выравненности по Пиелу, что также подтверждается значениями коэффициента Манна – Уитни.
Зоогенный фактор оказывает влияние на абиотические факторы среды, нами отмечено влияние деятельности Castor fiber на температуру водотока, значения БПК5, вызывающее увеличение этих показателей. Повышение температуры воды связано с лучшей прогреваемостью вод в условиях замедленного водотока. Увеличение значений БПК5 вызвано увеличением содержания органических веществ в воде зоогенно трансформированных участков, что требует большего количества кислорода для процессов его окисления. Одновременно в зоогенно трансформированных водотоках значения рН сдвигаются в сторону более кислых, отмечена более низкая электропроводность воды. Кислотность воды, как правило, увеличивается при более активном распаде органических веществ, которым характеризуются зарегулированные участки водотоков. Электропроводность воды – показатель, который связан со значениями кислотности природных вод (Женихов и др., 2022), уменьшающийся при снижении значений рН.
Заключение
Таким образом, ведущим биотическим фактором, определяющим развитие сообществ зоопланктона малых рек на территории государственного природного заповедника «Кологривский лес» им. М. Г. Синицына, является зоогенная деятельность. Обыкновенный бобр формирует в изученных водотоках специфичные условия в рефугиумах зоопланктонных организмов, которые значимо отличаются от параметров среды на участках рек, не подверженных зоогенной деятельности. Сложный комплекс факторов, складывающийся в зоогенно трансформированных участках водотоков, обеспечивает успешное развитие зоопланктонных организмов, что проявляется в повышении количественных показателей зоопланктона, в увеличении значений индекса видового разнообразия, а также отражается на изменении видового состава зоопланктоценозов.
Библиография
Гаврилко Д. Е. Структурно-функциональная организация сообществ зоопланктона зарослей высших водных растений (на примере водотоков Нижегородской области) : Дис. ... канд. биол. наук. Н. Новгород, 2019. 279 с.
Голубева Д. О., Золотарева Т. В., Кудрин И. А., Шурганова Г. В. Биоиндикация малых рек нагорной части Нижнего Новгорода на основе анализа видовой структуры зоопланктона // Сборник докладов VI Всероссийского фестиваля науки. Н. Новгород: ННГАСУ, 2016. С. 423–426.
Женихов К. Ю., Женихов Ю. Н., Шлеттерер М., Кузовлев В. В. Многолетние исследования влияния болотных вод на гидрохимический режим реки Тудовки в естественных условиях // Сборник Всероссийской конференции с международным участием, посвященной 90-летию организации Центрально-Лесного государственного природного биосферного заповедника, 150-летию основателя и первого директора Григория Леонидовича Граве, 140-летию эколога, профессора Владимира Владимировича Станчинского. М.: Т-во научн. изданий КМК, 2022. С. 176–184.
Завьялов Н. А. Средообразующая деятельность бобра (Castor fiber L.) в европейской части России . Великий Новгород, 2015. 320 с. (Труды государственного природного заповедника «Рдейский». Вып. 3).
Завьялов H. A., Крылов A. B., Бобров A. A., Иванов В. К., Дгебуадзе Ю. Ю. Влияние речного бобра на экосистемы малых рек . М.: Наука, 2005. 186 с.
Зайцев В. А., Сиротина М. В., Мурадова Л. В., Ситникова О. Н. Бобры заповедника «Кологривский лес» // Бобры в заповедниках европейской части России / Под ред. Н. А. Завьялова, Л. А. Хляп. Великие Луки: ООО «Великолукская типография», 2018. С. 125–180.
Ильин М. Ю., Кудрин И. А., Золотарева (Куклина) Т. В., Шурганова Г. В. Биоиндикация водных объектов особо охраняемых природных территорий Нижегородской области на основе анализа видовой структуры зоопланктона // Вода: химия и экология. № 3. Н. Новгород, 2016. С. 60–66.
Кадочников Д. А., Кузнецова Е. М., Овчанкова Н. Б. Оценка экологического состояния малых рек г. Перми (р. Егошихи и р. Данилихи) по биологическим показателям // Экосистемы малых рек: биоразнообразие, экология, охрана: Материалы лекций II Всероссийской школы-конференции 18–22 ноября 2014 г. Т. II. Ярославль, 2014. С. 172–174.
Кобзарь А. И. Прикладная математическая статистика . М.: Физматлит, 2006. 816 с.
Крылов А. В. Влияние жизнедеятельности бобров на зоопланктон предгорной реки (Монголия) // Биология внутренних вод. 2008. № 1. С. 78–80. DOI: 10.1007/s12212-008-1011-4
Крылов А. В. Изменение структурной организации зоопланктона малой реки в условиях различной проточности // Биология внутренних вод. 2002. № 2. С. 51–54.
Крылов А. В. Зоопланктон равнинных малых рек . М.: Наука, 2005. 263 с.
Крылов А. В. Речной бобр (Castor fiber L.) как ключевой вид экосистемы малой реки (на примере Приокско-Террасного государственного биосферного природного заповедника) . М.: Т-во научн. изданий КМК, 2012. С. 60–77.
Лобуничева Е. В., Макарёнкова Н. Н., Ивичева К. Н., Филоненко И. В., Литвин А. И., Попета Е. С., Думнич Н. В. Оценка экологического состояния малой реки урбанизированной территории по характеристикам фитопланктона, зоопланктона и зообентоса на примере р. Содема (Вологодская область) // Трансформация экосистем. 2023. № 6 (4). С. 119–140. DOI: 10.23859/estr-230922
Макеев И. С., Гаврилко Д. Е. Метазойный планктон как показатель экологического состояния малых водотоков Нижнего Новгорода // Зоологические исследования регионов России и сопредельных территорий: Материалы III Международной научной конференции / Под ред. проф. А. И. Дмитриева. Н. Новгород: НГПУ им. К. Минина, 2014. С. 123–127.
Мухортова О. В. Фитофильные сообщества зоопланктона нижнего течения реки Сок // Особенности пресноводных экосистем малых рек Волжского бассейна. / Под ред. Г. С. Розенберга, Т. Д. Зинченко. Тольятти: Кассандра, 2011. С. 121–128.
Осипов В. В., Башинский И. В., Подшивалина В. Н. О влиянии деятельности речного бобра – Сastor fiber (Сastoridae, Mammalia) на биоразнообразие экосистем малых рек лесостепной зоны // Поволжский экологический журнал. 2017. № 1. С. 69–83. DOI: 10.18500/1684-7318-2017-1-69-83
Салазкин А. А., Иванова М. Б., Огородникова В. А. Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах. Зоопланктон и его продукция . Л.: ГосНИОРХ, 1982. 55 с.
Шитиков В. К., Розенберг Г. С., Зинченко Т. Д. Количественная гидроэкология: методы современной идентификации . Тольятти: ИЭВБ РАН, 2003. 463 с.
Шурганова Г. В., Кудрин И. А., Гаврилко Д. Е., Ильин М. Ю., Золотарева Т. В., Жихарев В. С., Голубева Д. О. Изменения видовой структуры зоопланктонных сообществ разнотипных водотоков Нижегородской области как показатели качества их вод и экологического состояния // Биоиндикация в мониторинге пресноводных экосистем III: Материалы Международной конференции / Под ред. В. А. Румянцева, И. С. Трифоновой. СПб.: Своё издательство, 2017. С. 382–385.
Czerniawski R., Sługocki L., Kowalska-Góralska M. Effects of beaver dams on the zooplankton assemblages in four temperate lowland streams (NW Poland) // Biologia. 2017. № 72/4. P. 417–430. DOI: 10.1515/biolog-2017-0047
Grudzinski B., Fritz K., Golden H. E, Johnson T. A., Rech J. A., Levy J. A global review of beaver dam impacts: Stream conservation implications across biomes // Global Ecology and Conservation. 2022. № 37. P. 1–15. DOI: 10.1016/j.gecco.2022.e02163
Mann H. B., Whitney D. R. On a test of whether one of two random variables is stochastically larger than the other // Annals of Mathematical Statistics. 1947. Vol. 18. P. 50–60.
Pielou E. The measurement of diversity in different types of biological collections // Journal of Theoretical Biology. 1966. Vol. 13. P. 131–144. DOI: 10.1016/0022-5193(66)90013-0
Shannon C. E., Weaver. W. The mathematical theory of communication. IL: University of Illinois Press Urbana, 1963. 117 p.






 © 2011 - 2026
© 2011 - 2026