Введение
Клевер паннонский (Trifolium pannonicum Jacq.) – один из перспективных видов для интродукции на территории Северо-Востока европейской части РФ. Это многолетнее травянистое растение с несколькими прямыми, в основании восходящими, иногда маловетвистыми стеблями 40–80 см в высоту. Клевер паннонский – питательное кормовое растение, хороший медонос, может расти в культуре до 10 лет, отличается морозо- и засухоустойчивостью (Нечаева и др., 2020). Поверхность стеблей покрыта оттопыренным опушением. Из-за опушения листьев и грубости стеблей в зеленой массе животными поедается плохо, поэтому его рекомендуют использовать на сено или силосовать. Показано влияние минерального питания на урожайность семян клевера (Кшникаткина, Семенчев, 2013). В биомассе клевера паннонского содержатся биологически активные вещества (флавонолы, катехины, каротиноиды, пектины) (Храмова и др., 2020).
Перспективным направлением повышения урожайности бобовых культур является применение регуляторов роста растений. Предпосевная обработка семян ростстимулирующими препаратами способствует энергичному прорастанию семян, увеличению вегетативной массы растений и фотосинтетической поверхности. В условиях агроценозов растение сталкивается с действием неблагоприятных факторов: патогенные виды бактерий, грибов, вирусов; загрязнение почвы поллютантами; нехватка доступных для растения макро- и микроэлементов и др. Поэтому в настоящее время востребованным становится поиск и разработка биопрепаратов полифункционального действия, которые стимулируют рост и развитие растений, увеличивая при этом их фотосинтетическую активность, защищают от патогенной микрофлоры, обеспечивают растения органогенными элементами, проявляют фитопротекторную функцию в условиях химического загрязнения почв.
Для получения (разработки) биопрепаратов полифункционального действия перспективными являются аборигенные микроорганизмы различных систематических групп, выделенные в чистую культуру из почв Кировской области.
Известно, что клубеньковые бактерии, относящиеся к ризомикробам (Growth Promoting Rhizobacteria), повышают уровень симбиотической азотфиксации бобовых культур, стимулируют иммунитет и увеличивают урожайность (Домрачева и др., 2019). Кроме ризобактерий полезными свойствами для высшего растения обладают и другие группы почвенных микроорганизмов, такие как сине-зеленые водоросли – цианобактерии (ЦБ) и микромицеты. ЦБ в прижизненных выделениях содержат широкий спектр веществ высокой биологической активности (Андреюк и др., 1990; Сиренко, Козицкая, 1988; Rezanka, Dembitsky, 2006; Домрачева и др., 2009). В культуральной жидкости цианобактерии Nostoc paludosum методом ВЭЖХ обнаружены: ликопин, лютеин – проявляющие антиоксидантную активность, витамин А и провитамины, предшественники гормонов роста растений – гиббереллинов, цианопептид – борофицин (Фокина, Домрачева и др., 2019). ЦБ N. muscorum вырабатывает цианопептид борофицин, обладающий антимикробной, в том числе антифунгальной, активностью (Banker, Carmeli, 1998; Swain et al., 2017). Цианобактериальная инокуляция семян растений и/или внесение ЦБ в среду выращивания оказывают положительное влияние на физиолого-биохимические процессы растений, стимулируют рост, приводят к повышению урожайности культур и устойчивости растений в загрязненных средах (Домрачева, 2005; Домрачева и др., 2009; Коваль, Огородникова, 2014). ЦБ выполняют роль биоиндукторов иммунитета растений в условиях загрязнения среды фитопатогенами (Домрачева, 2005; Swain et al., 2017).
ЦБ обладают также повышенной адаптивной устойчивостью к экстремальным условиям обитания (отсутствие влаги, засоленные субстраты, почвы, загрязненные тяжелыми металлами, и др.) и свободно вступают во взаимосвязи с самой разнообразной микрофлорой (Зыкова, 2016).
Микромицеты, например р. Trichoderma, относятся к числу доминантов в почвах, подвергшихся разнообразному антропогенному загрязнению, при этом триходерма выполняет роль микодеструктора благодаря синтезу разнообразных экзоферментов (Стариков и др., 2022). В практике сельского хозяйства наибольший интерес вызывает способность триходермы к синтезу соединений, подавляющих развитие фитопатогенных бактерий и грибов (Woo et al., 2014). В ряде опытов показано, что смешанный инокулюм не только подавляет развитие фитопатогенов, но и увеличивает высоту растений, их биомассу, усиливает фотосинтез, повышает содержание в листьях хлорофилла (Стариков и др., 2022; Домрачева и др., 2019).
Целью работы было изучение влияния предпосевной обработки семян микробными препаратами, содержащими Rhizobium trifolii, Fischerella muscicola, Trichoderma sp., на всхожесть семян и накопление фотосинтетических пигментов в листьях клевера паннонского.
Материалы
В работе использовали семена клевера паннонского Trifolium pannonicum сорта Снежок, выведенный сотрудниками ФАНЦ Северо-Востока: М. Н. Грипась, Е. Г. Арзамасовой, Е. В. Поповой (Попова и др., 2022).
Изучали влияние предпосевной обработки семян микробными препаратами на полевую всхожесть клевера и накопление фотосинтетических пигментов в листьях растений первого года жизни. Для приготовления микробных препаратов использовали клубеньковые бактерии Rhizobium trifolii, цианобактерии Fischerella muscicola и микромицеты Trichoderma sp. из коллекции лаборатории микробиотехнологии и биомониторинга сельскохозяйственных и техногенных территорий Вятского ГАТУ (Домрачева и др., 2021; Товстик, 2017; Козылбаева и др., 2018, 2019). Культуры микроорганизмов выращивали на стандартных питательных средах с добавлением агара (2 %) для обеспечения прилипаемости инокулятов к семенам: Rhizobium trifolii культивировали на бобовой среде, Fischerella muscicola – на среде Громова № 6 без азота (Фокина, Лялина и др., 2019), Trichoderma sp. – на среде Чапека (Домрачева и др., 2019). Культивирование фототрофных микроорганизмов проводили в течение 1.5 месяца, гетеротрофных – 9 суток. Перед закладкой опыта проводили подсчет титра микроорганизмов, который составил для Rhizobium trifolii – 6.1∙109 кл/мл, Fischerella muscicola – 8.1∙106 кл/мл, Trichoderma sp. – 7.15∙107 конидий/мл. В опытах применяли одно-, двух- и трехкомпонентные микробные композиции (табл. 1).
Перед посевом семена скарифицировали с использованием наждачной бумаги (NO:1000). Семена клевера выдерживали в микробных суспензиях в течение 15 минут согласно вариантам опыта (см. табл. 1). Далее, не промывая, сразу же проводили посев семян на заранее подготовленные делянки рандомизированным методом по вариантам и повторностям опыта. Время посева – май 2022 г., норма высева семян – 15 г/кг. Повторность опыта трехкратная. Глубина заделки семян 1.5–2.0 см. Опыт проводили на территории агротехнопарка Вятского ГАТУ. Почва на делянках дерново-подзолистая среднесуглинистая, рН почвенного раствора 4.4, содержание органического вещества в почве находилось на уровне 1.73 %. Обеспеченность подвижным фосфором и обменным калием в целом была на высоком уровне и составляла 309 и 202 мг/кг соответственно, что указывает на высокое плодородие почвы. Всхожесть семян клевера в полевых условиях оценивали на 7-е сутки по количеству появившихся проростков.
Таблица 1. Варианты опыта по предпосевной обработке семян клевера паннонского
| № п/п | Вариант |
| 1 | Контроль (без обработки) |
| 2 | Rhizobium trifolii |
| 3 | Fischerella muscicola |
| 4 | Trichoderma sp. |
| 5 | Fischerella muscicola + Trichoderma sp. |
| 6 | Rhizobium trifolii + Fischerella muscicola |
| 7 | Rhizobium trifolii + Trichoderma sp. |
| 8 | Rhizobium trifolii + Fischerella muscicola + Trichoderma sp. |
Определение фотосинтетических пигментов в зеленых листьях клевера, отобранных в фазу стеблевания, проводили по общепринятой в физиологии растений методике. Пробы листьев массой 0.15 г фиксировали кипящим ацетоном. Содержание пластидных пигментов в ацетоновом экстракте оценивали фотометрически. Хлорофилл а, b и каротиноиды определяли при длинах волн 662, 644 и 470 нм соответственно (Шлык, 1971; Маслова и др., 1986). Долю хлорофиллов в светособирающем комплексе (ССК) рассчитывали по формуле (Lichtenthaler, 1987), исходя из того, что весь хлорофилл b находится в ССК ФСII, а соотношение Хл a / Хл b в этом комплексе равно примерно 1.2:
Доля хлорофилла в ССК = (Хл b + 1.2 Хл b) / (Хл a + Хл b).
Содержание пигментов в листьях выражали в мг/г сухой массы.
Для определения урожая биомассы клевера паннонского надземную часть растений срезали в конце вегетационного сезона и высушивали в сушильном шкафу в соответствии со стандартной методикой.
Методы
В таблицах представлены среднеарифметические данные трех повторностей вариантов опыта и стандартные ошибки. Полученные результаты обрабатывали статистически с использованием стандартного пакета Microsoft Office Excel и Past 2.17. Достоверные различия между средними рассчитывали с помощью LSD-теста при p < 0.05. Для интерполяции данных использовали метод обратных взвешенных расстояний (IDW) (Павлова, 2017).
Результаты
Весна 2022 г. была аномально холодной и затяжной, однако неблагоприятные погодные условия не повлияли на прорастание семян и развитие растений клевера. В полевых опытах всхожесть семян контрольного варианта (без обработки) составляла 68 %, что на 16 % выше производственной всхожести посевов клевера паннонского.
Предварительная инокуляция семян микробными препаратами оказывала положительное влияние на всхожесть клевера (табл. 2). Микробные суспензии, содержащие в составе Rh. trifolii, оказывали наибольший стимулирующий эффект на всхожесть семян. Среди однокомпонентных препаратов клубеньковые бактерии (Rh. trifolii) были более эффективны по сравнению с ЦБ и микромицетами. Двухкомпонентные инокулюмы, в состав которых входил Rh. trifolii, также значительно стимулировали полевую всхожесть семян, доля взошедших семян была на 18 % выше, чем в контроле. Максимальный показатель всхожести – 91 % был отмечен в варианте с обработкой семян трехкомпонентной ассоциацией микроорганизмов (Rhizobium trifolii + Fischerella muscicola + Trichoderma sp.).
Таблица 2. Влияние предпосевной обработки микробными препаратами на всхожесть семян клевера паннонского
| № п/п | Вариант | Всхожесть, % |
| 1 | Контроль (без обработки) | 68 ± 0.41 |
| 2 | Rhizobium trifolii | 78 ± 0.50 |
| 3 | Fischerella muscicola | 71 ± 0.47 |
| 4 | Trichoderma sp. | 70 ± 0.38 |
| 5 | Fischerella muscicola + Trichoderma sp. | 73 ± 0.42 |
| 6 | Rhizobium trifolii + Fischerella muscicola | 87 ± 0.63 |
| 7 | Rhizobium trifolii + Trichoderma sp. | 85 ± 0.70 |
| 8 | Rhizobium trifolii + Fischerella muscicola + Trichoderma sp. | 91 ± 0.71 |
В связи с поздней и затяжной весной растения после всходов замедлили свое развитие, но к концу июля благодаря увеличению среднесуточной температуры до +20.4 °С и умеренной влажности набрали достаточную биомассу. В августе из-за отсутствия дождей средняя влажность составила 58 %, растения замедлили вегетацию, не достигнув фазы цветения даже к концу вегетационного периода. В ходе наблюдений было выявлено, что полнота всходов и количество более развитых растений в конце вегетационного сезона были в вариантах с инокуляцией семян тройной ассоциацией Rhizobium trifolii + Fischerella muscicola + Trichoderma sp.
Биопродукционный процесс связан с фотосинтезом, содержание пигментов в фотосинтезирующих органах определяет рост растений и накопление урожая. Пигментный комплекс растений представлен пластидными пигментами – хлорофиллами и каротиноидами, которые принимают участие в процессах фотосинтеза. Основными ассимилирующими органами у клевера являются листья. Показатели содержания и соотношения фотосинтетических пигментов, доля хлорофиллов в светособирающем комплексе определяют продуктивность фотосинтетической деятельности посевов.
Было изучено влияние предпосевной обработки семян микробными препаратами на накопление фотосинтетических пигментов в листьях клевера паннонского. Листья клевера для изучения пигментного фонда были отобраны у растений в фазу вегетации в конце лета.
Установлено, что обработка семян микробными препаратами оказывала влияние на фотосинтетический аппарат листьев. В зависимости от состава микробного инокулюма отмечали разнонаправленные изменения в пигментном фонде опытных растений (табл. 3).
Таблица 3. Действие микробных препаратов на пигментный фонд листьев клевера паннонского
| № п/п | Вариант | Содержание пигментов, мг/г сухой массы | Доля хлорофилла в ССК, % | ||
| хлорофилл а | хлорофилл b | каротиноиды | |||
| 1 | Контроль (без обработки) | 5.19 ± 0.13 | 2.62 ± 0.06 | 1.00 ± 0.01 | 73.75 |
| 2 | Rh. trifolii | 6.28 ± 0.48* | 2.76 ± 0.22 | 1.62 ± 0.14* | 67.25 |
| 3 | F. muscicola | 5.53 ± 0.25* | 2.55 ± 0.05 | 1.49 ± 0.11* | 69.39 |
| 4 | Trichoderma sp. | 4.76 ± 0.17* | 1.97 ± 0.03* | 1.46 ± 0.02* | 64.43 |
| 5 | F. muscicola + Trichoderma sp. | 4.56 ± 0.01* | 1.81 ± 0.02* | 1.17 ± 0.07* | 62.60 |
| 6 | Rh. trifolii + F. muscicola | 5.42 ± 0.02* | 2.02 ± 0.08* | 1.37 ± 0.01* | 59.77 |
| 7 | Rh. trifolii + Trichoderma sp. | 6.03 ± 0.36* | 2.25 ± 0.11* | 1.77 ± 0.12* | 59.81 |
| 8 | Rh. trifolii + F. muscicola + Trichoderma sp. | 7.29 ± 0.36* | 2.99 ± 0.14* | 2.27 ± 0.10* | 64.02 |
Примечание. * – различия между контролем и опытом достоверны при p ≤ 0.05.
Предпосевная инокуляция семян клевера одно- и двухкомпонентными биопрепаратами, содержащими Trichoderma sp., приводила к снижению накопления хлорофиллов в листьях клевера (рис. 1). Концентрация хлорофиллов в листьях в среднем была меньше на 17 % по сравнению с контролем. В большей степени уменьшалось содержание хлорофилла b, уровень которого составлял 70–75 % от контрольного варианта. Хлорофилл а был более устойчив к действию микробных суспензий, содержащих Trichoderma sp. О чем свидетельствует изменение величины соотношения хлорофиллов а/b в сторону увеличения до 2.4–2.5 по сравнению с контролем –1.9

Рис. 1. Cодержание хлорофиллов в листьях клевера паннонского, обработанного перед посадкой микробными препаратами. 1 – хлорофилл а, 2 – хлорофилл b. Варианты: 1. Контроль (без обработки), 2. Rh. trifolii, 3. F. muscicola, 4. Trichoderma sp., 5. F. muscicola + Trichoderma sp., 6. Rh. trifolii + F. muscicola, 7. Rh. trifolii + Trichoderma sp., 8. Rh. trifolii + F. muscicola + Trichoderma sp.
Fig. 1. The content of chlorophylls in the leaves of Pannonian clover treated with microbial preparations before planting. 1 – chlorophyll a, 2 – chlorophyll b. Options: 1. Control (without treatment), 2. Rh. trifolii, 3. F. muscicola, 4. Trichoderma sp., 5. F. muscicola + Trichoderma sp., 6. Rh. trifolii + F. muscicola, 7. Rh. trifolii + Trichoderma sp., 8. Rh. trifolii + F. muscicola + Trichoderma sp.
Действие на семена суспензий, содержащих в составе ЦБ (F. muscicola и Rh. trifolii + F. muscicola), не приводило к значимым изменениям уровня зеленых пигментов в листьях клевера первого года вегетации, содержание хлорофиллов было близко к контролю.
По результатам кластерного анализа выделяется две группы опытных вариантов, которые различаются накоплением пигментов в листьях клевера (рис. 2).
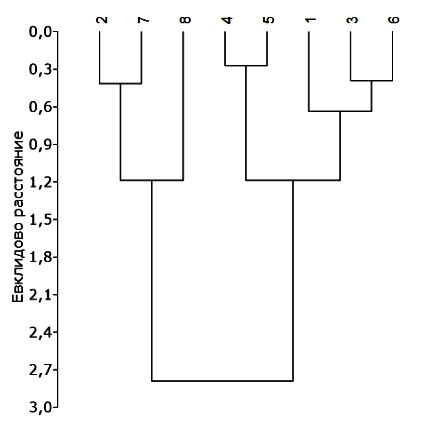
Рис. 2. Дендрограмма сходства вариантов опыта по содержанию пластидных пигментов в листьях клевера паннонского. Варианты: 1. Контроль (без обработки), 2. Rh. trifolii, 3. F. muscicola, 4. Trichoderma sp., 5. F. muscicola + Trichoderma sp., 6. Rh. trifolii + F. muscicola, 7. Rh. trifolii + Trichoderma sp., 8. Rh. trifolii + F. muscicola + Trichoderma sp.
Fig. 2. Dendrogram of the similarity of the variants of the experiment on the content of plastid pigments in the leaves of Pannonian clover. Options: 1. Control (without treatment), 2. Rh. trifolii, 3. F. muscicola, 4. Trichoderma sp., 5. F. muscicola + Trichoderma sp., 6. Rh. trifolii + F. muscicola, 7. Rh. trifolii + Trichoderma sp., 8. Rh. trifolii + F. muscicola + Trichoderma sp.
В опытных вариантах, выделенных в первую группу (опыты с Rh. trifolii, Rh. trifolii + Trichoderma sp., Rh. trifolii + F. muscicola + Trichoderma sp.), отмечали повышенное содержание хлорофиллов и каротиноидов в листьях клевера, которое составляло соответственно 9.20 ± 1.01 и 1.89 ± 0.34 мг/г сухой массы. В вариантах опыта, выделенных во 2-ю группу, уровень фотосинтетических пигментов был значимо ниже, концентрация зеленых и желтых пигментов в листьях составляла 7.29 ± 0.72 и 1.30 ± 0.21 мг/г сухой массы. Различия в пигментном фонде клевера обусловлены влиянием микробных препаратов, которыми обрабатывали семена перед посадкой.
Положительный эффект на фотосинтетический комплекс листьев клевера отмечен в вариантах с предпосевной обработкой семян препаратами, содержащими Rh. trifolii (Rh. trifolii, Rh. trifolii + Trichoderma sp., Rh. trifolii + F. muscicola + Trichoderma sp.). Суммарное содержание хлорофиллов в листьях было достоверно выше, чем в контрольном варианте, и варьировало в пределах 8.3–10.3 мг/г сухой массы. Среди хлорофиллов в большей степени возрастала концентрация хлорофилла а. Доля хлорофилла а в пигментном фонде листьев клевера, семена которого были инокулированы микробными суспензиями, увеличилась в 1.2–1.4 раза по сравнению с контролем. Хлорофилл b был менее чувствителен к действию микробных препаратов, содержащих Rh. trifolii.
В листьях клевера паннонского доля хлорофиллов, принадлежащих ССК, варьировала в пределах 60–73 % от общего фонда хлорофилла (см. табл. 3, рис. 1). Максимальное накопление хлорофилла в ССК отмечено в контроле, в опытных вариантах доля хлорофилла в ССК была ниже. Уменьшение доли хлорофилла в ССК в листьях опытных растений, вероятно, обусловлено снижением уровня хлорофилла b, входящего в фонды светособирающих комплексов. Это предположение подтверждается данными о накоплении хлорофилла b в листьях опытных растений. Только в двух вариантах опыта отмечали рост содержания хлорофилла b, в большинстве вариантов уровень хлорофилла b был снижен по сравнению с контролем.
Предпосевная обработка семян микробными суспензиями вызывала увеличение содержания каротиноидов в листьях клевера паннонского (см. табл. 3). Уровень желтых пигментов в листьях опытных растений был выше в 1.2–2.3 раза по сравнению с контролем. Самое высокое содержание каротиноидов в листьях клевера отмечали в вариантах с предпосевной обработкой семян биопрепаратами, содержащими Rh. trifolii (Rh. trifolii, Rh. trifolii + Trichoderma sp., Rh. trifolii + F. muscicola + Trichoderma sp.). В этих же вариантах было отмечено повышенное накопление хлорофиллов, что свидетельствует о стимуляции процессов образования хлорофиллов и каротиноидов в листьях растений под влиянием данных микробных препаратов.
В остальных вариантах опыта с предпосевной обработкой семян одно- и двухкомпонентными препаратами (F. muscicola, Trichoderma sp., F. muscicola + Trichoderma sp., Rh. trifolii + F. muscicola) уровень каротиноидов повышался в меньшей степени (на 17–50 %) при сниженном, по сравнению с контролем, содержании суммы хлорофиллов в листьях клевера. В условиях разреженных посевов клевера первого года вегетации растения не испытывают недостатка солнечной энергии и не накапливают в хлоропластах дополнительные светосборщики – каротиноиды. Вероятно, повышенное содержание каротиноидов обусловлено их антиоксидантыми функциями и способствует большей устойчивости растений к действию неблагоприятных факторов среды.
В конце вегетационного периода была определена биомасса надземной части растений клевера паннонского. Выявлена сильная положительная корреляция (r = 0.72) между накоплением биомассы растениями клевера и содержанием хлорофиллов в листьях (рис. 3). Наибольшую эффективность проявил трехкомпонентный биопрепарат, содержащий Rh. trifolii + F.muscicola + Trichoderma sp. Продуктивность посевов в данном варианте опыта была на 10 % выше, чем в контроле. Урожайность посевов во многом определяется концентрацией фотосинтетических пигментов в листьях, в данном варианте уровень хлорофиллов был в 1.3 раза выше, чем в контроле, что способствовало накоплению надземной биомассы.

Рис. 3. Связь между содержанием хлорофиллов и биомассой надземной части растений клевера паннонского. Варианты: 1. Контроль (без обработки), 2. Rh. trifolii, 3. F. muscicola, 4. Trichoderma sp., 5. F. muscicola + Trichoderma sp., 6. Rh. trifolii + F. muscicola, 7. Rh. trifolii + Trichoderma sp., 8. Rh. trifolii + F. muscicola + Trichoderma sp.
Fig. 3. Relationship between the content of chlorophylls and the biomass of the above-ground part of the Pannonian clover plants. Options: 1. Control (without treatment), 2. Rh. trifolii, 3. F. muscicola, 4. Trichoderma sp., 5. F. muscicola + Trichoderma sp., 6. Rh. trifolii + F. muscicola, 7. Rh. trifolii + Trichoderma sp., 8. Rh. trifolii + F. muscicola + Trichoderma sp.
Обсуждение
Известно, что хлорофилл в хлоропластах входит в состав светособирающего комплекса и комплекса фотосистем (антенн и реакционных центров). Хлорофилл ССК осуществляет основное поглощение света, хлорофилл антенн передает и фокусирует световую энергию в реакционные центры, где происходит ее превращение в химическую (Куренкова, 1998; Дымова, Головко, 2018). В ССК соотношение хлорофиллов а/b составляет 1.1–1.3 (Lichtenthaler, 1987).
Каротиноиды в пигментном комплексе растений являются дополнительными светосборщиками в области сине-фиолетового солнечного спектра, выполняют протекторную функцию (защищают реакционные центры в условиях высокой инсоляции) и являются антиоксидантами (улавливают и гасят активные формы кислорода) (Ладыгин, Ширшикова, 2006; Photosynthetic pigments, 2014).
Одним из факторов, которые способствуют накоплению пластидных пигментов в листьях клевера, может быть влияние азотфиксирующей клубеньковой бактерии Rh. trifolii на содержание в почве и растениях азота, который необходим для синтеза хлорофилла и белковых комплексов (Проворов и др., 2018; Домрачева и др., 2019).
Повышение интенсивности фотосинтетической деятельности клевера с помощью микробных препаратов имеет важное значение для формирования высокого урожая. Накопление пластидных пигментов свидетельствует о высокой ассимиляционной активности фотосинтетического аппарата и определяет высокую продуктивность посева клевера.
Заключение
Инокуляция семян микробными суспензиями повышала полевую всхожесть семян клевера паннонского. Наибольший стимулирующий эффект на всхожесть семян оказывали микробные суспензии, содержащие в составе Rh. trifolii.
Растения клевера паннонского, семена которого инокулировали микробными препаратами, отличались по накоплению пластидных пигментов. При обработке семян микробными суспензиями, содержащими Rh. trifolii (Rh. trifolii, Rh. trifolii + Trichoderma sp., Rh. trifolii + F. muscicola + Trichoderma sp.), формировался более мощный фотосинтетический аппарат с высоким содержанием пигментов, что свидетельствует о стимуляции процессов образования хлорофиллов и каротиноидов в листьях растений под влиянием данных микробных инокулюмов.
В остальных вариантах опыта содержание хлорофиллов было снижено или близко к контролю при повышенном уровне каротиноидов. Рост пула желтых пигментов в опытных растениях свидетельствует о повышении уровня низкомолекулярных антиоксидантов и направлен на повышение устойчивости растений к неблагоприятным условиям.
Среди тестируемых микробных препаратов наибольший положительный эффект на всхожесть семян, состояние фотосинтетического аппарата растений и накопление биомассы оказывают и одно-, двух- и трехкомпонентные препараты, в состав которых входит Rh. trifolii. Максимальный положительный эффект на изучаемые показатели оказывает трехкомпонентная суспензия Rh. trifolii + F. muscicola + Trichoderma sp. Микробные суспензии Rh. trifolii, Rh. trifolii + Trichoderma sp., Rh. trifolii + F. muscicola + Trichoderma sp. показали свою эффективность на растениях клевера паннонского и могут быть использованы для производства биопрепаратов, повышающих продуктивность агроценозов.
Библиография
Андреюк Е. И., Коптева Ж. П., Занина В. А. Цианобактерии . Киев: Наукова думка, 1990. 200 с.
Домрачева Л.И. «Цветение» почвы и закономерности его развития . Сыктывкар, 2005. 336 с.
Домрачева Л. И., Кондакова Л. В., Попов Л. Б., Зыкова Ю. Н. Биоремедиационные возможности почвенных цианобактерий (обзор) // Теоретическая и прикладная экология. 2009. № 1. С. 8–17. DOI: 10.25750/1995-4301-2009-1-008-017
Домрачева Л. И., Козылбаева Д. В., Ковина А. Л., Трефилова Л. В., Зыкова Ю. Н., Грипась М. Н., Изотова В. А. Оптимизация микробиологического состава биопрепарата при выращивании лядвенца рогатого (Lotus corniculatus L.) // Теоретическая и прикладная экология. 2019. №1. С. 94–101. DOI: 10.25750/1995-4301-2019-1-094-101
Домрачева Л. И., Ковина А. Л., Кондакова Л. В., Ашихмина Т. Я. Цианобактериальные симбиозы и возможность их практического использования (обзор) // Теоретическая и прикладная экология. 2021. № 3. С. 21–30. DOI: 10.25750/1995-4301-2021-3-021-030
Дымова О. В., Головко Т. К. Фотосинтетические пигменты: функционирование, экология, биологическая активность // Известия Уфимского научного центра РАН. 2018. № 3 (4). С. 5–16. DOI: 10.31040/2222-8349-2018-4-3-5-16
Зыкова Ю. Н. Свойства цианобактерий как объектов биотехнологии // Развитие научной, творческой и инновационной деятельности молодежи. Лесниково, 2016. С. 10–14.
Коваль Е. В., Огородникова С. Ю. Влияние цианобактерии Nostoc linckia на показатели жизнедеятельности растений ячменя, выращенных в модельных опытах в присутствии метилфосфоновой кислоты // Агрохимия. 2014. № 12. С. 65–70.
Козылбаева Д. В., Домрачева Л. И., Трефилова Л. В., Ковина А. Л., Изотова В. А., Малинина А. И., Товстик Е. В., Грипась М. Н. Последствия предпосевной микробной инокуляции семян лядвенца рогатого на численность аборигенной микрофлоры почвы // Биодиагностика состояния природных и природно-техногенных систем: Материалы XVI Всероссийской научно-практической конференции с международным участием. Книга 1. Киров: ВятГУ, 2018. С. 226–230.
Козылбаева Д. В., Домрачева Л. И., Трефилова Л. В., Ковина А. Л., Короткова А. В., Малинина А. И., Вахрушева Н. Э. Активизация аборигенной микрофлоры под влиянием бактеризации семян георгина // Комплексный подход к научно-техническому обеспечению сельского хозяйства: Материалы Международной научно-практической конференции (Международные Бочкаревские чтения), посвященной памяти члена-корреспондента РАСХН и НАНКР, академика МАЭП и РАВН Бочкарева Я. В., 6–9 декабря 2018 года. Рязань: Изд-во Рязанского гос. агротехнол. ун-та, 2019. С. 323–329.
Куренкова С. В. Пигментная система культурных растений в условиях подзоны средней тайги европейского Северо-Востока . Екатеринбург: УрО РАН, 1998. 114 с.
Кшникаткина А. Н., Семенчев А. В. Урожайность семян клевера паннонского (Trifolium pannonicum Jacq) при различных режимах питания // Вестник Ульяновской государственной сельскохозяйственной академии. 2013. № 2 (22). С. 21–24.
Ладыгин В. Г., Ширшикова Г. Н. Современные представления о функциональной роли каротиноидов в хлоропластах эукариот // Журнал общей биологии. 2006. Т. 67, № 3. С. 163–189.
Лобанов А. Н., Полюдова Т. В. Продукция экзополисахаридов бактериями Rhizobium leguminosarum при периодическом культивировании // Биомика. 2020. Т. 12, № 2. С. 224–231.
Маслова Т. Г., Попова И. А., Попова О. Ф. Критическая оценка спектрофотометрического метода количественного определения каротиноидов // Физиология растений. 1986. Т. 39, № 6. С. 615–619.
Нечаева Т. В., Якутина О. П., Боголюбова Е. В. Клевер паннонский (Trifolium pannonicum Jacq.) – перспективная кормовая культура и фитомелиорант (литературный обзор) // Почвы и окружающая среда. 2020. Т. 3, № 1. e115. DOI: 10.31251/pos.v3i1.115
Попова Е. В., Арзамасова Е. Г., Шихова И. В. Качество семян клевера паннонского (Trifolium pannonicum Jacq.) сорта Снежок // Аграрная наука Евро-Северо-Востока. 2022. Т. 23, № 5. С. 675–684. DOI: 10.30766/2072-9081.2022.23.5.675-684
Проворов Н. А., Тихонович И. А., Воробьев Н. И. Симбиоз и симбиогенез . СПб.: Информ-Навигатор, 2018. 464 с.
Сиренко Л. А., Козицкая В. Н. Биологически активные вещества водорослей и качество воды . Киев: Наукова думка, 1988. 256 с.
Стариков П. А., Домрачева Л. И., Скугорева С. Г. Сравнительная оценка питательных сред для культивирования микромицетов рода Trichoderma // Теоретическая и прикладная экология. 2022. № 1. С. 44–49. DOI: 10.25750/1995-4301-2022-1-044-049
Товстик Е. В., Козылбаева Д. В., Домрачева Л. И., Трефилова Л. В., Ковина А. Л., Малыгина О. Н., Шабалина А. В. Оценка действия цианобактерий и стрептомицетов на ризозферную микрофлору Georgine wild // Биодиагностика состояния природных и природно-техногенных систем: Материалы ХV Всероссийской научно-практической конференции с международным участием. Книга 2. Киров: ВятГУ, 2017. С. 97–100.
Фокина А. И., Домрачева Л. И., Огородникова С. Ю. Влияние цианобактерии Nostoc paludosum и ее экзометаболитов на рост ячменя // Принципы экологии. 2019. № 3. С. 133–143. DOI: 10.15393/j1.art.2019.9182
Фокина А. И., Лялина Е. И., Трефилова Л. В., Ашихмина Т. Я. Отклик почвенной цианобактерии Nostoc paludosum на действие cульфата меди (II) в присутствии глутатиона восстановленного // Теоретическая и прикладная экология. 2019. № 3. С. 101–108. DOI: 10.25750/1995-4301-2019-3-101-108
Храмова Е. П., Боголюбова Е. В., Кукушкина Т. А., Шалдаева Т. М., Зверева Г. К. Фитохимическая характеристика и антиоксидантные свойства Trifolium pannonicum Jacq. сорта Премьер в лесостепи Западной Сибири // Химия растительного сырья. 2020. № 2. С. 149–158. DOI: 10.14258/jcprm.2020026023
Шлык А. А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев // Биохимические методы в физиологии растений. М.: Наука, 1971. C. 154–171.
Banker R., Carmeli S. Tenuecyclamides A-D, cyclic hexapeptides from the cyanobacterium Nostoc spongiaeforme var. tenue // Journal of Natural Products. 1998. Vol. 61. Issue 10. P. 1248–1251.
Lichtenthaler H. K. Chlorophylls and Carotenoids: Pigments of Photosynthetic Biomembranes // Methods in Enzymology. Vol. 148. P. 350–382.
Pavlova A. I. Analysis of elevation interpolation methods for creating digital elevation models // Optoelectronics, Instrumentation and Data Processing. 2017. Vol. 53, No 2. P. 171–177. DOI: 10.3103/S8756699017020108
Photosynthetic pigments – chemical structure, biological function and ecology / Eds. T. K. Golovko, W. I. Gruszeski, M. N. V. Prasad, K. Strzalka. Syktyvkar, 2014. 448 p.
Rezanka T., Dembitsky V. M. Metabolites produced by cyanobacteria belonging to several species of the family Nostocaceae // Folia Microbiol. 2006. Vol. 51. P. 159–182.
Swain S. S., Paidesetty S. K., Padhy N. R. Antibacterial, antifungal and antimycobacterial compounds from cyanobacteria // Biomedicine & Pharmacotherapy. 2017. Vol. 90. P. 760–776. DOI: 10.1016 / j. biopha.2017.04.030
Woo S. L., Ruocco M., Vinale F., Nigro M., Marra R., Lombardi N., Pascale A., Lanzuise S., Manganiello G., Lorito M. Trichoderma-based products and their widespread use in agriculture // The Open Mycology Journal. 2014. Vol. 8, No 18. P. 71–126.
Благодарности
Работа выполнена в рамках научной тематики лаборатории микробиотехнологии и биомониторинга сельскохозяйственных и техногенных территорий ФГБОУ ВО Вятского ГАТУ.
Работа выполнена в рамках государственного задания ИБ ФИЦ Коми НЦ УрО РАН по теме «Структура и состояние компонентов техногенных экосистем подзоны южной тайги».






 © 2011 - 2025
© 2011 - 2025