Введение
Дисперсия (расселение особей) – важнейший процесс, поддерживающий генетическое разнообразие и численность популяций птиц (Greenwood, 1980). Дальность дисперсии зависит от пола, возраста, успеха предшествующего размножения и целого ряда других популяционных параметров (Greenwood, Harvey, 1982; Соколов, 1991; Haas, 1998; Paradis et al., 1998). В большинстве случаев дисперсия молодых птиц (натальная дисперсия) превышает дисперсию взрослых (гнездовую дисперсия), а дисперсия самок выше, чем дисперсия самцов. Распределение фактических величин натальной и гнездовой дисперсии часто бимодально (Pakanen et al., 2011), что позволяет условно разделять ближнюю (перемещение особи внутри района рождения или предшествующего размножения) и дальнюю (перемещение за пределы этого района) дисперсию (Barrowclough, 1978; Payne, Payne, 1990; Pakanen et al., 2011). Ближнюю дисперсию оценивают на основе контроля перемещения меченых особей, прямая оценка дальней дисперсии во многих случаях затруднена, т. к. требует обследования огромных территорий (Barrowclough, 1978; Paradis et al., 1998). Косвенно об интенсивности дальней дисперсии можно судить на основе анализа динамики численности (Бурский, 2008) или видимой выживаемости птиц (Payne, Payne, 1990; Pakanen et al., 2011). Целью настоящего сообщения является оценка натальной и гнездовой дисперсии желтой трясогузки (Motacilla flava) на основе регистраций возвратов меченых особей и анализа видимой выживаемости в локальной популяции, а также выявление связи дальности гнездовой дисперсии с успехом предшествующего размножения трясогузок.
Материалы
Исследование выполнено в 2005–2018 гг. в южной части национального парка «Русский Север» (Кирилловский р-н Вологодской обл.) на обширном (8 км2) участке заброшенных сельскохозяйственных земель в окрестностях д. Топорня (59°46′ с. ш., 38°22′ в. д.). Модельный вид (желтая трясогузка) – дальний мигрант с пятнистым распространением, склонный к агрегированному гнездованию, при котором компактные или диффузные локальные поселения численностью от нескольких пар до нескольких десятков пар могут быть разделены значительными пространствами не занятых видом местообитаний (Цветков, 2004; Shitikov et al., 2013). На территории стационара в период исследований существовало 3 диффузных поселения желтой трясогузки, суммарная численность гнездящихся трясогузок в которых в отдельные годы достигала 50 пар. В двух поселениях проводили индивидуальное мечение трясогузок (взрослых птиц и гнездовых птенцов) и контроль успешности размножения, поиск вернувшихся меченых птиц осуществляли на всей территории стационара. Учитывая изолированное положение контрольной территории среди непригодных для гнездования вида местообитаний, мы могли полностью контролировать все возвраты в район рождения (или предыдущего размножения), не вернувшихся птиц считали погибшими или эмигрировавшими (совершившими дальнюю дисперсию). В сообщении проанализированы материалы контроля 104 взрослых желтых трясогузок и 406 гнездовых птенцов, для которых получено 13 измерений натальной дисперсии и 55 – гнездовой дисперсии.
Методы
Полевые работы проводились ежегодно с третьей декады мая по третью декаду июля и включали поиск гнезд, отлов и индивидуальное цветное мечение взрослых трясогузок, контроль успешности размножения, а также регистрацию возвратов ранее меченных особей. Найденные гнезда картировали с помощью GPS навигатора Garmin 60s. Взрослых птиц отлавливали у гнезд с помощью паутинных сетей или автоматических лучков на 6–7-й день после вылупления птенцов и кольцевали с помощью индивидуальных комбинаций цветных колец. Птицу считали успешно гнездившейся, если ее гнездо покинул хотя бы один птенец. Птенцов кольцевали в гнездах в возрасте 5–9 дней, все птенцы одного выводка получали одинаковую комбинацию цветных колец. Натальную дисперсию измеряли как расстояние между родным гнездом птицы и первым известным собственным гнездом, гнездовую дисперсию – как расстояние между двумя гнездами одной и той же птицы в последовательные годы. Если гнездо вернувшейся трясогузки не удавалось обнаружить, измеряли расстояние до центра ее гнездовой территории. Измерения расстояний проводили на основе географических координат с помощью программного модуля geosphere (Hijmans et al., 2014) в среде R 3.2.3 (R Core Team, 2016).
Видимую выживаемость (apparent survival) молодых желтых трясогузок определяли с помощью стохастической модели Кормака – Джоли – Себера в программе MARK 8.0 (White, Burnham, 1999). Для оценки выживаемости и вероятности повторной регистрации строили модель вида phi(age)p(age), где оба оцениваемых показателя (видимую выживаемость и вероятность повторной регистрации) считали зависимыми от возраста. Чтобы повысить точность оценки этих показателей для молодых птиц, использовали фиксированные значения видимой выживаемости (φ = 0.32) и вероятности повторной регистрации (p = 1.00) взрослых желтых трясогузок, полученные ранее для той же локальной популяции (Шитиков и др., 2017). Модели с зависимыми от времени показателями не тестировали, т. к. наши выборки ежегодно меченных птиц не позволяли сделать этого. Также мы не тестировали влияние пола птиц на видимую выживаемость, т. к. не могли определить пол гнездовых птенцов во время кольцевания.
Влияние пола и успешности предшествующего размножения на величину гнездовой дисперсии трясогузок оценивали с помощью линейных моделей со смешанными эффектами (LMM). Логарифмированную величину гнездовой дисперсии использовали в качестве зависимой переменной, пол, индивидуальный успех размножения и их взаимодействие – в качестве независимых переменных. Календарный год и индивидуальный номер птицы рассматривали в качестве случайных факторов. Использовали информационно-теоретический подход к выбору моделей (Burnham, Anderson, 2002). Модели ранжировали с помощью информационного критерия Акаике, скорректированного для малых выборок (AICc). Модели, обладающие значениями ΔAICc менее 2 единиц, считали адекватно описывающими данные. Моделирование проводили в среде R 3.2.3 (R Core Team, 2016) с помощью модуля lme4 (Bates et al., 2016). Ранжирование моделей осуществляли с помощью функции dredge модуля MuMIn (Bartoń, 2013).
Результаты
Из 406 гнездовых птенцов, окольцованных в 2005–2017 гг., в последующие годы вернулись лишь 13 (показатель возврата – 3.2 %), среди которых было 11 самцов и 2 самки. На следующий после рождения год было обнаружено 11 трясогузок, еще 2 птиц удалось обнаружить лишь через год. Видимая выживаемость молодых птиц, оцененная с помощью модели φ(age)p(age), составила φ = 0.04 ± 0.01, а вероятность повторной регистрации p = 0.62 ± 0.18. Медиана натальной дисперсии (n = 13) для всех особей составила 2200 м (350–4989 м), что соответствует и показателю, рассчитанному только для самцов, вернувшиеся самки были обнаружены в 481 и 3304 м от своих родных гнезд. Анализ распределения расстояний натальной дисперсии (рис. 1) показывает, что большинство вернувшихся молодых трясогузок загнездились на значительном (более 500 м) расстоянии от своих родных гнезд.
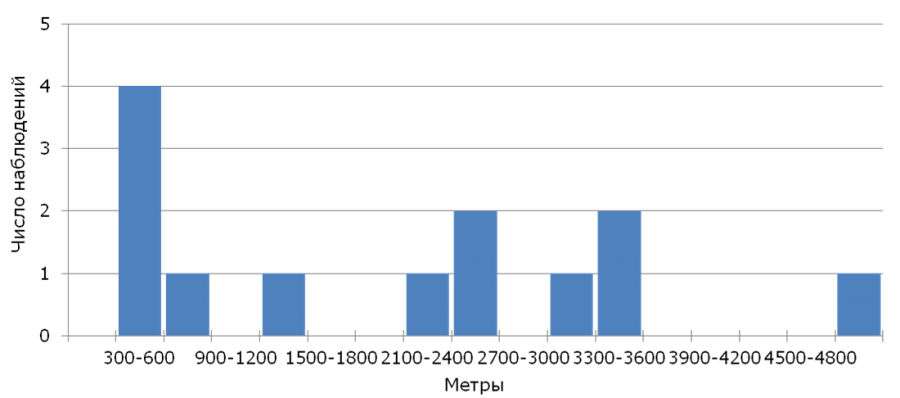
Рис. 1. Распределение расстояний натальной дисперсии желтой трясогузки
Fig. 1. Distribution of natal dispersal distances of the yellow wagtail
Медиана гнездовой дисперсии (n = 55) составила 195 м (1–3011 м), для самцов (n = 28) – 116 м (12–2922 м), для самок (n = 27) – 251 м (1–3011 м). Подавляющее большинство взрослых трясогузок обоего пола было обнаружено в радиусе менее 300 м от своих прошлогодних гнезд (рис. 2).
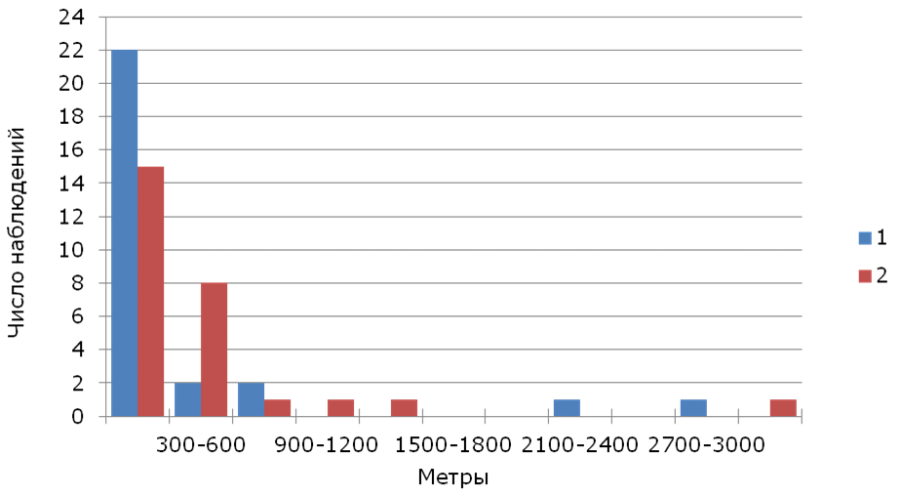
Рис. 2. Распределение расстояний гнездовой дисперсии желтой трясогузки. 1 – самцы, 2 – самки
Fig. 2. Distribution of breeding dispersal distances of the yellow wagtail. 1 – males, 2 – females
Вернувшиеся успешно гнездившиеся трясогузки (n = 33) устраивали гнезда в 195 (1–2992) м от своих прошлогодних гнезд, в то время как медиана гнездовой дисперсии неудачно гнездившихся птиц (n = 22) составила 212 (1–3011) м. Результаты моделирования показывают, что пол вернувшихся трясогузок и их индивидуальный успех размножения не оказывали влияния на величину гнездовой дисперсии, т. к. значениями ΔAICc менее 2 единиц обладала лишь константная модель (табл. 1). Все модели, учитывающие факторы «Пол» и «Успех», а также их комбинации имели значения ΔAICc более 2 единиц.
Таблица 1. Результаты ранжирования моделей влияния пола и успеха размножения на величину гнездовой дисперсии желтой трясогузки в национальном парке «Русский Север»
| Модель | df | ΔAICc | Вес модели |
| const | 4 | 0.00 | 0.74 |
| Пол | 5 | 3.65 | 0.12 |
| Успех | 5 | 3.72 | 0.12 |
| Пол + Успех | 6 | 7.47 | 0.02 |
| Пол + Успех + Пол * Успех | 7 | 9.90 | 0.01 |
Обсуждение
Видимая выживаемость молодых желтых трясогузок в национальном парке «Русский Север» была крайне низкой. Оценки выживаемости, полученные с помощью стохастической модели Кормака – Джоли – Себера (4 ± 1 %), находятся вблизи нижних пределов (0–13.5 %), известных для мелких воробьинообразных – дальних мигрантов (Соколов, 1991; Weatherhead, Forbes, 1994; Maness, Anderson, 2013). К сожалению, оценки выживаемости молодых желтых трясогузок для других частей ареала вида в литературе отсутствуют. Сходные с нашими показатели видимой выживаемости молодых (2–4 %) получены на Аляске для близкого вида – берингийской желтой трясогузки Motacilla (flava) tchutchensis (Renner, McCaffery, 2008). Наши результаты показывают, что с поправкой на вероятность повторной регистрации меченых птиц в район рождения не возвращалось 96 % молодых трясогузок. Мы полагаем, что значительная часть из них выжила, но эмигрировала за пределы района рождения (т. е. совершила дальнюю дисперсию), т. к. при смертности порядка 96 % в течение первого года жизни любая локальная популяция была бы обречена на быстрое вымирание. Сведения о дальности такой дисперсии остаются весьма скудными. Ранее нам удалось обнаружить самца желтой трясогузки, загнездившегося на расстоянии 14 км от своего родного гнезда (Shitikov et al., 2013). По данным анализа возвратов колец с погибших птиц (n = 28), в Великобритании средняя величина натальной дисперсии желтой трясогузки составила 12.5 км (Paradis et al., 1998). Немногочисленные вернувшиеся в район своего рождения трясогузки не стремились занять территорию в ближайших окрестностях своего родного гнезда, о чем свидетельствует распределение расстояний натальной дисперсии. Кроме того, следует отметить практически полное отсутствие возвратов у молодых самок, что подтверждает общепринятое мнение (Greenwood, Harvey, 1982) о меньшей верности району рождения у молодых самок по сравнению с самцами.
Видимая выживаемость взрослых трясогузок в изучаемой локальной популяции зависела от успешности предшествующего размножения и составляла для успешно гнездившихся птиц 0.39 ± 0.06, а для неудачно гнездившихся – 0.19 ± 0.06 (Шитиков и др., 2017). Таким образом, большинство удачно гнездившихся трясогузок возвращалось в район предыдущего гнездования, в то время как значительная часть неудачно гнездившихся птиц покидала его (т. е. совершала дальнюю дисперсию). Тем не менее видимая выживаемость неудачно гнездившихся взрослых существенно превышает таковую молодых птиц, что лишний раз свидетельствует о высоком стремлении последних покинуть район своего рождения. Существенные различия в выживаемости успешно и неудачно гнездившихся особей часто связываются с разницей в гнездовой дисперсии двух групп: неудачно гнездившиеся птицы смещаются на большее расстояние по сравнению с успешно гнездившимися (Haas, 1998; Hoover, 2003; Sedgwick, 2004). Наши данные лишь частично подтверждают это положение: успех предшествующего размножения влиял лишь на верность району гнездования (т. е. на вероятность совершения дальней дисперсии), при этом вернувшиеся в район гнездования трясогузки выбирали территорию вне связи с успехом предшествующего размножения. Более того, большинство вернувшихся трясогузок (вне зависимости от успешности предшествующего размножения) загнездилось на расстоянии менее 300 м от своих предыдущих гнезд, т. е. фактически птицы стремились занять свою прошлогоднюю гнездовую территорию.
Заключение
Связи между локальными популяциями желтой трясогузки на Европейском Севере России поддерживаются главным образом за счет натальной дисперсии. Большинство молодых птиц безвозвратно покидает район своего рождения, немногочисленные вернувшиеся смещаются на значительные расстояния относительно своих родных гнезд. При этом основу гнездовых поселений составляют ранее успешно гнездившиеся здесь особи, которые стремятся занять гнездовые территории в непосредственной близости от занимаемых в предшествующие годы.
Библиография
Бурский О. В. Выбор местообитаний и структура метапопуляции: анализ многолетнего распределения пятнистого конька Anthus hodgsoni Richm. (Aves, Passeriformes) // Жур. общ. биол. 2008. Т. 69. Вып. 5. С. 323–343.
Соколов Л. В. Филопатрия и дисперсия птиц // Труды Зоол. ин-та АН СССР. 1991. Вып. 230. С. 1–232.
Шитиков Д. А., Вайтина Т. М., Макарова Т. В., Федотова С. Е., Красных Н. А., Юрченко Ю. А. Влияние успешности размножения на видимую выживаемость луговых воробьиных птиц // Зоол. журн. 2017. Т. 96. № 7. С. 827–837.
Цветков А. В. Групповые поселения желтых и белых трясогузок (Motacilla flava, M. alba) // Рус. орнит. журн. 2004. Т. 3. С. 227.
Barrowclough G. F. Sampling bias in dispersal studies based on finite area // Bird-banding. 1978. Vol. 49. P. 333–341.
Bartoń K. MuMIn: multi-model inference // R package version 1.9.5. 2013. URL: http://CRAN.R-project.org/package=MuMIn.
Bates D., Mächler M., Bolker B., Walker S. lme4: linear mixed-effects models using Eigen and S4 // R package version 1.1-12. 2016. URL: https://CRAN.R-project.org/package=lme4.
Burnham K. P., Anderson D. R. Model Selection and Multimodel Inference: A Practical Information Theoretic Approach. Springer, New York. 2002.
Greenwood P. J. Mating systems, philopatry and dispersal in birds and mammals // Anim. Behav. 1980. Vol. 28. P. 1140–1162. doi: 10.1016/s0003-3472(80)80103-5.
Greenwood P. J., Harvey P. H. The natal and breeding dispersal of birds // Annu. Rev. Ecol. Syst. 1982. Vol. 13. P. 1–21.
Haas C. A. Effects of Prior Nesting Success on Site Fidelity and Breeding Dispersal: An Experimental Approach // Auk. 1998. Vol. 115. P. 929–936.
Hijmans R., Williams E., Vennes C. Geosphere: spherical trigonometry // R package version 1.3-11. 2014. URL: http://CRAN.R–project.org/package=geosphere.
Hoover J. P. Decision rules for site fidelity in a migratory bird, the Prothonotary Warbler // Ecology. 2003. Vol. 84. P. 416–430. doi: 10.1890/0012-9658(2003)0842.0.co;2.
Maness T. J., Anderson D. J. Predictors of juvenile survival in birds // Ornithological Monographs. 2013. Vol. 78. No 1. P. 1-55. doi: 10.1525/om.2013.78.1.1.
Pakanen V.-M., Hildén O., Rönkä A., Belda E. J., Luukkonen A., Kvist L., Koivula K. Breeding dispersal strategies following reproductive failure explain low apparent survival of immigrant Temminck’s stints // Oikos. 2011. Vol. 120. P. 615–622. doi: 10.1111/j.1600-0706.2010.18953.x.
Paradis E., Baillie S. R., Sutherland W. J., Gregory R. D. Patterns of natal and breeding dispersal in birds // J. Anim. Ecol. 1998. Vol. 67. P. 518–536.
Payne R., Payne L. Survival estimates of Indigo Buntings: comparison of banding recoveries and local observation // Condor. 1990. Vol. 92. P. 938–946.
R Core Team. R: A language and environment for statistical computing // Vienna: R Foundation for Statistical Computing. 2016. URL: https://www.R-project.org.
Renner H. M., McCaffery B. J. Demography of Eastern Yellow Wagtails at Cape Romanzof, Alaska // Wilson J. Ornith. 2008. Vol. 120. P. 85–91. doi: 10.1676/06-122.1
Sedgwick J. A. Site fidelity, territory fidelity, and natal philopatry in Willow Flycatchers (Empidonax traillii) // Auk. 2004. Vol. 121. P. 1103–1121. doi: 10.1642/0004-8038(2004)1212.0.co;2.
Shitikov D. A., Dubkova E. V., Makarova T. V. The demography of Yellow Wagtails Motacilla flava on abandoned fields in northern European Russia // Bird Study. 2013. Vol. 60. P. 518–526. doi: 10.1080/00063657.2013.850467.
Weatherhead P. J., Forbes M. R. L. Natal philopatry in passerine birds: genetic or ecological influences? // Behav. Ecol. 1994. Vol. 5. P. 426–433. doi: 10.1093/beheco/5.4.426.
White G. C., Burnham K. P. Program MARK: survival estimation from populations of marked animals // Bird Study. 1999. Vol. 46. P. 120–139.
Благодарности
Авторы приносят благодарность всем аспирантам и студентам кафедры зоологии и экологии МПГУ, принимавшим участие в сборе полевого материала. Настоящее исследование было бы невозможным без всесторонней помощи и поддержки дирекции ФГБУ «Национальный парк «Русский Север» и лично А. Л. и Л. В. Кузнецовых. Финансовая поддержка работ осуществлялась РФФИ, гранты № 13-04-00745, 16-04-01383 и 18-34-00466.






 © 2011 - 2026
© 2011 - 2026