Введение
В условиях глобального перманентного загрязнения биосферы особую актуальность приобретает проблема изучения возможности существования организма в субтоксичных условиях среды и поиска порога, за которым изменения биосистем приобретают необратимый характер (Ивантер, Медведев, 2007). Для выявления последствий загрязнения окружающей среды на растения и почву, на воду и природные популяции животных, на здоровье человека необходимы оценки этих изменений. Поэтому при мониторинге загрязнений окружающей среды целесообразно использовать модельные объекты, которые будут соответствовать поставленным задачам. В качестве таких объектов используются мышевидные грызуны (Ивантер, Ивантер, 1981). Благодаря высокой численности и интенсивному размножению, оседлости и небольшому участку обитания, а также высокой чувствительности к внешним агентам они являются незаменимым инструментом экологического мониторинга (Гилева, 1997; Бердюгин, Большаков, 2005; Guillermo Espinosa-Reyes et al., 2014; Rodriguez-Estival, Smits, 2016).
К настоящему времени работ, посвященных биоиндикационным исследованиям на техногенных участках Казахстана, очень мало. По данным А. С. Аталиковой (2009), в Центральном Казахстане под воздействием вредных выбросов Темиртауского промышленного комплекса установлено значительное уменьшение биоразнообразия мелких млекопитающих и снижение их численности. У животных происходит накопление тяжелых металлов во внутренних органах, что приводит к развитию патологических изменений в тканях и органах кроветворения (Шаймарданова, 2010).
Алюминиевое производство Казахстана расположено в г. Павлодаре и включает предприятия АО «Алюминий Казахстана» и АО «Казахстанский электролизный завод». В результате деятельности заводов сформировались участки с максимальными показателями концентрации фтора в почвах города и его окрестностях, превышающими фоновые значения (Макарина, 2015; Сергазинова и др., 2017). Известно, что фтор является одним из ядовитых газов, относящихся к элементам первого класса опасности (Фомин, 2001) и имеющих двойственную биологическую функцию. С одной стороны, фтор жизненно необходим для организма человека и животных, но в строго определенных концентрациях, а с другой стороны, может быть причиной различных заболеваний (Габович, Минх, 1979; Иванов, 1994). При изучении нарушений репродуктивной системы у женщин, проживающих вблизи алюминиевых производств, отмечен высокий процент патологий (Кузьмин, 2007). Установлено, что у беременных женщин соединения фтора проникают через плаценту, накапливаются в организме плода и оказывают токсическое действие в постэмбриональный период, вызывая ухудшение кровоснабжения, торможение деления клеток, ослабление функциональной активности остеокластов и остеобластов, в результате чего замедляется рост костей и в длину, и в толщину (Донских, 2013). Длительное избыточное поступление фтора в организм приводит к снижению умственной способности у детей и различным психическим расстройствам у взрослых (Trivedi et al., 2007; Tang et al., 2008). Поэтому проблема влияния загрязнения алюминиевого производства на окружающую среду и здоровье человека на территории Северного Казахстана стоит очень остро. Чтобы оценить скорость и количество накопления фтора в организме человека и животных, необходимы модельные объекты, которыми могут быть мелкие млекопитающие.
Цель данной работы состоит в исследовании структуры населения и численности мелких млекопитающих на участках с разной техногенной нагрузкой в промышленной зоне алюминиевого производства г. Павлодара. На основе этих данных необходимо выделить модельные виды для изучения концентрации фтора в организме животных.
Материалы
Исследования проводили в зоне действия двух крупных предприятий АО «Алюминий Казахстана» и АО «Казахстанский электролизный завод».
Расстояние между заводами около 10 км. Рядом с Павлодарским алюминиевым заводом (ПАЗ) располагается теплоэлектроцентраль (ТЭЦ), входящая в состав предприятия. Завод находится на юго-востоке города на расстоянии около 2 км от жилого микрорайона. Алюминиевый завод и ТЭЦ выбрасывают до 90 % от общего количества загрязняющих веществ в год, что приводит к наибольшим концентрациям в почвах вредных элементов (Панин и др., 2006).
АО «Казахстанский электролизный завод» (КЭЗ) располагается на расстоянии 13.5 км от города в юго-восточном направлении (Ибрагимов, Пак, 2009). Основными загрязнителями подобного производства являются фторидные соединения, которые могут рассеиваться в радиусе 50 км, а также окиси углерода, диоксид серы и пыль (Чибиряк, 1996; Ермиенко, 2010).
Полевые работы проводились в 2016–2017 гг. на 12 пробных участках в схожих биотопах в пределах трех зон техногенной нагрузки, расположенных в западном и восточном направлениях, на разном удалении от источников загрязнения. Зоны выделяли на основании данных статьи С. В. Мухачевой (2005): импактная зона до 0.5–3 км, буферная – 3–5 км, фоновая – 20–25 км. В импактной зоне выбрано пять пробных участков – И1, И2, И3, И4, И5; в буферной три – Б6, Б7, Б8; в фоновой четыре – Ф9, Ф10, Ф11, Ф12 (рис. 1). Кроме того, в качестве контрольной зоны выделен участок, расположенный на расстоянии около 200 км от г. Павлодара. Участок размещался в окрестностях с. Троицкое, в 15 км от г. Карасук Новосибирской области (Карасукский стационар Института систематики и экологии животных СО РАН, КК).
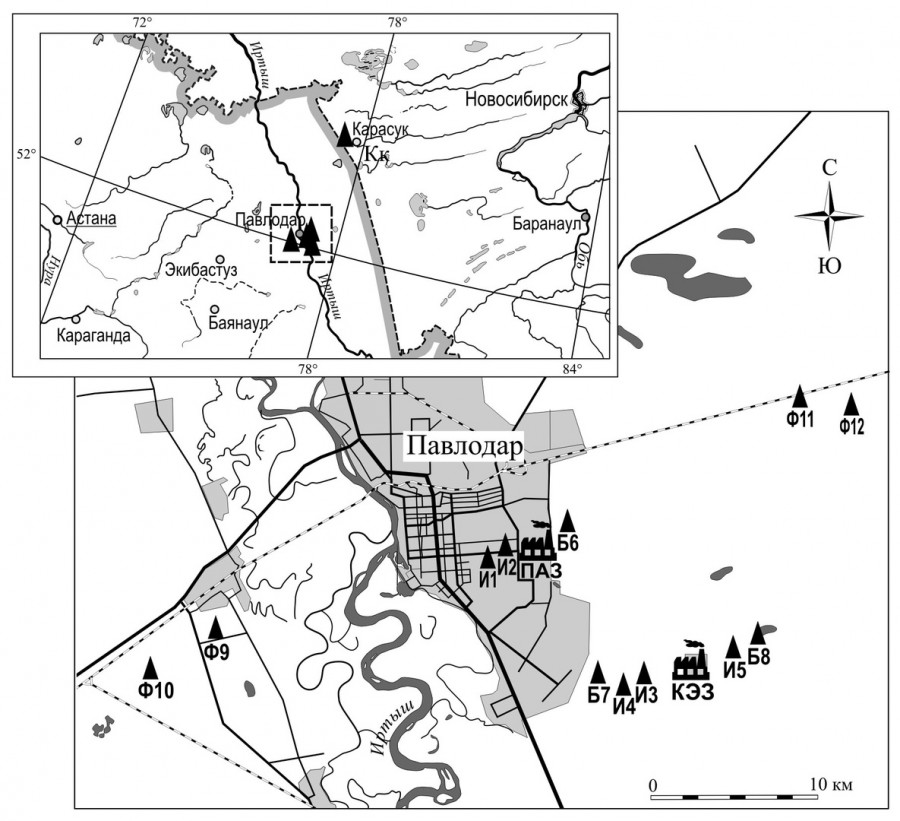
Рис. 1. Район исследования и участки отлова мелких млекопитающих. Ф9, Ф10, Ф11, Ф12 – фоновая зона; Б6, Б7, Б8– буферная зона, И1, И2, И3, И4, И5 – импактная зона; ПАЗ – алюминиевый завод; КЭЗ – электролизный завод; Карасук (Кк) – контрольный участок
Fig. 1. Study area and small mammal catching areas. Ф11, Ф12 – background zone; Б6, Б7, Б8 – buffer zone, И1, И2, И3, И4, И5 – impact zone; ПАЗ- aluminum plant; КЭЗ – electrolysis plant; Karasuk (Kk) – control plot
На территории импактной зоны пробные участки располагались в разнотравно-полынной (И1, И2), разнотравно-ковыльно-полынной (И3, И4) и разнотравно-типчаковой (И5) степях. Буферная зона представлена типчаково-полынной (Б6), полынно-ковыльной (Б7) и разнотравно-типчаковой степями (Б8), а фоновая – типчаково-полынной (Ф9, Ф10) и полынной степями (Ф11, Ф12). Контрольная территория в окрестностях с. Троицкое (КК) представлена следующими биотопами: типчаково-злаково-разнотравная степь, небольшой участок ковыльно-типчаковой степи вдоль лесополосы, участок пахотного поля, заросший злаково-разнотравной растительностью, и берег оз. Кротово, заросший злаково-разнотравной растительностью (Дупал, 2010). Этот участок был выбран на основании сходства ландшафтно-экологических условий до начала антропогенных воздействий и его можно рассматривать как зону регионального фона (Дупал, 2008). Как техногенная, так и контрольная территории располагаются в пределах южной части Западно-Сибирской низменности и представлены равнинным рельефом.
Методы
Для отлова и учета мелких млекопитающих использован метод ловчих канавок, дающий наиболее массовый и репрезентативный материал (Новиков, 1953), что особенно важно при дальнейшей статистической обработке (Песенко, 1982). Отловы проводились весь бесснежный период, с мая по сентябрь, 2016–2017 гг., в течение 10–20 дней каждого месяца. В дно ловчей канавки длиной 50 м и глубиной 10–12 см вкапывали пять пластиковых или железных конусов высотой 45–50 см и диаметром 25 см на расстоянии 10 м между ними и по 5 м за крайние конусы (Наумов, 1955). В качестве конусов были использованы обычные 5-литровые емкости со срезанным дном. Канавки проверяли ежедневно рано утром. В качестве числовых характеристик видов в сообществе применяли индекс доминирования (процент или доля вида в сообществе (и. д.)) и показатель численности (п. ч.), рассчитанный на 100 конусо-суток (к/с) (Кузякин, 1962; Литвинов и др., 2010).
Систематический перечень видов, их русские и латинские названия даны по справочнику «Систематика современных млекопитающих» (Павлинов, 2006) с некоторыми поправками по Каталогу мировой фауны млекопитающих (Wilson, Reeder, 2005).
Добытых животных обрабатывали по стандартным методикам (Ралль, 1947; Новиков, 1953; Тупикова, 1964). Животных и их внутренние органы взвешивали, измеряли экстерьерные и интерьерные показатели, определяли состояние генеративной системы. Возраст зверьков устанавливали по комплексу признаков с учетом размеров и массы тела, состояния половой системы, краниологических признаков, степени стертости зубов и сношенности мехового покрова (Дунаева, 1955). Так, для узкочерепной полевки самцов массой тела больше 20 г, длиной тела меньше 100 мм с хорошо развитым межглазничным гребнем черепа и весом семенника более 100 мг, а также беременных и с плацентарными пятнами самок относили к половозрелым сеголеткам. Неполовозрелых самцов и самок массой тела менее 20 г относили к группе неполовозрелых сеголетков. Перезимовавшие половозрелые полевки имели массу тела более 30 г, длину тела от 110 до 120 мм, на черепе относительно узкое межглазничное пространство, хорошо выраженные теменные и затылочные гребни, широко расставленные скуловые дуги. Особей степной мышовки массой тела около 7 г и длиной тела около 55 мм относили к половозрелым сеголеткам, при этом у самцов размер семенных пузырьков составлял 9.3 мм, а самки были беременными и/или с плацентарными пятнами. Самцов и самок массой тела менее 6 г и длиной тела около 53.7 мм относили к группе неполовозрелых сеголетков. У самцов данной возрастной группы длина семенных пузырьков составляла 3.6 мм, а у самок отмечена матка нитевидной формы. Перезимовавшие степные мышовки имели массу тела около 8 г, длину тела около 61 мм, у самцов размер семенных пузырьков составлял 11.6 мм, самки также были беременные и/или с плацентарными пятнами. Нами также учитывалось время рождения грызунов. Как правило, у самцов и самок, родившихся весной и в начале лета, половое созревание наступает через несколько недель после рождения. Зверьки, родившиеся в конце лета и осенью, обычно созревают после зимовки. Половое созревание мелких грызунов колеблется от 3–4 недель до 7–12 месяцев. Массу и длину тела, физиологическое состояние и признаки черепа использовали для всех видов мелких млекопитающих. По этим показателям мы выделили три возрастные группы: перезимовавшие, сеголетки половозрелые и сеголетки неполовозрелые.
Определение содержания фтора в костной ткани животных проводили в лаборатории биогеохимии почв Института почвоведения и агрохимии СО РАН методом потенциометрии с помощью фтор-селективного электрода (Хаземова, 1983; Методика измерений…, 2012). Проанализировано 76 объединенных проб костного материала от 156 особей мелких грызунов доминирующих видов. Пробы анализируемого материала объединяли по возрасту животных и участку отлова, т.е. по зонам техногенной нагрузки и контрольной территории. Половозрелых и неполовозрелых сеголетков объединили в одну группу из-за малочисленности каждой из них.
Результаты
Численность и население мелких млекопитающих. Всего за время исследований отработано 7892 к/с в техногенной и 1535 к/с на контрольной территориях. Отловлено 497 особей мелких млекопитающих 20 видов, 12 родов, 5 семейств и 2 отрядов.
Показатель суммарного обилия мелких млекопитающих во всех зонах техногенной нагрузки в период массового размножения был весьма низок (2.9 особи на 100 к/с), в то время как на контрольной территории численность выше в шесть раз и составляет 17.5 особи на 100 к/с (табл. 1). В зоне техногенной нагрузки отмечена тенденция уменьшения видового разнообразия и показателя численности по мере приближения к источникам загрязнения. Тем не менее распределение мелких млекопитающих на всех территориях техногенного воздействия, независимо от расстояния до заводов, неравномерное. Так, на фоновых наветренных участках (Ф9, Ф10), характеризующихся меньшим влиянием от выбросов промышленных предприятий, население мелких млекопитающих представлено 12 видами с общим показателем численности 4.3 особи на 100 к/с. В то же время на подветренных участках (Ф11, Ф12), где вредное воздействие от выбросов выражено в большей степени, отмечено всего семь видов, а суммарное обилие составляет 1.6 особи на 100 к/с. В буферной зоне алюминиевого завода (Б6), характеризующейся понижениями в рельефе и более густым и высоким травостоем, показатель численности мелких млекопитающих самый высокий – 7.7 особи на 100 к/с, а видовое богатство достигает шести видов. В то же время в импактной зоне, т.е. в непосредственной близости от алюминиевого завода на пробных участках И1, И2, количество видов достигает девяти с более низким показателем численности (1.8 особи на 100 к/с). В буферной (Б7, Б8) и импактной (И3, И4, И5) зонах электролизного завода отмечено по девять и восемь видов соответственно, с одинаково невысоким показателем численности (2.6 особи на 100 к/с).
На фоновых наветренных территориях (Ф9, Ф10) доминирует узкочерепная полевка (56.7 %), а на подветренных (Ф11, Ф12) – обыкновенная слепушонка (43.5 %) и степная мышовка (25.1 %). На буферных участках алюминиевого завода (Б6) абсолютно доминируют узкочерепная полевка (64.1%) и тундряная бурозубка (15.4 %), а электролизного завода (Б7, Б8) – степная мышовка (30.7 %) и джунгарский хомячок (25 %). В населении импактной зоны алюминиевого завода (И1, И2) преобладают обыкновенная (39.1 %) и узкочерепная (21.7 %) полевки, а в импактной зоне электролизного (И3, И4, И5) – степная мышовка (62.5 %) и джунгарский хомячок (16.7 %). На контрольной территории (Кк) доминируют узкочерепная полевка (44.4 %), тундряная бурозубка (15.3 %) и мышь-малютка (10.4 %).
Итак, на большей части территории техногенной зоны, как и на контрольном участке, преобладает узкочерепная полевка, предпочитающая открытые степные ландшафты (Млекопитающие..., 1978). В буферной зоне электролизного завода отмечается уменьшение индекса доминирования узкочерепной полевки, а в импактной зоне он не встречается. Доминирующее положение в этих зонах КЭЗ занимает степная мышовка, которая предпочитает ковыльные степи с задернованной почвой. Кроме того, данный вид отмечен на всех фоновых участках и на буферном участке алюминиевого завода. На контрольной территории степная мышовка за период исследований не встречена. Среди землероек на техногенной территории ведущее положение занимает тундряная бурозубка, которая встречена в импактных, буферных и фоновых участках. Реже встречается малая белозубка, отмеченная также во всех трех зонах, а обилие обыкновенной, малой и крошечной бурозубок совсем незначительно. Низкая численность землероек на техногенной территории, а в особенности в импактных сообществах, обусловлено прежде всего деградацией кормовых ресурсов – почвенных беспозвоночных (Безель, 2006). В то же время на контрольной территории обилие насекомоядных значительно выше, а тундряная, малая и обыкновенная бурозубки занимают доминантное и содоминантное положение. На техногенной территории структура доминирования мелких млекопитающих характеризуется значительной монодоминантностью. Больше половины всего населения здесь занимают узкочерепная полевка и степная мышовка (37 и 23 %), а на долю остальных видов приходится всего 39 %. На контрольной территории структура доминирования характеризуется большей выравненностью. Доминируют здесь три вида – узкочерепная полевка, тундряная бурозубка и мышь-малютка (44, 15 и 10 %), и совсем немного уступают им обыкновенная и малая бурозубки (по 9 %).
Нарушение структуры доминирования сообществ мелких млекопитающих и их низкая численность на техногенной территории указывает на низкую продуктивность местообитаний по сравнению с контролем. Схожая тенденция наблюдается и на территории Гиссарской долины в окрестностях Таджикского алюминиевого завода, Южно-Минусинской котловины в районе действия двух крупнейших алюминиевых заводов Саянского промышленного комплекса, а также Центрального Казахстана в районе Темиртауского промышленного комплекса (Джураев, 1993; Чибиряк, 1996; Аталикова, 2009; Преловский, 2015).
Таблица 1. Население мелких млекопитающих в зонах техногенной нагрузки и на контрольной территории
| Вид | Импактная зона | Буферная зона | Фоновая зона | Контрольная зона | ||||||||||
| И1,И2 | И3,И4,И5 | Б6 | Б7,Б8 | Ф9,Ф10 | Ф11,Ф12 | КК | ||||||||
| n | п. ч.* | n | п. ч. | n | п. ч. | n | п. ч. | n | п. ч. | n | п. ч. | n | п. ч. | |
| Малая бурозубка (Sorex minutus L., 1766) | 1 | 0.08 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.07 | 1 | 0.07 | 24 | 1.6 |
| Средняя бурозубка (S. caecutiens Laxmann, 1785) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.07 |
| Тундряная бурозубка (S. tundrensis Merriam, 1900) | 1 | 0.08 | 0 | 0 | 6 | 1.2 | 3 | 0.2 | 3 | 0.2 | 1 | 0.07 | 41 | 2.7 |
| Обыкновенная бурозубка (S. araneus L., 1758) | 0 | 0 | 1 | 0.05 | 0 | 0 | 1 | 0.07 | 0 | 0 | 0 | 0 | 23 | 1.5 |
| Крошечная бурозубка (S. minutissimus Zimmermann, 1780) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.07 | 0 | 0 | 0 | 0 |
| Малая белозубка (Crocidura suaveolens Pall., 1811) | 2 | 0.2 | 1 | 0.05 | 1 | 0.2 | 0 | 0 | 4 | 0.3 | 0 | 0 | 0 | 0 |
| Краснощекий суслик (Spermophilus erythrogenys, Brandt, 1841) | 1 | 0.08 | 0 | 0 | 0 | 0 | 1 | 0.07 | 0 | 0 | 0 | 0 | 0 | 0 |
| Степная мышовка (Sicista subtilis Pall., 1773) | 0 | 0 | 30 | 1.6 | 5 | 1.0 | 11 | 0.8 | 1 | 0.07 | 6 | 0.4 | 0 | 0 |
| Джунгарский хомячок (Phodopus sungorus Pall., 1773) | 2 | 0.2 | 8 | 0.4 | 0 | 0 | 9 | 0.6 | 3 | 0.2 | 1 | 0.07 | 2 | 0.1 |
| Обыкновенная слепушонка (Ellobius talpinus Pall., 1770) | 0 | 0 | 2 | 0.1 | 0 | 0 | 3 | 0.2 | 0 | 0 | 10 | 0.7 | 0 | 0 |
| Красная полевка (Myodes rutilus Pall., 1779) | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.07 | 0 | 0 | 0 | 0 | 0 | 0 |
| Степная пеструшка (Lagurus lagurus Pall., 1773) | 0 | 0 | 4 | 0.2 | 1 | 0.2 | 3 | 0.2 | 4 | 0.3 | 2 | 0.1 | 1 | 0.07 |
| Водяная полевка (Arvicola amphibius L., 1758) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.07 |
| Полевка-экономка (Microtus oeconоmus Pall., 1776) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 0.3 | 0 | 0 | 9 | 0.6 |
| Узкочерепная полевка (M. gregalis Pall., 1779) | 5 | 0.4 | 1 | 0.05 | 25 | 4.9 | 4 | 0.3 | 34 | 2.4 | 2 | 0.1 | 119 | 7.8 |
| Обыкновенная полевка (M. arvalis Pall., 1779 ) | 9 | 0.8 | 1 | 0.05 | 1 | 0.2 | 0 | 0 | 1 | 0.07 | 0 | 0 | 0 | 0 |
| Восточноевропейская полевка (M. levis Miller, 1908) | 1 | 0.08 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 8 | 0.5 |
| Мышь-малютка (Micromys minutus Pall., 1771) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.07 | 0 | 28 | 1.8 | |
| Полевая мышь (Apodemus agrarius Pall., 1771) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 9 | 0.6 |
| Малая лесная мышь (A. uralensis Pall., 1811) | 1 | 0,08 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0.2 | 0 | 0 | 2 | 0.1 |
| Всего | 23 | 1.8 | 48 | 2.6 | 39 | 7.7 | 36 | 2.6 | 60 | 4.3 | 23 | 1.6 | 268 | 17.5 |
Примечание. * п. ч. – показатель численности
Накопление фтора в почве промышленной зоны ПАЗ и КЭЗ
В результате деятельности предприятий происходит накопление фтора в почве и по мере приближения к заводам площадь загрязненных участков увеличивается. Исследования Л. А. Макариной (2015) выявили участки почвы с максимальными содержаниями фтора, которые превышают фоновые значения (0.1 мг/кг) в 492–847 раз. Наибольшие значения содержания фтора наблюдаются в импактных зонах обоих предприятий (14.5–15.3 мг/кг) и в буферной зоне электролизного завода (12 мг/кг), что превышает норму ПДК (до 10 мг/кг) (Гигиенические нормативы…, 2015) и фоновые значения (6.3 мг/кг) (Сергазинова и др., 2017).
Вокруг электролизного завода санитарно-защитная зона не имеет плотного лесного барьера, который мог бы усваивать частично продукты загрязнения. Имеющиеся древесные насаждения, как правило, молодые и редкие в отличие от окрестностей алюминиевого завода. Вследствие этого фтор за счет более дренированных почв может быстрее вымываться со степных участков в сторону жилых территорий (п. Жетекши, с. Красноармейка, с. Кенжеколь) и негативно сказываться на здоровье населения. Степные растительные сообщества способны накапливать и выносить высокие концентрации фтора, что делает опасным содержание скота в данных районах из-за его потенциальной токсичности. Тем не менее выпас скота интенсивно ведется на прилегающих территориях обоих заводов, что может приводить к повышению уровня фтора в организме животных и как следствие в продуктах питания (молоке, мясе) (Сергазинова и др., 2017).
Содержание фтора в костной ткани грызунов. Анализ фауны и населения мелких млекопитающих на техногенной территории показал, что больше половины всего населения здесь занимают узкочерепная полевка (31 %) и степная мышовка (23%), а также относительно высока доля джунгарского хомячка (10 %) и степной пеструшки (6 %). Данные виды в сравнении с другими более равномерно распределены по зонам техногенной нагрузки. Поэтому для изучения содержания фтора в костной ткани были выбраны эти четыре вида. Аккумуляция фтора в костях грызунов разных видов происходит неодинаково (табл. 2). У узкочерепной полевки и степной мышовки наблюдается тенденция линейного увеличения накопления фтора в костях, так же как и в почве, по мере приближения к заводу. Пик концентрации фтора в данных случаях приходится на ближайшее расстояние от заводов.
Таблица 2. Концентрация фтора в костях грызунов (мг/кг золы), 2016-2017 гг.
| Вид | n | Возраст | Контрольная зона | Зона техногенной нагрузки | ||||||
| фоновая зона | буферная зона | импактная зона | ||||||||
| n | F (M ± m) | n | F (M ± m) | n | F (M ± m) | n | F (M ± m) | |||
| Узкочерепная полевка | 70 | перезимовавшие | 1 | 22.3 | - | - | 4 | 63.2±34.4 | - | - |
| сеголетки | 17 | 48.8±11.5 | 26 | 144.8±27 | 16 | 146.1±61.1 | 6 | 175.4±88.7 | ||
| Степная мышовка | 48 | перезимовавшие | - | - | - | - | 6 | 420.0±66.0 | 6 | 1447.2±674.8 |
| сеголетки | - | - | 3 | 275.6 | 9 | 334.8±194.6 | 24 | 550.2±269.3 | ||
| Джунгарский хомячок | 22 | перезимовавшие | - | - | 1 | 500.9 | 2 | 142.9 | 1 | 1049.8 |
| сеголетки | - | - | 3 | 54.4±20.7 | 7 | 90.6±66.0 | 8 | 254.0±118.3 | ||
| Степная пеструшка | 13 | перезимовавшие | - | - | 1 | 8.5 | 1 | 1196.5 | 2 | 251.8±76.6 |
| сеголетки | - | - | 4 | 104.0±35.7 | 3 | 108.5±80.9 | 2 | 107.92 | ||
У степной мышовки обнаружены самые высокие средние концентрации валового фтора в костной ткани. Более того, на фоновых территориях значения фтора выше (275.6 мг/кг), чем у других видов животных, в том числе и с импактных зон. Более высокая концентрация фтора у степной мышовки может быть связана со смешанным характером питания этого вида. В отдельные сезоны года в питании степной мышовки могут преобладать животные корма (Млекопитающие, 1977). Из литературы известно, что у насекомых фтор может накапливаться до критических значений. Так, на расстоянии 1 км от алюминиевого завода содержание фтора в хитиновом покрове насекомых может быть выше в 17–35 раз, чем на контроле (Селиховкин, 2013; Dewey, 1973). Видимо, поэтому максимальное содержание фтора в объединенной пробе костей степной мышовки наблюдается с подветренной стороны импактной зоны электролизного завода (И5) – 2122.1 мг/кг, куда ветром приносит насекомых. С наветренной стороны содержание фтора значительно ниже (И3, И4) – 43.6 мг/кг. Как показано в табл. 2, накопление фтора в костной ткани степной мышовки связано с возрастом животных: более высокие концентрации у перезимовавших особей, чем у сеголетков, причем в импактной зоне отмечено почти трехкратное превышение. Известно, что концентрации фтора в тканях животных с возрастом только нарастают (Ермаков, Тютиков, 2008).
Среднее содержание валового фтора в костях перезимовавших особей узкочерепной полевки на контрольной территории составило 22.3 мг/кг, а в буферной зоне этот показатель выше почти в три раза (63.2 мг/кг). У сеголетков из фоновых (р ˂ 0,01) и буферных зон также отмечено трехкратное увеличение содержания фтора по сравнению с контролем, а в импактной зоне этот показатель выше в 3.6 раза (175.4 мг/кг). Максимальное значение содержания фтора в костях узкочерепной полевки отмечено в буферной зоне алюминиевого завода (Б6) – 831.5 мг/кг, что может быть связано с тем, что данный участок располагался с подветренной стороны завода. Кроме того, наличие здесь древесно-кустарниковой растительности может служить геохимическим барьером, в котором происходит накопление фтора.
В отличие от первых двух видов, у перезимовавших особей джунгарского хомячка содержание фтора в костной ткани имеет большой разброс, самые высокие значения наблюдаются в импактной (1049.8 мг /кг) и в фоновой (500.9 мг /кг) зонах, а минимальное – в буферной (142.9 мг/кг). Аналогичный большой разброс содержания фтора в костях отмечен у взрослых особей степной пеструшки. Здесь самые высокие значения отмечены в буферной зоне (1196.5 мг/кг), значительно меньше в импактной (251.8 мг/кг), а минимум характерен для фоновой территории – 8.5 мг/кг. Только у сеголетков джунгарского хомячка наблюдается тенденция увеличения фтора в костях по мере приближения к заводу: в импактных зонах значения почти в 5 раз выше, чем на фоновых (254.0 и 54.4 мг/кг соответственно). Однако у сеголетков степной пеструшки во всех трех зонах техногенной нагрузки отмечены практически одинаковые показатели (104.0–107.92 мг/кг).
Обсуждение
Анализ показывает, что увеличение накопления фтора в организмах этих животных с приближением к источнику выбросов происходит неравномерно, а скачкообразно. С одной стороны, это может быть связано с недостаточной выборкой, но, возможно, и с природными условиями территории. По данным В. А. Преловского (2015), концентрация фтора в окружающей среде может значительно изменяться в зависимости не только от расстояния до источника эмиссий, но и от рельефа, структуры и свойств почвенного покрова, типа растительности, а также хозяйственного использования территории. Установлено, что накопление поллютантов зависит от удерживающих способностей почв и подстилающих пород, вследствие чего их содержание вдали от источника может быть значительно выше, чем вблизи его (Давыдова, 2007).
Показатели содержания фтора в костной ткани грызунов на подветренной стороне импактной зоны (И5) значительно выше, чем на наветренной стороне (И3, И4). У степной пеструшки эти показатели выше в два раза, у степной мышовки в три, а у джунгарского хомячка в 4.5 раза. Аналогичная тенденция наблюдается и на фоновых участках. Так, в костях узкочерепной полевки содержание фтора на фоновых территориях с подветренной стороны почти в два раза выше, чем на аналогичных участках, но с наветренной стороны (255.2 и 132.5 мг/кг соответственно). Такая же тенденция наблюдается и у джунгарского хомячка (501 и 54 мг/кг соответственно).
Дальнейшее увеличение мощностей алюминиевого производства Северного Казахстана прогнозируемо приведет к усилению техногенной нагрузки на окружающие экосистемы и увеличению концентраций фтора в почвах и в организме животных. Так, в результате более длительного негативного воздействия алюминиевых заводов Саянского промышленного комплекса на экосистемы Южно-Минусинской котловины произошло постепенное накопление вредных веществ во всех ее компонентах и расширение общей зоны загрязнения. Эти накопления проявляются в аномально высоких концентрациях фтора в организмах животных даже на значительном расстоянии от заводов (Преловский, 2015).
Заключение
Техногенное воздействие алюминиевого производства г. Павлодара приводит к снижению уровня численности мелких млекопитающих, обеднению видового состава и нарушению структуры доминирования животных. Установлено что по мере приближения к источникам загрязнения в населении мелких млекопитающих снижается не только суммарное обилие, но и видовое богатство. Максимальные значения показателя численности зарегистрированы в буферной зоне алюминиевого завода, где для зверьков сформированы оптимальные условия в виде понижения в рельефе и более высокой и густой растительности. Количество видов выше всего на фоновых наветренных участках и значительно меньше на подветренных. Мелкие млекопитающие распределены по территории неравномерно.
В зоне техногенной нагрузки фтор в костных тканях грызунов аккумулируется неодинаково. Самые высокие средние концентрации валового фтора обнаружены у степной мышовки. У узкочерепной полевки, степной мышовки и сеголетков джунгарского хомячка наблюдается тенденция линейного увеличения накопления фтора в костях, так же как и в почве, по мере приближения к заводу. Пик концентрации фтора в данных случаях приходится на ближайшее расстояние от заводов. Однако у перезимовавших особей степной пеструшки, наоборот, содержание фтора в буферной зоне выше, чем в импактной. У перезимовавших особей джунгарского хомячка максимальные значения наблюдаются на фоновой и импактной территориях и значительно меньше в буферной. Выявленная нами тенденция снижения уровня численности мелких млекопитающих, обеднения видового состава и увеличения накопления фтора в костной ткани животных по мере приближения к заводам согласуется с данными по другим промышленным зонам алюминиевого производства.
В качестве наиболее подходящего биоиндикатора фторового загрязнения исследуемой территории можно рекомендовать узкочерепную полевку, что обусловлено ее относительно высокой численностью и встречаемостью практически на всех обследуемых участках. В районе электролизного завода, где отсутствует узкочерепная полевка, в качестве биоиндикатора может быть рекомендована доминирующая здесь степная мышовка.
Библиография
Аталикова А. С. Оценка и биомониторинг негативного воздействия на окружающую среду Темиртауского промышленного комплекса: Автореф. дис. … канд. биол. наук . Алматы, 2009. 20 с.
Безель В. С. Экологическая токсикология: популяционный и биоценотический аспекты . Екатеринбург: Гощицкий, 2006. 280 с.
Бердюгин К. И., Большаков В. Н. Млекопитающие в экологическом мониторинге // Методы экологического мониторинга: большой специальный практикум: Учеб. пособие. Екатеринбург: Изд-во Урал. ун-та, 2005. 236 с.
Габович Р. Д., Минх А. А. Гигиенические проблемы фторирования питьевой воды . М.: Медицина, 1979. 200 с.
Гигиенические нормативы к безопасности окружающей среды (почве): Приказ Министра национальной экономики Республики Казахстан от 25 июня 2015 . URL: https://tengrinews.kz/zakon/pravitelstvo_respubliki_kazahstan_premer_ministr_rk/ohrana_okrujayuschey_sredyi (дата обращения: 20.12.2017).
Гилева Э. А. Эколого-генетический мониторинг с помощью грызунов (уральский опыт) . Екатеринбург: Изд-во Урал. ун-та, 1997. 105 с.
Давыдова Н. Д. Техногенные потоки и дифференциация веществ в геосистемах // Географические исследования Сибири. Новосибирск, 2007. Т. 2. С. 261–277.
Джураев М. И. Экологический анализ поражения животных Гиссарской долины техногенным фтором : Автореф. дис. … канд. биол. наук. Ектеринбург, 1993. 26 с.
Донских И. В. Влияние фтора и его соединений на здоровье населения (обзор данных литературы) // Бюллетень ВСНЦ СО РАМН. 2013. № 3 (91). Ч. 2. С. 179–185.
Дунаева Т. Н. К изучению биологии размножения обыкновенной бурозубки (Sorex araneus L.) // Бюллетень МОИП. Отд. Биол. 1955. Т. 60. № 6. С. 27–43.
Дупал Т. А. Глава 9: Млекопитающие // Биоразнообразие Карасукско-Бурлинского региона (Западная Сибирь). Новосибирск: Изд-во СО РАН, 2010. С. 234–239.
Дупал Т. А. Популяционная динамика и изменения структуры сообщества мелких млекопитающих Северной Кулунды // Зоологический журнал. 2008. Т. 87. № 5. С. 609–613.
Ермаков В. В., Тютиков С. Ф. Геохимическая экология животных . М.: Наука, 2008. 315 с.
Ермиенко А. В. Влияние деятельности электролизного завода на экологическую обстановку Павлодарского района (Республика Казахстан): Автореф. дис. … канд. биол. наук . Омск, 2010. 18 с.
Ибрагимов А. Т., Пак Р. В. Электрометаллургия алюминия. Казахстанский электролизный завод . Павлодар: Дом печати, 2009. 261 с.
Иванов В. В. Экологическая геохимия элементов: В 6 кн. . М.: Недра, 1994. Кн. 2. 300 с.
Ивантер Э. В., Ивантер Т. В. Биоценотические группировки мелких млекопитающих в коренных и антропогенных ландшафтах Приладожья // Влияние антропогенных факторов на структуру и функционирование биогеоценозов: Сб. материалов конф. Калинин: Изд-во КГУ, 1981. С. 47–50.
Ивантер Э. В., Медведев Н. В. Экологическая токсикология природных популяций птиц и млекопитающих Севера . М.: Наука, 2007. 229 с.
Кузьмин Д. В. Сравнительный анализ показателей репродуктивного здоровья женщин, проживающих в районах расположения алюминиевого производства // Гигиена и санитария. 2007. № 3. С. 13–15.
Кузякин А. П. Зоогеография СССР // Ученые записки Московского пед. института. 1962. Т. 59. Вып. 1. С. 3–182.
Литвинов Ю. Н. Элементы пространственной организации сообществ мелких млекопитающих Сибири // Труды Института систематики и экологии животных СО РАН. Вып. 46. Сообщества и популяции животных: морфологический и экологический анализ. Новосибирск; М.: Товарищество научных изданий КМК, 2010. С. 17–49.
Макарина Л. А. Оценка содержания фтора в почвах в зоне влияния АО «Алюминий Казахстана» и АО «Казахстанский электролизный завод» // Проблемы геологии и освоения недр: Труды XIX Международного симпозиума имени академика М. А. Усова студентов и молодых ученых, посвященного 70-летнему юбилею Победы советского народа над фашистской Германией: В 2 т. Томск: Изд-во ТПУ, 2015. Т. 1. C. 634–636.
Методика измерений массовых концентраций фторид ионов в питьевых, природных и сточных водах потенциометрическим методом . М., 2012. 13 с.
Млекопитающие Казахстана: В 4 т. . Т. 1. Ч. 2. Алма-Ата: «Наука» КазССР, 1977. 536 с.
Млекопитающие Казахстана: В 4 т. . Т. 1. Ч. 3. Алма-Ата: «Наука» КазССР, 1978. 492 с.
Мухачева С. В. Особенности питания рыжей полевки (Gletrionomys glareolus, Shreber, 1780) в условиях техногенного загрязнения среды обитания // Сибирский экологический журнал. 2005. № 3. C. 523–533.
Наумов Н. П. Изучение подвижности и численности мелких млекопитающих с помощью ловчих канавок // Вопросы краевой и экспериментальной паразитологии и медицинской зоологии. М., 1955. С. 179–202.
Новиков Г. А. Полевые исследования по экологии наземных позвоночных . М., 1953. 502 с.
Павлинов И. Я. Систематика современных млекопитающих . М.: Изд-во МГУ, 2006. 297 с.
Панин М. С., Ажаев Г. С., Э. А. Гельдымамедова. Загрязнение снегового покрова ртутью на территории города Павлодара // Вестник ПГУ. Серия «Биологическая». Павлодар, 2004. С. 61–64.
Песенко Ю. А. Принципы и методы количественного анализа в фаунистических исследованиях . М.: Мысль, 1982. 288 с.
Преловский В. А. Антропогенная трансформация структуры населения наземных позвоночных животных Южно-Минусинской котловины: Автореф. дис. … канд. геогр. наук . Иркутск, 2015. 24 с.
Ралль Ю. М. Методика полевого изучения грызунов и борьба с ними . Ростов н/Д, 1947. 158 с.
Селиховкин А. В. Ответные реакции насекомых-дендрофагов на промышленное загрязнение воздуха // Междисциплинарный научный и прикладной журнал «Биосфера». 2013. Т. 5. № 1. С. 48–76.
Сергазинова З. М., Дупал Т. А., Ержанов Н. Т. Накопление фтора в костях грызунов в промышленной зоне г. Павлодар // Вестник. Астана. 2017. № 2 (117). С. 287–297.
Тупикова Н. В. Изучение размножения и возрастного состава популяций мелких млекопитающих // Методы изучения природных очагов болезни человека. М.: Медицина, 1964. С. 154–191.
Фомин Г. С., Фомин Ф. Г. Почва. Контроль качества и экологической безопасности по международным стандартам . М.: Протектор, 2001. 304 с.
Хаземова Л. А., Радовская Т. Л., Круглова Н. В., Качалкова Т. К. Определение фтора в растительном материале // Агрохимия. 1983. № 6. С. 66–72.
Чибиряк М. В. Популяция домовой мыши в условиях техногенного загрязнения среды фтором: Автореф. дис. … канд. биол. наук . Екатеринбург, 1996. 22 с.
Шаймарданова Б. Х. Оценка качества урбанизированных территорий (на примере г. Павлодара) и прогнозирование экологической безопасности среды обитания: Автореф. дис. … канд. биол. наук . Алматы, 2010. 50 с.
Dewey J. E. Accumulation of fluorides by insects near an emission source in western Montana // Environ. Entomol. 1973. № 2. P. 179–180.
Guillermo Espinosa-Reyes, Gonzalez-Mille D. J., Ilizaliturri-Hernandez C. A. et al. Effect of mining in biotic communities of villa de la Paz San Luis Potosi, Mexico // BioMed Research International. 2014. 13 p. DOI: org/10.1155/2014/65046.
Rodriguez-Estival Jaime, Smits Judit T. G. Small mammals as sentinels of oil sands related contaminants and health effects in northeastern Alberta, Canada // Ecotoxicology and Environmental Safety. 2016. № 124. P. 285–295.
Tang Q.-Q., Du J., Ma H.-H., Jiang S.-J., Zhou X.-J. Fluoride and children‘s intelligence: a meta analysis // Biol. Trace Elem. Res. 2008. Vol. 126. P. 115–120.
Trivedi M. H., Verma R. J., Chinoy N. J. et al. Effect of high fluoride water on intelligence of school children in India // Fluoride. 2007. Vol. 40. P. 178–183.
Wilson D. E., Reeder D. M. (editors). Mammal Species of the World. A Taxonomic and Geographic Reference (3rd ed). Johns Hopkins University Press, 2005. URL: http://www.departments.bucknell.edu/biology/resources/msw3/
Благодарности
Авторы статьи выражают благодарность директору института ИПА СО РАН, д. б. н. А. И. Сысо за ценные советы при планировании исследования и ведущему инженеру В. В. Демину за помощь в проведении анализов определения фтора в костной ткани грызунов. Исследования выполнены при частичной финансовой поддержки РФФИ, грант 17-04-00269.






 © 2011 - 2026
© 2011 - 2026