Введение
Исследование влияния абиотических факторов на живые организмы в современных условиях с целью оценки устойчивости организмов к внешним воздействиям – одна из важнейших задач факториальной экологии. У амфибий, постоянно обитающих в загрязненной водной среде, выявляются разнообразные адаптивные изменения, проявляющиеся в том числе и на уровне крови, ключевой гомеостатической структуры организма (Чернышова, Старостин, 1994; Пескова, 2004; Силс, 2008; Davis et al., 2008 и др.). Адаптивные реакции системы крови амфибий протекают неодинаково не только в различных систематических группах, но и у близких видов (Вершинин, 2004). В связи с этим исследования иммуногематологических показателей не только имеют практическую значимость, связанную с оценкой качества среды путем биоиндикации, но и способствуют получению характеристик популяционного гомеостаза, обеспечивающего выживание и существование животных в условиях антропогенного средового стресса.
Перспективным направлением в изучении влияния факторов окружающей среды на генетический аппарат клеток организма является цитогенетический анализ (микроядерный тест). Анализ основан на особенности клеток пролиферирующей (в первую очередь эритроцитов разной степени созревания) ткани под воздействием мутагенов образовывать особые ядерные структуры, которые называются микроядрами (Жулева, Дубинин, 1994; Манских, 2006; Кузина, 2010; Luzhna et al., 2013; Mansi et al., 2014 и др.). Несмотря на относительную изученность механизмов возникновения микроядер (Квасов и др., 2000; Манских, 2006; Прошин, 2007; Ковалева, 2008; Woznicki et al., 2004; Koh-ichi et al., 2011), разные характеристики хромосомных нарушений, изменчивости генома и взаимосвязь их с факторами окружающей среды до сих пор остаются несистематизированными.
Цель работы – аутэкологическое исследование лейкоцитарного состава крови и формирование микроядер в эритроцитах озерных Pelophylax ridibundus (Pallas, 1771) и прудовых лягушек Pelophylax lessonae (Camerano, 1882), обитающих в водных объектах Нижегородской области, в течение двух лет наблюдений.
Материалы
Материалом работы послужили озерные Pelophylax ridibundus (Pallas, 1771) и прудовые Pelophylax lessonae (Camerano, 1882) лягушки, собранные в течение полевых сезонов 2016–2017 гг. в трех водных объектах Нижегородской области, в разной степени подверженных прессу антропогенной нагрузки (табл. 1). Определение видового состава амфибий проводили по внешним морфологическим признакам при помощи определителя (Банников и др., 1977). Определение пола и возраста лягушек проводили по стандартной методике (Шляхтин, Голикова, 1986). Сравниваемые выборки подбирали из животных сходного размера, обоего пола, старше двух лет.
Таблица 1. Эколого-географическая характеристика исследуемых водоемов и объем собранного материала
| № п/п | Водоем | Характеристика водоема | Количество особей |
| Озерные лягушки Pelophylax ridibundus | |||
| 1 | Торфокарьер Ситниковского заказника (Нижегородская обл., Борский р-н); географические координаты: широта 56°43´42.93´´, долгота 44°07´17.99´´ | Искусственный водоем, созданный на месте торфодобычи. Находится рядом с территорией Ситниковского орнитологического заказника. Антропогенная нагрузка слабая | 35 |
| 2 | Оз. Силикатное (г. Н. Новгород, Сормовский р-н); географические координаты: широта 56°36´83.89´´, долгота 43°78´12.47´´ | Искусственный водоем, антропогенная нагрузка значительная. Зона многоэтажной застройки, высокая рекреационная нагрузка, автотранспортное и хозяйственно-бытовое загрязнение | 35 |
| Прудовые лягушки Pelophylax lessonae | |||
| 3 | Оз. Вторчермет (г. Н. Новгород, Канавинский р-н); географические координаты: широта 56°31´21.14´´, долгота 43°84´89.36´´ | Искусственный водоем. Антропогенная нагрузка значительная, находится в зоне многоэтажной застройки, испытывает влияние ОАО «Вторчермет» | 35 |
Методы
В исследованных водоемах в прибрежной зоне были отобраны пробы воды, в которых с помощью спектрофотометра Hach DR-2800 определены химические загрязнители: железо общее, марганец, медь, хром, нитрат-ионы (NO3), нитрит-ионы (NO2), свинец, никель, цинк, хлориды, сульфаты, сульфиды, нефтепродукты и водородный показатель (рН). По результатам анализа был произведен расчет удельного комбинаторного индекса загрязненности воды УКИЗВ (Смирнова и др., 2011; Гелашвили и др., 2016) по формуле:
Sj ' = Sj / Nj,
где Sj – комбинаторный индекс загрязненности воды в j-м створе; Nj – число учитываемых в оценке ингредиентов;
Sj ' – удельный комбинаторный индекс загрязненности воды в j-створе.
У всех особей была взята кровь из сердца для определения количественного содержания эритроцитов (тыс./мм3), лейкоцитов (тыс./мм3), лейкоцитарной формулы крови и приготовления мазков для оценки микроядерного теста. Лейкоцитарную формулу определяли по окрашенным препаратам крови (по Романовскому – Гимзе) на 100 клеток и выражали в виде процентного соотношения отдельных видов лейкоцитов (Меньшиков и др., 1981). Подсчет микроядер (Жулева, Дубинин, 1994) осуществляли на микроскопе «Meiji Techno» с использованием иммерсионного объектива при общем увеличении x1500, просматривая для каждой особи по 2 препарата и анализируя 1000 эритроцитов на препарат (40000 клеток на выборку). Дифференцировали четыре вида микроядер: 1 – оформленные; 2 – прикрепленные; 3 – палочковидные; 4 – разрыхленные (Романова и др., 2018). Окуляр-микрометром проводили измерение большой (2a) и малой (2b) оси каждого микроядра и рассчитывали его площадь (мкм2) по формуле эллипса: S = πab, где а – большая полуось эллипса, b – малая полуось эллипса, π = 3.14.
Статистическую обработку проводили непараметрическими методами в среде R-studio и программе STATISTIСA 10.0 с расчетом критериев: Уилкоксона (W), Краскела м Уоллиса (H), Дана (D), критерия z – при сравнении долей, корреляционным и дисперсионным анализом. Критический уровень значимости (a) принимали равным 0.05. При проведении множественных сравнений производилась коррекция критического уровня значимости с помощью поправки Холма.
Результаты
Спектрофотометрический анализ химического состава вод исследованных водных объектов показал, что основными загрязнителями являлись: железо, марганец, медь, хром и нефтепродукты, содержание которых в наблюдаемый период времени варьировало. Качество воды, согласно удельному комбинаторному индексу загрязненности воды (УКИЗВ), ухудшилось во всех водоемах (табл. 2).
Таблица 2. Гидрохимический анализ загрязненности воды исследуемых водоемов
| Водоем | Год | УКИЗВ, отн. ед. | Класс качества воды |
| Торфокарьер | 2016 | 2.06 | II, слабо загрязненная |
| 2017 | 9.5 | IV, очень грязная | |
| Оз. Силикатное | 2016 | 4.87 | III, умеренно загрязненная |
| 2017 | 7.2 | IV, очень грязная | |
| Оз. Вторчермет | 2016 | 4.51 | III, умеренно загрязненная |
| 2017 | 9.1 | IV, очень грязная |
Так, в 2016 г. воды торфокарьера характеризовались как слабо загрязненные, II класс качества воды; воды оз. Силикатное и оз. Вторчермет относились к III классу качества, умеренно загрязненные. Результаты гидрохимического анализа в 2017 г. показали соответствие вод IV классу качества, очень грязная во всех водных объектах.
В течение двухлетних наблюдений изменялись и иммуногематологические показатели индикаторных видов. Так, у озерных (торфокарьер) и прудовых (оз. Вторчермет) лягушек в периферической крови происходило снижение количества лейкоцитов. Пониженное содержание лейкоцитов в крови озерных лягушек оз. Силикатное наблюдалось в течение всего периода исследований.
Супрессорное действие комплекса загрязнителей водной среды обитания проявлялось и в снижении количества эритроцитов в периферической крови амфибий. Так, в 2017 г. у озерных лягушек торфокарьера выявлено снижение числа эритроцитов в 1.3 раза (W = 2.59; р = 0.009); у особей оз. Силикатное – в 1.25 раза (W = 3.41; р = 0.0006); у прудовых лягушек (оз. Вторчермет) – в 1.9 раза (W = 3.4; р = 0.0006) по сравнению с 2016 г. (табл. 3).
Таблица 3. Общее содержание лейкоцитов (M ± m) и эритроцитов (M ± m) в крови лягушек
| № п/п | Водоем | Год | Содержание лейкоцитов, тыс./мм3 | Содержание эритроцитов, тыс./мм3 |
| Озерные лягушки Pelophylax ridibundus | ||||
| 1 | Торфокарьер | 2016 | 22.10 ± 1.22* | 215.50 ± 4.67* |
| 2017 | 8.30 ± 3.48* | 163.55 ± 2.99* | ||
| 2 | Оз. Силикатное | 2016 | 15.40 ± 0.42 | 216.86 ± 1.79* |
| 2017 | 13.85 ± 4.48 | 172.22 ± 2.15* | ||
| Прудовые лягушки Pelophylax lessonae | ||||
| 3 | Оз. Вторчермет | 2016 | 34.33 ± 2.51* | 191.80 ± 3.66* |
| 2017 | 14.35 ± 6.25* | 99.25 ± 2.81* | ||
Примечание. M – среднее арифметическое; m – ошибка среднего арифметического. * – статистически значимые различия по критерию Уилкоксона (W).
Методом многомерного дисперсионного анализа с расчетом λ Уилкса (λWilks = 0.209, р < 0.001) подтверждена значимость различий по совокупности показателей лейкоцитарного состава крови между выборками зеленых лягушек в 2016 и 2017 гг. Установлено, что на 79 % (коэффициент η2 = 0.791) дисперсия зависимых переменных, показателей лейкоцитарной формулы крови, может быть объяснена межгодовой изменчивостью. Значение λ Уилкса (λWilks = 0.614, р < 0.001) подтверждало и значимость межвидовых различий по совокупности показателей лейкоцитарного состава крови между выборками озерных и прудовых лягушек. Показано, что на 64 % (коэффициент η2 = 0.647) дисперсия зависимых переменных, показателей лейкоцитарной формулы крови, может быть объяснена классом качества воды, определенного по удельному комбинаторному индексу загрязненности.
В течение двух лет наблюдений наиболее стабильные показатели лейкоцитарной формулы крови сохранялись у озерных лягушек торфокарьера. У этих особей наблюдалось снижение в крови доли палочкоядерных нейтрофилов, эозинофилов и повышение доли моноцитов при отсутствии статистически значимых различий в количестве других показателей. Следует отметить, что этот водный объект характеризовался слабым антропогенным влиянием и изменение комплексного индекса качества воды (слабо загрязненная, II класс, 2016; очень грязная, IV класс, 2017) определялось повышением фонового содержания элемента природного происхождения (марганца). У озерных лягушек оз. Силикатное изменились все значения лейкоцитарной формулы крови, кроме содержания миелоцитов, доля которых оставалась высокой в течение всего периода наблюдений. Прудовые лягушки характеризовались снижением в крови доли миелоцитов, больших лимфоцитов и возрастанием количества клеток гранулоцитарного ряда (табл. 4).
Таблица 4. Лейкоцитарные формулы крови зеленых лягушек
| Показатель | Показатели лейкограммы, % | ||||||||
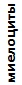 |
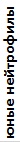 |
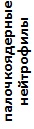 |
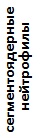 |
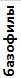 |
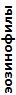 |
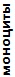 |
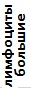 |
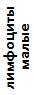 |
|
| Озерные лягушки (Pelophylax ridibundus), торфокарьер, 2016 г. | |||||||||
| M | 8.0 | 2.2 | 3.27 | 4.27 | 3.33 | 4.26 | 1.6 | 23.93 | 49.13 |
| m | 0.2 | 0.14 | 0.15 | 0.23 | 0.25 | 0.18 | 0.13 | 0.5 | 0.39 |
| Озерные лягушки (Pelophylax ridibundus), торфокарьер, 2017 г. | |||||||||
| M | 9.40 | 3.26 | 2.60 | 5.05 | 2.90 | 3.00 | 2.90 | 25.00 | 45.40 |
| m | 0.89 | 0.76 | 0.54 | 1.07 | 0.33 | 0.35 | 0.37 | 1.68 | 2.24 |
| W | 1.82 | 1.42 | 2.41 | 0.36 | 0.50 | 2.62 | 2.48 | 1.73 | 1.82 |
| р | 0.07 | 0.15 | 0.02 | 0.72 | 0.62 | 0.01 | 0.01 | 0.08 | 0.07 |
| Озерные лягушки (Pelophylax ridibundus), оз. Силикатное, 2016 г. | |||||||||
| M | 8.00 | 0.87 | 0.6 | 0.6 | 1.93 | 4.73 | 1.4 | 63.2 | 19.33 |
| m | 0.81 | 0.24 | 0.16 | 0.16 | 0.21 | 0.5 | 0.21 | 1.27 | 1.38 |
| Озерные лягушки (Pelophylax ridibundus), оз. Силикатное, 2017 г. | |||||||||
| M | 6.00 | 3.7 | 1.85 | 3.60 | 6.75 | 7.30 | 2.65 | 19.25 | 48.70 |
| m | 0.74 | 0.87 | 0.40 | 0.70 | 0.74 | 0.84 | 0.34 | 1.02 | 1.22 |
| W | 1.39 | 3.13 | 2.22 | 3.23 | 3.40 | 2.22 | 2.20 | 3.41 | 3.41 |
| р | 0.16 | 0.001 | 0.002 | 0.001 | 0.0006 | 0.02 | 0.027 | 0.001 | 0.001 |
| Прудовые лягушки (Pelophylax lessonae), оз. Вторчермет, 2016 г. | |||||||||
| M | 8.4 | 0.73 | 0.8 | 1.07 | 2.53 | 6.73 | 2.47 | 17.53 | 60.13 |
| m | 1.1 | 0.18 | 0.28 | 0,3 | 0.22 | 0.37 | 0.26 | 1.0 | 1.43 |
| Прудовые лягушки (Pelophylax lessonae), оз. Вторчермет, 2017 г. | |||||||||
| M | 4.70 | 2.65 | 2.40 | 3.15 | 4.30 | 7.70 | 2.60 | 13.80 | 58.85 |
| m | 0.60 | 0.59 | 0.26 | 0.57 | 0.44 | 0.85 | 0.41 | 0.80 | 1.37 |
| W | 2.38 | 2.59 | 2.64 | 1.85 | 2.65 | 0.71 | 0.38 | 2.47 | 0.14 |
| р | 0.017 | 0.01 | 0.008 | 0.064 | 0.008 | 0.477 | 0.7 | 0.013 | 0.887 |
Примечание. M – среднее арифметическое; m – ошибка среднего арифметического; W – критерий Уилкоксона; р – уровень значимости. Жирным текстом выделены статистически значимые различия, a = 0.05.
Лейкоцитарные формулы крови прудовых и озерных лягушек, усредненные по всем исследованным особям, анализировались как между выделенными группами с помощью множественного критерия Краскела – Уоллиса, так и внутри групп с применением критерия Дана. Сравнение лейкоцитарного состава крови озерных и прудовых лягушек по критерию Краскела – Уоллиса выявило межвидовые различия по содержанию миелоцитов, базофилов, эозинофилов и лимфоцитов. Изменчивость параметров лейкоцитарной системы крови прудовых лягушек в специфических условиях среды обитания затрагивала лимфоцитарные клетки, отвечающие за формирование адаптивного иммунитета. В крови прудовых лягушек преобладали некрупные лимфоциты (Н = 39.16, р < 0.001, 2016; Н = 24.02, р < 0.001, 2017). Доля крупных, зрелых лимфоцитов у прудовых лягушек, по сравнению с озерными, оказалась пониженной (Н = 36.62, р < 0.001, 2016; Н = 24.94, р < 0.001, 2017). При снижении в 2017 г. по сравнению с 2016 г. в крови прудовых лягушек количества лейкоцитов (лейкопении) такой характер лейкоцитарной формулы свидетельствовал об истощении костно-мозговых резервов организма. В отношении клеток гранулоцитарного ряда в 2016 г. выявлены значимые различия между озерными лягушками торфокарьера и прудовыми по всем показателям, кроме миелоцитов. В 2017 г. установлены различия между этими выборками по содержанию: миелоцитов (Z = 3.68, р = 0.0006), сумме нейтрофилов (Z = 3.39, р = 0.002) и эозинофилов (Z = 4.10, р = 0.0001). Лейкоцитарные формулы крови озерных лягушек оз. Силикатное отличались от прудовых повышенной долей базофилов (Z = 2.54, р = 0.03). Гидрохимические особенности среды обитания накладывали отпечаток и на физиологическое состояние озерных лягушек, что отражалось в повышенном содержании в крови незрелых форм нейтрофильных гранулоцитов и изменении соотношения доли больших и малых лимфоцитов. Повышенная доля в кровяном русле амфибий молодых, незрелых гранулоцитов, коррелировала с содержанием в водных объектах железа (r = 0.85, р = 0.029) и хлоридов (r = -0.87, р = 0.021).
На фоне снижения числа эритроцитов в крови озерных и прудовых лягушек в течение двухлетних наблюдений выявлены как количественные, так и качественные изменения цитогенетического гомеостаза. Вначале отметим возрастание доли эритроцитов с микроядрами в крови лягушек при повышении уровня загрязнения водоема (рис. 1). Так, у озерных лягушек оз. Силикатное доля микроядер возрастала в 4.3 раза (W = 3.82; р = 0.0001), у прудовых лягушек оз. Вторчермет – в 2.3 раза (W = 3.65; р = 0.00025). Усредненный показатель доли эритроцитов с микроядрами озерных лягушек торфокарьера в течение двух лет оставался высоким (табл. 5). По-видимому, специфические условия обводненного торфокарьера с высокой кислотностью, низкой минерализацией, значительным содержанием органических соединений (Муравьева и др., 2010), превышением ПДКрыб-хоз по содержанию железа (18.3 ПДК, 2016; 14 ПДК, 2017), марганца (375 ПДК, 2017), нефтепродуктов (6 ПДК, 2016; 2.62 ПДК, 2017) и других загрязнителей способствовали формированию микроядер в эритроцитах крови озерных лягушек.
Результаты дисперсионного анализа выявили влияние фактора (класс качества воды) (λWilks = 0.926, р = 0.009) на индукцию микроядер в эритроцитах периферической крови лягушек и подтверждали значимость межвидовых (λWilks = 0.917, р = 0.003) и межгодовых (λWilks = 0.850, р < 0.001) различий по совокупности показателей микроядерного теста между озерными и прудовыми лягушками в 2016 и 2017 гг.
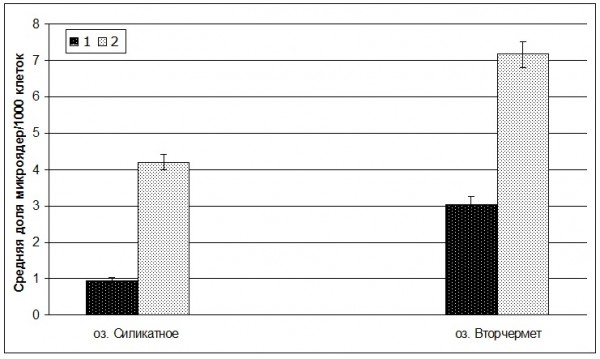
Рис. 1. Изменение доли эритроцитов с микроядрами в крови озерных (оз. Силикатное) и прудовых (оз. Вторчермет) лягушек в период с 2016 по 2017 г. 1 – 2016 г.; 2 – 2017 г. По оси абсцисс – исследованные водоемы; по оси ординат – средняя доля микроядер в эритроцитах крови/1000 клеток
Fig. 1. Change of the share of erythrocytes with micronuclei in the blood of lake frogs (lake. Silicate) and pond frogs (lake Vtorchermet) during the period from 2016 to 2017. 1 – 2016 year; 2 – 2017 year. x-axis – studied reservoirs; y-axis – average share of micronuclei in red blood cells/1000 cells
Таблица 5. Сравнение выборок из популяций зеленых лягушек по содержанию микроядер
| Показатель | Озерные лягушки | Прудовые лягушки | ||||
| торфокарьер | оз. Силикатное | оз. Вторчермет | ||||
| 2016 | 2017 | 2016 | 2017 | 2016 | 2017 | |
| Сумма микроядер в выборке | 114 | 145 | 29 | 169 | 91 | 274 |
| В том числе: оформленные микроядра | 27/0.9 | 14/0.35 | 4/0.13* | 1/0.02 | 29/0.97 | 3/0.07 |
| W = 2.69, р = 0.0069 | W = 1.82, р = 0.06789 | W = 3.15, р = 0.0016 | ||||
| прикрепленные микроядра | 32/1.07 | 49/1.22 | 4/0.13 | 132/3.3 | 24/0.80 | 213/5.32 |
| W = 0.59, р = 0.5502 | W = 4.07, р = 0.00005 | W = 4.11, р = 0.00004 | ||||
| палочковидные микроядра | 6/0.2 | 4/0.1 | 1/0.03 | – | 6/0.2 | 3/0.07 |
| W = 0.94, р = 0.3454 | – | W = 1.15, р = 0.2488 | ||||
| разрыхленные микроядра | 49/1.63 | 82/2.05 | 20/0.67 | 36/0.9 | 32/1.06 | 68/1.7 |
| W = 0.65, р = 0.5097 | W = 0.51, р = 0.06051 | W = 1.007, р = 0.3134 | ||||
| Средняя доля эритроцитов с микроядрами /1000 клеток | 3.8 ± 0.69 | 3.7 ± 0.49 | 0.97 ± 0.18 | 4.2 ± 0.54 | 3.03 ± 0.53 | 7.17 ± 0.85 |
| W = 0.28, р = 0.7759 | W = 3.82, р = 0.0001 | W = 3.65, р = 0.00025 | ||||
| Показатель | Озерные лягушки | Прудовые лягушки | ||||
| торфокарьер | оз. Силикатное | оз. Вторчермет | ||||
| 2016 | 2017 | 2016 | 2017 | 2016 | 2017 | |
| Сумма микроядер в выборке | 114 | 145 | 29 | 169 | 91 | 274 |
| В том числе: оформленные микроядра | 27/0.9 | 14/0.35 | 4/0.13* | 1/0.02 | 29/0.97 | 3/0.07 |
| W = 2.69, р = 0.0069 | W = 1.82, р = 0.06789 | W = 3.15, р = 0.0016 | ||||
| прикрепленные микроядра | 32/1.07 | 49/1.22 | 4/0.13 | 132/3.3 | 24/0.80 | 213/5.32 |
| W = 0.59, р = 0.5502 | W = 4.07, р = 0.00005 | W = 4.11, р = 0.00004 | ||||
| палочковидные микроядра | 6/0.2 | 4/0.1 | 1/0.03 | – | 6/0.2 | 3/0.07 |
| W = 0.94, р = 0.3454 | – | W = 1.15, р = 0.2488 | ||||
| разрыхленные микроядра | 49/1.63 | 82/2.05 | 20/0.67 | 36/0.9 | 32/1.06 | 68/1.7 |
| W = 0.65, р = 0.5097 | W = 0.51, р = 0.06051 | W = 1.007, р = 0.3134 | ||||
| Средняя доля эритроцитов с микроядрами /1000 клеток | 3.8 ± 0.69 | 3.7 ± 0.49 | 0.97 ± 0.18 | 4.2 ± 0.54 | 3.03 ± 0.53 | 7.17 ± 0.85 |
| W = 0.28, р = 0.7759 | W = 3.82, р = 0.0001 | W = 3.65, р = 0.00025 | ||||
Примечание. W – критерий Уилкоксона, р – уровень значимости. * – в числителе: число эритроцитов с микроядрами в выборке, шт.; в знаменателе: доля клеток с микроядрами на 1000 эритроцитов.
При этом во всех исследованных выборках не только возрастало среднее содержание эритроцитов с микроядрами, но и изменялось соотношение видов микроядер в эритроцитах. Наиболее выраженные изменения отмечены в выборках озерных лягушек оз. Силикатное и прудовых лягушек оз. Вторчермет. Доля эритроцитов с оформленными микроядрами у этих особей уменьшалась, и возрастала доля эритроцитов с прикрепленными микроядрами (рис. 2).
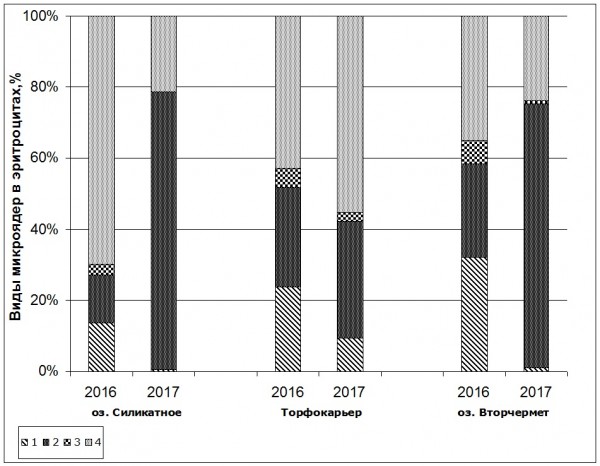
Рис. 2. Изменение соотношения видов микроядер в эритроцитах крови озерных (оз. Силикатное, торфокарьер) и прудовых (оз. Вторчермет) лягушек, обитающих в загрязненных водоемах. 1 – оформленные микроядра, 2 – прикрепленные микроядра, 3 – палочковидные микроядра, 4 – разрыхленные микроядра
Fig. 2. Change of the ratio of types of micronuclei in erythrocytes in the blood of marsh frogs (lake Silicate, a peat bog) and pool frogs (lake Vtorchermet) dwelling in polluted reservoirs. 1 – rounded micronuclei, 2 – attached micronuclei, 3 – rod-shaped micronuclei, 4 – disintegrated micronuclei
Непараметрическим ранговым корреляционным анализом по Спирману (r) показано существование статистически значимой положительной умеренной взаимосвязи между индукцией микроядер разрыхленного типа и содержанием в водоеме марганца (r = 0.69; р = 0.01); между микроядрами прикрепленного типа и содержанием в водоеме хлоридов (r = 0.64; р = 0.02). Таким образом, при повышении в водоеме концентрации марганца (мг/л) наблюдалось увеличение доли разрыхленных, а при повышении в водоеме концентрации хлоридов – доли прикрепленных микроядер в эритроцитах крови лягушек обоих видов.
Сравнительный анализ размеров микроядер показал, что площадь разрыхленных (6.99 ± 0.32 мкм2) превосходила площадь оформленных (D = 3.10, р = 0.01) и прикрепленных (D = 24.19, р < 0.001) микроядер в 2–3 раза (табл. 6).
Таблица 6. Площадь разных видов микроядер (мкм2) в эритроцитах зеленых лягушек урбанизированной территории
| Показатель | Виды микроядер в эритроцитах | |||
| 1. Оформленные | 2. Прикрепленные | 3. Палочковидные | 4. Разрыхленные | |
| M | 3.06 | 1.48 | 3.80 | 6.99 |
| m | 0.34 | 0.03 | 0.79 | 0.32 |
| H, p | H = 620.22, p < 0.001 | |||
| D, p | D1-2 = 5.07, р < 0.001; D1-3 = 0.56, р = 1.00; D1-4 = 3.10, р = 0.01;
D2-3 = 3.18, р = 0.008; D2-4 = 24.19, р < 0.001; D3-4 = 0.98, р = 1.00 |
|||
Примечание. M – среднее арифметическое; m – ошибка среднего арифметического; H – критерий Краскела – Уоллиса; D – критерий Дана; р – уровень значимости. Жирным текстом выделены статистически значимые различия, a = 0.05.
Обсуждение
Амфибии являются связующим звеном между водными и наземными экосистемами, реагируют активными адаптивными и микроэволюционными преобразованиями на весь спектр экологических факторов, характерных для локального местообитания (Вершинин, 2004). Согласно данным литературы (Гелашвили и др., 2005, 2012), подавляющее большинство водоемов в городских округах Нижнего Новгорода характеризуется смешанным антропогенно-природным загрязнением, при этом присутствующие в водоеме микроэлементы – марганец и железо – имеют природное происхождение, а медь, цинк, хром, хлориды – техногенное.
Сетевое представление о законах функционирования организма и количественно-качественный принцип развития адаптаций в ответ на действие раздражителей позволяют заключить, что в зависимости от интенсивности стресс-факторов в организме происходят изменения гематологических параметров, направленные на обеспечение оптимального уровня жизнедеятельности (Чернышова, Старостин, 1998; Силс, 2008; Davis et al., 2008 и др.). Известно, что у земноводных выявлены разнообразные адаптивные изменения к условиям загрязненной водной среды пестицидами, тяжелыми металлами и нефтепродуктами (Пескова, 2004). Различные химические соединения меди, марганца и сульфаты приводят к развитию хронического стресса у лягушек и повышению индекса сдвига лейкоцитов (Минеева, Минеев, 2011). В наших исследованиях гематоксическое воздействие приоритетных загрязнителей водных объектов, таких как медь, нефтепродукты и др., подтверждалось лейкоцитозом и свидетельствовало о протекании воспалительных процессов в организме прудовых и озерных лягушек. Известно, что эритропоэтическая активность костного мозга амфибий коррелирует с содержанием в водоемах железа (r = -0.81, р = 0.04), нефтепродуктов (r = 0.89, р = 0.015) и других поллютантов (Романова и др. 2017). В условиях постоянного обитания в загрязненных водоемах (особенно нефтепродуктами) увеличение числа эритроцитов в крови является, по-видимому, компенсаторной реакцией, поскольку обеспечивает повышение кислородной емкости крови и способствует выживанию амфибий. При этом в смеси загрязнителей может происходить и усиление токсического действия отдельных поллютантов на эритропоэз, что приведет, напротив, к снижению числа эритроцитов в периферической крови амфибий. Наблюдаемую при этом стимуляцию гранулоцитопоэза можно рассматривать как своеобразную защитную (антимикробную и антитоксическую) реакцию. Показано, что гиперэозинофилия и базофилия свидетельствуют о попытке организма амфибий справиться с высокими дозами токсических веществ (Чернышева, Старостин, 1994).
Хорошо известны иммунотоксические эффекты ртути (Nepomuceno et al., 1997; Kour et al., 2016), хлорида кадмия (Kasuba et al., 2003), бензо(а)пирена (Woznicki et al., 2004), синергический эффект кадмия, хрома и меди (Zhu, Zhang, 1999). По всей видимости, присутствующие в исследованных водных объектах загрязнители природного (марганец) и техногенного (медь, хром, хлориды) происхождения, являясь гемотоксинами, приводили к возрастанию доли эритроцитов с микроядрами в крови амфибий.
Заключение
Анализ данных литературы и полученные результаты позволяют заключить, что обитание в загрязненной среде может приводить к появлению адаптационных и патологических изменений в организме амфибий. Формирование адаптивной реакции на популяционном уровне определялось разнокачественностью особей по основным физиологическим свойствам, поэтому их выборки по-разному реагировали на уровень и специфику загрязнения водной среды. В крови озерных и прудовых лягушек установлено снижение количества лейкоцитов и эритроцитов. Сравнение лейкоцитарных показателей крови амфибий загрязненных водоемов выявило межвидовые различия по содержанию миелоцитов, базофилов, эозинофилов и лимфоцитов. Лейкоцитарные формулы крови прудовых лягушек по сравнению с озерными характеризовались повышенным количеством малых лимфоцитов. Лейкограммы озерных лягушек отражали возрастание доли незрелых форм нейтрофильных гранулоцитов, скоррелированное с содержанием в водоеме железа (r = 0.85, p = 0.029), хлоридов (r = -0.87, p = 0.021), и изменение соотношения доли больших и малых лимфоцитов. Микроядерным тестом выявлено ухудшение состояния качества среды обитания, стимулирующее формирование микроядер прикрепленного и разрыхленного вида на фоне снижения доли оформленных микроядер в эритроцитах крови амфибий. Индукция микроядер прикрепленного типа коррелировала с содержанием в водоеме хлоридов (r = 0.64; p = 0.02), разрыхленного типа – с содержанием в водоеме марганца (r = 0.69; p = 0.01). Определяющими факторами образования микроядер в эритроцитах особей разных выборок являлись как химическая природа конкретного загрязнителя, так, по-видимому, и их совокупное воздействие. Впервые проведен сравнительный анализ площади микроядер в крови индикаторных видов амфибий. Показано, что площадь разрыхленных микроядер в эритроцитах крови амфибий превосходила площадь оформленных и прикрепленных микроядер.
Использованные в работе методы биологической индикации (гематологический подход и микроядерный тест), позволяющие дать интегральную оценку состояния окружающей среды, указывали на экологическое неблагополучие водных объектов и выявляли эколого-генетические особенности организмов-биоиндикаторов в условиях повышенного загрязнения.
Библиография
Банников А. Г., Даревский И. С., Ищенко В. Г., Рустамов А. К., Щербак Н. Н. Определитель земноводных и пресмыкающихся фауны СССР . М.: Просвещение, 1977. 414 с.
Вершинин В. Л. Гемопоэз бесхвостых амфибий – специфика адаптациогенеза видов в современных экосистемах // Зоологический журнал. 2004. № 11. С. 1367–1374.
Гелашвили Д. Б., Безель В. С., Романова Е. Б., Безруков М. Е., Силкин А. А., Нижегородцев А. А. Принципы и методы экологической токсикологии / Под ред. проф. Д. Б. Гелашвили. Нижний Новгород: Изд-во ННГУ, 2016. 702 с.
Гелашвили Д. Б., Копосов Е. В., Лаптев Л. А. Экология Нижнего Новгорода . Н. Новгород: ННГАСУ, 2012. 530 с.
Гелашвили Д. Б., Охапкин А. Г., Доронина А. И., Колкутин В. И., Иванов Е. Ф. Экологическое состояние водных объектов Нижнего Новгорода: Монография . Н. Новгород: Изд-во ННГУ, 2005. 414 с.
Жулева Л. Ю., Дубинин Н. П. Использование микроядерного теста для оценки экологической обстановки в районах Астраханской области // Генетика. 1994. Т. 30. № 7. С. 999–1004.
Квасов И. Д., Парфенов В. Н., Цветков А. Г. Внутриядерные структуры, содержащие факторы созревания РНК, в ранних вителлогенных ооцитах травяной лягушки // Цитология. 2000. Т. 42. № 6. С. 536–549.
Ковалева О. А. Цитогенетические аномалии в соматических клетках млекопитающих // Цитология и генетика. 2008. № 1. С. 58–72.
Кузина Т. В. Изменение структуры ядра эритроцитов периферической крови промысловых рыб Волго-Каспийского канала // Вестник МГОУ. Сер. Естественные науки. 2010. № 2. С. 50–57. URL: http://www.vestnik-mgou.ru/Articles/Doc/5785 (дата обращения: 29.05.2018).
Манских В. Н. К вопросу о механизмах образования микроядер в соматических клетках бесхвостых амфибий в норме и при действии N-нитрозо-N-метилкарбамида // Бюллетень экпериментальной биологии и медицины. 2006. Т. 141. № 2. С. 217–220.
Меньшиков В. В., Делекторская Л. Н., Золотницкая Р. П. и др. Лабораторные методы исследования в клинике . М.: Медицина, 1987. 368 с.
Минеева О. В., Минеев А. К. Нарушения лейкоцитарной формулы крови озерной лягушки Саратовского водохранилища // Вестник Нижегородского университета им. Н. И. Лобачевского. 2011. № 2 (2). С. 94–97.
Муравьева Л. В., Тихомиров О. А., Марков М. В. Формирование аквально-территориальных комплексов выработанных торфяных болот и их классификация // Ученые записки Казанского университета. Сер. Естественные науки. 2010. Т. 152. Кн. 4. С. 102–115.
Пескова Т. Ю. Адаптационная изменчивость земноводных в антропогенно загрязненной среде: Автореф. дис. … д-ра биол. наук . Тольятти, 2004. 36 с.
Прошин С. Н. Нарушения морфологии интерфазных ядер в клеточных популяциях животных при оценке на геном дестабилизирующих факторов: Автореф. дис. … д-ра биол. наук . СПб.; Пушкин: ВНИИГРЖ, 2007. 33 с.
Романова Е. Б., Шаповалова К. В., Марьин И. А. Миелограммы озерных (Pelophylax ridibundus) и прудовых (Pelophylax lessonae) (Amphibia: Ranidae) условно «фоновых» и антропогенно-трансформированных территорий Нижегородской области // Поволжский экологический журнал. 2017. № 3. С. 298–307. URL: https://elibrary.ru/item.asp?id=30565828 (дата обращения: 29.05.2018). DOI: 10.18500/1684–7318–2017–3–298–307.
Романова Е. Б., Шаповалова К. В., Рябинина Е. С., Гелашвили Д. Б. Лейкоцитарные индексы и микроядра в эритроцитах как популяционные маркеры иммунного статуса Pelophylax ridibundus (Pallas, 1771) (Amphibia: Ranidae), обитающих в различных биотопических условиях // Поволжский экологический журнал. 2018. № 1. С. 60–75. URL: https://elibrary.ru/item.asp?id=32779299 (дата обращения: 29.05. 2018). DOI: 10.18500/1684-7318-2018-1-60-75.
Силс Е. А. Сравнительный анализ гематологических показателей остромордой (Rana arvalis, Nilsson, 1842) и озерной (Rana ridibunda, Pallas, 1771) лягушек городских популяций // Вестник Оренбургского университета. 2008. № 10 (92). С. 230–235.
Смирнова В. М., Макеев И. С., Благодаткин А. В. Метод комплексной оценки загрязненности поверхностных вод по гидрохимическим показателям. Определение удельного комбинаторного индекса загрязненности воды (УКИЗВ) и класса качества воды . Н. Новгород, 2011. 19 с.
Чернышова Э. В., Старостин В. И. Периферическая кровь лягушек рода Rana как тест-система для оценки загрязнения окружающей среды // Известия РАН. 1994. Сер. биол. № 4. С. 656–660.
Шляхтин Г. В., Голикова В. Л. Методика полевых исследований экологии амфибий и рептилий . Саратов: Изд-во Саратовского ун-та, 1986. 78 с.
Davis A. K., Maney D. L., Maerz J. C. The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists // Functional Ecology. 2008. Vol. 22. P. 760–772.
Nepomuceno J. C., Ferrari I., Spano M. A., Centeno A. J. Detection of micronuclei in peripheral erytrocytes of Cyprinus carpio exposed to metallic mercury // Environ and Mol. Mutagenes. 1997. Vol. 30. № 3. P. 293–297.
Kasuba V., Rozgaj R., Trusic I. Genotoxic effects of cadmium chloride in V79 cell culture / 41 Congress of the European Societies of Toxicology "Eurotox 2003", Florence, Sept. 28 – Oct.1, 2003 // Toxicol. Lett. 2003. Vol. 144. P. 136.
Koh-ichi U., Atsushi O., Noriaki S. Generation of Micronuclei during Interphase by coupling between cytoplasmic membrane blebbing and nuclear budding // PLoS ONE. 2011. Vol. 6. P. 11 URL: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0027233 (дата обращения: 29.05.2018).
Kour P., Tripathi N., Poonam. Micronuclei introduction in different tissues of Euphlyctis cyanophlyctis (common skittering frog) exposed to sublethal concentration of mercuric chloride // International Journal of Current Research. 2016. Vol. 8. P. 35680–3568.
Luzhna L., Kathiria P., Kovalchuk O. Mironuclei in genotoxicity assessment: from genetics to epigenetics and beyond // Frontiers in Genetic. 2013. Vol. 4. P. 17. URL: https://www.ncbi.nlm.nih.gov/pubmed/23874352 (дата обращения: 29.05.2018).
Mansi A., Sunitha J. D., Geetanshu D., Neelakshi S. R. Micronuclei assay of exfoliated oral mucosal cells: review // Annals of Dental Specialty. 2014. Vol. 2. P. 47–50. URL: https://pdfs.semanticscholar.org/e965/408168ba3699938d4062fd282a8eff66284e.pdf (дата обращения: 29.05.2018).
Woznicki P., Lewandowska R., Brzuzan P. The level of DNA damage and the frequency of micronuclei in haemolymph of freshwater mussels Anodonta woodiana exposed to benzo(a)pyrene // Acta toxicol. 2004. Vol. 12. № 1. P.41–45.
Zhu Yi., Zhang Y. Formation of micronuclei in carp polychromatocytes under the influence of cadmium, chromium and copper: synergistic effect // J. Nanjing Norm. Univ. Nat. Sci. 1999. Vol. 22. № 3. P. 60–63.
Благодарности
Авторы выражают благодарность д. б. н. В. Н. Якимову за конструктивные советы и помощь при интерпретации результатов многомерного дисперсионного анализа.






 © 2011 - 2026
© 2011 - 2026