Введение
В соответствии с Экологической доктриной Российской Федерации (2002 г.) увеличение доли возобновляемых ресурсов в получении моторных топлив является актуальной задачей современности. Перспективным вариантом считается производство моторных топлив из растительного сырья путем ферментации. Особыми потребительскими преимуществами в качестве добавки в традиционные топлива обладает биобутанол, получаемый путем сбраживания углеводсодержащих сред бактериями рода Clostridium (Qureshi, Ezeji, 2008).
При этом все более актуальным становится получение биобутанола не из пищевого сырья, а из недорогого легкодоступного растительного сырья, в качестве которого могут быть использованы предварительно гидролизованные отходы АПК и лесного хозяйства (Procentese et al., 2016). Использование в качестве сырья 100 % лигноцеллюлозного гидролизата может значительно снизить себестоимость растворителей в сравнении с использованием в качестве субстрата пищевого сырья (Morone, Pandey, 2014).
Перед сбраживанием гидролизаты лигноцеллюлозного сырья очищают от ингибиторов, образующихся в процессе гидролиза за счет деградации лигнина, целлюлозы и гемицеллюлозы, и затем обогащают ростовыми веществами, необходимыми для ацетонобутиловых бактерий (Roth, Tippkӧtter, 2016; Nanda et al., 2014). Применяемые на сегодняшний день ростовые компоненты, такие как ПАБК, тиамин, биотин и др., в большинстве своем имеют высокую стоимость, поэтому поиск недорогих источников ростовых веществ является одним из наиболее значимых факторов в снижении себестоимости производства биобутанола.
В 60-х годах прошлого века в качестве недорогих источников необходимых белковых компонентов и витаминных комплексов предлагалось использование кукурузного глютена или жмыха подсолнечника (Яровенко, 1963), которые по ряду свойств являются ценной кормовой добавкой для сельскохозяйственных животных и имеют долгий срок хранения из-за невысокой влажности. Поэтому их использование в ацетонобутиловом производстве (АБЭ-процесс) нерационально, т. к. после процесса они насыщаются влагой и срок их хранения резко снижается.
Более экономичным считается использование таких отходов, которые имеют определенные ограничения на использование в качестве корма для сельскохозяйственных животных. Например, пивная дробина, массовый отход пивоваренного производства, являясь прекрасным кормом, обладающим комплексом питательных, минеральных и биологически активных веществ, в то же время из-за высокой влажности (75–85 %) имеет крайне короткий срок хранения. Уже на вторые сутки происходит ее закисание и поражение патогенными для сельскохозяйственных животных грибками. В настоящее время основная масса прокисшей пивной дробины складируется на полигонах твердых бытовых отходов или на несанкционированных свалках. Ее сброс в окружающую среду приводит к загниванию, сопровождающемуся выделением токсичных продуктов распада (аммиак, скатол, индол, микотоксины и др.), что вызывает увеличение экологической нагрузки на окружающую среду. При этом степень экологической опасности дробины в течение месяца возрастает с V класса до IV (Руденко, 2007).
Пивная дробина образуется в технологиях пивоваренного производства после фильтрования затора и промывания солодовой дробины горячей водой и представляет собой остаток дробленых зерновых продуктов (Тихомиров, 1998). Содержание гемицеллюлозы и целлюлозы в сухом веществе пивной дробины составляет 52 %. Для нее характерно высокое содержание пентоз. После кислотного гидролиза содержание пентоз в гидролизате пивной дробины составляет 7 об. %. А соотношение таких углеводов, как глюкоза/ксилоза/арабиноза, составляет приблизительно 1:2:1 (Xiros, Christakopoulos, 2009). Пивная дробина богата протеинами (до 24 % к абсолютно сухому веществу), клетчаткой, жирами и витаминными комплексами (Петров и др., 2014).
Лигноцеллюлозную часть пивной дробины ранее уже предлагали использовать в качестве источника редуцирующих веществ при производстве спиртов (Xiros, Christakopoulos, 2009). Белково-витаминный комплекс, остающийся после осуществления гидролиза пивной дробины, так же было бы рациональным использовать в технологиях получения биотоплива как возможный источник ростовых веществ.
Таким образом, пивная дробина содержит в себе все необходимые ростовые вещества, необходимые для биоагентов ацетонобутилового брожения. Возможность ее использования в технологиях ацетонобутилового производства позволила бы снизить себестоимость производства биобутанола, а также решить вопрос эффективной утилизации массового отхода пивоварения.
Целью работы является изучение возможности использования пивной дробины в качестве источника ростовых веществ в ацетонобутиловом производстве при сбраживании гидролизатов лигноцеллюлозного сырья.
Материалы
Для проведения исследований нами была получена пивная дробина с ОАО «Томское пиво» влажностью 82–86 %. Процесс брожения осуществлялся штаммом бактерий Clostridium acetobutylicum ATCC 824, полученным из ВКПМ. Данный штамм характеризуется способностью сбраживать как пентозы, так и гексозы (Ounine et al., 1983), а также обладает ярко выраженной амилолитической (Croux et al., 1992) и протеолитической способностью (Annous, Blaschek, 1990).
Поскольку свежая пивная дробина может являться ценной кормовой добавкой, а после ее хранения более суток в ней образуются микотоксины, в результате чего ее использование в кормопроизводстве становится невозможным, для осуществления экспериментов нами была использована четырехдневная пивная дробина. Использование прокисшей пивной дробины в ацетонобутиловом производстве не только позволит осуществить эффективную утилизацию некондиционной пивной дробины, но и провести ее дезинфекцию и детоксикацию, в результате чего отработанная в ацетонобутиловом процессе пивная дробина может быть в дальнейшем использована в качестве кормовой добавки.
В опытах по оценке влияния пивной дробины на сбраживаемость углеводов штаммом бактерий C. acetobutylicum АТСС 824 использовались среды, включающие в себя 45 г/л глюкозы и пивную дробину в различных концентрациях. В качестве контроля осуществлялось сбраживание полусинтетической среды, указанной в паспорте культуры C. acetobutylicum АТСС 824, включающей в себя следующие компоненты (г/л): глюкоза – 20, аммония ацетат – 3, дрожжевой экстракт – 1, пептон – 1, крахмал – 1, KH2PO4 – 0.7, K2HPO4 – 0.7, цистеин – 0.5, MgSO4* 7H2O – 0.1, MnSO4* H2O – 0.02, FeSO4* 7H2O – 0.015, NaCl – 0.01, ПАБК – 0.001.
В экспериментах по сбраживанию гидролизатов лигноцеллюлозного сырья совместно с пивной дробиной в качестве источников редуцирующих веществ применялся ферментативный гидролизат целлюлозы мискантуса, содержащий 34.8 г/л глюкозы и 15.6 г/л ксилозы. В контрольном варианте в качестве ростовых веществ использовались следующие компоненты полусинтетической среды: ПАБК – 0.001, тиамин – 0.001, биотин – 0.001, цистеин – 0.5, дрожжевой экстракт – 1.
Методы
Стерилизация сред осуществлялась при 0.15 МПа при температуре 111 ± 2 °С в течение 20 минут. Проводилась раздельная стерилизации источников ростовых и редуцирующих веществ с целью предотвращения образования продуктов карамелизации и меланоидинов. В соответствии с методикой (Логоткин, 1958) в свежеприготовленную стерильную среду, охлажденную до 60 °С, вносился инокулят в количестве 3 об. %. Для создания анаэробных условий объем сосудов заполнялся на 85 %. Сосуды закрывались ватно-марлевыми пробками, использование пеногасителя не требовалось. Культивирование проводили в термостате при 37 °С.
Процесс брожения оценивался по макропараметрам: образование разрыва, подъема, осадка и по интенсивности газовыделения и пенообразования, а также микроскопированием. Концентрации бутанола, ацетона и этанола измерялись газовым хроматографом Хроматэк кристалл. 5000.2.
Данные, полученные в ходе экспериментов, обрабатывались с помощью пакета STATISTICA, версия 6.0. Обработка результатов сбраживания сред была выполнена с использованием методов параметрической статистики с вычислением средних значений и стандартного отклонения.
Результаты
На первом этапе работ по оценке влияния пивной дробины на сбраживаемость углеводов штаммом бактерий C. acetobutylicum АТСС 824 проводилось сбраживание среды, состав которой включал в себя 20 об. % четырехдневной пивной дробины влажностью 86 % и 40 г/л глюкозы. Опыт состоял из 8 повторностей. После внесения в среду инокулята в половине повторностей брожение наступило со значительным опозданием (через 56 часа) и остановилось на первой стадии образования кислот. В процессе брожения были зафиксированы разрыв, подъем, образование осадка, но газовыделение в течение всей ферментации было крайне слабым. При этом в половине повторностей брожение не наступило.
В результате серии последовательных брожений, в которых состав среды оставался прежним, а микроорганизмы каждого эксперимента использовались как инокулят для следующего эксперимента, процесс сбраживания углеводов не был значительно улучшен.
Для достижения нормального процесса брожения, характеризующегося интенсивным газовыделением и пенообразованием, а также последовательным образованием разрыва, подъема и осадка, был проведен ряд экспериментов на обнаружение отсутствующего в пивной дробине какого-либо компонента, являющегося лимитирующим фактором процесса жизнедеятельности ацетонобутиловых бактерий.
Для определения недостающего компонента были приготовлены стандартные среды с пивной дробиной (20 об. % пивной дробины и 45 г/л глюкозы), включавшие те или иные соединения, которые определялись в соответствии с составом полусинтетической среды, прописанной в паспорте для штамма бактерий C. acetobutylicum ATCC 824 (табл. 1). В качестве контроля выступал опыт по сбраживанию полусинтетической среды с добавлением 20 об. % пивной дробины.
Таблица 1. Предполагаемые отсутствующие компоненты в составе среды с пивной дробиной, необходимые для штамма бактерий C. acetobutylicum ATCC 824
| № опыта | Предполагаемые недостающие компоненты |
| 1 | дрожжи, КН2РО4, К2НРО4, MgSO4*7H2O, MgSO4*7H2O, FeSO4*7H2O, MnSO4*H2O, NaCl |
| 2 | ПАБК, тиамин, биотин |
| 3 | ПАБК, биотин |
| 4 | ПАБК, тиамин |
| 5 | аммоний ацетат |
Во всех вариантах брожение отсутствовало, вследствие чего был сделан вывод о наличии веществ в пивной дробине, ингибирующих ацетонобутиловое брожение.
С целью удаления ингибиторов были проверены два способа очистки пивной дробины: высушивание и промывка водой. Часть пивной дробины тщательно промывалась водопроводной водой, а другая часть высушивалась при температуре 110 ºС до влажности 0 %. Состав среды изменен не был.
Во всех повторностях с промытой пивной дробиной брожение наступило на 36-м часу, а в повторностях с высушенной дробиной – на 44-м часу. Так как ферментация наблюдалась во всех случаях, было сделано предположение, что данные ингибиторы являются летучими веществами. Кроме того, данное предположение подтверждалось тем, что четырехдневная пивная дробина перед промывкой или выпариванием имела кисловато-сладкий запах, который возникает при закисании пивной дробины, из-за чего в ней образуются летучие соединения. К предполагаемым ингибиторам относятся фурфурол, муравьиная кислота, ацетаты и др., которые удаляются из среды промывкой или выпариванием. Но при обоих методах удаления ингибиторов брожение, начавшись нормально, внезапно остановилось, и к концу процесса значение pH составило 4.5–4.7, что свидетельствовало о прокисании среды и остановке брожения на стадии образования кислот.
Анализируя литературные данные, учитывая при этом высокое содержание протеинов в пивной дробине (до 24 % к абсолютно сухому веществу), был сделан вывод об ингибировании аминокислотами второй стадии брожения – стадии образования растворителей. Считается, что избыток легко усвояемых протеализатов способствует хорошему росту культуры ацетонобутиловых бактерий, но мешает наступлению второй фазы брожения (Логоткин, 1958). Сольвентогенная стадия брожения может осуществляться только в том случае, если бактерии в период быстрого размножения питаются высокомолекулярными фракциями. При развитии бактерий за счет продуктов расщепления белков способность культуры к осуществлению второй фазы нарушается. Так как для пивной дробины характерно высокое содержание аминокислот, вероятно, что при такой используемой ее концентрации в среде содержалось избыточное количество легкоусвояемых азотистых веществ, что привело к ингибированию второй фазы брожения.
Таким образом, следующий опыт заключался в поиске оптимальной концентрации пивной дробины, при которой не происходит ингибирования аминокислотами, но при этом ее достаточно для обеспечения ацетонобутиловых бактерий необходимыми ростовыми веществами. Проводилась оценка сбраживаемости глюкозы при различных концентрациях пивной дробины. Брожение во всех случаях начиналось через 22–24 часа после внесения в среду инокулята. По окончании процесса был проведен хроматографический анализ на выход целевых продуктов (рис. 1).
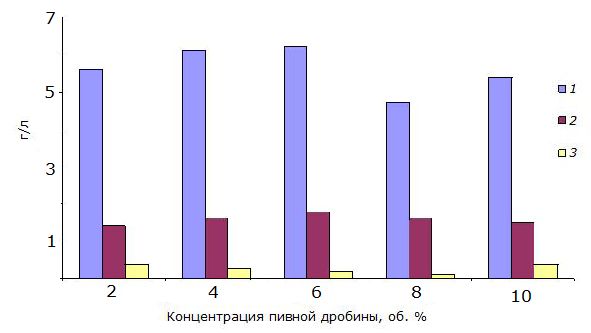
Рис. 1. Выход целевых продуктов в зависимости от концентрации пивной дробины влажностью 82–86 % в сбраживаемой среде: 1 – бутанол, 2 – ацетон, 3 – этанол
Fig.1. Yield of target products depending on the concentration of the spent grain (moisture 82–86 %) in the fermentation medium: 1 – butanol, 2 – acetone, 3 – etanol
На основании хроматографического анализа была определена оптимальная концентрация пивной дробины, которая составила 5–6 % от объема среды. При таком количестве пивной дробины в сбраживаемой среде наблюдался наибольший выход целевых продуктов по окончании брожения.
Для того чтобы сократить время начала брожения от момента заражения среды с 22–24 до 8–10 часов, осуществлялась серия последовательных сбраживаний сред, содержащих 45 г/л глюкозы и 6 об. % пивной дробины, для заражения которых использовался инокулят из отбродивших сред аналогичного состава. В результате 4–5 последовательных генераций время начала брожения уменьшилось до 8 часов, а выход целевых продуктов повысился в 1.5–2 раза.
В опытах по сбраживанию ферментативного гидролизата целлюлозы мискантуса, очищенного при помощи специально адаптированного активного ила (Morozova, Semyonov, 2016), из 16 повторностей брожение наступило во всех случаях и характеризовалось интенсивными процессами газовыделения и пенообразования. Брожение наступило через 8–9 часов и закончилось через 79–88 часов. Контроль также имел все признаки интенсивного брожения. Средние результаты сбраживания представлены в табл. 2.
Таблица 2. Выход бутанола, ацетона и этанола с различных сред на основе ферментативного гидролизата целлюлозы мискантуса
| Состав среды | Средний выход целевых продуктов, г/л | ||
| бутанол | ацетон | этанол | |
| Гидролизат + компоненты полусинтетической среды (г/л): ПАБК – 0.001, тиамин – 0.001, биотин – 0.001, цистеин – 0.5, дрожжевой экстракт – 1. | 10.21 ± 0.74 | 02.97 ± 0.43 | 0.97 ± 0.4 |
| Гидролизат + пивная дробина (6 об. %) | 10.14 ± 0.87 | 02.48 ± 0.53 | 01.02 ± 0.42 |
Обсуждение
Полученные результаты по сбраживанию гидролизатов лигноцеллюлозного сырья соответствуют литературным данным (Логоткин, 1958; Яровенко, 1963). При использовании пивной дробины в концентрации 5–6 об. % брожение протекает нормально, характеризуется интенсивными процессами газовыделения и пенообразования. При использовании оптимальной концентрации пивной дробины установлено, что при таком варианте не происходит ингибирования жизнедеятельности бактерий веществами, образующимися при закисании дробины (фурфурол, муравьиная кислота, ацетаты и др.), поэтому необходимость в ее промывании или высушивании отсутствует. Тем не менее срок хранения дробины не должен превышать 30 суток, в этом случае для осуществления процесса брожения требуется промывание прокисшей пивной дробины, что, однако, может повысить себестоимость целевых продуктов. Поэтому для наиболее эффективного применения пивной дробины в ацетонобутиловом производстве в качестве источника ростовых веществ рекомендуется использовать пивную дробину, которая хранилась от 2 до 30 суток.
Интересным представляется вариант, при котором смыв с пивной дробины (отжим) будет применяться в качестве источника ростовых веществ, а сухой остаток (жом) – как сырье для получения гидролизатов с целью их дальнейшего сбраживания в спирты. В этом случае возможна полная утилизация отхода пивоваренного производства.
При использовании пивной дробины в ацетонобутиловом производстве (АБЭ-процесс) только в качестве источника ростовых веществ отработанная в ацетонобутиловом брожении дробина может быть в дальнейшем применена в качестве корма для сельскохозяйственных животных. При этом выдержка прокисшей пивной дробины в анаэробных условиях, промывка ее большим количеством воды и воздействие на нее бутанола и ацетона снижают токсичность ее как корма, поэтому прокисшую дробину, переработанную в АБЭ-процессе, также можно будет скармливать сельскохозяйственным животным или сырой, или после предварительного силосовования.
Заключение
Полученные в ходе исследования результаты указывают на возможность использования пивной дробины в качестве источника ростовых веществ для ацетонобутилового сбраживания гидролизатов лигноцеллюлозного сырья. В серии опытов по оценке влияния пивной дробины на сбраживаемость углеводов штаммом бактерий C. acetobutylicum АТСС 824 определены лимитирующая и ингибирующая концентрации дробины в среде, которые составили 2 и 20 об. % соответственно. Выявлена оптимальная доза дробины, составившая 6 об. %. Для ацетонобутилового брожения допускается применение как свежей, так и закисшей пивной дробины. Использование прокисшей пивной дробины в АБЭ-процессе позволяет осуществить ее дезинфекцию, а также не снижает ее в количественном соотношении, т. е. не происходит безвозвратной утилизации ценного потенциального пищевого ресурса, как, например, в процессах сжигания или захоронения пивной дробины. Предложенный способ утилизации пивной дробины, основанный на ее использовании в АБЭ-процессе, позволит снизить себестоимость производства биобутанола и решить экологическую проблему утилизации отхода пивоваренного производства.
Библиография
Логоткин И. С. Технологии ацетоно-бутилового производства . М.: Пищепромиздат, 1958. 254 с.
Об Экологической доктрине Российской Федерации: Распоряжение Правительства РФ от 31 авг. 2002 г. № 1225-р // СПС КонсультантПлюс.
Петров С. М., Филатов С. Л., Пивнова Е. П., Шибанов В. М. К вопросу о способах утилизации пивной дробины // Пиво и Напитки. 2014. № 6. С. 32–37.
Руденко Е. Ю. Современные тенденции переработки основных побочных продуктов пивоварения // Пиво и Напитки. 2007. № 2. С. 66–68.
Яровенко В. Л., Нахманович Б. М., Щеблыкин Н. П., Сенкевич В. В. Непрерывное брожение в ацетонобутиловом производстве . Нальчик: Кабардино-балкарское книжное издательство, 1963. 327 с.
Annous B. A., Blaschek H. P. Regulation and Localization of amylolytic enzymes in Clostridium acetobutylicum ATCC 824 // Applied and environmental microbiology. 1990. Vol. 56 (8). P. 2559–2561.
Croux Ch., Canard B., Goma G. Autolysis of Clostridium acetobutylicum ATCC // Journal of General Microbiology. 1992. Vol. 138. P. 861–869.
Morone A., Pandey R. A. Lignocellulosic biobutanol production: Gridlocks and potential remedies // Renewable and Sustainable Energy Reviews. 2014. Vol. 37. P. 21–35.
Morozova T. S., Semyonov, S. Y. Biological detoxification of lignocellulosic hydrolysates for improved biobutanol production // Key Engineering Materials. 2016. Vol. 683. P. 525–530.
Nanda S., Dalai A. K., Kozinski J. A. Butanol and ethanol production from lignocellulosic feedstock: biomass pretreatment and bioconversion // Energy Science & Engineering. 2014. Vol. 2 (3). P. 138–148.
Ounine K., Petitdemange H., Raval G., Gay R. Acetone-butanol production from pentoses by Clostridium acetobutylicum // Biotechnology Letters. 1983. Vol. 5 (9). P. 605–610.
Procentese A., Raganatia F., Olivieria G., Russo M. E., Feld M., Marzocchella A. Renewable feedstocks for biobutanol production by fermentation // New Biotechnology. 2016. 29 October. P 1–6.
Qureshi N., Ezeji T. C. Isolation Butanol, «a superior biofuel» production from agricultural residues (renewable biomass): recent progress in technology // Biofuels. Bioprod. Bioref. 2008. Vol. 2. P. 319–330.
Roth J., Tippkӧtter N. Evaluation of lignocellulosic material for butanol production using enzymatic hydrolysate medium // Cellulose Chem. and Technol. 2016. Vol. 50 (3–4). P. 405–410.
Xiros Ch., Christakopoulos P. Enhanced ethanol production from brewer's spent grain by a Fusarium oxysporum consolidated system // Biotechnology for Biofuels. 2009. Vol. 2. P. 4–10.
Благодарности
Работа была выполнена в рамках выполнения госзаказа Минобрнауки России (проект № 6.7525.2017/8.9) и частично поддержана программой «Научный фонд Д. И. Менделеева Томского государственного университета» (проект № 8.1.17.2017/8.9).






 © 2011 - 2026
© 2011 - 2026