Введение
Нормальное функционирование почвенных экосистем обусловлено наличием в них определенных группировок микроорганизмов, осуществляющих важнейшие функции синтеза и деградации органических веществ, азотфиксации, гумификации, круговорота биогенных элементов и др. (Добровольский, Гришина, 1985). Однако привнесение в почву чужеродных для нее соединений, например, таких, как пестициды, может приводить к перестройке микробных комплексов. С другой стороны, именно микроорганизмам принадлежит ведущая роль в трансформации и биодеградации пестицидов, в ходе которых последние используются в качестве источников углерода, азота, фосфора и энергии. При участии микроорганизмов или их ферментов в почве и воде происходят процессы гидролиза, окисления и восстановления пестицидов. В результате действия абиотических и биотических факторов происходит трансформация пестицидов до соединений, которые отличаются друг от друга по степени токсичности и стойкости в окружающей среде (Brusa, Del Puppo, 1995; Feng et al., 1998; Ашихмина и др., 2010; Домрачева и др., 2012; Singh et al., 2014).
В настоящее время пестициды с истекшим сроком годности и запрещенные к применению подвергаются уничтожению. Однако в предыдущие годы большое количество подобных опасных ядохимикатов было захоронено на специализированных полигонах. Одним из таких объектов является Кильмезское захоронение ядохимикатов Кировской области, созданное в 70-е гг. ХХ в. Подобные полигоны могут служить объектами изучения эффекта хронического воздействия пестицидов на микробные комплексы почвы.
Экологический контроль острого и хронического пестицидного загрязнения почвы в настоящее время является комплексным, включая группу физико-химических методов, а также приемы биотестирования и биоиндикации с использованием организмов различной систематической принадлежности.
Цель данной работы – оценка влияния пестицидов при хроническом воздействии на микробные комплексы почв в районе Кильмезского захоронения ядохимикатов и эффективности использования методов биоиндикации и биотестирования.
Материалы
Объектами исследования служили смешанные образцы почв, отобранные в сентябре 2010 г. с площадок мониторинга (ПМ), заложенных в рамках региональной программы мониторинга Кильмезского захоронения ядохимикатов. Общая масса пестицидов, захороненных на данном объекте в 1975–1976 гг., составляла около 590 тонн. Пестициды (более 70 наименований) относились к разным группам по химическому составу: неорганические соединения в основном были представлены соединениями Cu, Hg, As, Zn; органические – хлорорганическими и фосфорорганическими соединениями. Захоронение оборудовано в Кильмезском районе Кировской области. Эта территория находится на востоке Русской равнины, в северной части Кильмезской низменности и представляет собой дюнно-бугристый с дерново-подзолами на водноледниковых песках и супесях ландшафт на границе подзоны южной тайги и хвойно-широколиственных лесов (География…, 2015). Захоронение расположено на водоразделе рек Икма и Осиновка, на южном, обращенном к реке Осиновке, склоне Ореховской возвышенности (рис. 1).
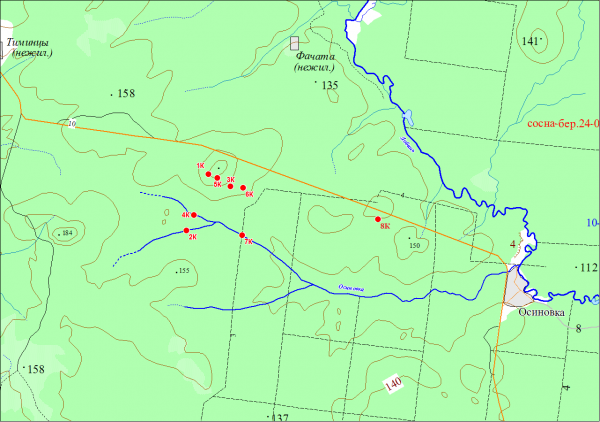
Рис. 1. Схема расположения площадок мониторинга на территории Кильмезского полигона захоронения пестицидов
Fig. 1. The scheme of monitoring sites in the territory Kilmezsky landfill dumping of pesticides
Для оценки состояния окружающей среды было заложено 8 ПМ. Возможные пути загрязнения связаны с переносом поллютантов грунтовыми водами, разгружающимися в ближайшие ручьи и р. Осиновке, поэтому половина площадок сети мониторинга приурочена к берегам водотоков (ПМ 2К, 4К, 6К и 7К). Почвенный покров на них представлен аллювиальными перегнойно-глеевыми почвами. Условно фоновой площадкой для гидроморфных почв можно считать ПМ 2К, расположенную выше по течению реки Осиновки. Одна из ПМ заложена непосредственно на территории ядомогильника (1К), почвенный покров на ней формируется из песчано-галечникового материала с небольшой примесью глины, изъятого из карьера, расположенного в сотне метров от объекта. Две ПМ (5К и 3К) находятся ниже по склону от объекта. На ПМ 5К распространены песчаные подзолы. Фоновая площадка (8К) находится примерно в 5 км к востоку от захоронения. На этой площадке, так же как и на 5К, под посадками сосны распространены песчаные подзолы, верхняя часть профиля которых была нарушена при посадочных работах 30–40 лет назад. В связи с этим слой подстилки маломощный, всего 1.5–2 см, нижележащий горизонт (до 15 см) представлен однородной буровато-желтой песчаной массой. Оподзоленность проявляется в виде осветленной «отмытой» минеральной прослойки на границе этих горизонтов, которая со временем (с 2006 г.) стала проявляться во всех индивидуальных пробах. Мощность ее постепенно увеличивается, что свидетельствует о развитии в нарушенном профиле под подстилкой подзолистого процесса. Площадка 3К заложена на заброшенной пашне в урочище Орехово. Состояние почв на ней отслеживается без учета фона, т. к. аналогичной площадки в окрестностях объекта найти невозможно.
Таблица 1. Характеристика площадок мониторинга Кильмезского захоронения ядохимикатов
| № ПМ | Место заложения | Удаленность от объекта, км | Тип фитоценоза, растительная ассоциация | Почвы |
| 1К | Непосредственно на «крыше» захоронения | 0 | Луговой, вейник наземный + люпин многолистный | Насыпной грунт |
| 2К (фон) | Берег р. Осиновки, выше по течению | 1.8 | Прибрежно-водная растительность, ольшаник с березой и елью | Аллювиальная перегнойно-глеевая |
| 3К | Южный склон Ореховской возвышенности, ниже по склону от захоронения | 0.6 | Луговой, ежа сборная + зверобой + будра плющевидная | Дерново-подзол легкосуглинистый на водноледниковых супесях подстилаемых элювием глин |
| 4К | Берег ручья, у подножья склона Ореховской возвышенности | 1.4 | Прибрежно-водная растительность, ольшаник с елью и березой | Аллювиальная перегнойно-глеевая |
| 5К | Южный склон Ореховской возвышенности, ниже захоронения | 0.1 | Лесной, сосняк мертвопокровный | Подзол песчаный на водноледниковых песках |
| 6К | Берег пересыхающего ручья, стекающего с восточного склона Ореховской возвышенности | 0.6 | Прибрежно-водная растительность, ольшаник с елью и березой | Аллювиальная перегнойно-глеевая |
| 7К | Берег р. Осиновки, ниже по течению | 1.9 | Прибрежно-водная растительность, ольшаник с елью и березой | Аллювиальная перегнойно-глеевая |
| 8К (фон) | Водораздел рек Осиновки и Лобани | 5.1 | Лесной, сосняк мертвопокровный | Подзол песчаный на водноледниковых песках |
На всех площадках мониторинга преобладают кислые почвы. По результатам определения элементного состава отмечено превышение ПДК (ОДК) кадмия (2.6 мг/кг при ОДК 1 мг/кг) и цинка (202 мг/кг при ОДК 110 мг/кг) в верхнем горизонте почв на участке 6К. В образцах с участка 7К содержание мышьяка 7.9 и 11.8 мг/кг при ОДК 5 мг/кг, цинка 111 и 140 мг/кг при ОДК 110 мг/кг (Домрачева, Дабах, 2010). Периодически на участках мониторинга выявляются пестициды. Например, в 2009 г. на ПМ 5К, 6К и 7К по результатам хроматографического анализа выявлены неидентифицируемые соединения, которые, возможно, являются продуктами разложения пестицидов, а в 2010 и 2011 гг. почти на всех площадках за исключением фона обнаружен ДДТ и его метаболиты.
Методы
Отбор почвенных образцов осуществлялся согласно требованиям ГОСТ 17.4.3.01-83 «Охрана природы. Почвы. Общие требования к отбору проб» и ГОСТ 17.4.4.02-84 «Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа». Отбор образцов для видового анализа и количественного учета водорослей и цианобактерий (ЦБ) проводили по общепринятым методикам почвенной альгологии с глубины 0–5 см для изучения внутрипочвенных группировок фототрофов (Голлербах, Штина, 1969).
Для определения видового состава водорослей и ЦБ использовали водные и почвенные культуры со стеклами обрастания (Штина, Голлербах, 1976). Разнообразие диатомовых водорослей определялось без изготовления постоянных препаратов.
Прямой микроскопический учет численности водорослей и ЦБ проводили на мазках (Домрачева, 2005) в 9-кратной повторности. Для определения количественного обилия микромицетов (микроскопических грибов разной систематической принадлежности) использовался модифицированный метод прямого подсчета длины мицелия под микроскопом (Полянская, 1996).
Биотестирование проводили с применением аттестованных методик с использованием культур инфузорий Paramecium caudatum, люминесцентных генно-инженерных бактерий Escherichia coli M-17.
Биоиндикация на степень токсичности почвы проводилась с использованием альго-циано-микологических группировок. Для этого методом прямого микроскопирования на мазках определялась численность фототрофных микроорганизмов (водорослей и ЦБ) в почвенных образцах с одновременным определением на тех же мазках длины мицелия микромицетов. Параллельно с определением длины грибного мицелия проводили дифференциацию популяций грибов на бесцветные и меланизированные формы.
Комплексные химические, микробиологические и токсикологические исследования проводились в 2010–2011 гг.
Результаты
Видовой состав фототрофных комплексов почв в районе Кильмезского захоронения ядохимикатов
При альгологическом анализе в почвах Кильмезского полигона захоронения ядохимикатов было выявлено 56 видов почвенных водорослей и ЦБ, в том числе: Cyanophyta (Сyanobacteria) – 8 (14.3 %), Chlorophyta – 33 (58.9 %), Xanthophyta – 8 (14.3 %), Eustigmatophyta – 4 (7.1 %), Bacillariophyta – 3 (5.4 %).
В районе объекта исследования доминируют представители отдела Chlorophyta (Bracteacoccus minor, Chlamydomonas gloeogama, Ch. oblongella, Chlorella vulgaris, Chloroccocum infusionum, Coccomyxa solorinae и др.). Отмечено незначительное видовое разнообразие представителей отделов Xanthophyta и Eustigmatophyta (Pleurochloris pyrenoidosa, P. сommutata, Eustigmatus magnus). Слабое развитие желтозеленых водорослей, чувствительных к техногенной нагрузке, указывает на нарушение естественной структуры альгосинузий. Из диатомовых водорослей встречены Hantzschia amphioxys, Luticola mutica, Stauroneis anceps. ЦБ представлены незначительным количеством видов. Из безгетероцистных форм в почвах полигона доминируют представители рода Phormidium (Ph. autumnale, Ph. uncinatum, Ph. formosum). Азотфиксирующие виды ЦБ Сylindrospermum catenatum, C. licheniforme, Nostoc paludosum развивались только на участках гидроморфных почв (2К, 6К). На всех ПМ были отмечены: Chlamydomonas gloeogama, Hantzschia amphioxys (рис. 2).
Рис. 2. Доминирующие виды водорослей в райoне Кильмезского захоронения ядохимикатов
Fig. 2. The dominant species of algae in the area of Kilmezsky dumping of toxic chemicals
Анализ видового разнообразия выявил специфику альго-цианобактериальных группировок, сформировавшихся в различных типах почв (рис. 3). Так, в песчаных подзолах выявлено 39 видов: Cyanophyta – 1 (2.6 %), Chlorophyta – 28 (71.8 %), Xanthophyta – 6 (15.4 %), Eustigmatophyta – 2 (5.1 %), Bacillariophyta – 2 (5.1 %). На ПМ 1К из 13 выявленных видов 10 относятся к отделу Chlorophyta. Наибольшее число видов (30) отмечено на ПМ 5К. Фоновый участок 8К имеет более низкое видовое разнообразие (20 видов). В аллювиальных перегнойно-глеевых почвах (ПМ 2К, 4К, 6К и 7К) выявлено 37 видов почвенных водорослей и ЦБ: Cyanophyta – 6 (16.2 %), Chlorophyta – 21 (56.8 %), Xanthophyta – 6 (16.2 %), Eustigmatophyta – 2 (5.4 %), Bacillariophyta – 2 (5.4 %).
В фоновом для гидроморфных почв варианте (2К) видовое разнообразие оказалось ниже, чем на опытных участках (см. рис. 3). При этом на участке 6К, на котором отмечено превышение ПДК (ОДК) Cd и Zn, видовое разнообразие водорослей почти в 3 раза выше фонового. В гидроморфных почвах участков отмечены гидрофильные виды: Oscillatoria agardhii, Chlorogonium leiostracum, Closterium pusillum, Cosmarium cucumis, Lobomonas rostrata.
Вероятно, на видовое разнообразие фототрофов в почве площадок мониторинга оказывают влияние растительность, водный и световой режим, характер нарушенности территории, степень загрязнения.
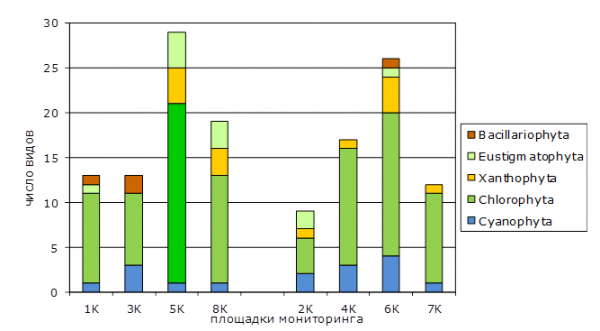
Рис. 3. Видовой состав водорослей и цианобактерий почв участков
Кильмезского полигона захоронения ядохимикатов
Fig. 3. Species composition of algae and cyanobacteria in soil plots of Kilmezsky landfill dumping of toxic chemicals
Количественный состав альго-циано-микологических комплексов почв в районе Кильмезского захоронения ядохимикатов
Количественный учет водорослей и ЦБ в исследуемых почвах показал, что их численность колеблется в широких пределах: от 500 тыс. клеток/г почвы до 2500 тыс. клеток/г почвы. В песчаных подзолах наиболее высокая численность клеток водорослей и ЦБ отмечена для участков 1К и 3К (рис. 4).
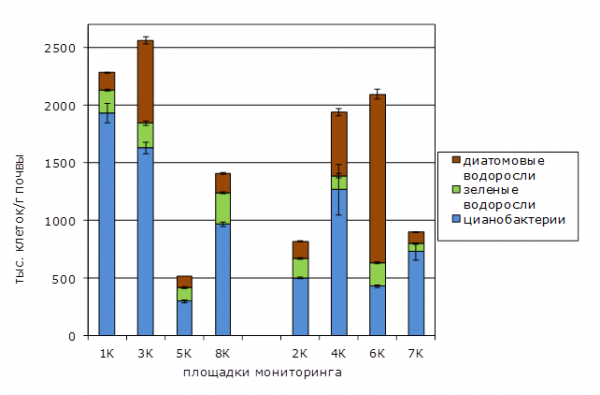
Рис. 4. Количественная характеристика фототрофных популяций
Fig. 4. Quantitative characteristics of phototrophic populations
Этот показатель на контрольном участке 8К был в полтора раза ниже. Максимальные количественные показатели фототрофных микроорганизмов отмечены для гидроморфных почв на участках 6К и 4К. Низкая численность клеток водорослей наблюдается на участках 7К и 2К (фон). Анализ результатов определения видового состава фототрофов и количества клеток водорослей и цианобактерий (см. рис. 3 и 4) показывает, что малому видовому разнообразию ЦБ соответствует высокая численность их клеток. В то же время при высоком видовом разнообразии зеленых водорослей численность их клеток в почве незначительна. Подобное явление – массового развития немногих видов ЦБ в течение всего вегетационного сезона – неоднократно наблюдалось при различных видах химического загрязнения почвы (Помелов и др., 2011; Гайфутдинова и др., 2012; Особенности…, 2012; Елькина и др., 2014). Данный феномен получил название цианофитизации фототрофных комплексов и может рассматриваться как индикаторный признак загрязнения почвы.
В ходе микологического анализа установлено, что максимальная длина мицелия характерна для участка 4К и фоновой площадки 8К, минимальная длина мицелия наблюдается на ПМ 6К, 7К.
Определение степени загрязнения почвы по соотношению микромицетов с окрашенным и бесцветным мицелием выявило минимальный уровень загрязнения на фоновых площадках, а максимальный – на ПМ 4К, 5К, 6К и 7К, где доля окрашенных форм составляет свыше 70 % (табл. 2).
Таблица 2. Особенности развития микокомплексов
| Площадки мониторинга | Длина мицелия, м/г | Структура популяции микромицетов, % | |||
| бесцветного | окрашенного | всего | с бесцветным мицелием | с окрашенным мицелием | |
| 1К | 55.3 ± 2.2 | 81.1 ± 19.2 | 136.4 ± 21.4 | 40.5 | 59.5 |
| 5К | 33.3 ± 3.1 | 121.6 ± 11.4 | 154.9 ± 14.8 | 21.5 | 78.5 |
| 8К(фон) | 298.6 ± 9.6 | 196.0 ± 33.0 | 494.2 ± 42.6 | 60.4 | 39.6 |
| 4К | 94.7 ± 19.2 | 222.1 ± 10.9 | 316.8 ± 30.1 | 29.9 | 70.1 |
| 6К | 17.6 ± 1.1 | 69.6 ± 15.0 | 87.2 ± 16.1 | 20.2 | 79.8 |
| 7К | 19.4 ± 2.3 | 52.2 ± 2.5 | 71.6 ± 4.8 | 27.1 | 72.9 |
| 2К(фон) | 51.2 ± 1.3 | 51.2 ± 1.5 | 102.4 ± 2.8 | 50.0 | 50.0 |
| 3К | 71.4 ± 3.5 | 127.7 ± 20.0 | 199.1 ± 23.5 | 35.9 | 64.1 |
Примечание. Жирным шрифтом выделены максимальные показатели уровня меланизации популяций микромицетов.
Цианофитизация фототрофных комплексов (количественное доминирование ЦБ в структуре фототрофных популяций) достигает максимальных значений, превышающих 80 % на ПМ 1К и 7К (табл. 3), что свидетельствует о загрязнении почв на них. Микоиндикация указывает на высокую степень загрязнения ПМ 4К, 5К, 6К, 7К. Биотестирование выявляет как самые токсичные участки 4К и 7К. Комплексное применение методов биоиндикации и биотестирования позволило выявить самый загрязненный участок – ПМ 7К (по всем 4 используемым методам).
Таблица 3. Степень токсичности почвенных образцов
| Площадка мониторинга | Методы биоиндикации | Методы биотестирования | ||
| содержание клеток цианобактерий в количественной структуре фототрофных популяций, % | микромицеты с окрашенным мицелием | Paramecium caudatum, значение индекса токсичности Т, у. е. | «Эколюм», значение индекса токсичности Т, у. е. | |
| 1К | 84.7 | 59.5 | 0.40 | 21.1 |
| 5К | 55.7 | 78.5 | 0.38 | 15.8 |
| 8К(фон) | 68.8 | 36.9 | 0.20 | 8.2 |
| 4К | 68.5 | 70.1 | 0.41 | 25.2 |
| 6К | 20.5 | 79.8 | 0.25 | 12.1 |
| 7К | 81.1 | 72.9 | 0.48 | 26.5 |
| 2К(фон) | 61.0 | 50.0 | 0.38 | 18.2 |
| 3К | 63.6 | 64.1 | 0.08 | 5.5 |
Примечание. Жирным шрифтом выделены максимальные показатели токсичности пробы по данной группе организмов. Методами биоиндикации по структуре фототрофных популяций и особенностям развития микоценозов определялась хроническая токсичность почв, а методами биотестирования с использованием культур инфузорий Paramecium caudatum и люминесцентных генно-инженерных бактерий Escherichia coli M-17 определялась острая токсичность почвенных вытяжек для этих организмов.
Таким образом, по результатам комплексных анализов (химических, биоиндикационных, биотестовых) выявлены наиболее загрязненные участки на территории Кильмезского захоронения ядохимикатов − 4К и 7К. На основании того, что данные участки находятся в нижней части склона по направлению стока поверхностных вод от полигона захоронения ядохимикатов, на берегах водотоков, в которые разгружаются подземные воды, учитывая то, что почвы на участке 7К содержат As и Zn в количествах, превышающих ПДК (ОДК), а периодически в них определяют пестициды, можно предположить активную миграцию продуктов деструкции пестицидов в природном комплексе.
Обсуждение
Изучение действия пестицидов на водоросли и цианобактерии было начато еще в середине ХХ в. Э. А. Штиной (Штина, 1957) и впоследствии продолжено многочисленными работами почвенных альгологов (Балезина, 1967; Круглов, 1991; Neuhaus et al., 1997; Sancho et al., 2001 и др.). Результаты проведенных исследований были довольно противоречивы. Отмечалось как ингибирующее, так и стимулирующее действие отдельных пестицидов и на видовой состав, и на численность микрофототрофов. Выявляли наиболее стойкие и наиболее чувствительные виды водорослей к конкретным ядохимикатам. При этом происходило образование качественно нового сообщества с низким видовым разнообразием. Однако в большинстве случаев было обнаружено, что спустя определенный период времени альгоценоз восстанавливался с прежним таксономическим составом водорослей и цианобактерий.
Как правило, подобные исследования проводились в агроценозах, но не на полигонах захоронения ядохимикатов. Настоящая работа показала, что хроническое многолетнее действие смеси пестицидов на почвенные альгоценозы в почвах Кильмезского ядомогильника привело к стабилизации альго-цианобактериальных комплексов на определенном видовом и количественном уровнях. При этом, если по числу видов на всех площадках мониторинга преобладают зеленые водоросли, то в количественном отношении доминирование принадлежит цианобактериям, кроме участка 6К, где на гидроморфных почвах преобладают диатомовые водоросли.
Согласно литературным данным, действие пестицидов на почвенные грибы носит разноплановый характер. Известны случаи, когда подавления развития микромицетов не происходит (Digrak, Ozcelik, 1998) или же происходит только кратковременное подавление их развития (Zhang et al., 2015). В то же время количество грибов может даже возрастать с ростом концентрации пестицидов (Ismail et al., 1996). Адаптационные антистрессовые механизмы у микромицетов в ответ на гербицидный стресс включают увеличение линейной скорости роста, что дает возможность территориально выходить из области стресса; у грибов-фитопатогенов возможно формирование более агрессивных рас. Особую устойчивость придает и феномен меланизации спор и мицелия, заключающийся в синтезе темноокрашенных пигментов – меланинов, выполняющих роль универсального протектора при воздействии на грибную клетку физико-химических факторов (Марфенина, 2005; Коробова, 2009). Увеличение доли меланизированных грибов при многих видах химического загрязнения следует рассматривать как компенсаторный механизм, позволяющий грибам, адаптированным к стрессовым условиям, продуцировать меланизированную биомассу и вносить вклад в гумификацию почвы (Терехова, 2014). Поэтому меланизация микокомплексов в экологии почв рассматривается как важный и достаточно надежный биоиндикационный признак на загрязнение почвы поллютантами различной химической природы.
Анализ результатов видового определения водорослей и цианобактерий, а также количественного состава альго-цианобактериальных и микологических комплексов показал, что эти показатели малоинформативны для диагностики состояния почвы при хроническом действии пестицидов. Однако такая характеристика, как структура фототрофных (соотношение водорослей и цианобактерий) и грибных (соотношение грибов с бесцветным и окрашенным мицелием) комплексов, является важным биоиндикационным признаком.
Сравнение результатов биотестирования почвы с помощью аттестованных методик с использованием инфузорий и системы «Эколюм» и предлагаемых нами методов биоиндикации позволило выявить наиболее загрязненные участки на исследуемом полигоне.
Заключение
В почвах в районе Кильмезского захоронения ядохимикатов выявлено 56 видов почвенных водорослей и ЦБ: Cyanophyta – 8, Chlorophyta – 33, Xanthophyta – 8, Eustigmatophyta – 4, Bacillariophyta – 3. Наибольшее видовое разнообразие представлено отделом Chlorophyta – 58.9 %. Видовое разнообразие в песчаных подзолах колеблется от 13 до 30 видов, при этом отмечены участки с более высоким и более низким видовым обилием относительно фонового. В аллювиальных перегнойно-глеевых почвах количество видов на ПМ колеблется от 10 до 27, при этом для этих ПМ характерно более высокое видовое разнообразие относительно контроля.
Плотность фототрофных популяций в исследуемых почвах достаточно велика и находится в пределах от 500 до 2500 тыс. кл/г.
На основании комплексного подхода к исследованию почв, включающего методы биоиндикации (по соотношению в структуре микрофототрофов водорослей и ЦБ и доли меланизированных микромицетов в структуре грибных популяций), методы биотестирования (с использованием инфузории Paramecium caudatum и люминесцентной генно-инженерной бактерии Escherichia coli M-17) и химической анализ, в районе Кильмезского захоронения ядохимикатов выявлено 2 наиболее загрязненных участка. Эти участки находятся ниже по склону в направлении стока поверхностных вод от полигона захоронения ядохимикатов, на берегах водотоков, в которые разгружаются грунтовые воды.
Таким образом, использование комплексного подхода к оценке состояния почв в условиях хронического действия пестицидов позволяет определить наиболее загрязненные участки для дальнейшего поиска путей их возможной реабилитации.
Библиография
ГОСТ 17.4.3.01-83. Охрана природы. Почвы. Общие требования к отбору проб. М.: ИПК Издательство стандартов, 2004. 4 с.
ГОСТ 17.4.4.02-84. Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа. М.: Стандартинформ, 2008. 8 с.
Ашихмина Т. Я., Колупаев А. В., Широких А. А. Биотрансформация пестицидов в наземных экосистемах (обзор литературы) // Теоретическая и прикладная экология. 2010. № 2. С. 4–12.
Балезина Л. С. Влияние некоторых удобрений и пестицидов на развитие почвенных водорослей // Современное состояние и перспективы изучения почвенных водорослей в СССР: Труды межвузовской конференции. Киров, 1967. С. 208–214.
Гайфутдинова А. Р., Елькина Т. С., Березин Г. И., Домрачева Л. И. Оценка воздействия пестицидов старого и нового поколений на развитие почвенных микробных комплексов // Адаптационные реакции живых систем на стрессорные воздействия: Материалы Всероссийской молодежной конференции (г. Киров, 23–25 апреля 2012 г.). Киров: ООО «Лобань», 2012. С. 128–131.
География Кировской области: Атлас-книга / Под ред. Е. А. Колеватых, А. М. Прокашева, Г. А. Русских. Киров, 2015. 80 с.
Голлербах М. М., Штина Э. А. Почвенные водоросли . Л.: Наука, 1969. 228 с.
Добровольский Г. В., Гришина Л. А. Охрана почв . М.: Изд-во МГУ, 1985. 224 с.
Домрачева Л. И. «Цветение» почвы и закономерности его развития . Сыктывкар, 2005. 336 с.
Домрачева Л. И., Ашихмина Т. Я., Кондакова Л. В., Березин Г. И. Реакция почвенной микробиоты на действие пестицидов (обзор) // Теоретическая и прикладная экология. 2012. № 3. С. 4–19.
Домрачева Л. И., Дабах Е. В. Химико-биологический мониторинг почв (на примере Кильмезского захоронения ядохимикатов) // Современные проблемы загрязнения почв: III Международная конференция (г. Москва, 24–28 мая 2010). М.: МГУ, 2010. С. 345–349.
Елькина Т. С., Домрачева Л. И., Хитрин С. В., Фукс С. Л., Девятерикова С. В. Определение степени токсичности отходов производства фторполимеров по реакции почвенной микрофлоры и цианобактерии Nostoc paludosum Kütz // Принципы экологии. 2014. № 1. С. 43–52.
Коробова Л. Н. Адаптации мицелиальных грибов к стрессам в агросистемах // Современные проблемы физиологии, экологии и биотехнологии микроорганизмов: Всероссийский симпозиум с международным участием. М., МГУ им. М. В. Ломоносова. 24–27 декабря 2009: Материалы. М.: МАКС Пресс, 2009. С. 93.
Круглов Ю. В. Микрофлора почвы и пестициды . М.: Агропромиздат, 1991. 128 с.
Марфенина О. Е. Антропогенная экология почвенных грибов . М.: Медицина для всех, 2005. 196 с.
Особенности урбоэкосистем подзоны южной тайги Европейского Северо-Востока / Под ред. Т. Я. Ашихминой, Л. И. Домрачевой. Киров: Изд-во ВятГГУ, 2012. 282 с.
Полянская Л. М. Микробная сукцессия в почве: Автореф. дис. … докт. биол. наук. М., 1996. 96 с.
Помелов А. В., Березин Г. И., Домрачева Л. И. Адаптационные резервы высшего растения и почвенной альгофлоры при действии пестицидов // Теоретическая и прикладная экология. 2011. № 3. С. 87–93.
Терехова В. А. Динамика структуры и физиологические особенности меланизированных микромицетов в условиях разного гумусового статуса сред и химического загрязнения // Экология и биология почв: Международная научная конференция. Ростов-на-Дону, 17–19 ноября 2014. Ростов н/Д, 2014. С. 587–590.
Штина Э. А. Действие гербицида 2,4Д на почвенные водоросли // Труды Кировского сельскохозяйственного института. 1957. Т. 2. Вып. 24. С. 29–34.
Штина Э. А., Голлербах М. М. Экология почвенных водорослей . М.: Наука, 1976. 143 с.
Brusa T., Del Puppo E. Microbial. degradation of the sulfonylurea herbicides // Current knowledge. 1995. Vol. 45. № 2. P. 321–330.
Digrak M., Ozcelik S. Effect of some pesticides on soil microorganisms // Bull. Environ. Contam. and Toxicol. 1998. Vol. 60. № 6. P. 916–922.
Ismail B. S., Goh K. M., Kader J. Effects of metsulfuron-methyl on microbial biomass and population in soils // J. Environ. Sci. and Health. 1996. Vol. 31. № 5. P. 987–999.
Feng Y., Minard R. D., Bollag J. M. Photolytic and microbial degradation of 3,5,6-trichloro-2-pyridinol // Environ. Toxicol. and Chem. 1998. Vol. 17. № 5. P. 814–819.
Neuhaus W., Seefeld F., Hahn A. Auswirkungen von Igran 500 flussig auf Abundanz von Bodenalgen unter Labor- und Freilandingungen // Nachrichtenbl. Dtsch, Pflanzenschutzdienst. 1997. Vol. 49. № 10. P. 260–267.
Sancho E., Sanchez M., Ferrando M. D., Andreu-Moliner E. Effects of thiobencarb herbicide to an alga (Nannochloris oculata) and the cladocera (Daphnia magna) // J. Environ. Sci. and Health. 2001. Vol. 36. № 1. P. 55–65.
Singh B., Kaur J., Singh K. Microbial degradatijn of an organophosphate pesticide, malathion // Crit. Rev. Microbiol. 2014. Vol. 40. № 2. P. 146–154.
Zhang J., Qin J., Zhao C., Liu C. Response of Bacteria and Fungi in in Soil Microcosm under The Presence Of Pesticide Endosulfan // Water, Air and Soil Pollut. 2015. Vol. 226. № 4. P. 109/1–109/9.






 © 2011 - 2026
© 2011 - 2026