Введение
Электромагнитное поле (ЭМП) искусственного происхождения является важным и значимым экологическим фактором с высокой биологической активностью. Электромагнитное загрязнение окружающей среды ВОЗ включено в перечень приоритетных проблем для человечества. В последние десятилетия в связи с развитием электроэнергетики увеличивается количество электростанций и протяженность линий электропередачи, которые являются источниками электромагнитного излучения промышленной частоты (ПЧ) – 50 Гц. Источники излучения данного частотного диапазона распространены повсеместно и оказывают непрекращающееся воздействие на все живые организмы зоны влияния. В связи с этим актуальным видится изучение различных аспектов воздействия на живые системы и млекопитающих, в частности, ЭМП промышленных частот.
Целью настоящей работы являлось изучение влияния электромагнитного излучения промышленной частоты на гематологические показатели периферической крови беспородных белых мышей в условиях хронического воздействия фактора.
Материалы
Эксперимент выполнен на 40 взрослых беспородных белых мышах (Mus musculus var. alb.) возраста 12–13 месяцев. В группы опыта и контроля отбирали по 10 активных и внешне здоровых самцов и самок. Животных содержали в условиях вивария на полноценной диете со свободным доступом воды. В постановке эксперимента руководствовались приказом № 267 МЗ РФ (19.06.2003 г.) и требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18 марта 1986 г.).
Методы
Общее облучение мышей группы опыта осуществляли электромагнитным полем трансформатора «Вега–5М» (частота 50 Гц). Время экспозиции составляло по 8 часов ежедневно в течение 30 дней. Стабильность и напряженность электромагнитного поля внутри клетки контролировали комплектом приборов «Циклон-05». Напряженность электрического поля составляла 10 В/м (санитарная норма для человека до 0.5 кВ/м (МСанПин 001-96; СанПиН 2.1.2.2645-10)), значение магнитной индукции (плотности магнитного потока) – 195 нТл (санитарная норма для человека до 5 мкТл (СанПиН 2.1.2.2645-10)). Контрольная группа животных воздействию изучаемого фактора не подвергалась.
Диагностическое тестирование цельной крови in vitro проводили в день сбора, не позднее 0.5 часа от момента взятия из хвостовой вены животного и при комнатной температуре. В качестве антикоагулянта использовали ЭДТА. При подсчете форменных элементов крови прибегали к помощи автоматического гематологического анализатора для ветеринарии PCE 90 Vet (производитель High Technology, США. Версия 1.1 от 03.2006). При исследовании участия системы крови в неспецифических защитных реакциях основывались на работе Л. Х. Гаркави с соавторами (Гаркави, 1998).
Достоверность различий оценивали по t критерию Стьюдента. Данные представлены в виде средних значений и их ошибок. Кроме того, использовали двухфакторный дисперсионный анализ для определения доли влияния на изучаемый признак ЭМП и пола зверьков.
Результаты
По результатам эксперимента в крови животных группы опыта отмечены сниженные относительно контроля и справочных норм (Мотузко и др., 2008) числа эритроцитов (табл. 1). Концентрация гемоглобина цельной крови была ниже контрольного значения на 26.8 % у самцов и на 38.2 % у самок. Состояния систем эритрон обоих полов животных опыта, таким образом, могут быть описаны как анемии. Согласно значениям гематокрита и концентрации гемоглобина определена анемия легкой степени тяжести у самцов и средней степени у самок.
Таблица 1. Показатели эритроцитов периферической крови беспородных белых мышей после месячной экспозиции в эксперименте
| Показатели | Группа животных | |||
| ♀опыт | ♀контроль | ♂опыт | ♂контроль | |
| Число эритроцитов, ×1012/л | 6.51 ± 0.548** | 8.79 ± 0.452 | 7.60 ± 0.762* | 9.49 ± 0.497 |
| Концентрация гемоглобина, г/л | 78.10 ± 7.741*** | 126.40 ± 6.010 | 94.90 ± 11.236* | 129.60 ± 7.525 |
| Гематокрит, % | 32.76 ± 2.745** | 43.98 ± 2.184 | 36.98 ± 4.207 | 45.56 ± 3.027 |
| Средний объем эритроцита, фл | 50.41 ± 1.110 | 50.36 ± 1.619 | 48.45 ± 1.884 | 47.87 ± 1.464 |
| Среднее содержание гемоглобина в эритроците, пг | 11.81 ± 0.194*** | 14.36 ± 0.180 | 12.25 ± 0.516* | 13.56 ± 0.181 |
| Средняя концентрация гемоглобина в эритроците, г/л | 236.10±5.431*** | 287.70 ± 6.116 | 254.20 ± 6.022** | 285.90 ± 5.954 |
| Ширина распределения эритроцитов, % | 14.55 ± 0.367 | 14.88 ± 0.472 | 15.36 ± 0.873 | 13.85 ± 0.281 |
Примечание. Здесь и в табл. 2, 3: * p < 0.05, ** p < 0.01, *** p< 0.001
При изучении эритроцитарных показателей мышей группы опыта выявили одинаковые направления их изменений относительно контрольных значений у самцов и самок. Параллельно со снижением уровня гемоглобина отметили снижение содержания гемоглобина в эритроците (MCH) и насыщенности эритроцита гемоглобином (MCHC), что является показателем гипохромии. Статистически значимых различий среднего объема эритроцита (MCV) у животных эксперимента не выявлено. Этот факт дает возможность определить нормоцитарный характер анемии мышей опыта, а отсутствие достоверных отличий ширины распределения эритроцитов (RDW) указывает на гомогенность популяции эритроцитов нормального размера. Таким образом, анемия животных, которые 30 дней находились в зоне общего 8-часового воздействия ЭМП ПЧ, может быть морфологически классифицирована как нормоцитарная гипохромная и гомогенная.
По результатам дисперсионного анализа фактор наличия ЭМП обеспечивает 25.3 % от общего влияния всех факторов на снижение числа эритроцитов, 39.3 % снижение концентрации гемоглобина, 21.3 % снижение гематокрита и 55.1 % уменьшение насыщенности эритроцита гемоглобином у мышей группы опыта.
Система эритрон осуществляет функцию газообмена и способна благодаря эффективным обратным связям сохранять гомеостаз в изменившихся условиях жизнедеятельности организма. Эритропоэтическая функция мышей синхронно угнеталась у самцов и самок, что говорит об ухудшении антигипоксических свойств крови. Наряду с газообменом, эритроциты участвуют в работе буферных систем крови, в водно-солевом обмене, в адсорбировании токсинов и продуктов расщепления белков, различных ферментативных процессах и др. Очевидно, что снижение как количества красных клеток крови, так и содержания гемоглобина в них, вследствие воздействия электромагнитного излучения промышленной частоты, оказывает влияние и на упомянутые процессы. При этом стоит отметить, что у самок изучаемые показатели красной крови снижены относительно контрольных значений в большей степени, чем у самцов.
Показатели общего числа лейкоцитов периферической крови животных, которые находились в зоне воздействия ЭМП ПЧ, достоверно отличались от контрольных (табл. 2). Выявили противоположное направление отмеченных изменений для самцов и самок. Так, у самцов группы опыта общее количество лейкоцитов в крови было почти троекратно повышено относительно контрольного значения, самым заметным было нарастание числа гранулоцитов. У самок, напротив, отмечено более чем двукратное угнетение лейкопоэза, в большей мере выраженное для лимфопоэза и в меньшей – для гранулопоэза. Эти факты могут свидетельствовать о том, что физиологическая реакция организма животного на воздействие изучаемого фактора зависит от пола.
Таблица 2. Показатели лейкоцитов периферической крови беспородных белых мышей после месячной экспозиции в эксперименте
| Показатели, ×109/л | Группа животных | |||
| ♀опыт | ♀контроль | ♂опыт | ♂контроль | |
| Общее число лейкоцитов | 11.99 ± 1.227*** | 29.26 ± 3.100 | 25.29 ± 6.019* | 8.88 ± 1.159 |
| Количество лимфоцитов | 7.79 ± 0.878*** | 21.21 ± 2.502 | 16.84 ± 4.195* | 6.13 ± 0.976 |
| Количество моноцитов | 0.57 ± 0.072* | 0.93 ± 0.114 | 1.10 ± 0.262* | 0.40 ± 0.039 |
| Количество гранулоцитов | 3.63 ± 0.425*** | 7.12 ± 0.543 | 7.35 ± 1.676** | 2.35 ± 0.205 |
В периферической крови самок группы опыта наблюдали сниженные (с различной степенью достоверности) абсолютные количества лимфоцитов, гранулоцитов и моноцитов. У самцов из группы опыта с различной степенью достоверности отметили увеличенные абсолютные количества лимфоцитов, моноцитов и гранулоцитов. Таким образом, уменьшение общего числа лейкоцитов в периферической крови самок, так же как и увеличение аналогичного показателя в крови самцов беспородных белых мышей, подвергнутых хроническому воздействию ЭМП ПЧ, обусловлено изменением количества всех типов лейкоцитов.
Дисперсионный анализ позволил заключить, что на изменение общего числа лейкоцитов фактор присутствия ЭМП не оказал никакого влияния. Однако именно совместное действие факторов (пола и наличия ЭМП) обуславливает количественные изменения всех клеток белой крови: на 38.6 % изменение общего количества лейкоцитов, на 37.6 % количества лимфоцитов, на 25.5 % числа моноцитов и на 36.9 % количества гранулоцитов.
Изменение количества лейкоцитов в крови характеризует функциональное состояние кроветворных органов. Повышение уровня лейкоцитов в крови указывает на усиление деятельности лейкопоэтического аппарата, а понижение свидетельствует об ослаблении лейкопоэза. Возможно, что оба эти состояния, отмеченные для животных опытной группы, являются разными стадиями в развитии одного процесса физиологической реакции на изучаемый фактор. В настоящее время общепризнанно, что нервная система является потенциально наиболее уязвимой к воздействию техногенных электромагнитных полей (Гавриш и др., 2008; Гичев, 1999; Каляда и др., 2014; Суворов, 2013). Мы полагаем, что патологическое раздражение ЭМП вегетативной нервной системы мышей влечет за собой изменение общего количества лейкоцитов в крови животных, при котором наблюдаются две последовательные фазы: 1-я фаза – лейкоцитоз с миелоидной тенденцией, преимущественно симпатикотония, 2-я фаза – лейкопения с лимфатической тенденцией, преимущественно ваготония. При этом можно предположить, что чувствительность к изучаемому фактору и скорость физиологической реакции на его воздействие зависят от пола животного.
Согласно полученным данным, относительное процентное содержание различных форм лейкоцитов в 1 мкл крови животных опытной группы не имело значимых отличий от контроля как у самцов, так и у самок (рис.).
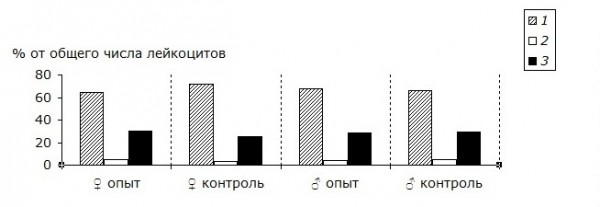
Рис. Дифференциальное количество лейкоцитов периферической крови беспородных белых мышей, находившихся в зоне воздействия электромагнитного поля промышленной частоты и в контроле: 1 – лимфоциты, 2 – моноциты, 3 – гранулоциты
Fig. The differential white cell count in peripheral blood of outbred white mice that were in the area affected by electromagnetic field of industrial frequency, and in controls: 1 – lymphocytes, 2 – monocytes, 3 – granulocytes
Количественные изменения состава белой крови мышей опытной группы, таким образом, носят равномерный, возможно, физиологический характер, без существенного отклонения доли различных типов лейкоцитов. Дифференциальные числа лейкоцитов периферической крови самцов и самок, подвергнутых облучению, находятся также в пределах справочной нормы для данного вида животных (Мотузко и др., 2008).
При сравнении уровня тромбоцитов в крови животных эксперимента отметили, что величина показателя в значительной степени достоверно снижена у мышей-самок, находившихся в зоне ЭМП ПЧ (табл. 3).
Таблица 3. Показатели тромбоцитов периферической крови беспородных белых мышей после месячной экспозиции в эксперименте
| Показатели | Группа животных | |||
| ♀опыт | ♀контроль | ♂опыт | ♂контроль | |
| Количество тромбоцитов, ×109/л | 277.5 ± 29.3*** | 503.4 ± 46.9 | 474.7 ± 76.6 | 408.6 ± 20.4 |
| Средний объем тромбоцита, фл | 6.59 ± 0.109 | 6.74 ± 0.211 | 6.88 ± 0.216* | 6.27 ± 0.127 |
| Ширина распределения тромбоцитов | 15.86 ± 0.155 | 15.76 ± 0.169 | 15.78 ± 0.317 | 15.39 ± 0.104 |
| Тромбокрит, % | 0.18 ± 0.020*** | 0.34 ± 0.031 | 0.33 ± 0.054 | 0.26 ± 0.013 |
У мышей-самцов группы опыта не выявили достоверных различий с контролем по показателю количества тромбоцитов, однако отметили увеличение среднего объема тромбоцита относительно контроля.
Следует отметить, что цитопении описываются как нарушения системы крови, вызываемые воздействием ЭМП различных диапазонов частот. Например, в исследовании (Суворов, 2013) поражение системы крови, вследствие длительного облучения ЭМП радиочастот, проявлялось лейкопенией и (в меньшей степени) угнетением тромбоцитарного ростка. Анализ многолетних наблюдений позволил автору указать на фазность развития процесса при хроническом воздействии фактора.
Обсуждение
Таким образом, ЭМП ПЧ снижало защитные механизмы у самок по параметрам красной и белой крови. У самцов устойчивость, возможно, обеспечивалась за счет активации лейкоцитарной неспецифической резистентности. Основываясь на данных литературы (Гольдберг и др., 2002; Каляда и др., 2014; Лизарев, 2013; Суворов, 2013) и с учетом результатов наших исследований влияния на организм грызунов нефтяного загрязнения (Елифанов и др., 2012) и загрязнения продуктами сгорания попутного нефтяного газа (Гашев и др., 1994), можно предположить, что отмеченные эффекты при электромагнитном воздействии неспецифичны и могут отражать общую реакцию организма на экстремальные физико-химические воздействия.
Заключение
Установлено, что общее хроническое облучение электромагнитным полем промышленной частоты вызвало у беспородных белых мышей сдвиг в системе эритрон, который можно охарактеризовать как анемию средней степени тяжести. Полагаем, что патологическое раздражение ЭМП ПЧ вегетативной нервной системы мышей влечет за собой изменение общего количества лейкоцитов в крови животных, при котором наблюдаются две последовательные фазы: 1-я фаза – лейкоцитоз с миелоидной тенденцией, преимущественно симпатикотония, 2-я фаза – лейкопения с лимфатической тенденцией, преимущественно ваготония. При этом чувствительность к воздействию изучаемого фактора зависит от пола животного. Отмеченные эффекты при электромагнитном воздействии неспецифичны и могут отражать общую реакцию организма на экстремальные физико-химические воздействия.
Библиография
Гавриш Н. Н., Зуев В. Г., Походзей Л. В. и др. Состояние здоровья и работоспособность персонала электроразрядных установок – источников электромагнитных импульсов // Мед. труда. 2008. № 7. С. 15—19.
Гаркави Л. Х., Квакина Е. Б., Кузьменко Т. С. Антистрессорные реакции и активационная терапия . М.: ИМЕДИС, 1998. 656 c.
Гашев С. Н., Казанцева М. Н., Соромотин А. В., Рыбин А. В. Влияние факелов на биогеоценозы Среднего Приобья // Бюл. МОИП. Отд. биологический. 1994. Т. 99. № 1. С. 3—6.
Гичев Ю. П., Гичев Ю. Ю. Влияние электромагнитных полей на здоровье человека: Аналитический обзор . Новосибирск: СО РАН. ГПНТБ, 1999. Вып. 52. 90 с.
Гольдберг Е. Д., Дыгай А. М., Зюзьков Г. Н. и др. Реакции эритроидного ростка кроветворения и механизмы их развития при гипоксии различной степени тяжести // Бюл. экспер. биол. 2002. № 8. С. 142—145.
Елифанов А. В., Гашев С. Н., Моисеенко Т. И. Влияние сырой нефти на организм грызунов в подостром эксперименте // Труды КарНЦ РАН. 2012. № 2. С. 76—83.
Каляда Т. В., Вишневский А. М., Городецкий Б. Н. и др. Медико-биологические исследования электромагнитных полей диапазона радиочастот. Итоги и перспективы // Мед. труда. 2014. № 9. С. 5—11.
Лизарев А. В. Динамика изменений показателей гормонального гомеостаза у работающих при воздействии электромагнитных полей промышленной частоты // Бюл. ВСНЦ СО РАМН. 2013. № 1 (89). С. 188—190.
Мотузко Н. С., Никитин Ю. И., Гусаков В. К. и др. Физиологические показатели животных: Справочник . Минск: Техноперспектива, 2008. 95 с.
МСанПин 001-96 «Санитарные нормы допустимых уровней физических факторов при применении товаров народного потребления в бытовых условиях» .
СанПиН 2.1.2.2645-10 «Санитарно-эпидемиологические требования к условиям проживания в жилых зданиях и помещениях» .
Суворов И. М. Клинический мониторинг в зонах воздействия электромагнитных полей радиочастотного диапазона // Мед. труда. 2013. № 2. С. 14—17.
Благодарности
Работа выполнена в рамках базовой части государственного задания Министерства образования и науки РФ № 01201460003.






 © 2011 - 2025
© 2011 - 2025