Введение
Адаптации организма к экстремальным факторам, в частности к недостатку кислорода, являются одной из актуальнейших медико-биологических проблем (Галанцев, 1977; Storey, 1996; Elsner et al., 1998; Kooyman, Ponganis, 1998; Toien et al., 2001; Hochachka, Somero, 2002; Wihelm Filho et al., 2002; Zenteno-Savín, Clayton-Hernandez, Elsner, 2002; Carey, Andrews, Martin, 2003). Зимоспящие и ныряющие млекопитающие являются природно-адаптированными к дефициту кислорода животными. В настоящем обзоре внимание уделено именно гибернации, так как данное явление менее изучено с точки зрения антиоксидантных защитных механизмов и имеет ряд существенных отличий от ныряния. Известно, что гибернация является энергосберегающим состоянием, при котором происходит значительное снижение температуры тела (до -2 °С), позволяющее гетеротермным млекопитающим выживать в неблагоприятных условиях среды (Carey, Andrews, Martin, 2003; Drew et al., 2007; Storey, Storey, 2010; Dave et al., 2012). В то время как ныряние мелких млекопитающих даже в зимний период сопровождается лишь небольшим снижением температуры тела (до 30 °С) (MacArthur, 1984; McCulloch, 2012). Необходимо отметить, что длительные периоды оцепенения регулярно перемежаются короткими периодами разогрева, когда температура тела восстанавливается до нормального эутермического уровня на несколько часов (Hut et al., 2002), что тесно связано с серьезными колебаниями уровня кислорода. Несмотря на ряд физиологических адаптаций, период пробуждения сопровождается окислительным стрессом, ассоциированным с колоссальным повышением потребления кислорода, который необходим для поддержания термогенеза бурой жировой тканью (БЖТ) и скелетными мышцами (Allan, Storey, 2012). Механизмы устойчивости у впадающих в спячку животных до настоящего времени изучены недостаточно. При адаптации зимоспящих к низким температурам происходят существенные изменения большинства физиолого-биохимических показателей – частоты дыхания и сердечных сокращений, давления крови, экскреции мочи, кровоснабжения органов, насыщения кислородом, гемопоэза и других (Hochachka, Somero, 2002; Bouma et al., 2010a). Изменяются и такие показатели, как устойчивость к ишемической нагрузке и антиоксидантная защита, призванные предотвратить существенные повреждения органов при переходе от оцепенения к пробуждению и обратно (Carey, Frank, Seifert, 2000; Kurtz et al., 2006; Storey, 2010; Dave et al., 2012). Антиоксидантная система (АОС) обеспечивает длительное сохранение жизнеспособности клетки в течение гипометаболических периодов, когда степень деградации и ресинтеза окислительно поврежденных макромолекул минимальна (Allan, Storey, 2012).
Несмотря на невероятно низкий уровень метаболизма в течение оцепенения (торпора), экспрессия некоторых генов и синтез белков тем не менее усиливаются для обеспечения нужд организма в каждый конкретный момент (Eddy, Storey, 2007). В последнее десятилетие интерес исследователей к гибернации значительно вырос, и это не удивительно, так как механизмы, смягчающие снижение метаболизма, до сих пор до конца не установлены. Как свидетельствуют экспериментальные данные, у сусликов, выходящих из спячки, не наблюдается ни нейрональных патологий, ни клеточных повреждений, вызванных окислительным стрессом (Ma et al., 2005; Dave et al., 2012), а спящие особи не демонстрируют никаких признаков гипоксии, связанных с изменением метаболизма (Ma et al., 2005; Storey, Storey, 2010; Dave et al., 2012) и поэтому являются прекрасной моделью для изучения ишемических и реперфузных состояний.
В настоящем обзоре мы не рассматриваем крупных млекопитающих (медведи, барсуки, енотовидные собаки), которые также проводят зимний период в состоянии спячки, однако не испытывают столь значительного снижения температуры тела, как мелкие виды. Поскольку животные, впадающие в летнюю спячку, с анализируемой в обзоре позиции изучены фрагментарно, поэтому и упоминаются они только в случае, если необходимо пояснить роль антиоксидантов в адаптациях к гипоксии, а также для понимания общих закономерностей участия АОС в гипометаболических состояниях.
Аналитический обзор
Антиоксидантная система при гипоксических состояниях
По современным представлениям, наиболее опасными в плане активации перекисных процессов при гипоксии являются состояния, когда временное выраженное нарушение кровоснабжения сменяется его восстановлением – реперфузией (Allan, Storey, 2012). Так, например, данный процесс наблюдается при периодических пробуждениях и выходе из зимней спячки у гибернирующих млекопитающих. Считается, что усиление образования свободных радикалов и перекисных соединений, которое происходит сразу вслед за нарушениями кровообращения, является ведущим фактором в патогенезе ишемических поражений тканей и органов (Wilhelm Filho et al., 2007).
В последние годы становится все более ясным, что генерация умеренных количеств АФК является совершенно необходимым элементом клеток всех типов (Hulbert et al., 2007; Sanz, Stefanatos, 2008; Stuart et al., 2014). Наиболее известные классические представления о защитной роли АФК касаются их участия в неспецифическом иммунитете, в частности в процессах фагоцитоза (Коган, 1999), и в микросомальном окислении самых разнообразных химических соединений (детоксицирующая роль) (Ozaki, Ohashi, Niva, 1986). Помимо этого известно, что Н2О2 и ряд других АФК могут выступать в клетках в качестве «двойных агентов»: либо инициируя интенсивный окислительный стресс, что сопровождается повреждениями и гибелью клеток, либо действуя в качестве сигнальных молекул, индуцирующих ряд молекулярных, биохимических и физиологических реакций, которые способствуют формированию адаптивных механизмов и повышению устойчивости организма (Jaspers, Kangasjärvi, 2010; Stuart et al., 2014). Хотя механизмы избыточной генерации АФК при гипоксии – реперфузии до конца не ясны, установлено, что они имеют множественную природу. В этой связи весьма привлекательна гипотеза, высказанная В. П. Скулачевым (1998), согласно которой образование супероксидного радикала в клетках уже на ранней стадии гипоксии имеет для организма определенный биологический смысл. Образующийся из супероксидного аниона гидроксильный радикал может экстренно стимулировать вазодилатацию, т. е. способствовать укорочению периода гипоксии. Таким образом, клетки «заинтересованы» в как можно более ранней генерации АФК. Биологическое значение этого явления объясняется способностью АФК, в частности оксида азота (NO), обеспечивать расслабление гладкомышечных клеток сосудов и способствовать тем самым восстановлению кровоснабжения ткани (Скулачев, 1998). Тем не менее участие АФК в цепных свободнорадикальных реакциях, главным образом в перекисном окислении липидов (ПОЛ), приводит к химической модификации важных биологических структур (нуклеиновые кислоты, белки, липиды) (рисунок) и развитию патологических состояний (Harman, 1994; Hulbert et al., 2007).
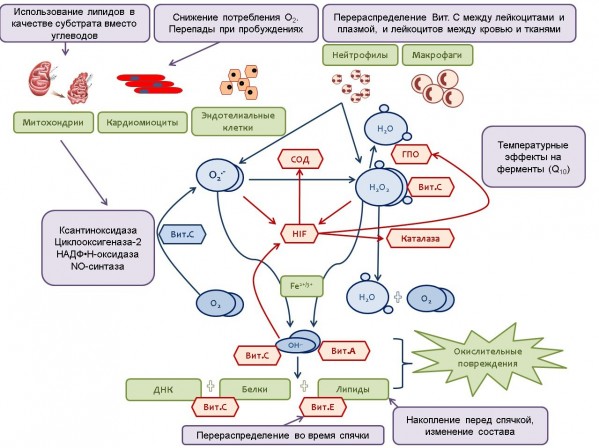
Блок-схема участия системы антиоксидантной защиты в адаптационных процессах при гибернации (синие стрелки – образование активных форм кислорода, красные – реакции антиоксидантной защиты)
Scheme of the antioxidant defense system participation in adaptation processes during hibernation (blue arrows – the formation of reactive oxygen species, red arrows – the reaction of antioxidant protection)
Способность зимоспящих животных понижать температуру своего тела при сохранении основных метаболических функций органов и тканей также связана со свойством липидов мембран клеток адаптироваться к экстремальным температурам. У животных в состоянии спячки, как и у пойкилотермных организмов, понижение температуры тела сопровождается повышением уровня ненасыщенных жирных кислот в составе липидов мембран (Серебрянникова, Векслер, 1977; Carey et al., 2003), таким образом, уменьшается вязкость мембран и обеспечивается нормальное функционирование мембраносвязанных белков при пониженной температуре. Однако данная стратегия имеет один недостаток – двойные связи жирных кислот являются прекрасной мишенью для АФК. Вероятно, поэтому у сусликов перед залеганием в зимнюю спячку параллельно с повышением ненасыщенности липидов происходит значительное увеличение содержания первичных продуктов ПОЛ) – диеновых конъюгатов (Carey et al., 2003).
В процессе эволюции в клетках для борьбы с АФК выработались специализированные системы антиоксидантной защиты (см. рисунок). Антиоксиданты определяются как вещества, ингибирующие или задерживающие окислительное повреждение субклеточных белков, углеводов, липидов и ДНК (Brune, Zhou, 2003; Kim, 2014). Антиоксидантные механизмы включают в себя редокс-активные низкомолекулярные клеточные соединения (глутатион (GSH), витамины Е и С), а также ферментативные системы метаболизма АФК (супероксиддисмутаза (СОД), каталаза и GSH-пероксидаза) (Зенков, Ланкин, Меньщикова, 2001; Didion, Kinzenbaw, 2004; Stuart et al., 2014). Считается, что основным фактором адаптации к гипоксии у толерантных к ней животных может быть усиление антиоксидантных механизмов (см. рисунок), защищающих клетки от АФК при реоксигенации (Selman et al., 2000; Wilhelm Filho, 2007).
Необходимо отметить, что имеющаяся в литературе информация о роли антиоксидантов в условиях гибернации касается, главным образом, лабораторных животных (Hudson, Scott, 1979; Barja et al., 1994; Ohta et al., 2006), в то время как исследования, проведенные на диких зимоспящих млекопитающих, малочисленны (Sohal, Orr, 1992; Sohal et al., 1993; Selman et al., 2000; Morin, Storey, 2007; Allan, Storey, 2012), и только в последнее десятилетие возрос интерес к таким объектам исследования, как летучие мыши (Wilhelm Filho et al., 2007; Conde-Pérezprina et al., 2012).
Поскольку различные компоненты АОС находятся в тесных взаимокомпенсаторных отношениях – ослабление одного, как правило, сопровождается усилением других (Зенков, Меньщикова, 1993; Владимиров, 1998), то при адаптации к какому-либо фактору среды преимущественно могут использоваться либо низкомолекулярные, либо ферментативные антиоксиданты. Что касается роли различных компонентов АОС при гибернации, то первооткрывателем в этой области является российский ученый Н. И. Калабухов. Уже в 1929 г. им было показано, что токоферол тормозит уровень обмена веществ в тканях и тем самым подавляет выведение и расход аскорбиновой кислоты, в связи с чем уровень токоферола служит важным регулятором физиологического состояния зимоспящих животных (Калабухов, 1929). Доказано, что изменение содержания обоих антиоксидантов (витаминов С и Е) при переходе от спячки к пробуждению происходит синхронно, но их кинетика имеет противоположную направленность (Okamoto et al., 2006). Предполагается, что аскорбат и GSH могут действовать как первая линия обороны от окислительного стресса при реперфузии, тогда как витамин Е включается в процесс позднее при его более тяжелой форме, что частично объясняет противоречивые результаты о витамине Е, полученные на различных животных и в клинических исследованиях (Dhalla, Elmoselhi, 2000). У сусликов при гибернации наблюдается увеличение содержания аскорбата (витамин С), одного из низкомолекулярных антиоксидантов, в плазме крови и спинномозговой жидкости (Drew et al., 2002; Drew et al., 2004). Во время пробуждения его уровень резко снижается, но в основном не из-за взаимодействия с АФК, а вследствие захвата лейкоцитами. Вероятно, летучие мыши используют другой механизм, т. к. известно, что они утратили в процессе эволюции способность к синтезу витамина С (Cui et al., 2011).
Весьма интересен вопрос об использовании антиоксидантных ферментов (АОФ) во время гибернации. Их уровень находится под генетическим контролем, принцип которого заключается в активации генов (см. рисунок), кодирующих ферменты, при повышении концентрации О2•- или Н2О2 (Mongkolsuk, Helmann, 2002). Тем не менее энзиматическая активность, как правило, снижается во время спячки, так, например, значительно понижается трансляция белков, которая возвращается к норме в период пробуждения. Синтез белков у зимоспящих нарушается как на уровне инициации, так и на уровне элонгации. Сходное угнетение в период спячки и пробуждения отмечается и для окислительного фосфорилирования (Breukelen, Martin, 2002). Снижение метаболизма имеет определенные последствия для использования ферментов, так как для синтеза белков, во-первых, необходима энергия (при этом организм находится в состоянии максимального энергосбережения), во-вторых, нужно большое количество аминокислот, которые также имеются в дефиците. Но гибернирующие виды нашли выход из данной ситуации – регуляция активности ферментов может осуществляться посредством изменения содержания его изоформ, что описано для разных ферментов (Carey et al., 2003; Storey, Storey, 2004; Eddy, Storey, 2007), а также в результате посттрансляционных модификаций фермента, таких как фосфорилирование (MacDonald, Storey, 1999) и глутатионилирование (Storey, 1997).
Гибернация как феномен
Гибернация – это самая эффективная энергосберегающая стратегия выживания, доступная млекопитающим, при которой существенно снижается потребность в ресурсах (Carey et al., 2003; Geiser, 2004; Storey, 2010). В зимний период мелкие млекопитающие впадают в оцепенение, при котором температура тела приближается к температуре окружающей среды (Heldmaier, Ortmann, Elvert, 2004). Спячка была зарегистрирована в восьми различных систематических группах млекопитающих: однопроходные, сумчатые, грызуны, летучие мыши, землеройки, насекомоядные, приматы (некоторые лемуры) и хищные (медведи) (Geiser, 2004). Она наиболее распространена среди видов отрядов Rodentia и Chiroptera, и поэтому не удивительно, что именно на эти группы обращено наиболее пристальное внимание исследователей (Ануфриев, 2008).
Основными характеристиками спячки мелких млекопитающих является значительное снижение метаболизма и потребления кислорода до 1/100 от «базального» уровня, более чем стократное уменьшение частоты сердечных сокращений (ЧСС) и экстремально низкая температура тела, которая колеблется у разных видов в пределах +2...+4 ºС (Breukelen, Martin, 2002; Storey, 2010), но может снижаться до -2 °С (Heldmaier, Ortmann, Elvert, 2004). Необходимо отметить, что у гибернирующих видов температура тела регулируется, если происходит снижение температуры окружающей среды до -6 ºС, – включаются механизмы для увеличения теплопродукции (Carey et al., 2003). Поддержание на определенном уровне температуры и кровообращения мозга необходимо для сохранения функций данного органа, т. к. сразу после выхода из спячки поведение животного должно оставаться в норме для обеспечения выживаемости вида. Возможно, подвешенное состояние вниз головой у летучих мышей в какой-то мере помогает сохранять кровообращение и снабжение головного мозга кислородом, а повышение уровня ненасыщенных жирных кислот в составе липидов мембран клеток головного мозга снижает вязкость мембран и функционирование мембрановстроенных ферментов при пониженной температуре. В зависимости от вида животного и температуры среды оцепенение длится от 4 до 40 дней и регулярно прерывается короткими эутермическими фазами пробуждения (Heldmaier, Ortmann, Elvert, 2004). В целом во время спячки мелкие млекопитающие могут сэкономить около 90 % энергии (Wang, Wolowyk, 1988). На самом деле экономия энергии была бы гораздо больше, если бы животные не подвергались периодическим выходам из спячки, поскольку эти процессы требуют значительных энергозатрат (для сократительного термогенеза скелетных мышц и дыхания специализированных митохондрий, найденных в БЖТ). Во время спячки у всех мелких млекопитающих наблюдаются периодические пробуждения, длящиеся до 24 часов, в период которых животные разогреваются до 37 ºС, в этот момент они вырабатывают большое количество энергии (Storey, 2010). Периодические пробуждения во время спячки необходимы для поддержания нормального функционирования иммунной и нервной систем, что требует значительных энергетических затрат, в том числе и усиленного потребления кислорода (Prendergast et al., 2002; Bouma et al., 2010а). Предполагается, что изменения иммунной системы при гибернации направлены на ограничение повреждений при повторяющихся переходах от спячки к пробуждению (Bouma et al., 2010a). У всех мелких млекопитающих, изученных к настоящему времени, при гибернации количество лейкоцитов падает, в частности у европейского суслика примерно на 90 %, и быстро возрастает после выхода из нее (Bouma et al., 2010b). Снижение при оцепенении содержания циркулирующих лейкоцитов и тромбоцитов и увеличение после пробуждения являются одним из наиболее поразительных явлений, наблюдаемых при адаптации зимоспящих к низким температурам (Reznik et al., 1975). Интересен и тот факт, что у млекопитающих, выходящих из спячки, не наблюдается ни нейрональных патологий, связанных с оксидативными модификациями, ни окислительных повреждений клеток из-за повышения потребления кислорода (Ma et al., 2005). В одном из исследований Dave и соавторов (2012) была выдвинута гипотеза, что гибернирующие животные в результате селективного отбора приобрели физиологические адаптации, связанные со входом в оцепенение и выходом из него. Авторы утверждают, что эти приспособления касаются устойчивости к ишемии головного мозга и увеличения синаптической пластичности. Генетические факторы и, возможно, стадии онтогенеза вносят вклад в способность переносить несколько пробуждений без когнитивных нарушений и клеточных повреждений. Быстрая регенерация синапсов во время пробуждения предотвращает когнитивные нарушения и, вероятно, способствует улучшению процессов памяти уже через 24 часа после пробуждения. Снижение температуры тела в сочетании с подавлением метаболизма во время оцепенения экономит энергию, а сохранение клеточного гомеостаза во время пробуждения способствует как выживанию нейронов, так и устойчивости к ишемии гибернирующих видов (Dave et al., 2012).
Довольно интересным является вопрос о влиянии спячки на продолжительность жизни, хотя полученные результаты весьма противоречивы. В 1954 г. Д. Харман предложил гипотезу о том, что причиной старения организмов является свободнорадикальное окисление липидов, белков и других компонентов клеток (Harman, 1994). В механизмах старения, безусловно, важное значение имеют повреждения биомолекул внутренними и внешними факторами при окислительном метаболизме (Barja et al., 1994; Brunet-Rossinni, Austad, 2004). Возможно, что при сниженном метаболизме риск повреждения АФК также уменьшен. Однако межвидовые сравнения внутри систематических групп обычно приводят к выводу, что гибернация мало влияет на продолжительность жизни. Один из примеров – это продолжительность жизни представителей семейства беличьи: самым долгоживущим является не впадающий в спячку вид белок и некоторые из видов гибернантов этой группы (например, суслики, сурки, бурундуки) (Austad, 2005). В исследовании Lyman и соавторов (Lyman et al., 1981) была показана положительная корреляция между долей времени, проведенного в оцепенении, и долголетием хомяков Брандта (Mesocricetus brandti). Другая группа, летучие мыши, живут почти в 3,5 раза дольше, чем нелетающие млекопитающие того же размера. При этом зимоспящие летучие мыши живут в среднем на 5 лет больше негибернирующих летучих мышей (Brunet-Rossinni, Austad, 2004; Austad, 2005). Однако и для не впадающих в зимнюю спячку летучих мышей характерны оцепенение в дневное время, а также пусть и не столь значительное, но достоверное снижение температуры тела.
Существует мнение, что повышение уровня GSH и активности СОД и каталазы в крови летучих мышей, отмечаемые во время оцепенения, могут находиться под циркадным контролем (Wilhelm Filho et al., 2007). Эта антиоксидантная компенсация, вероятно, минимизирует окислительный стресс, происходящий при повседневном переходе летучих мышей от торпидного в активное состояние (Geiser, Budinette, 1990), что делает кровь первой линией обороны для противодействия окислительным повреждениям, которые высоко вероятны во время полета (Halliwell, Gutteridge, 1999). Ранее суточная модуляция антиоксидантов уже была описана в различных тканях позвоночных животных (Wilhelm Filho et al., 1994, 2000). Таким образом, относительно высокая антиоксидантная защита их тканей, возможно, является определяющим фактором их долговечности (Wilhelm Filho et al., 2007). В дополнение к указанным выше приспособлениям относительно низкая скорость продукции митохондриями АФК, обнаруженная у летучих мышей (Brunet-Rossini, 2004), других высокоспециализированных млекопитающих (Ku et al., 1993; Sohal et al., 1993) и птиц (Barja et al., 1994), а также некоторые важные аспекты их эволюции и генетики (Wilkinson, South, 2002; Brunet-Rossini, Austad, 2004) имеют существенное значение и, вероятно, действуют согласованно в отношении увеличения их продолжительности жизни (Wilhelm Filho et al., 2007).
Особенности АОС зимоспящих грызунов и летучих мышей
Выявление специфических особенностей хода зимней спячки позволяет предположить наличие различных адаптивных механизмов у гибернирующих животных. Так, например, у грызунов в период глубокой спячки продолжительность теплокровного состояния составляет 4–6 % их общего бюджета времени, у рукокрылых – только 1–2 % (Ануфриев, Ревин, 2006).
Необходимо отметить, что зимоспящие грызуны существенно отличаются от летучих мышей по ряду других показателей. Во-первых, это размеры животных – масса тела гладконосых летучих мышей в среднем до спячки составляет 5–76 г, а сусликов 150–300 г (Eddy, Storey, 2007; McMullen, Hallenbeck, 2010). Известно, что мелкому животному необходимо затрачивать больше энергии для поддержания жизненно важных функций, а это, в свою очередь, ведет к увеличению интенсивности удельного метаболизма и потребления кислорода (Шмидт-Ниельсен, 1987). Поэтому летучие мыши, в отличие от сусликов, должны иметь ряд трудностей, связанных с поддержанием на стационарном уровне АФК при гибернации. У летучих мышей уровень метаболизма может составлять 0.2–0.4 % от этого показателя в активном состоянии (Ануфриев, Ревин, 2006), при этом у сусликов метаболизм при спячке снижается до 1 % от «базального» уровня (Buck, Barnes, 2000). Использование различных субстратов является главным изменением метаболизма при вхождении в состояние оцепенения (Storey, Storey, 2010). Гликолиз тормозится при гибернации и суточном оцепенении (Brooks, Storey, 1992; Storey, 1997), и метаболизм переключается на окисление жирных кислот (Breukelen, Martin, 2002). Жировые запасы имеют значение не только как источник энергии, т. к. накопление жира перед спячкой сочетается с аккумуляцией в организме витамина Е, являющегося ингибитором обменных процессов и одновременно низкомолекулярным антиоксидантом. Размеры тела и способность к полету летучих мышей ограничивают накопление липидов и жирорастворимых витаминов. На протяжении зимней спячки происходит постепенная подготовка организма, и в первую очередь половой системы животных, к размножению. Известно, что европейские виды летучих мышей в естественных условиях спариваются как весной, так и осенью. Физиологической особенностью летучих мышей является обратимое торможение гестационной доминанты, которое имеет место у некоторых видов млекопитающих. Хорошо известно, что дефицит витамина Е в организме вызывает нарушения функции размножения, поэтому достаточный уровень токоферола и его высвобождение из жировых и других депо является существенным условием не только для перенесения млекопитающими зимней спячки, но и их благополучного размножения. Особенно это важно для самок летучих мышей, имеющих продолжительный латентный период беременности. Во-вторых, это условия гибернации, представители отряда грызуны спят зимой в подземных норах, где уровень кислорода является естественно низким, при этом некоторые виды запасают корм (Drew et al., 2004). По сравнению с ними летучие мыши зимуют в хорошо аэрируемых укрытиях и не заготавливают корм (Maistrovski, Biggar, Storey, 2012). В-третьих, грызуны эффективно используют такой низкомолекулярный антиоксидант, как витамин С. Во время пробуждения от зимней спячки у сусликов происходит его перераспределение между тканями и накопление в селезенке, печени и лимфоцитах, а другого низкомолекулярного антиоксиданта – мочевины – практически во всех органах. Наблюдения показывают, что перераспределение аскорбата из плазмы в метаболически активные ткани в периоды пробуждения защищает эти ткани от окислительных модификаций (Toien et al., 2001). Летучие мыши утратили в процессе эволюции способность к синтезу данного витамина (Cui et al., 2011) и, вероятно, должны использовать другие защитные механизмы. Это подтверждают некоторые исследования, свидетельствующие, что концентрация α-токоферола у летучих мышей была более чем на порядок выше, чем у крыс и мышей (Wilhelm Filho et al., 2007; Ilyina et al., 2014).
Другой метаболит с антиоксидантными свойствами – это мелатонин, который также, возможно, играет важную роль при гипоксии – реоксигенации (ныряние, гибернация и рождение) (Tan et al., 2005; Aarseth, Froiland, Jorgensen, 2010). Обнаруженные кратковременные высокие уровни мелатонина у сусликов во время пробуждения от зимней спячки, очевидно, образуются благодаря синтетическим процессам во многих тканях, а не только шишковидной железе.
Внутриклеточные механизмы антиоксидантной защиты у гибернирующих видов включают в себя как метаболиты (GSH) (Carey et al., 2003), так и ферменты. Действительно, скрининг ДНК сусликов и летучих мышей показал увеличение в 2 раза регуляции супероксиддисмутазы, глутатионпероксидазы и глутатион-S-трансферазы в почках (Carey et al., 2003). Во время пробуждения в плазме сирийских хомячков выявлено 3-кратное увеличение активности СОД и каталазы, необходимых для нейтрализации АФК (Ohta et al., 2006; Okamoto et al., 2006).
Снижение метаболизма в организме млекопитающих в течение торпора предполагает обратимое подавление уровня дыхания митохондрий. Так, у сусликов в печени и скелетной мышце оно достигает 70 и 30 % соответственно (Brown et al., 2012). Метаболические приспособления, необходимые организму во время гибернации, включают в себя активацию одной из транскрипционных мишеней фактора HIF-1, киназы пируватдегидрогеназы 4 (PDK-4), как это показано в скелетной мышце (Buck, Squire, Andrews, 2002).
Поддержание размера и активности скелетной мышечной ткани в течение периодов естественной спячки является необходимым условием для успешной двигательной активности в течение последующего после гибернации периода пробуждения. В клинических и экспериментальных моделях мышечный покой млекопитающих, такой, например, как иммобилизация конечностей, ведет к атрофии мышц и снижению их сократительной способности (Musacchia, Steffen, Fell, 1988; Powers, Kavazis, McClung, 2007; Clark, 2009). В течение баутов торпора гибернанты не показывают заметных движений, хотя при этом отмечается относительно низкий уровень мышечной дистрофии по сравнению с неестественными моделями мышечного покоя (Musacchia, Steffen, Fell, 1988; Hudson, Franklin, 2002; Shavlakadze, Grounds, 2006). Целый ряд механизмов вносит вклад в устойчивость гибернантов к мышечной атрофии, включая повышенный уровень антиоксидантов (Hudson, Franklin, 2002; Allan, Storey, 2012), пониженный уровень миостатина (Braulke et al., 2010; Brooks, Myburgh, Storey, 2011; Nowell et al., 2011) и регуляция транскрипционных факторов, связанных с мышечной активностью (Tessier, Storey, 2010). Так, выявлено повышение активности Mn-SOD в начале оцепенения в скелетной мышце у сусликов (Allan, Storey, 2012). Также на сусликах показано, что общая антиоксидантная мощность икроножной мышцы была на 156 % выше у животных во время торпора по сравнению с летними особями (James et al., 2013).
Заключение
Гипоксические состояния являются основными или сопровождающими патогенез многих заболеваний факторами. В разработку методов их профилактики и коррекции определенный вклад вносит изучение адаптаций млекопитающих к дефициту кислорода, в частности при гибернации, отличительной особенностью которой от других гипоксических состояний является то, что она сопровождается значительным снижением температуры тела. Однако существенное снижение метаболизма приводит к невозможности получения энергии с помощью гликолиза, что, в свою очередь, изменяет энергетический баланс клетки, модифицирует работу АТФ-зависимых ионных каналов и связанных с ними путей внутриклеточной сигнализации, а также активирует редокс-сигнализацию, опосредованную изменением уровня кислорода и его активных форм.
В процессе эволюции возникли различные стратегии защиты от АФК, так, например, одни виды используют низкомолекулярные антиоксиданты, другие – ферментативные, но всех гибернантов объединяет то, что перед спячкой они накапливают необходимое количество антиоксидантов, что, вероятно, является своеобразной преадаптацией.
Возросший интерес к гибернации в последнее десятилетие подтверждает актуальность данной проблемы, поскольку млекопитающие, способные впадать в спячку, представляют собой пример устойчивости к ишемии головного мозга и являются прекрасной моделью для изучения гипоксии и реоксигенации. Еще многое предстоит узнать о клеточных, молекулярных и общесистемных механизмах, которые защищают гибернирующих млекопитающих от гипоксии – реоксигенации и способствуют синаптической пластичности при пробуждении. Использование разнообразных стратегий антиоксидантной защиты, по-видимому, является одним из факторов выживания различных групп гибернантов в зимний период.
Библиография
Ануфриев А. И. Механизмы зимней спячки мелких млекопитающих Якутии . Новосибирск: СО РАН, 2008. 158 с.
Ануфриев А. И., Ревин Ю. В. Биоэнергетика зимней спячки летучих мышей (Chiroptera: Vespertilionidae) в Якутии // Plecotus et al. 2006. № 9. С. 8–17.
Владимиров Ю. А. Свободные радикалы // Вестн. Рос. АМН. 1998. № 7. С. 43–51.
Галанцев В. П. Эволюция адаптаций ныряющих животных. Эколого- и морфофизиологические аспекты . Л.: Наука, 1977. 191 с.
Зенков Н. К., Ланкин В. З., Меньщикова Е. Б. Окислительный стресс: Биохимический и патофизиологический аспекты . М.: МАИК «Наука/Интерпериодика», 2001. 343 с.
Зенков Н. К., Меньщикова Е. Б. Активированные кислородные метаболиты в биологических системах // Усп. соврем. биол. 1993. Т. 113, № 3. С. 286–296.
Калабухов Н. И. Летняя спячка сусликов (С. fulvus и С. pygmaeus) // Тр. лаб. эксперимент. биологии Моск. Зоопарка. 1929. Т. 5. С. 163–176.
Коган А. X. Фагоцитзависимые кислородные свободнорадикальные механизмы аутоагрессии в патогенезе внутренних болезней // Вестник РАМН. 1999. № 2. С. 3–10.
Серебрянникова Э. Т., Векслер Я. И. Влияние адаптации к переохлаждению на жирно-кислотный состав липидов тканей крыс // Укр. биохим. журн. 1977. Т. 49, № 2. С. 16–21.
Скулачев В. П. Альтернативные функции клеточного дыхания // Соросовский образовательный журнал. 1998. № 8. С. 2–7.
Шмидт-Ниельсен К. Размеры животных: почему они так важны? : Пер. с англ. М.: Мир, 1987. 259 с.
Aarseth J. J., Froiland E., Jorgensen E. H. Melatonin implantation during spring and summer does not affect the seasonal rhythm of feeding in anadromous Arctic charr (Salvelinus alpinus) // Polar Biol. 2010. Vol. 33. P. 379–388.
Allan M. E., Storey K. B. Expression of NF-kB and downstream antioxidant genes in skeletal muscle of hibernating ground squirrels, Spermophilus tridecemlineatus // Cell. Biochem. Funct. 2012. Vol. 30. P. 166–174.
Austad S. N. Diverse aging rates in metazoans: targets for functional genomics // Mech. Ageing Dev. 2005. Vol. 126. P. 43–49.
Barja G., Cadenas S., Rojas C., Pérez-Campo R. et al. Low mitochondrial free radical production per unit O 2 consumption can explain the simultaneous presence of high longevity and high metabolic rate in birds // Free Radic. Res. 1994. Vol. 21. P. 317–328.
Bouma H. R., Carey H. V., Kroese F. G. M. Hibernation: the immune system at rest? // J. Leukoc. Biology. 2010a. Vol. 88. P. 619–624.
Bouma Н. R., Strijkstra F. M., Boerema A. S., Deelman L. E. et al. Bllod cell dynamics during hibernation in the Europian Ground Squirrel // Vet. Immunol. Immunopathol. 2010b. Vol. 136. P. 319–323.
Braulke L. J., Heldmaier G., Berriel Diaz M., Rozman J. et al. Seasonal changes of myostatin expression and its relation to body mass acclimation in the Djungarian hamster, Phodopus sungorus // J. Exp. Zool. 2010. Vol. 313. P. 548–556.
Breukelen F., Martin S. L. Invited Review: Molecular adaptations in mammalian hibernators: unique adaptations or generalized responses? // J. Appl. Physiol. 2002. Vol. 92. Р. 2640–2647.
Brooks N. E., Myburgh K. H., Storey K. B. Myostatin levels in skeletal muscle of hibernating ground squirrels // J. Exp. Biol. 2011. Vol. 214. P. 2522–2527.
Brooks S. P., Storey K. B. Mechanisms of glycolytic control during hibernation in the ground squirrel Spermophilus lateralis // J. Comp. Physiol. 1992. Vol. 162. P. 23–28.
Brown J. C., Chung D. J., Belgrave K. R., Staples J. F. Mitochondrial metabolic suppression and reactive oxygen species production in liver and skeletal muscle of hibernating thirteen-lined ground squirrels // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2012. Vol. 302. № 1. Р. 15–28.
Brune B., Zhou J. Nitric oxide, oxidative stress, and apoptosis // Kidney Int. 2003. Vol. 84. P. 22–24.
Brunet-Rossini A. K. Reduced free-radical production and extreme longevity in the little brown bat (Myotis lucifugus) versus two non-flying mammals // Mech. Ageing Dev. 2004. Vol. 125. P. 11–20.
Brunet-Rossinni A. K., Austad S. N. Ageing studies on bats: a review // Biogerontology. 2004. Vol. 5. P. 211–222.
Buck C. L., Barnes B. M. Effects of ambient temperature on metabolic rate, respiratory quotient, and torpor in an arctic hibernator // Am. J. Physiol. Regulatory Integrative Comp. Physiol. 2000. Vol. 279. P. 255–262.
Buck M. J., Squire T. L., Andrews M. T. Coordinate expression of the PDK4 gene: a means of regulating fuel selection in a hibernating mammal // Physiol. Genomics. 2002. Vol. 8. P. 5–13.
Carey H. V., Andrews M. T., Martin S. L. Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature // Physiol. Rev. 2003. Vol. 83. P. 1153–1181.
Carey H. V., Frank C. L., Seifert J. Hibernation induces oxidative stress and activation of NF-κB in ground squirrel intestine // J. Comp. Physiol. 2000. Vol. 170B. P. 551–559.
Clark B. C. In vivo alterations in skeletal muscle form and function after disuse atrophy // Med. Sci. Sports Exerc. 2009. Vol. 41. P. 1869–1875.
Conde-Perezprina J. C., Luna-Lopez A., Gonzalez-Puertos V. Y., Zenteno-Savın T. et al. DNA MMR systems, microsatellite instability and antioxidant activity variations in two species of wild bats: Myotis velifer and Desmodus rotundus, as possible factors associated with longevity // Age. 2012. Vol. 34. № 6. P. 1473–1492.
Cui J., Pan Y. H., Zhang Y., Jones G. et al. Progressive pseudogenization: vitamin C synthesis and its loss in bats // Mol. Biol. Evol. 2011. Vol. 28. P. 1025–1031.
Dave K. R., Christian S. L., Perez-Pinzon M. A., Drew K. L. Neuroprotection: lessons from hibernators // Comp. Biochem. Physiol. 2012. Vol. 162. P. 1–9.
Dhalla N. S., Elmoselhi A. B., Hata T., Makino N. Status of myocardial antioxidants in ischemia-reperfusion injury // Cardiovascular Research. 2000. Vol. 47. P. 446–456.
Didion S. P., Kinzenbaw D. A., Fegan P. E., Didion L. A. et al. Overexpression of CuZn-SOD prevents lipopolysaccharide-induced endothelial dysfunction // Stroke. 2004. Vol. 35. № 8. P. 1963–1967.
Drew K. L., Buck C. L., Barnes B. M., Christian S. L. et al. Central nervous system regulation of mammalian hibernation: implications for metabolic suppression and ischemia tolerance // J. Neurochem. 2007. Vol. 102. P. 1713–1726.
Drew K. L., Harris M. B., Laмanna J. C. et al. Hypoxia tolerance in mammalian heterotherms // Am J. Exp. Biol. 2004. Vol. 207. Р. 3155–3162.
Drew K. L., Toien O., Rivera P. M., Smith M. A. et al. Role of the antioxidant ascorbate in hibernation and warming from hibernation // Comp. Biochem. Physiol. 2002. Vol. 133. P. 483–492.
Eddy S. F., Storey K. B. p38 MAPK regulation of transcription factor targets in muscle and heart of hibernating bats, Myotis lucifugus // Cell. Biochem. Function. 2007. Vol. 25. P. 759–765.
Elsner R., Oyaseter S., Almaas R., Saugstad O. D. Diving seals, ischemia-reperfusion and oxygen radicals // Comp. Biochem. Physiol. 1998. Vol. 119A. № 4. P. 975–980.
Geiser F. Metabolic rate and body temperature reduction during hibernation and daily torpor // Annu. Rev. Physiol. 2004. Vol. 66. P. 239–274.
Geiser F., Budinette R. V. The relationship between body mass and rate of rewarming from hibernation and daily torpor in mammals // J. Exp. Biol. 1990. Vol. 151. P. 349–359.
Halliwell B., Gutteridge J. M. C. Free radicals in biology and medicine. 3rd ed. Oxford: Oxford Univ. Press, 1999. 888 p.
Harman D. Free-radical theory of aging. Increasing the functional life span // Ann. N. Y. Acad. Sci. 1994. Vol. 717. P. 1–15.
Heldmaier G., Ortmann S., Elvert R. Natural hypometabolism during hibernation and daily torpor in mammals // Respir. Physiol. Neurobiol. 2004. Vol. 141. P. 317–329.
Hochachka P. W., Somero G. N. Biochemical Adaptation: Mechanism and Process in Physiological Evolution. New York: Oxford University Press, 2002. 466 p.
Hudson N. J., Franklin C. E. Maintaining muscle mass during extended disuse: aestivating frogs as a model species // J. Exp. Biol. 2002. Vol. 205. P. 2297–2303.
Hudson J. W., Scott J. M. Daily torpor in the laboratory mouse // Physiol. Zool. 1979. Vol. 52. № 2. P. 219–220.
Hulbert A. J., Pamplona R., Buffenstein R. et al. Life and Death: Metabolic Rate, Membrane Composition, and Life Span of Animals // Physiol. Rev. 2007. Vol. 87. P. 1175–1213.
Hut R. A., Barnes B. M., Daan S. Body temperature patterns before, during, and after semi-natural hibernation in the European ground squirrel // Journal of Comparative Physiology. 2002. Vol. 172B. P. 47–58.
Ilyina T., Baishnikova I., Belkin V., Ruokolaynen T. Vitamins A and E in physiological adaptation of mammals with different ecogenesis // Acta Biol. Univ. Dagavp. 2014. Vol. 14. № 1. P. 45–50.
James R. S., Staples J. F., Brown J. C. L., Tessier S. T. et al. The effects of hibernation on the contractile and biochemical properties of skeletal muscles in the thirteen-lined ground squirrel, Ictidomys tridecemlineatus // The Journal of Experimental Biology. 2013. Vol. 216. P. 2587–2594.
Jaspers P., Kangasjärvi J. Reactive Oxygen Species in Abiotic Stress Signaling // Physiol. Plant. 2010. Vol. 138. P. 405–413.
Kim A. A. Panoramic Overview of Mitochondria and Mitochondrial Redox Biology // Toxicol. Res. Dec. 2014. Vol. 30. № 4. P. 221–234.
Kooyman G. L., Ponganis P. J. The physiological basis of diving to depth: birds and mammals // Annu. Rev. Physiol. 1998. Vol. 60. P. 19–32.
Ku H. H., Sohal R. S. Comparison of mitochobdrial pro-oxidant generation and anti-oxidant defenses between rat and pigeon: possible basis of variation in longevity and metabolic potential // Mech. Ageing. Dev. 1993. Vol. 72. № 1. P. 67–76.
Kurtz C. C., Lindell S. L., Mangino M. J., Carey H. V. Hibernation confers resistance to intestinal ischemia-reperfusion injury // Am. J. Physiol. Gastrointest. Liver. Physiol. 2006. Vol. 291. P. 895–901.
Lyman C. P., O’Brien R. C., Greene G. C., Papafrangos E. D. Hibernation and longevity in the Turkish hamster Mesocricetus brandti // Science. 1981. Vol. 212. P. 668–670.
Ma Y. L., Xiongwei Z., Rivera P. M., Toien O. et al. Absence of cellular stress in brain after hypoxia induced by arousal from hibernation in Arctic ground squirrels // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2005. Vol. 289. P. 1297–1306.
MacArthur R. A. Aquatic thermoregulation in the muskrat (Ondatra zibethicus): energy demands of swimming and diving // Can. J. Zool. 1984. Vol. 62. P. 241–248.
MacDonald J. A., Storey K. B. Regulation of ground squirrel Na+ K+ -ATPase activity by reversible phosphorylation during hibernation // Biochem. Biophys. Res. Commun. 1999. Vol. 254. P. 424–429.
Maistrovski Y., Biggar K. K., Storey K. B. HIF‐1 alpha regulation in mammalian hibernators: role of non‐coding RNA in HIF‐1 alpha control during torpor in ground squirrels and bats // J. Comp. Physiol. 2012. Vol. 182. P. 849–859.
McCulloch P. F. Animal models for investigating the central control of the mammalian diving response // Front. Physiol. 2012. Vol. 3. P. 1–16.
McMullen D. C., Hallenbeck J. M. Regulation of Akt during torpor in the hibernating ground squirrel, Ictidomys tridecemlineatus // J. Comp. Physiol. 2010. Vol. 180B. № 6. P. 927–934.
Mongkolsuk S., Helmann J. D. Regulation of inducible peroxide stress responses // Mol. Microbiol. 2002. Vol. 45. P. 9–15.
Morin P., Storey K. B. Antioxidant defense in hibernation: cloning and expression of peroxiredoxins from hibernating ground squirrels, Spermophilus tridecemlineatus // Arch. Biochem. Biophys. 2007. Vol. 461. P. 59–65.
Musacchia X. J., Steffen J. M., Fell R. D. Disuse atrophy of skeletal muscle: animal models // Exerc. Sport Sci. Rev. 1988. Vol. 16. P. 61–87.
Nowell M. M., Choi H., Rourke B. C. Muscle plasticity in hibernating ground squirrels (Spermophilus lateralis) is induced by seasonal, but not lowtemperature, mechanisms // J. Comp. Physiol. 2011. Vol. 181. P. 147–164.
Ohta H., Okamoto I., Hanaya T., Arai S. et al. Enhanced antioxidant defense due to extracellular catalase activity in Syrian hamster during arousal from hibernation // Comp. Biochem. Physiol. 2006. Vol. 143C. P. 484–491.
Okamoto I., Kayano T., Hanaya T., Arai S. et al. Up-regulation of an extracellular superoxide dismutase-like activity in hibernating hamsters subjected to oxidative stress in mid- to late arousal from torpor // Comp. Biochem. Physiol. 2006. Vol. 144C. P. 47–56.
Ozaki Y., Ohashi T., Niwa Y. Oxygen radical production by neutrophils from patients with bacterial infection and rheumatoid arthritis // Inflammation. 1986. Vol. 10. P. 119–130.
Powers S. K., Kavazis A. N., McClung J. M. Oxidative stress and disuse muscle atrophy // J. Appl. Physiol. 2007. Vol. 102. P. 2389–2397.
Prendergast B. J., Freeman D. A., Zucker I. et al. Periodic arousal from hibernation is necessary for initiation of immune responses in ground squirrels // Am. J. Physiol. Regulatory Integrative Comp. Physiol. 2002. Vol. 282. P. 1054–1062.
Reznik G., Reznik-Schüller H., Emminger A., Mohr U. Comparative studies of blood from hibernating and nonhibernating European hamsters (Cricetus сricetus) // Laboratory animal science. 1975. Vol. 25. № 2. P. 210–215.
Sanz A., Stefanatos R. K. The mitochondrial free radical theory of aging: a critical view // Curr. Aging Sci. 2008. Vol. 1. № 1. P. 10–21.
Selman C., McLaren J. S., Himanka M. J., Speakman J. R. Effect of long-term cold exposure on antioxidant enzyme activities in a small mammal // Free Radic. Biol. Med. 2000. Vol. 28. P. 1279–1285.
Sohal R. S., Orr W. C. Relationship between antioxidants, prooxidants, and the aging process // Ann. N. Y. Acad. Sci. 1992. Vol. 663. P. 74–84.
Sohal R. S., Ku H. H., Agarwal S. Biochemical correlates of longevity in two closely related rodent species // Biochem. Biophys. Res. Commun. 1993. Vol. 196. P. 7–11.
Shavlakadze T., Grounds M. D. Of bears, frogs, meat, mice and men: insight into the complexity of factors affecting skeletal muscle atrophy/hypertrophy and myogenesis/adipogenesis // Bio Essays. 2006. Vol. 28. № 10. P. 994–1009.
Storey K. B. Oxidative stress: animal adaptations in nature // Braz. J. Med. Biol. Res. 1996. Vol. 29. P. 1715–1733.
Storey K. B. Metabolic regulation in mammalian hibernation: enzyme and protein adaptations // Comp Biochem Physiol. 1997. Vol. 118. P. 1115–1124.
Storey K. B. Out cold: biochemical regulation of mammalian hibernation – a mini-review // Gerontology. 2010. Vol. 56. P. 220–230.
Storey K. B., Storey J. M. Metabolic rate depression in animals: transcriptional and translational controls // Biol. Rev. Camb. Philos. Soc. 2004. Vol. 79. P. 207–233.
Storey K. B., Storey J. M. Metabolic rate depression: the biochemistry of mammalian hibernation // G. S Makowski (ed.). Advances in clinical chemistry. Elsevier Inc., 2010. P. 77–108.
Stuart J. A., Maddalena L. A., Merilovich M., Robb E. L. A midlife crisis for the mitochondrial free radical theory of aging // Longev. Healthspan. 2014. Vol. 3. P. 4.
Tan D. X., Manchester L. C., Sainz R. M., Mayo J. C. et al. Physiological ischemia/reperfusion phenomena and their relation to endogenous melatonin production: a hypothesis // Endocrine. 2005. Vol. 27. P. 149–158.
Tessier S. N., Storey K. B. Expression of myocyte enhancer factor-2 and downstream genes in ground squirrel skeletal muscle during hibernation // Mol. Cell. Biochem. 2010. Vol. 344. P. 151–162.
Toien O., Drew K. L., Chao M. L. et al. Ascorbate dynamics and oxygen consumption during arousal from hibernation in Arctic ground squirrels // Am. J. Physiol. Reg. Integr. Comp. Physiol. 2001. Vol. 281. P. 572–583.
Wang L. C. H., Wolowyk M. W. Torpor in mammals and birds // Can. J. Zool. 1988. Vol. 66. P. 133–137.
Wilhelm Filho D., Althoff S. L., Dafre A. L., Boveris A. Antioxidant defenses, longevity and ecophysiology of South American bats // Comparative Biochemistry and Physiology. 2007. Vol. 146C. P. 214–220.
Wilhelm Filho D., González-Flecha B., Bredeston L., Boveris A. Gill diffusion as a physiological mechanism for hydrogen peroxide elimination by fish // Braz. J. Med. Biol. Res. 1994. Vol. 27. P. 2879–2882.
Wilhelm Filho D., Marcon J. L., Fraga C. G., Boveris A. Antioxidant defenses in vertebrates: emphasis on fish and mammals // Trends Comp. Biochem. Physiol. 2000. Vol. 7. P. 33–45.
Wilhelm Filho D., Sell F., Ribeiro L. et al. Comparison between the antioxidant status of terrestrial and diving mammals // Comp. Biochem. Physiol. 2002. Vol. 133. № 3. P. 885–892.
Wilkinson G. S., South J. M. Life history, ecology and longevity in bats // Aging Cell. 2002. Vol. 1. P. 124–131.
Zenteno-Savín T., Clayton-Hernandez E., Elsner R. Diving seals: are they a model for coping with oxidative stress? // Comp. Biochem. Physiol. 2002. Vol. 133C. № 4. P. 527–536.
Благодарности
Работа выполнена при финансовой поддержке гранта Президента РФ для ведущих научных школ НШ-1410.2014.4, средств федерального бюджета на выполнение государственного задания (темы № 50.1, № г. р. 01201358732) с использованием оборудования центра коллективного пользования ИБ КарНЦ РАН.






 © 2011 - 2026
© 2011 - 2026