Введение
Прежде чем приступить к теме нашего сообщения, выскажем несколько комментариев к статье Э. В. Ивантера (2012), отмечающего искусственность бума научных исследований в области биологического разнообразия. Нельзя не признать справедливость замечаний автора, который подчеркивает спекулятивный характер использования этого термина в экологии. Однако, во-первых, понятие разнообразия вовсе не является прерогативой экологии, поскольку многокомпонентность и структурная неоднородность всех наблюдаемых явлений во Вселенной есть аксиома, которая не нуждается в обосновании. Поэтому разнообразие in pleno есть важнейшая «наднаучная» категория оценки свойств любой системы от абстрактных теоретико-множественных конструкций до социально-экономических ценозов любого уровня. Можно говорить о разнообразии выпускаемых электромоторов (см. работы Б. И. Кудрина), товаров в супермаркете, морфем языка, политических групп в парламенте и проч. Нелишне также отметить, что основные индексы и модели разнообразия были разработаны В. Парето, К. Джини, Дж. Ципфом, А. Реньи, Г. Тейлом именно для экономических и лингвистических приложений.
Понятие биологического разнообразия, несомненно, значительно шире представлений биоценологии, поскольку относится ко всем уровням организации жизни, а не только к локальным сообществам. На одном краю этой иерархии фигурирует «геноцентрическая» концепция Р. Докинза, сводящая биологическое разнообразие к отличиям между индивидуальными генами. Классическая «организмоцентрическая» концепция И. И. Шмальгаузена рассматривает разнообразие уже как проявление особого рода «морфопроцесса» на множестве индивидуальных особей (Павлинов, 2010). В глобальном биогеографическом масштабе разнообразие трактуется почти исключительно как некоторый оставшийся на сегодняшний день фонд видов флоры и фауны, который необходимо всемерно поддерживать и сберегать. И здесь, конечно, речь не идет о неуклонном повышении всеобщего индекса Шеннона, а об оперативных, эффективных и тщательно продуманных мероприятиях по сохранению стремительно исчезающих популяций.
В экологии сообществ видовое разнообразие представляет собой основной и наиболее объективный слой знаний об экосистеме, полученный в ходе мониторинга и включающий таксономический состав изучаемых биоценозов и пространственно-временную изменчивость популяционной плотности каждого вида. Разумеется, экологи стараются сформировать на этой основе последующие слои знаний, состоящие из гипотез (догадок, предположений и просто шаблонов смутных идей) относительно трофической структуры сообществ, межвидовых взаимодействий, функционального значения отдельных синтаксонов или трансформации «вещества, энергии и информации (!)». К сожалению, насколько невнятны практические методы количественного обоснования всех этих гипотез, столь же сомнительны попытки представить биоразнообразие сообществ «одним числом». Поэтому «заблуждения» вокруг диверситологии относятся не к переоценке глобальности ее понятий, а к несовершенству способов их количественного измерения. Если вспомнить притчу о слепых мудрецах, которые по-разному представляют слона, ощупывая ногу, хвост, хобот и т. д., то «все мы – слепцы, пытающиеся описать чудовищного слона экологического и эволюционного разнообразия...» (Nanney, 2004).
Предложено большое количество императивных мер для оценки биоразнообразия, таких как индексы Джини–Симпсона или Шеннона, которые имеют смысл вариации численностей в многокомпонентных системах. Они не столько отражают подлинную видовую структуру сообществ, сколько основываются на «экономности объясняющих принципов» (Левич, 1980). В результате «разнообразие как экологическое понятие стало весьма отличаться от разнообразия как статистического индекса» (Ricotta, 2005). В частности, предполагается, что все виды в сообществе нейтральны и эквивалентны (т. е. в равной степени отличны между собой), а информация относительно «связанности» этих видов не учитывается (Chao at al., 2010).
Однако еще Е. Пиелу (Pielou, 1975) заметила, что понятие разнообразия может быть существенно расширено, если включить, в частности, филогенетические различия между видами. Например, индекс биоразнообразия для сообщества из таксономически различных видов (орел, сорока и чернозобик) должен быть при прочих равных условиях выше, чем у сообщества из близких между собой популяций (сорока, голубая сорока и древесная сорока). Это вполне естественное соображение вызвало появление ряда новых концепций и постоянно увеличивающееся множество мер разнообразия, учитывающих таксономическое или функциональное дифференцирование видов.
Важной особенностью экосистем является иерархичность их построения (Саймон, 1972), поскольку такой способ организации во многом определяет высокую функциональную устойчивость и филогенетическую направленность эволюции биологических сообществ. Хотя изменение биоразнообразия может иметь в природе не только поступательно-иерархический, но и циклический характер (Чернов, 1975), в каждый момент времени морфология экосистемы может быть представлена как определенная иерархия компонент, составляющих ее структуру. В ряде работ (Faith, 1992; Crozier, 1997) филогенетическое разнообразие (PD, Phylogenetic Diversity) было определено как сумма длин ветвей филогенетического дерева, соединяющих все виды в целевом сообществе, что по существу является общей мерой значимости событий эволюционной истории, воплощенных со времени появления общего предка составляющих сообщество видов. Длина каждой ветви дерева пропорциональна времени дивергенции, числу генетических преобразований или изменению иных наблюдаемых маркеров.
Другое направление (Vane-Wright et al., 1991; Warwick, Clarke, 1998) рассматривает таксономическое разнообразие (ТD, Taxonomic Diversity), которое является обобщением видового разнообразия, учитывающим не только богатство видов в сообществе и их относительное обилие, но и таксономическое различие видов между собой. Оно основывается на подсчете сумм длин ветвей или числа узлов дерева систематики, построенного на основе линнеевской классификации, либо с использованием кладистического подхода (Емельянов, Расницын, 1991). Если эволюционное время при расчете PD мысленно заменить на число таксономических категорий, используемых для оценки ТD, то легко показать (Chao at al., 2010), что алгоритмы анализа топологии деревьев практически идентичны между собой, поэтому в обоих случаях используются одни и те же математические выражения для мер разнообразия.
Основным элементом количественного анализа пространственного распределения гидробионтов является оценка структурно-функциональной неоднородности таксоценозов вдоль градиентов естественного или антропогенного происхождения и поиск характерных границ, относительно которых видовой состав сообществ претерпевает резкие изменения сукцессионного характера. Важное место в развитии биотических концепций лотических экосистем, таких как теория речного континуума и динамика «пятен» (Vannote et al., 1980), занимает оценка изменчивости видового разнообразия и перераспределение ведущей роли в сообществе между отдельными систематическими или функциональными группами.
Цель настоящей работы – сравнительный анализ результатов использования различных мер таксономического разнообразия для изучения структурной динамики сообществ пресноводного макрозообентоса по продольному градиенту водотока. Выбор объекта исследования обусловлен тем, что макрозообентос является наиболее стабильным и малоподвижным звеном экосистемы, чутко реагирующим на изменения факторов окружающей среды (Зинченко, 2011), что позволяет обоснованно оценивать степень изменчивости сообществ гидробионтов на основе параметров его видовой структуры.
Материалы
Расчет индексов таксономического разнообразия проводился по данным гидробиологической съемки, выполняемой в течение ряда лет на всем протяжении р. Сок (длина 375 км), которая является незарегулированной равнинной рекой II–IV класса качества вод (Особенности пресноводных, 2011). Всего по результатам 97 проб было обнаружено 277 видов и таксономических групп донных организмов. С учетом гидрологических характеристик по продольному профилю реки было выделено 9 биотопически однородных участков, на каждом из которых выполнено примерно одинаковое количество гидробиологических проб (от 9 до 11). Для проведения расчетов были сформированы матрицы N и P размерностью 9x277, которые включали суммарные значения численности Ni особей каждого i-го вида и их относительные доли pi от общей численности бентосных организмов во всех пробах, взятых на каждом из 9 участков.
Методы
Большинство предложенных мер таксономического разнообразия являются генерализацией классических нейтральных метрик видового разнообразия: богатства видов, энтропии Шеннона и индексов Джини – Симпсона. Наиболее целенаправленные попытки учесть в явном виде структурную информацию, необходимую для оценки биологической сложности экосистемы, связаны с квадратичной энтропией Рао (Rao, 1982):
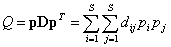

где D – квадратная симметричная матрица, состоящая из оценок dij различий между каждой парой видов, dii = 0, dij = dji, i, j 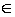
Квадратичная энтропия Рао представляет собой обобщенную форму индекса видового доминирования Симпсона 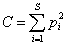 и определяет среднее экологическое различие между двумя случайно извлеченными из сообщества особями. При этом индекс Рао может быть разложен на следующие составляющие (Shimatani, 2001; Жуков, 2005):
и определяет среднее экологическое различие между двумя случайно извлеченными из сообщества особями. При этом индекс Рао может быть разложен на следующие составляющие (Shimatani, 2001; Жуков, 2005):

где С – индекс Симпсона, Dm – среднее экологическое расстояние между видами, B – фактор баланса относительных частот, который рассчитывается как ковариация между dij и pipj, если считать их случайными переменными.
Индексы таксономического разнообразия, предложенные Р. Уорвиком и К. Кларком (Warwick, Clarke, 1995; Clarke, Warwick, 1998), основаны на подсчете сумм длин ветвей, соединяющих узлы таксономического дерева для видового состава изучаемого сообщества. Если виды расположить в соответствии с линнеевской классификацией по типам, классам, отрядам, семействам, родам, то меру таксономического различия wij двух видов i и j можно задать как длину половины пути, который связывает эти виды по ветвям дерева иерархии. Например, если два вида принадлежат к одному роду, то нужно пройти один шаг для того, чтобы достичь общего узла, следовательно, wij = 1a, где а – стандартное расстояние между смежными узлами. Если виды принадлежат к разным родам, но к одному семейству, то потребуется два последовательных шага («вид – род» и «род – семейство») и т. д.
Если данные представлены в формате 1/0, т. е. «присутствие/отсутствие видов», то индекс среднего таксономического своеобразия (average taxonomic distinctness), предложенный Р. Уорвиком и К. Кларком (Warwick, Clarke, 1995), равен средней длине ветвей wij, соединяющих любую пару видов на дереве иерархии:
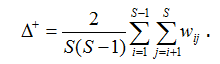

Длина шага а стандартизирована таким образом, чтобы максимальное расстояние wij было бы равно 100, т. е. значение индекса ∆+ изменяется в пределах от 0 до 100.
Если в формуле для ∆+ дополнительно учесть относительное обилие видов pi, то получим индекс таксономического разнообразия (taxonomic diversity – Clarke, Warwick, 1998), который является простой модификацией квадратичной энтропии Рао:

Еще два индекса, названных Р. Уорвиком и К. Кларком (1998) вариациями (variation) таксономического своеобразия/разнообразия, оценивают размах (дисперсию) распределения таксонов в пределах иерархического дерева:
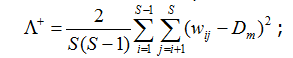
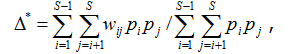

где Dm = ∆+ – среднее таксономическое расстояние между видами, представленное также в формуле (2).
При сравнении значений индексов для двух или нескольких обследованных биотопов важной составляющей является статистический анализ, в ходе которого проверяется нулевая гипотеза об отсутствии различий между ними. Кларк и Уорвик (Clarke, Warwick, 1998) разработали рандомизационную процедуру оценки стандартной ошибки среднего таксономического своеобразия ∆+ для произвольного местообитания. При этом многократно (не менее 1000 раз) для каждого участка с исходным видовым богатством S генерируются частные псевдовыборки, являющиеся случайной комбинацией S видов, извлеченных из общего видового списка видов Sобщ, обнаруженных во всех выборках (Sобщ > S). На основе этих итераций восстанавливается неизвестное статистическое распределение значений ∆+, и по гистограмме находятся оценки дисперсии и математического ожидания.
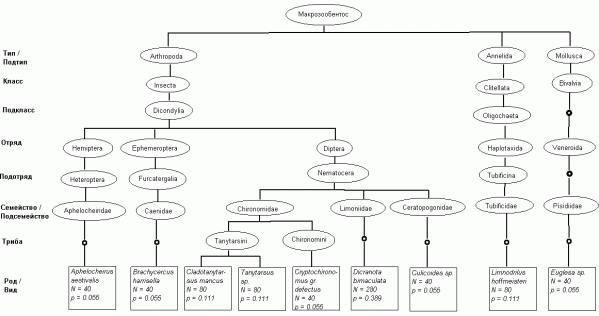
Для каждого из 277 видов было сделано систематическое описание по 11 таксономическим уровням: вид → род → триба → подсемейство → семейство → подотряд → отряд → подкласс → класс → подтип → тип. Выделение трибы в качестве отдельного уровня обуславливалось тем, что 122 вида относились к семейству Chironomidae, для которого эта градация имеет важное самостоятельное значение. Общая таксономическая таблица, описывающая сообщество донных организмов р. Сок, представляла собой матрицу T размерностью 11x277, состоящую из наименований представленных систематических уровней каждого вида. Таксономическое дерево видового состава для одной из 97 выполненных проб макрозообентоса представлено на рис. 1.
Рис. 1. Пример таксономического дерева для видового состава макрозообентоса в пробе, взятой 14.07.1998 г. на станции 5 р. Сок
Fig. 1. Examples of taxonomic trees for a sample of 9 species macrozoobenthos (from st. 5 river Sok at 14.07.1998 y.)
Для примера на рис. 1 могут быть легко рассчитаны следующие показатели разнообразия: число видов S = 9; общая численность N = 720 экз/м2; индекс видового разнообразия Шеннона H = 1.9 нит; индекс доминирования Симпсона С = 0.204; среднее таксономическое своеобразие по формуле (3) ∆+ = 66.8; таксономическое разнообразие ∆ = 48.8 (4); вариации таксономического различия Λ+ = 956 и ∆* = 61.2 (5).
Расчеты проводились в статистической среде R с использованием функций пакета vegan. Сначала с помощью процедуры taxa2dist(T) формировалась матрица D размером 277x277 таксономических дистанций wij между каждой парой видов, а на втором этапе с использованием функции taxondive(P, D) для каждого участка реки рассчитывались таксономические индексы по формулам (3)–(5).
Результаты
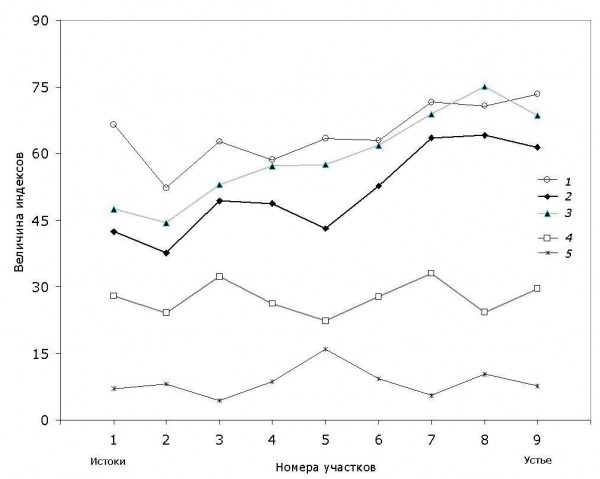
Пространственная динамика основных индексов разнообразия, представленная на рис. 2, достаточно адекватно отражает основные тенденции в изменении ценотической структуры донных сообществ по продольному профилю р. Сок.
Рис. 2. Изменение индексов таксономического разнообразия сообществ макрозообентоса от истоков к устью р. Сок: 1 – среднее таксономическое своеобразие ∆+ (3); 2 – таксономическое разнообразие ∆ (4); 3 – вариация таксономического своеобразия ∆* (5); 4 – индекс видового разнообразия Шеннона H×10; 5 – индекс доминирования Симпсона с учетом среднего таксономического расстояния CDm (2)
Fig. 2. Variation of indexes of the taxonomic diversity of macrobenthos communities from the river's Sok sources to its mouth: 1 – average taxonomic distinctness ∆+ (3); 2 – taxonomic diversity ∆ (4); 3 – variation of taxonomic distinctness ∆* (5); 4 – Shannon's index of species diversity H×10; 5 – Simpson's dominance index with taking into account an average taxonomic distances CDm (2)
По мере развития бентоценозов видовое богатство в верхнем течении р. Сок постепенно возрастает, достигая максимума на участке 4 (S = 100), после чего стабилизируется. На участках в верховьях реки 1–3 с песчано-галечным субстратом и относительно чистой водой наблюдается таксономически компактный видовой состав макрозообентоса, типичный для ритральных сообществ, а основную долю фаунистического разнообразия составляют литореофильные группы личинок амфибиотических насекомых Diptera, Ephemeroptera, Trichoptera. На участке 4 происходит некоторое изменение экоморф за счет развития эврибионтных видов. Далее на участках 5–6 под воздействием органического загрязнения и снижения содержания кислорода происходит коренная перестройка донного сообщества и ведущая роль переходит к различным по своим аутэкологическим характеристикам эвритопным и эвриоксибионтным таксонам. Наконец, на устьевом участке 9 под влиянием подпора вод Саратовского водохранилища происходит перераспределение ценотических ролей за счет развития лимнофильных моллюсков, пелофильных хирономид и ракообразных.
На фоне этих изменений для изученного водотока не наблюдается теоретическое «колоколообразное» изменение биологического разнообразия сообществ гидробионтов с максимумом в среднем течении, что традиционно предсказывается в рамках теории речного континуума (Vannote et al., 1980). В частности, индекс видового разнообразия Шеннона H какой-либо тенденции вообще не обнаруживает (рис. 2).
В то же время отмечается характерное возрастание по продольному градиенту водотока общего разнообразия систематических групп рангом выше вида, оцениваемого как по индексу среднего таксономического своеобразия ∆+, не зависящего от численности особей Ni, так и по индексам ∆ и ∆*, учитывающим относительное обилие видов pi. Это подтверждается также расчетом модели линейной регрессии на порядковый номер участка L, которая имеет высокий уровень значимости (p = 0.027 по перестановочному тесту, коэффициент корреляции r = 0.713): ∆+ = 52.3 + 2.45 L.
Важно отметить также локальное снижение таксономического разнообразия ∆ на участке 5, где в наибольшей мере имеет место антропогенное воздействие. Здесь отмечается характерный скачок доминирования отдельных видов, оцениваемый по индексу Симпсона – см. кривую CDm на рис. 2.
Последовательный рост таксономического разнообразия от истока к руслу может быть объяснен эффектом «вложенности» сообществ (nestedness), когда биоценозы, расположенные ниже по течению, претерпевают влияние со стороны вышерасположенных композиций видов и «наследуют» часть их видового богатства (Шитиков, Зинченко, 2011). Разумеется, многие виды, для которых новые экологические условия оказываются неприемлемыми, будут «выпадать» из сообщества, и индексы видового разнообразия при этом могут даже уменьшаться, но таксономическое дерево в естественных условиях по продольному профилю реки имеет очевидную тенденцию к разветвлению.
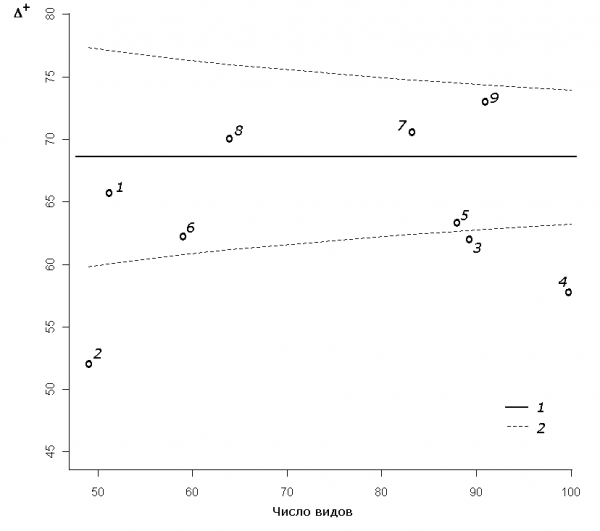
Для последовательности участков водотока была построена «туннельная» диаграмма (рис. 3), на которой представлены рандомизированное среднее ∆+m, кривые доверительных интервалов для 95%-й вероятности в зависимости от видового богатства S и облако рассеяния точек эмпирических значений ∆+ для отдельных участков. За пределами нижней доверительной границы Cl95 расположились индексы своеобразия для участков 2–4, что указывает на статистически значимое увеличение таксономического разнообразия биоценозов по продольному градиенту водотока.
Рис. 3. «Туннельная» диаграмма 95%-й вероятности для математического ожидания индекса таксономического своеобразия ∆+ в зависимости от числа видов на отдельных участках р. Сок: 1 – среднее значения индекса ∆+m; 2 – верхний и нижний пределы доверительного интервала Cl95
Fig. 3. The 95% probability funnels for population mean of index taxonomic distinctness ∆+ depending on the number of species on separate sites of the river Sok: 1 – average value of an index ∆+m; 2 – upper and lower confidential intervals Cl95
Заключение
Использование индексов таксономического разнообразия ∆ и своеобразия ∆+ является весьма интересной возможностью оценить структурную изменчивость биоценозов по продольному градиенту водотоков, что вносит элементы теоретической новизны в развитие концепции речного континуума. Индексы ∆ и ∆+ обладают хорошей чувствительностью и практически не зависят от выборочного усилия, в том числе, величины наблюдаемого видового богатства S и суммарной плотности гидробионтов N (Bevilacqua et al., 2009). Однако, несмотря на настойчивую рекламу (Clarke, Warwick, 1998), нам представляется не вполне убедительной необходимость дополнительно рассчитывать и анализировать индексы вариации Λ+ и ∆*, которые на нашем материале не вносят ничего нового в конечные выводы (см. рис. 2) и являются «излишней частностью Оккама».
Как и для любого иного индекса квадратичной формы, значительная доля энтропии Рао (1) формируется за счет небольшого количества слагаемых с высокими значениями pi. Так, для устьевого участка 9 ровно половина общего таксономического разнообразия ∆ связана только с 15 (т. е. 16 % от S) видами-доминантами семейства Chironomidae (Polypedilum nubeculosum, Chironomus nudiventris, Lipiniella araenicola, Chironomus agilis, Endochironomus albipennis, Tanytarsus sp, Cladotanytarsus mancus и др.), которые имеют одновременно высокие филогенетические различия с олигохетами семейства Nais.
Динамика изменения индексов разнообразия может сигнализировать о предполагаемой неоднородности видовой структуры сообществ или обозначить границы биотопов, однако не дает ответа, за счет каких конкретно экологических групп это произошло. Безусловно, по своей информативности диверситология, как любой метод, основанный на суммарных обобщенных показателях, уступает многомерным методам, использующим полное пространство видов.
В то же время методы оценки таксономического разнообразия активно развиваются. Например, общий подход к оптимизации мер Кларка – Уорвика был предложен с использованием концепции «филогенетической репрезентативности» (Plazzi at al., 2010). Авторы разработали алгоритм автоматической «подстройки» длины шага между двумя последовательными иерархическими уровнями пропорционально потере биологической вариативности (то есть уменьшению числа таксонов на каждом из них). Наконец, обобщение и генерализация мер таксономического разнообразия с использованием чисел Хилла была выполнена А. Чао с соавторами (Chao at al., 2010).
Библиография
Емельянов А. Ф., Расницын А. П. Систематика, филогения, кладистика // Природа. 1991. № 7. С. 26–37.
Жуков А. В. Экологическое разнообразие и таксономическая организация сообществ животных // Вісн. Дніпропетр. ун-ту. 2005. № 3/2. С. 96–104.
Зинченко Т. Д. Эколого-фаунистическая характеристика хирономид (Diptera, Chironomidae) малых рек бассейна Средней и Нижней Волги: Атлас. Тольятти: Кассандра, 2011. 258 с.
Ивантер Э. В. Биоразнообразие – история одного заблуждения // Принципы экологии. 2012. Т. 1. № 4. С. 61–64.
Левич А. П. Структура экологических сообществ. М.: Изд-во МГУ, 1980. 182 с.
Особенности пресноводных экосистем малых рек Волжского бассейна / Под редакцией Г. С. Розенберга, Т. Д. Зинченко.Тольятти: Кассандра, 2011. 322 с.
Павлинов И. Я. Морфологическое разнообразие: общие представления и основные характеристики // Сб. тр. Зоол. музея МГУ. 2010. Т. 49. С. 343–388.
Саймон Г. Науки об искусственном. М.: Мир, 1972. 147 с.
Чернов Ю. И. Природная зональность и животный мир суши. М.:Мысль. 1975. 222 с.
Шитиков В. К., Зинченко Т. Д. Анализ статистических закономерностей организации видовой структуры донных речных сообществ // Журн. общей биологии, 2011. Т. 72, № 5. С. 355–368.
Bevilacqua S., Fraschetti S., Terlizzi A., Boero F. The use of taxonomic distinctness indices in assessing patterns of biodiversity in modular organisms // Marine Ecology. 2009. V. 30. P. 151–163.
Chao A., Chiu C.-H., Jost L. Phylogenetic diversity measures based on Hill numbers // Philos. Trans. R. Soc. Lond. Ser. B – Biol. Sci. 2010. № 365. Р. 3599–3609.
Clarke K. R., Warwick R. M. A further biodiversity index applicable to species lists: variation in taxonomic distinctness // Mar. Ecol. Prog. Ser. 2001. V. 216. P. 265–278.
Clarke K. R., Warwick R. M. A taxonomic distinctness index and its statistical properties // J. Appl. Ecol. 1998. V. 35. P. 523–531.
Crozier R. H. Preserving the information content of species: genetic diversity, phylogeny, and conservation worth // Annu. Rev. Ecol. Syst. 1997. V. 28. P. 243–268.
Faith D. P. Conservation evaluation and phylogenetic diversity // Biol. Conserv. 1992. V. 61. P. 1–10.
Nanney D. L. No trivial pursuit // BioScience. 2004. V. 54. Р. 720–721.
Pielou E. C. Ecological Diversity. N. Y.: Wiley, 1975. 165 p.
Plazzi F., Ferrucci R. R., Passamonti M. Phylogenetic representativeness: a new method for evaluating taxon sampling in evolutionary studies // BMC Bioinformatics. 2010. V. 11. P. 209.
Rao C. R. Diversity and dissimilarity coefficients: a unified approach // Theor. Popul. Biol. 1982. V. 21. P. 24–43.
Ricotta C. Through the jungle of biological diversity // Acta Biotheor. 2005. V. 53. P. 29–38.
Shimatani K. On the measurement of species diversity incorporating species differences // Oikos. 2001. V. 93. P. 135–147.
Vane-WrightR. I., Humphries C. J., Williams P. M. What to protect: systematics and the agony of choice // Biol. Conserv. 1991. V. 55. P. 235–254.
Vannote R. L., Minshall G. W., Cummins K. W. et al. The river continuum concept // Canad. J. Fish. Aquatic Sci. 1980. V. 37. P. 130–137.
WarwickR. M., Clarke K. R. New ‘biodiversity’ measures reveal a decrease in taxonomic distinctness with increasing stress // Mar. Ecol. Prog. 1995. Ser. 129. P. 301–305.
Warwick R. M, Clarke K. R. Taxonomic distinctness and environmental assessment // J. Appl. Ecol. 1998. V. 35. P. 532–543.
Благодарности
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 07-04-96610) и в рамках программы Президиума РАН «Биологическое разнообразие» (раздел «Динамика биоразнообразия и механизмы обеспечения устойчивости биосистем»).





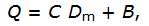
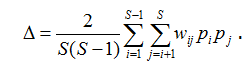

 © 2011 - 2026
© 2011 - 2026