Введение
Высокая устойчивость к дефициту кислорода у генотипически адаптированных к гипоксии млекопитающих обусловлена рядом физиологических и биохимических механизмов. В настоящее время по данному вопросу накоплен большой теоретический, экспериментальный и клинический материал (Storey, 1996; Галанцев и др., 1999; Лощагин и др., 2002; Hochachka, Somero, 2002; Wihelm Filho et al., 2002). Вместе с тем основное внимание уделяется морским млекопитающим, которые подвергаются периодической гипоксии-реоксигенации во время ныряния, в то время как обитающие на суше мелкие млекопитающие со сходной экологической специализацией практически не изучаются. Известно, что у мелких млекопитающих более интенсивный по сравнению с крупными удельный метаболизм и увеличенное потребление кислорода, что влечет за собой повышение риска образования избытка активных форм кислорода (АФК). Вместе с тем аллометрические зависимости между удельным метаболизмом и размерами тела нарушаются у высокоспециализированных видов (McNab, 2008). Для понимания механизмов адаптации организма к гипоксии многое могут дать исследования природно-адаптированных к дефициту кислорода животных (Галанцев, Камардина, Коваленко, 1994; Hochachka, Somero, 2002). Удобной моделью для изучения этих процессов могут служить мелкие полуводные (Томилин, 1977) и зимоспящие млекопитающие. К усиленной генерации АФК, разбалансировке между продукцией кислородных радикалов и антиоксидантной системой может приводить как дефицит кислорода (Hindle et al., 2009), так и его повышенное потребление непосредственно после ныряния (кислородная задолженность) (Vazques-Medina, Zenteno-Savin, Elsner, 2006; Cantu-Medellin et al., 2011) и при выходе из спячки (Breukelen, Martin, 2002); а сами периоды гипоксии и реоксигенации – к нарушению клеточных структур, как прямо через оксидативные модификации, так и опосредованно, через активацию воспалительных и проапоптических путей (Drew et al., 2004). Наряду с низкомолекулярными антиоксидантами в поддержании на стационарном уровне АФК участвуют антиоксидантные ферменты – супероксиддисмутаза (СОД) и каталаза.
В связи с этим целью нашего исследования явилось изучение состояния ферментативного звена антиоксидантной системы в печени, почках и сердце у мелких представителей двух отрядов млекопитающих – насекомоядных и грызунов, существенно различающихся по своим экологическим особенностям.
Материалы
Объектами исследования являлись представители отряда насекомоядных (Insectivora) и отряда грызунов (Rodentia). Материалами исследования служили образцы тканей печени, почек и сердца этих млекопитающих (табл. 1.). Крысы содержались в условиях вивария ПетрГУ, остальные животные отловлены в природе на Каскеснаволоцком стационаре Института биологии КарНЦ РАН в 2007–2011 гг.
Таблица 1. Характеристика экспериментальных животных
Table 1. Characteristic of the experimental animals
| Отряд | Вид | Анализируемые органы | ||
| печень | почки | сердце | ||
| Грызуны (Rodentia) | крыса (Rattus norvegicus Berk.) | 10 | 10 | 10 |
| полевка водяная (Arvicola terrestris L.) | 20 | 20 | 20 | |
| полевка-экономка (Microtus oeconomus Pall.) | 3 | 3 | НО | |
| полевка рыжая (Myodes glareolus Schreb.) | 4 | 11 | НО | |
| мышовка лесная (Sicista betulina Pall.) | 6 | 6 | 5 | |
| Насекомоядные (Insectivora) | крот обыкновенный (Talpa europaea L.) | 4 | 4 | 4 |
| водяная кутора (Neomys fodiens Pennant.) | 21 | 21 | 10 | |
| бурозубка обыкновенная (Sorex araneus L.) | 11 | 11 | НО | |
* Примечание: НО – определение активности в данном органе не проводилось.
* Comment: НО – the activity of antioxidant enzyme in this organ was not measured.
Методы
Исследования выполнены с использованием оборудования Центра коллективного пользования ИБ КарНЦ РАН. Гомогенаты органов и тканей готовили в 0.05 М фосфатном буфере (рН 7.0). После центрифугирования при 6000 g в течение 15 мин в супернатантах определяли активность ферментов и содержание белка. Активность ферментов определяли по оптической плотности раствора на спектрофотометре СФ-46: СОД – по модифицированной адренохромной методике (Misra, Fridovich, 1972), каталазы – по количеству разложенной перекиси водорода (Bears, Sizer, 1952) с учетом коэффициента молярной экстинкции – 43.6 (М/л). Активность каталазы выражали в мкМ перекиси водорода, разложенной за 1 минуту. За 1 усл. ед. активности СОД принимали количество фермента, способное затормозить реакцию автоокисления адреналина на 50 %. Активность ферментов рассчитывали на 1 г сырой ткани и 1 мг белка (удельная активность). Содержание белка определяли по Лоури (Lowry et al., 1951) с использованием бычьего сывороточного альбумина в качестве стандарта. Полученные данные обрабатывали общепринятыми методами вариационной статистики, сравнение проводили с применением непараметрического критерия Вилкоксона – Манна – Уитни и кластерного анализа с использованием компьютерной программы Statgrafics 2.0 (Коросов, Горбач, 2010).
Результаты
В рассматриваемой нами группе представлены млекопитающие, различающиеся как по систематической принадлежности, так и по особенностям экологических условий обитания. У изученных животных выявлены общие, свойственные и другим млекопитающим, закономерности распределения активности СОД и каталазы в органах (Marklund, Karlsson, 1990; Ilukha et al, 1998; Зенков, Ланкин, Меньщикова, 2001; Илюха, 2001): максимальная активность данных ферментов обнаружена, как правило, в печени, меньшая – в почках, и самая низкая – в сердце (рис. 1, 2). При исследовании представителей отрядов насекомоядных (Insectivora) и грызунов (Rodentia) выявлена высокая межвидовая вариабельность активности СОД в печени, почках и сердце (рис. 1А.). Активность СОД в печени была достоверно выше по сравнению с аналогичным показателем в почках и сердце у крысы и водяной полевки. У бурозубки обыкновенной и полевки рыжей максимальная активность данного фермента наблюдалась в почках, причем у последней она была достоверно выше, чем в печени.
Интересно, что у рыжей полевки активность других антиоксидантных ферментов, связанных с метаболизмом глутатиона (глутатионредуктазы, глутатионпероксидазы и глутатион-S-трансферазы), в печени более высокая, чем в почках (Swiergosz-Kowalewska, Bednarska, Kafel, 2006). При этом даже экспозиция к тяжелым металлам в естественной среде обитания не приводила к существенному изменению органоспецифичности распределения активности. По относительному весу почек рыжая полевка занимает в ряду изученных грызунов второе место (после лесной мышовки). Это характеризует рассматриваемый вид как один из наиболее подвижных, отличающихся высокой интенсивностью обменных процессов (Ивантер и др., 1985).
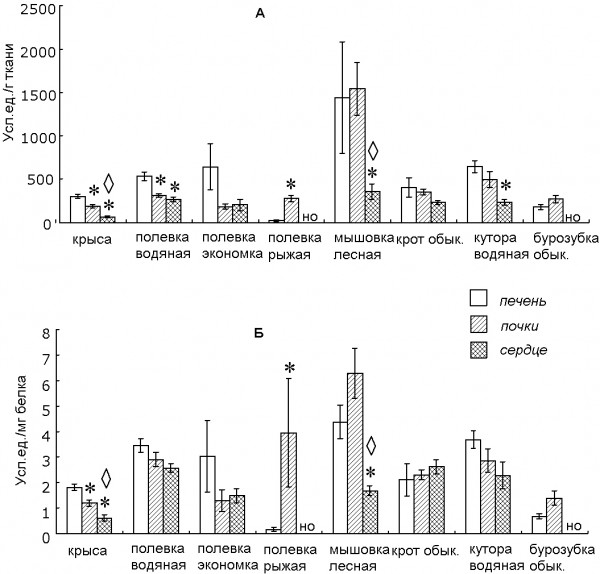
Рис. 1. Активность (А) и удельная активность (Б) СОД в печени, почках и сердце у млекопитающих: * – различия достоверны по сравнению с печенью; ◊ – различия достоверны по сравнению с почками (р < 0.05, критерий Вилкоксона – Манна – Уитни); НО – определение активности в данном органе не проводилось
Fig. 1. The activity (А) and specific activity (Б) of SOD in mammal’s liver, kidneys and heart: * – the differences are significant in comparison with the liver; ◊ – the differences are significant in comparison with the kidneys (р < 0.05, U-test); НО – the activity of antioxidant enzyme in this organ was not measured
Наибольшая удельная активность СОД наблюдалась в почках у зимоспящего вида – мышовки лесной, причем была достоверно выше, чем в сердце (рис. 1Б). При изучении зависимости уровня метаболизма от массы тела у шести впадающих в спячку млекопитающих (орешниковой сони (Muscardinus avellanarius), сони-полчка (Glis glis), суслика (Spermophilus citellus), хомяка (Cricetus cricetus), ежа (Erinaceus europaeus) и альпийского сурка (Marmota marmota)) было показано, что эта зависимость существует, но только до тех пор, пока животные находятся в активном состоянии (Singer et al, 1995). При гибернации уровень основного обмена у них одинаков и не зависит от массы тела. Перестройки, связанные с пробуждением, в наибольшей степени затрагивают более мелких животных, поскольку относительное увеличение метаболизма у них наиболее значительно (Singer et al, 1995). Показано, что на ранних стадиях пробуждения хомячков отмечается существенное увеличение активности каталазы в сыворотке крови, что обеспечивает дополнительный цитопротекторный эффект для различных органов (Hitomi et al, 2006). При этом авторы не уточняют источник фермента в сыворотке.
В нашем исследовании установлено, что активность каталазы и удельная активность у всех исследуемых видов в печени была выше, чем в почках, причем для крысы, полевки водяной, полевки рыжей, мышовки лесной, крота, куторы и бурозубки обыкновенной достоверно (рис. 2.).
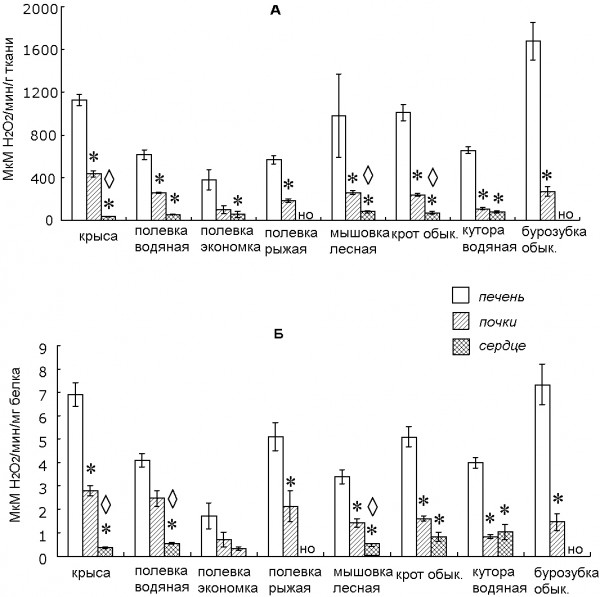
Рис. 2. Активность (А) и удельная активность (Б) каталазы в печени, почках и сердце у млекопитающих (условные обозначения – как на рис. 1)
Fig. 2. The activity (А) and specific activity (Б) of catalase in mammal’s liver, kidneys and heart (аll other shorthands as in Fig. 1)
Наибольшая активность каталазы среди всех исследуемых видов наблюдалась в печени у бурозубки обыкновенной, причем её абсолютные значения у этого вида были в 2 раза выше, чем у куторы водяной (рис. 2А). Возможно, это связано с тем, что у бурозубок уровень метаболизма в 2-3 раза выше, чем у других млекопитающих того же размера (Nagel, 1985). Наименьшая активность каталазы наблюдалась в тканях сердца крысы, полевки-экономки и водяной полевки (рис. 2Б).
Среди изученных грызунов по относительной величине сердца и почек выделяется мышовка лесная, обладающая высокой двигательной активностью и общей сложностью движений (Маринина, 1976). Максимальная активность СОД наблюдалась у мышовки в почках, причем достоверно выше по сравнению с другими изученными видами (рис. 1А). Важной особенностью данного вида является то, что это единственный в таежной зоне представитель надсемейства тушканчикообразных (Dipodoidea), обитающий значительно севернее своих сородичей. Специфику лесной мышовки, в сравнении с другими мелкими млекопитающими Карелии, составляет целый комплекс черт, в частности переживание неблагоприятного периода года в состоянии спячки и относительно низкие темпы размножения. Мелкие зимоспящие – это млекопитающие, уникальные в плане адаптации к функционированию при низких температурах тела. У них происходит резкое снижение температуры (до 0 ºС) во время спячки и быстрое повышение ее в период пробуждения (до 37 ºС). Какие физиолого-биохимические механизмы позволяют этим животным сохранять нормально функционирующее сердце, клеточную целостность и энергетический баланс со снижением температуры тела и избегать нарушений при отогревании, до сих пор не ясно (Dark, 2005; Epperson et al, 2011).
В природе животные сталкиваются не с одним, а с целым рядом воздействующих на них факторов (Шмидт-Ниельсен, 1982; Hochachka, Somero, 2002). В результате у животных формируются адаптации. В рассматриваемой нами группе представлены млекопитающие, различающиеся как по систематической принадлежности, так и по особенностям экологических условий обитания. Из исследуемых видов животных четыре можно отнести к тем, которые в той или иной степени испытывают выраженную гипоксию: околоводные млекопитающие – полевка водяная и кутора (испытывают функциональную нагрузку на организм, связанную с дефицитом кислорода при нырянии); ведущий подземно-роющий образ жизни крот обыкновенный и обладающая способностью впадать в зимнюю спячку мышовка лесная. Интересно изучение антиоксидантной системы у данных видов, так как эти животные подвергаются периодической гипоксии и реоксигенации, что приводит не только к анатомо-морфологическим и физиологическим, но и к биохимическим перестройкам.
Результаты кластерного анализа не выявили существенного влияния систематической принадлежности, массы тела и экологических особенностей на активность антиоксидантных ферментов в печени и почках у исследуемых животных (рис. 3). Так, наибольшим сходством по активности СОД и каталазы в данных органах обладали крот обыкновенный и лесная мышовка, что связано с экологическими особенностями этих животных, а именно – адаптацией к подземно-роющему образу жизни первого и способности впадать в зимнюю спячку второй. В то же время такие виды, как полевка водяная и кутора водяная, несмотря на их околоводный образ жизни, кластер не образовали (рис. 3А). Влияние систематической принадлежности на активность СОД и каталазы в печени и почках было незначительно. Так, в один кластер вошли крот обыкновенный, кутора водяная, бурозубка обыкновенная – представители насекомоядных (Insectivora), а также зимоспящий представитель отряда грызунов (Rodentia) – мышовка лесная (рис. 3В). Известно, что к периоду гибернации животные накапливают много ненасыщенных жиров. Увеличение количества ненасыщенных жирных кислот, наряду с усиленным потреблением кислорода при полном пробуждении от спячки и во время баутов, является одной из проблем, которую животные вынуждены решать на физиолого-биохимическом уровне (Dark, 2005). Перестройки метаболизма у зимоспящих затрагивают прежде всего сердце, в связи с переключением энергообеспечения с углеводов как основного источника энергии на жиры. Гликолиз приводит к накоплению лактата и к закислению среды, что может увеличивать и нагрузку на почки (Breukelen, Martin, 2002).
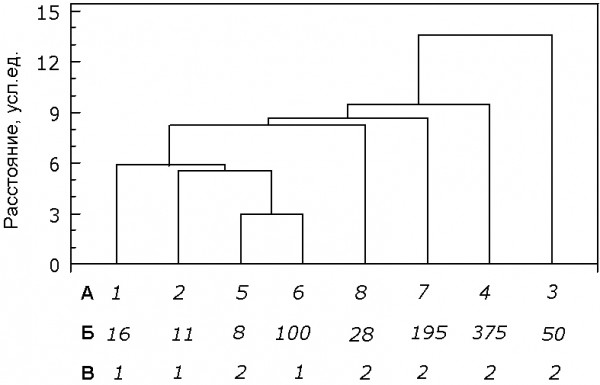
Рис. 3. Дендрограмма сходства изученных видов по показателям активности антиоксидантных ферментов в печени и почках:
в строке А : 1 – кутора водяная, 2 – бурозубка обыкновенная, 3 – полевка-экономка, 4 – крыса, 5 – мышовка лесная, 6 – крот обыкновенный, 7 – полевка водяная, 8 – полевка рыжая; в строке Б – средняя масса тела, г; в строке В: 1 – представители отряда насекомоядных, 2 – представители отряда грызунов
Fig. 3. The tree of species similarity based on the antioxidant enzymes activity in the liver and kidneys:
line А: 1 – Eurasian water shrew, 2 – Common shrew, 3 – Tundra vole, 4 – White rat, 5 – Northern Birch Mouse, 6 – European mole, 7 – European water vole, 8 – Bank vole; line Б – mean body mass; line В: 1 – Insectivora, 2 – Rodentia
Нами выявлено влияние экологических особенностей вида на активность СОД и каталазы в сердце. В результате анализа выделилось 2 группы, в одну из которых вошли виды, испытывающие гипоксию (кутора, полевка водяная, крот обыкновенный и мышовка лесная), в другую – крыса и полевка-экономка (рис. 4). Было отмечено, что наиболее высокая удельная активность СОД и каталазы в сердце наблюдалась у млекопитающих первой группы.
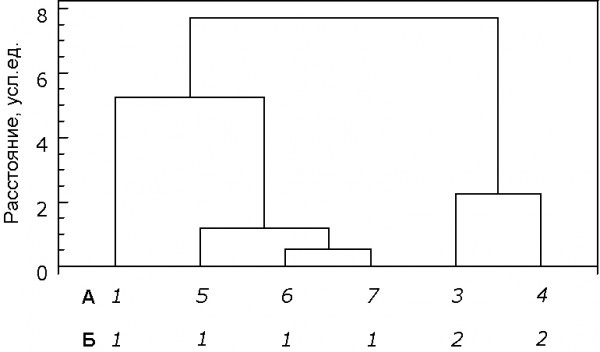
Рис. 4. Дендрограмма сходства изученных видов по показателям активности антиоксидантных ферментов в сердце:
в строке А: 1 – кутора водяная, 3 – полевка-экономка, 4 – крыса, 5 – мышовка лесная, 6 – крот обыкновенный, 7 – полевка водяная; в строке Б: 1 – виды, испытывающие гипоксию; 2 – виды, не испытывающие гипоксию
Fig. 4. The tree of species similarity based on the antioxidant enzymes activity in the heart:
line А: 1 – Eurasian water shrew, 3 – Tundra vole, 4 – White rat, 5 – Northern Birch Mouse, 6 – European mole, 7 – European water vole; line Б: 1 – species naturally not experiencing hypoxia, 2 – species naturally not experiencing hypoxia
Обсуждение
Хорошо известно, что у морских животных, адаптированных к нырянию, происходят перестройки во всех органах, однако наиболее существенны они в сердце, легких и мозге, которые продолжают оставаться на аэробном режиме метаболизма даже в условиях анаэробиоза (Шмидт-Ниельсен, 1982; Hochachka, Somero, 2002). В наших исследованиях именно в сердечной мышце у куторы отмечается более высокая удельная активность СОД и каталазы (рис. 1, 2). В большинстве случаев адаптация к полуводному образу жизни (нырянию) не ограничивается только морфологическими или физиологическими изменениями, а затрагивает в том числе и биохимический уровень (Галанцев, 1977; Hochachka, Somero, 2002). Для всех ныряющих животных характерно резкое замедление сердечной деятельности при погружении (Галанцев, 1977). К настоящему времени описана брадикардия при нырянии как у высокоспециализированных ныряющих животных, так и полуводных видов. Замедление сердечной деятельности приводит к уменьшению обеспечения большинства тканей кислородом, т. е. к гипоксии. Сама по себе гипоксия, также как и метаболические сдвиги, способна приводить к продукции избытка кислородных радикалов, превышающего возможности обычной антиоксидантной защиты (Elsner et al., 1998). Поток электронов через дыхательную цепь у ныряльщиков, возможно, более высоковариабелен, чем у сухопутных млекопитающих, так как ныряльщики функционируют и в условиях гипоксии. Влияние гипоксии на скелетную мышцу в этом плане не изучено, однако при исследовании эффекта на гепатоциты и кардиомиоциты in vitro показано, что существенно повышается уровень супероксидного радикала. Высокая активность АОФ у полуводных млекопитающих является не только приспособительной реакцией, обеспечивающей защиту органов и тканей при реоксигенации, связанной с восстановлением после ныряния, но, очевидно, и необходимым условием для выработки дополнительного кислорода в результате разложения перекиси водорода. Авторами проверялась гипотеза о том, что для предотвращения отрицательных последствий усиленной генерации АФК и толерантности к повторяющимся циклам ишемии-реперфузии, связанной с нырянием, ткани кольчатой нерпы (Phoca hispida) должны обладать увеличенной активностью антиоксидантных ферментов. Сравнение проводили с теми же показателями у свиньи (Sus scrofa). Эффективная защита каждого из органов обеспечивалась за счет своего набора ферментов: сердца – СОД, глутатионпероксидазы и глутатионредуктазы; печени – за счет каталазы; скелетной мускулатуры – глутатионпероксидазы; легких – СОД и глутатионпероксидазы (Vazquez-Medina, Zenteno-Savin, Elsner, 2006). Кроме этого, у ныряющих млекопитающих, по сравнению с сухопутными, отмечается значительное накопление гликогена в печени и других тканях, а также ряд биохимических адаптаций, связанных с процессами брожения (Шмидт-Ниельсен, 1982; Hochachka, Somero, 2002). Повышенное потребление кислорода непосредственно после ныряния (кислородная задолженность) у полевки водяной и куторы, при пробуждении и выходе из спячки у мышовки лесной также может приводить к усиленной генерации АФК, для утилизации которых, очевидно, и необходима более высокая активность АОФ. При этом у животных, испытывающих состояние гипоксии-реоксигенации, поддерживается высокий базальный уровень активности этих ферментов (Hermes-Lima, Zenteno-Savin, 2002), что предотвращает нарушение клеточных структур – как прямо через оксидативные модификации, так и опосредованно, через активацию воспалительных и проапоптических путей – и является своеобразной преадаптацией.
Заключение
В результате исследования была выявлена ткане- и видоспецифичность активности антиоксидантных ферментов в органах восьми изученных видов мелких млекопитающих. Несмотря на то, что исследуемые виды относились к различным отрядам и экологическим группам, межорганное распределение по активности СОД и каталазы было сходным: максимальная активность наблюдалась в печени, минимальная – в сердце. Аналогичное распределение активности антиоксидантных ферментов у млекопитающих отмечают и другие авторы (Marklund, Karlsson, 1990; Илюха, 2001; Зенков, Ланкин, Меньщикова, 2001). Нами не было отмечено связи между изученными биохимическими показателями (активность антиоксидантных ферментов) в печени и почках представителей отрядов насекомоядных и грызунов и их систематической принадлежностью, экологическими особенностями и массой тела. В целом проведенные сравнительные исследования показывают специфический профиль антиоксидантной системы в сердце (существенное увеличение активности каталазы) у подвергающихся периодической гипоксии-реоксигенации видов (кутора, полевка водяная, крот обыкновенный и мышовка лесная), что может быть связано и с важной сигнальной ролью перекиси водорода в кровеносной системе (Droge, 2002).
Библиография
Галанцев В. П. Эволюция адаптаций ныряющих животных. Эколого- и морфофизиологические аспекты. Л.: Наука, 1977. 191 с.
Галанцев В. П., Камардина Т. А., Коваленко Р. И. Реакции сердечно-сосудистой системы и биоэнергетический метаболизм в связи с адаптацией к апноэ // Физиол. журн. им. И. М. Сеченова. 1994. Т. 80, № 9. С. 117–123.
Галанцев В. П., Коваленко Р. И., Криворучко Б. И. и др. К вопросу об особенностях толерантности к дефициту кислорода у неадаптированных и адаптированных к водному образу жизни грызунов // Журн. эволюц. биохимии и физиологии. 1999. Т. 35, №1. С. 43–47.
Зенков Н. К., Ланкин В. З., Меньщикова Е. Б. Окислительный стресс: Биохимический и патофизиологический аспекты. М.: Наука/Интерпериодика, 2001. 343 с.
Ивантер Э. В., Ивантер Т. В., Туманов И. Л. Адаптивные особенности мелких млекопитающих: эколого-морфологические и физиологические аспекты. Л.: Наука. 1985. 318 с.
Илюха В. А. Супероксиддисмутаза и каталаза в органах млекопитающих различного экогенеза // Журн. эволюц. биохимии и физиологии. 2001. Т. 37, № 3. С. 183–186.
Коросов А. В, Горбач В. В. Компьютерная обработка биологических данных. Петрозаводск: ПетрГУ, 2010. 84 с.
Лощагин О. В., Коваленко Р. И., Ноздрачев А. Д. и др. Возможная роль каталазы в адаптации к нырянию полуводных грызунов (Ondatra Zibethica) // Журн. эволюц. биохимии и физиологии. 2002. Т. 38, №1. С. 71–75.
Маринина Л. С. Зависимость между размерами тела и относительным весом сердца у хомякообразных и тушканчиков. // Экология. 1976, №6. С. 91–92.
Томилин А. Г. Снова в воду: биологический очерк об околоводных, полуводных и водных млекопитающих. М.: Знание, 1977. 144 с.
Шмидт-Ниельсен К. Физиология животных. Приспособление и среда. : Пер. с англ. / Под ред. Е.М. Крепса. М.: Мир, 1982. Кн. 1. 414 с.
Bears R. F., Sizes I. N. A spectral method for measuring the breakdown of hydrogen peroxide by catalase // J. Biol. Chem. 1952. Vol. 195. P. 133–140.
Breukelen F., Martin S. L. Invited Review: Molecular adaptations in mammalian hibernators: unique adaptations or generalized responses? // J. Appl. Physiol. 2002. Vol. 92. Р. 2640–2647.
Cantu-Medellin N., Byrd B., Hohn A., Vazquez-Medina J. P., Zenteno-Savin T. Differential antioxidant protection in tissues from marine mammals with distinct diving capacities. Shallow/short vs. deep/long divers. // Comparative Biochemistry and Physiology. 2011. Vol. 158. Р. 438–443.
Dark J. Annual lipid cycles in hibernators // Ann. Rev. Nutr. 2005. Vol. 25. Р. 469–97.
Drew K. L., Harris M. B, Laмanna J. C. et al. Hypoxia tolerance in mammalian heterotherms // Am. J. Exp. Biol. 2004. Vol. 207. Р. 3155–3162.
Droge W. Free Radicals in the Physiological Control of Cell Function // Physiol. Rev. 2002. Vol. 82. P. 47–95.
Elsner R., Oyaseter S., Almaas R., Saugstad O. D. Diving seals, ischemia-reperfusion and oxygen radicals // Comp. Biochem. Physiol. 1998. Vol. 119A, № 4. Р. 975–980.
Epperson M. E., Karimpour-Fard A., Hunter L. E. and Sandra L. Metabolic cycles in a circannual hibernator // Physiol. Genomics. 2011. Vol. 43. Р. 799–807.
Hermes-Lima M., Zenteno-Savin T. Animal response to drastic changes in oxygen availability and physiological oxidative stress // Comp. Biochem. Physiol. 2002. Vol. 133. Р. 537–556.
Hindle A. G., Lawler J. M., Campbell K. L., Horning M. Muscle aging and oxidative stress in wild-caught shrews // Comparative Biochemistry and Physiology. 2009. Vol. 155. 427–434.
Hitomi O., Okamoto I., Hanaya T., Arai S., Ohta T., Fukuda S. Enhanced antioxidant defense due to extracellular catalase activity in Syrian hamster during arousal from hibernation // Comparative Biochemistry and Physiology. 2006. Vol. 143. Р. 484–491.
Hochachka P. W., Somero G. N. Biochemical adaptation: mechanisms and process in physiological evolution. N. Y.: Oxford University Press, 2002. 466 p.
Ilukha V. A., Kozhevnikova L. K., Tyutyuimik N. N., Unzhakov A. R., Meldo H. I. Activity of antioxidant enzyme and the LDH isoenzyme spectrum in organs of mink with Aleutian disease // Scientifur. 1998. Vol. 22, № 4. P. 309–314.
Lowry O. H., Rosenbrough N. J., Farr A. L., Randan R. J. Protein measurement with the Folin phenol reagent // J. Biol. Chem. 1951. Vol. 193. P. 265–275.
Marklund S. L., Karlsson K. Extracellular-superoxide dismutase, distribution in the body and therapeutic implications // Antioxidants in Therapy and Preventive Medicine. N. Y.: Plenum Press. 1990. Р. 1–4.
McNab B. K. An analysis of the factors that influence the level and scaling of mammalian BMR // Comp. Biochem. Physiol. 2008. Vol. 151. Р. 5–28.
Misra H. P., Fridovich I. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase // J. Biol. Chem. 1972. Vol. 247. P. 3170–3175.
Nagel A. Sauerstoffverbrauch, Temperaturregulation und Herzfrequenz bei europaischen Spitzmаusen (Soricidae) // Z. Saugetierkunde. 1985. Vol. 50. Р. 249–266.
Storey K. B. Oxidative stress: animal adaptations in nature // Braz. J. Med. Biol. Res. 1996. V. 29. P. 1715–1733.
Singer D., Schunck O., Bach F. and Kuhn H. J. Size effects on metabolic rate in cell, tissue, and body calorimetry. // Thermochim. Acta. 1995. Vol. 251. Р. 227–240.
Swiergosz-Kowalewska R., Bednarska A., Kafel A. Glutathione levels and enzyme activity in the tissues of bank vole Clethrionomys glareolus chronically exposed to a mixture of metal contaminants // Chemosphere. 2006. Vol. 65. Р. 963–974.
Vazquez-Medina J. P., Zenteno-Savin T., Elsner R. Antioxidant enzymes in ringed seal tissues: Potential protection againstdive-associated ischemia/reperfusion // Comparative Biochemistry and Physiology. 2006. Vol. 142. Р. 198–204.
Wilhelm Filho W. D., Sell F., Ribeiro L., Ghislandi M., Carrasquedo F., Fraga C.G., Wallauer J. P., Simões-Lopes P. C., Uhart M. M. Comparison between the antioxidant status of terrestrial and diving mammals // Comp. Biochem. Physiol. 2002. Vol. 133, № 3. P. 885–892.
Благодарности
Работа выполнена при финансовой поддержке гранта Президента НШ-1642.2012.4 и ФЦП ГК № 02.740.11.0700.






 © 2011 - 2026
© 2011 - 2026