Введение
Креветки рода Sclerocrangon, известные в русскоязычной литературе как шримсы-медвежата, являются десятиногими ракообразными (Decapoda), входящими в состав арктических морских экосистем. Эти виды встречаются в бентосных сообществах, где служат пищевым ресурсом для рыб (например, трески, камбалы) и морских млекопитающих, а также участвуют в регуляции численности некоторых донных беспозвоночных (Кузнецов, 1964; Соколов, 2003; Zimina et al., 2015). Экологическая значимость Sclerocrangon дополнительно подчеркивается чувствительностью их личиночных стадий к температурным колебаниям, что делает их удобным объектом для изучения реакции гидробионтов на изменения среды (Thorson, 1950; Berge et al., 2009).
В Баренцевом море и сопредельных водах распространены два вида шримсов-медвежат: Sclerocrangon boreas и S. ferox (Кузнецов, 1964). Оба вида относятся к циркумполярным высокобореально-арктическим формам, чье распределение тесно связано с холодными арктическими водными массами (Соколов, 2003; Zimina et al., 2015; Зимина, 2021). Согласно исследованиям Я. М. Веславского (Weslawski, 1987), S. boreas и S. ferox служат биоиндикаторами атлантических и арктических вод соответственно, что отражает их экологические ниши: S. boreas тяготеет к зонам смешения вод с умеренной соленостью (32–34 ‰), тогда как S. ferox приурочен к стабильно холодным (-1–2 °C) и высокосоленым (34–35 ‰) акваториям.
Ранее исследования фауны Decapoda Баренцева моря фокусировались на таксономии и общем распределении видов (Кузнецов, 1964; Петряшев, 2002а, б; Соколов, 2003), однако данные о пространственной динамике в контексте климатических изменений остаются ограниченными. Совместные российско-норвежские экосистемные съемки, проводимые с 2004 г., предоставляют такую возможность для анализа современных тенденций и прогностического моделирования (Jørgensen et al., 2015). Цель работы – проанализировать современное распределение шримсов-медвежат (S. boreas и S. ferox) в Баренцевом море, выявить их экологические предпочтения и оценить их реакцию на атлантификацию региона к концу XXI в.
Для достижения поставленной цели была предпринята попытка статистически связать массив данных по встречаемости креветок рода Sclerocrangon с информационным массивом океанографических и биоклиматических данных для Баренцева моря, полученных как для настоящего периода 2004–2023 гг., так и с помощью сценарных прогнозов на основе глобальных климатических моделей CMIP6 для периода 2025–2100 гг. (Assis et al., 2024). В качестве инструмента исследования был выбран ансамблевый подход моделирования распределения видов SDM (species distribution model), объединяющий несколько алгоритмов, в т. ч. машинного обучения. Ансамблевый подход, объединяющий в данной работе 11 алгоритмов пространственно-временной оценки, минимизирует неопределенности, связанные с выбором единичной модели, и повышает точность прогнозов за счет усреднения результатов. В морских экосистемах, где сбор данных осложнен логистическими и техническими ограничениями, такой подход позволяет эффективно использовать фрагментарные данные съемок, спутникового мониторинга и климатических реконструкций (Siders et al., 2020). Например, связывая температурные градиенты, соленость и продуктивность вод с встречаемостью десятиногих ракообразных, SDM выявляет критические пороговые значения параметров, определяющие границы их экологических ниш (Баканев, 2015; Goulet et al., 2022; Liu et al., 2022; Nephin et al., 2023).
Материалы
Район исследований включал акваторию Баренцева моря и сопредельных вод и был ограничен координатами 5–65° в. д. и 68–82° с. ш., а его площадь составила около 2.8 млн км2. В качестве текущих и прогнозируемых факторов среды были использованы данные веб-портала Bio-ORACLE, полученные с использованием моделей общей циркуляции атмосферы и океана (Assis et al., 2024). Репозиторий предоставляет 26 слоев физических, химических, биологических и топографических морских данных с глобальным покрытием и равномерной системой координат с пространственным разрешением 0.05 градуса и временным десятилетним шагом с 2000 по 2100 г. 19 основных физических, химических и биологических переменных представлены в виде 6 наборов данных, которые соответствуют сценариям общего социально-экономического пути SSP (Shared Socio-Economic Pathways; Frame et al., 2018) на 2020–2100 гг., выполненных с помощью климатической модели CMIP6 (Coupled Model Intercomparison Project Phase 6; Eyring et al., 2016).
В работе рассматривается текущее и потенциальное распределение двух видов креветок рода Sclerocrangon в Баренцевом море с учетом трех сценариев изменения климата. Первый сценарий, SSP1-1.9, отражающий «устойчивое развитие» с минимальным антропогенным воздействием (включая переход к низкоуглеродной экономике), характеризуется наименьшим потеплением – средний рост температуры придонных вод в регионе составит +0.46 °C. Однако текущие социально-экономические тренды снижают вероятность реализации данного сценария. Второй, промежуточный сценарий, SSP2-4.5, предполагает умеренные темпы экономического роста без радикальных мер по декарбонизации. При таком развитии глобальное повышение температуры с вероятностью >66 % превысит порог +2 °C к 2100 г. Третий сценарий, SSP5-8.5, соответствует инерционному развитию с интенсивным использованием ископаемого топлива, что приведет к экстремальному потеплению: прогнозируемый рост глобальной температуры к концу столетия достигнет +4.3 °C (±0.7 °C) (Notz, 2020). Данная модель рассматривается как наихудший, но эмпирически значимый сценарий для оценки экологических рисков.
Встречаемость S. boreas и S. ferox в Баренцевом море и сопредельных водах оценивалась по данным Полярного филиала ФГБНУ «ВНИРО», полученных в ходе комплексных российско-норвежских летних экосистемных съемок в 2004–2023 гг. (рис. 1). Ежегодные экосистемные съемки проводились по стандартной методике в летне-осенний период и охватывали большую часть акватории Баренцева моря на площади в среднем около 1500 тыс. км2 (Eriksen et al., 2018). Каждая съемка проводилась одновременно 4–5 судами. Сбор материала осуществляли донным тралом Campelen с горизонтальным раскрытием 15 м, вертикальным – 6 м и вставкой в кутовой части из дели с ячеей 22 мм. Количество донных тралений, выполненных за съемку, варьировало от 311 до 649. Всего было проанализировано 8033 траления, выполненных в 20 рейсах на всей исследованной акватории. Океанографические наблюдения в ходе съемок выполнялись, как правило, с помощью океанографического зонда SBE 19 Plus фирмы SeaBird Electronics. Океанографические условия (температуру и соленость) изучали в толще воды от поверхности до дна. В процессе исследований океанографические станции сопровождали постановку каждой траловой станции.
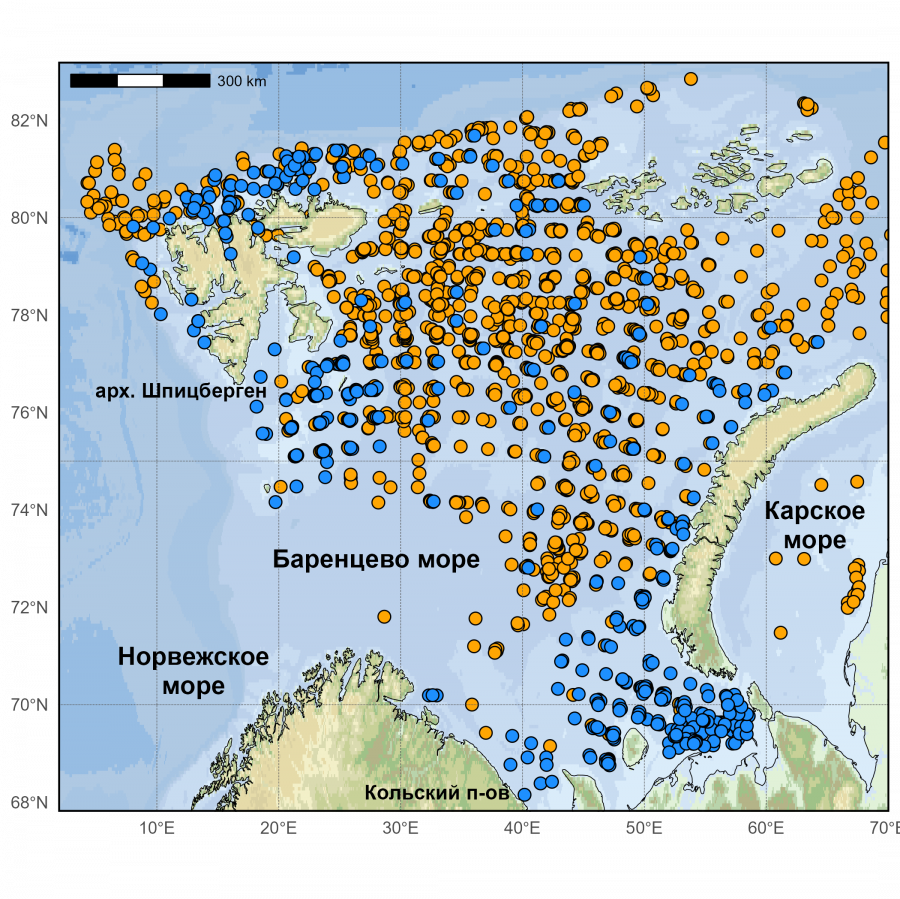
Рис. 1. Места поимок Sclerocrangon boreas (синие точки) и S. ferox (оранжевые точки) по данным экосистемных съемок в Баренцевом море и прилегающих водах в 2004–2023 гг.
Fig. 1. Capture sites of Sclerocrangon boreas (blue dots) and S. ferox (orange dots) according to ecosystem surveys in the Barents Sea and adjacent waters in 2004-2023.
В ходе съемок было идентифицировано 16845 экз. S. boreas из 413 тралений и 43567 экз. S. ferox из 1718 тралений. Кроме того, в работе использованы данные по встречаемости этих видов, находящиеся в открытом доступе на репозиториях AQUAMAPS (https://www.aquamaps.org/) и норвежского банка данных о биоразнообразии (https://artskart.artsdatabanken.no/#map/).
Методы
Предварительный анализ подходящей среды обитания включал оценку доли (%) объясненной дисперсии частоты встречаемости вида параметрами среды с использованием аддитивных обобщенных моделей (GAM) и построением кривых вероятности встречаемости креветок Sclerocrangon в зависимости от факторов среды, как взятых из репозитория Bio-ORACLE, так и полученных на основе собственных измерений температуры, солености и глубины в ходе экосистемных съемок. Кривые вероятности встречаемости шримсов-медвежат в зависимости от наиболее значимых факторов визуализировались с помощью библиотеки R: visreg (Breheny, Burchett, 2017). Чтобы при построении моделей избежать эффекта коллинеарности, в расчетах учитывалась коррелированность биоклиматических данных, и в конечных расчетах отбирались несколько базовых переменных с минимальным уровнем фактора инфляции дисперсии (VIF) (Guisan et al., 2017).
Для оценки текущего и потенциального распределения креветок, а также анализа факторов среды, влияющих на это распределение, было использовано ансамблевое моделирование семейства картографических моделей распределения вида (species distribution model; SDM), реализованных в библиотеке R: Biomod2 (Thuiller, 2003). Модели оценивались с использованием 100-кратной перекрестной проверки (cross-validation) и случайного разделения данных на обучающие (70 %) и тестовые (30 %) данные для калибровки и тестирования, что позволяло оценить точность модели и эффективность прогнозирования с использованием внутренних и внешних данных (Мастицкий, Шитиков, 2014). Эффективность моделей оценивалась с использованием AUC (area under receiver operating characteristic (ROC) curve; площадь под ROC-кривой) – непараметрического иерархического инструмента, используемого для оценки прогнозной способности модели (Fielding, Bell, 1997). Модели с AUC более 0.7 были включены и объединены в окончательные ансамблевые модели (Hosmer, Lemeshow, 2000). Ансамблевые модели для оценки потенциального распределения креветок оценивались с использованием той же статистики, что и отдельные модели: AUC, TSS (True Skill Statistics или критерий Пирса-Обухова (Киктев и др., 2021; Allouche et al., 2006)), чувствительность (доля правильно идентифицированных истинных положительных результатов) и специфичность (доля правильно определенных истинных отрицательных результатов) (Pearson, 2007).
Функциональные взаимосвязи между предикторами окружающей среды и вероятностью потенциального распределения гидробионтов были дополнительно изучены с использованием анализа важности переменных и графиков влияний факторов. В качестве оценки влияния того или иного фактора на распределение гидробионта использована мера относительной важности каждой переменной, полученная с помощью процедуры пермутации (Fisher, 1935). Суть метода состоит в анализе корреляционной связи между прогнозными значениями двух вариантов модели: с обычным набором независимых переменных и при замещении исследуемой переменной ее рандомизированным аналогом. При этом, чем ниже корреляция, тем выше влияние исследуемой переменной, и наоборот (Mielke, Berry, 2001). Площадь распространения вида рассчитывали на акватории с вероятностью встречаемости вида более 50 % (Иоганзен, Файзова, 1978)
Визуализация и анализ данных производились в среде R с помощью библиотек: biomod2, ggOceanMaps, ggplot2, ggspatial, marmap, mgcv, sf, stars, tidyverse, tmap, rnaturalearth, visreg.
Результаты
Анализ взаимосвязи распределения шримсов-медвежат (S. boreas и S. ferox) с параметрами среды, выполненный с использованием обобщенных аддитивных моделей (GAM), выявил значимые различия в экологических предпочтениях видов. Для S. boreas ключевыми факторами, объясняющими 25.36 % дисперсии, стала глубина, что свидетельствует о его приуроченности к относительно мелководным участкам. Вторым по значимости параметром оказался размах температурного диапазона (19.78 %), отражающий толерантность вида к значительным сезонным термическим колебаниям на мелководьях. Существенный вклад также внесли соленость (18.62 %) и минимальная температура самого холодного месяца (16.51 %), что подтверждает адаптацию S. boreas к устойчиво холодным водам с умеренной соленостью, характерным для арктических водных масс (табл. 1).
Таблица 1. Доля (%) объясненной дисперсии, рассчитанная на основе встречаемости S. boreas и S. ferox в зависимости от параметров среды в Баренцевом море по данным экосистемных съемок 2004–2023 гг.
| Факторы / вид | S. boreas | S. ferox |
| Фактическая придонная температура, °C | 1.02 | 21.7 |
| Максимальная температура самого теплого месяца, °C | 2.91 | 21.44 |
| Минимальная температура самого холодного месяца, °C | 16.51 | 17.57 |
| Максимальная температура, °C | 3.72 | 20.97 |
| Средняя температура, °C | 3.50 | 18.27 |
| Минимальная температура, °C | 3.72 | 20.97 |
| Размах температурного диапазона, °C | 19.78 | 6.19 |
| Глубина, м | 25.36 | 4.97 |
| Дистанция до берега, км | 13.74 | 14.99 |
| Концентрация кислорода, ммоль/м³ | 16.85 | 9.35 |
| Ледовитость, % | 14.13 | 15.33 |
| Концентрация нитратов, ммоль/м³ | 13.53 | 14.86 |
| Концентрация фосфатов, ммоль/м³ | 13.65 | 7.10 |
| Первичная продукция, ммоль/м³ | 11.28 | 14.94 |
| Соленость, ‰ | 18.618 | 4.84 |
| pH | 15.24 | 7.19 |
| Коэффициент диффузного ослабления света (Kd, м⁻¹) | 8.52 | 22.51 |
Для S. ferox доминирующими факторами стали коэффициент диффузного ослабления света (Kd), связанный с прозрачностью воды и проникновением фотосинтетически активной радиации, и фактическая придонная температура, что указывает на чувствительность вида к термическому режиму. Высокая значимость максимальной температуры самого теплого месяца (21.44 %) и ледовитости (15.33 %) подчеркивает роль летнего прогрева и сезонной динамики льдов в формировании его ареала.
Корреляционный кластер, включающий придонную температуру, ледовитость и концентрацию биогенов, объясняется совместным воздействием адвекции атлантических вод (перенос тепла течениями) и солнечного прогрева. Параметры с низким вкладом (например, дистанция до берега – 13.74 % для S. boreas) могут на первый взгляд отражать вторичную роль пространственных факторов по сравнению с гидрохимическими и термическими условиями.
Анализ данных моделирования выявил выраженные различия в экологических предпочтениях S. boreas и S. ferox. Для S. ferox ключевым фактором стала придонная температура: вероятность встречаемости достигает пика (39 %) при температурах от -1 до 0 °C, но резко снижается при прогреве выше 4 °C (рис. 2А). Напротив, S. boreas демонстрирует умеренную зависимость от температуры с максимумом встречаемости (9.7 %) при 1.1–1.6 °C, что соответствует зонам смешения арктических и атлантических вод. Батиметрическая приуроченность видов также различается. S. boreas тяготеет к мелководным участкам (25–150 м) в радиусе 0–150 км от береговой линии, где вероятность его встречаемости достигает 61 % (рис. 2Б). Для S. ferox оптимальны глубины 100–300 м (26 % вероятности), что коррелирует с его распространением в северо-восточной части Баренцева моря.
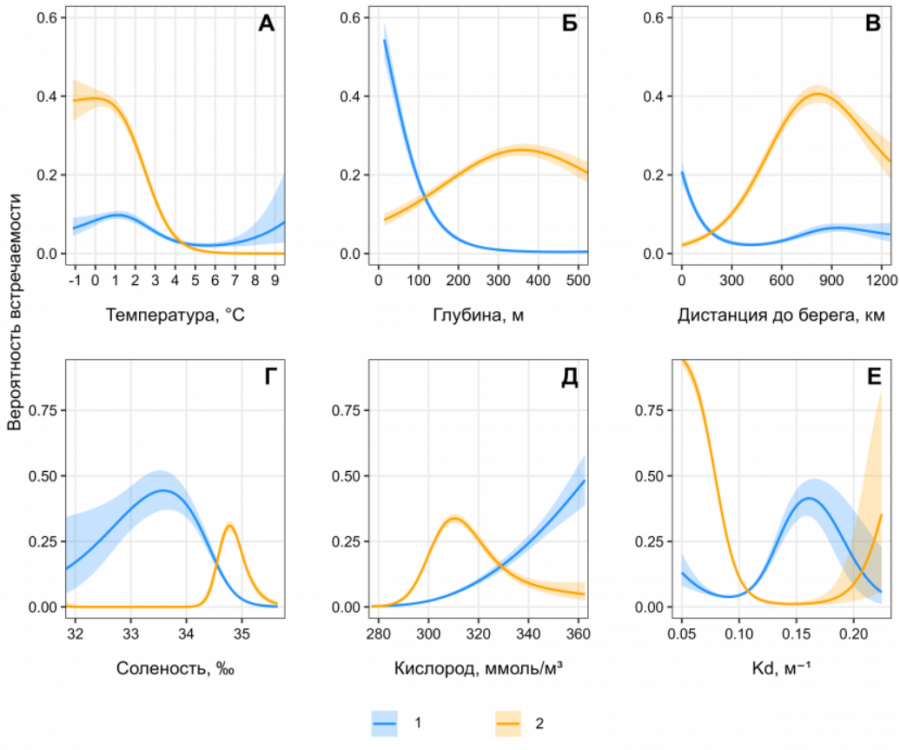
Рис. 2. Кривые вероятности встречаемости S. boreas (1) и S. ferox (2) в Баренцевом море и прилегающих водах в зависимости от абиотических факторов: А – среднегодовая придонная температура; Б – глубина; В – дистанция до берега; Г – придонная соленость; Д – концентрация растворенного кислорода; Е – коэффициент диффузного ослабления света (Kd) по результатам моделирования GAM
Fig. 2. Probability curves of S. boreas (1) and S. ferox (2) occurence in the Barents Sea and adjacent waters depending on abiotic factors: A – average annual bottom temperature; Б – depth; В – distance to the shore; Г – bottom salinity; Д – dissolved oxygen concentration; E – diffuse light attenuation coefficient (Kd) based on the results of GAM modeling
Соленость играет критическую роль: S. ferox демонстрирует резкий рост встречаемости (до 30 %) при солености 34.6–35.0 ‰ (рис. 3Г), что характерно для атлантических вод. Для S. boreas пик вероятности (44 %) наблюдается при умеренной солености (32.5–33.5 ‰), что отражает его связь с опресненными прибрежными зонами. Концентрация кислорода оказывает противоположное влияние. Для S. ferox вероятность встречаемости возрастает до 34 % при 309–313 ммоль/м³, что соответствует холодным водам с высоким содержанием кислорода. S. boreas достигает максимума (≈45 %) при 355–360 ммоль/м³, что характерно для прогретых мелководных акваторий. Коэффициент диффузного ослабления света (Kd) подчеркивает различия в адаптации к освещенности. Для S. ferox прозрачность воды (Kd < 0.1 м⁻¹) критична: вероятность встречаемости достигает 95 % (рис. 3Д). S. boreas, напротив, тяготеет к мутным водам (Kd > 0.15 м⁻¹), где вероятность встречаемости достигает 41 %, что связано с его приуроченностью к эстуарным зонам.
Градиенты биогенов также значимы: S. ferox связан с районами высокой концентрации нитратов (8–9 ммоль/м³), характерными для зон апвеллинга. S. boreas чаще встречается в водах с повышенным содержанием фосфатов (13.65 %), что типично для прибрежных биотопов. Таким образом, распределение S. boreas и S. ferox отражает их адаптацию к разным экологическим нишам: первый вид тяготеет к мелководным, умеренно соленым и мутным водам, второй – к глубоководным, холодным и прозрачным акваториям с высокой соленостью.
Прогнозы, основанные на моделировании климатических сценариев, демонстрируют существенные изменения в распределении S. boreas и S. ferox в Баренцевом море к концу XXI в. (табл. 2). При экстремальном сценарии SSP5-8.5 (повышение придонной температуры до 4.08 °C) площадь обитания S. boreas сократится с 0.82 млн км² (29 % акватории Баренцева моря) до 0.63 млн км² (22 %), а для S. ferox – с 0.81 млн км² (28 %) до 0.29 млн км² (10 %). Это связано с их чувствительностью к прогреву вод: S. ferox, как холодноводный вид, теряет биотопы при температурах выше 3 °C, тогда как S. boreas сохраняет части ареала за счет адаптации к смешанным водам.
Таблица 2. Площадь (тыс. км2) и доля (%) акватории потенциального распределения крабов в Баренцевом море и сопредельных водах и ее площадь (млн км2) при текущей оценке и трех вариантах прогноза придонной температуры в 2090–2100 гг.
| Сценарии прогноза | Текущая оценка | SSP1-1.9 | SSP2-4.5 | SSP5-8.5 |
| Среднемноголетняя придонная температура (медиана),ºС | 1.05 (0.55) | 1.51 (1.09) | 2.63 (2.53) | 4.08 (4.25) |
| Доля (%) акватории потенциального распределения видов в Баренцевом море | ||||
| S. boreas | 0.82 (29 %) | 0.77 (27 %) | 0.70 (25 %) | 0.63 (22 %) |
| S. ferox | 0.81 (28 %) | 0.58 (20 %) | 0.41 (14 %) | 0.29 (10 %) |
Рассмотрим подробнее пространственно-временную динамику популяций шримсов-медвежат в Баренцевом море при сценарии SSP5-8.5 (экстремальное потепление). Динамика ареала шримса-медвежонка S. boreas в Баренцевом море демонстрирует два ключевых тренда. Это постепенное сокращение общей площади обитания. К 2100 г. ареал S. boreas уменьшится на 23 % – с 0.82 до 0.63 млн км², что связано с прогнозируемым ростом придонной температуры с 1.05 °C (2020–2029 гг.) до 4.08 °C (2090–2100 гг.). Второй тренд – сохранение ключевых биотопов. Несмотря на общее сокращение, зоны с высокой вероятностью встречаемости (>60 %) останутся стабильными как к середине (2050–2060 гг., рис. 3-1Б), так и концу века (рис. 3-1В). Причина устойчивости ареала S. boreas заключается в его адаптации к термическим колебаниям от холодных арктических вод (прибрежные воды северной части архипелага Шпицберген и Земли Франца-Иосифа) до прогретых прибрежных акваторий Норвегии. Даже в условиях усиления атлантификации S. boreas может сохранить основные места концентрации популяции в мелководных районах, демонстрируя более высокую устойчивость по сравнению с глубоководным S. ferox.
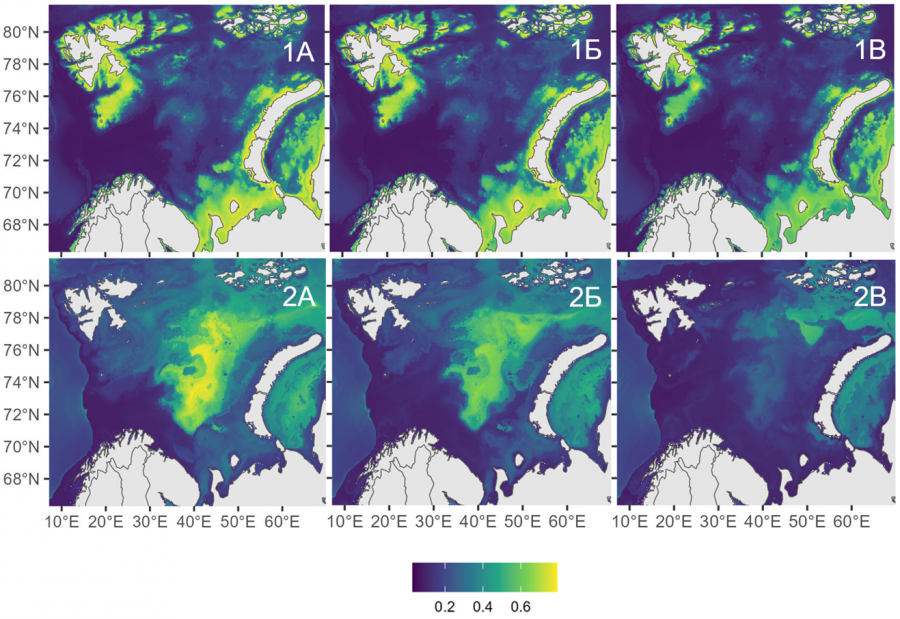
Рис. 3. Прогноз вероятности встречаемости S. boreas (1) и S. ferox (2) в Баренцевом море и прилегающих водах в 2020–2030 гг. (А), 2050–2060 гг. (Б), 2090–2100 гг. (В), выполненный на основе моделирования распределения видов в рамках социально-экономического сценария SSP5-8.5
Fig. 3.Prediction of the probability of Sclerocrangon boreas (1) and S. ferox (2) occurrence in the Barents Sea and adjacent waters in 2020-2030 (A), 2050-2060 (Б), 2090-2100 (В), based on modeling of the distribution of species n the framework of the socio-economic scenario SP5-8.5
Пространственно-временная динамика ареала S. ferox в Баренцевом море при сценарии SSP5-8.5 демонстрирует выраженную уязвимость вида к климатическим изменениям. К концу XXI в. прогнозируемое повышение придонной температуры до 4.08 °C приведет к сокращению площади его обитания на 64 % – с 0.81 млн км² (28 % акватории) в 2020–2029 гг. до 0.29 млн км² (10 %) к 2090–2100 гг. В отличие от S. boreas, который сохраняет стабильность в мелководных зонах, ареал S. ferox смещается в северо-восточные районы моря, где сохраняются холодные арктические воды с температурой ниже 3 °C (рис. 3-2A, Б, В). Основной причиной сокращения является узкий температурный оптимум вида. S. ferox достигает пика встречаемости (39 %) при придонных температурах от -1 до 0 °C, но его вероятность резко падает при прогреве выше 4 °C. Это ограничивает распространение вида глубоководными участками (100–300 м) с высокой соленостью (34.6–35.0 ‰), которые постепенно исчезают из-за усиления адвекции атлантических вод. Ключевым фактором риска выступает деградация ледовых биотопов. Сокращение сезонного ледового покрова нарушает условия для размножения и нагула молоди, что может усугубляться конкуренцией с бореальными видами бентоса. Прогнозы показывают, что к 2100 г. зоны с высокой вероятностью встречаемости S. ferox (>50 %) сохранятся лишь в северно-восточной части моря, где влияние атлантических вод будет минимально.
Глобальное потепление и связанное с ним сокращение ледового покрова, усиление адвекции атлантических и тихоокеанских вод, а также изменения в солености и продуктивности трансформируют ареалы холодноводных видов по всему арктическому шельфу (Blum, 2024; Lind et al., 2018; Smedsrud et al., 2013). Используя только входные данные по Баренцеву морю, можно оценить индекс пригодности среды обитания на всем арктическом шельфе для баренцевоморских шримсов-медвежат. Прогноз их потенциального распределения был выполнен для текущего периода и на конец XXI в., и для S. boreas и S. ferox он имеет видовую специфичность, определяемую их экологической пластичностью (рис. 4).
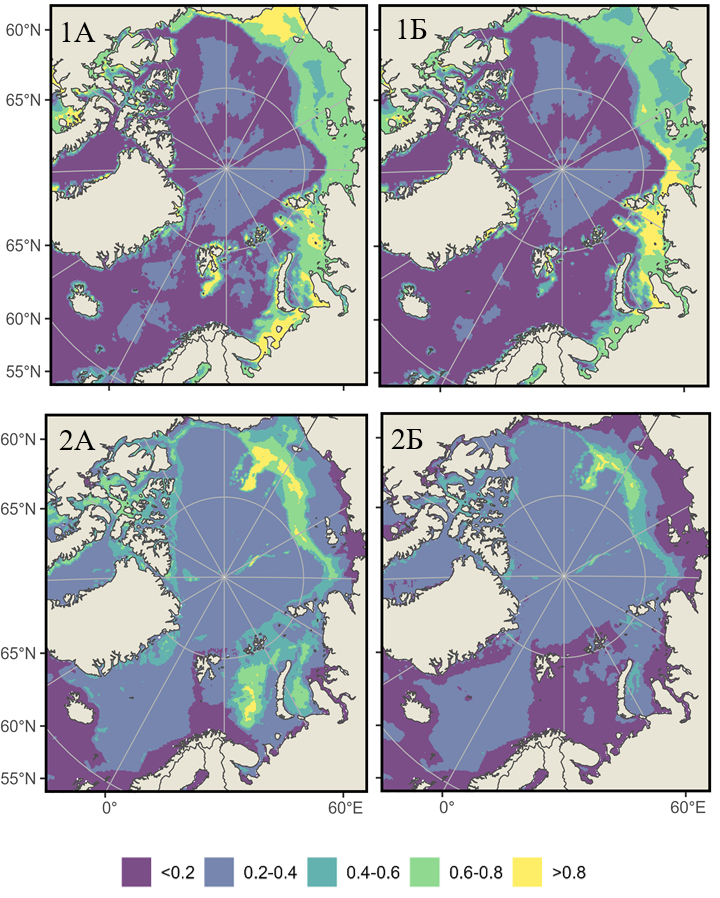
Рис. 4. Прогноз вероятности встречаемости S. boreas (1) и S. ferox (2) в Северном Ледовитом океане и прилегающих водах в 2020–2030 гг. (А) и 2090–2100 гг. (Б), выполненный на основе моделирования распределения видов в рамках социально-экономического сценария SSP5-8.5
Fig. 4. Prediction of the probability of Sclerocrangon boreas (1) and S. ferox (2) occurrence in the Arctic Ocean and adjacent waters in 2020-2030 (A) and 2090-2100 (Б), based on modeling of species distribution in the framework of the socio-economic scenario SP5-8.5
S. boreas – высокобореальный, арктический циркумполярный вид, обнаруженный у берегов Гренландии, Исландии, архипелага Шпицберген, вдоль восточного побережья Северной Америки и во всех арктических и дальневосточных морях России (Соколов, 2003; Zimina et al., 2015), что хорошо согласуется с данными моделирования (рис. 4-1А). Увеличение продолжительности безледного периода и прогрев мелководных акваторий могут позволить S. boreas колонизировать восточные районы Карского моря и прибрежные зоны моря Лаптевых, где в настоящее время доминируют строго арктические виды (рис. 4-1А). В устьевых зонах крупных рек (Обь, Енисей, Лена) вид может укрепить позиции благодаря устойчивости к низкой солености (до 25 ‰), что подтверждается его присутствием в настоящее время в Печорском море и в южной части Карского моря. Одновременно с увеличением вероятности встречаемости S. boreas в арктических зонах уменьшается его вероятность присутствия в высоко бореальных районах, например в Баренцевом и Чукотском морях.
S. ferox сконцентрирован в относительно глубоководных желобах (300–500 м) Баренцева, Карского и Чукотского плато, где сохраняются стабильно низкие температуры (-1.5-2 °C) и высокая соленость (34.5–35 ‰) (рис. 4-2А). Прогрев придонного слоя в Баренцевом и Карском морях может привести к сокращению пригодных биотопов на 50–70 % к 2100 г. На Чукотском плато и проливах Канадского арктического архипелага S. ferox, вероятно, найдет рефугиумы благодаря сохраняющемуся ледовому покрову и низким температурам, однако фрагментация ареала может повысить уязвимость популяций.
Заключение
Экологические предпочтения и реакции на климатические изменения двух видов шримсов-медвежат Баренцева моря – S. boreas и S. ferox – демонстрируют существенные различия. Ансамблевое моделирование распределения видов подтвердило, что S. boreas, адаптированный к мелководным зонам с умеренной соленостью и термической пластичностью, может сохранить устойчивость даже в условиях экстремального потепления (сокращение ареала на 23 % при SSP5-8.5). В отличие от него S. ferox, связанный с холодными глубоководными биотопами, вероятно, потеряет до 64 % ареала к 2100 г. из-за узкого температурного оптимума (-1–0 °C) и зависимости от высокой солености. Эти тенденции, вероятно, будут отражать глобальные процессы «арктической атлантификации», ведущие к смещению холодноводных видов в рефугиумы северо-восточных акваторий.
Ограничения прогностических расчетов связаны с локальным охватом данных научно-исследовательских съемок, которые не полностью отражают реальное распределение видов. Включение литературных данных из других бореальных и арктических регионов позволило бы уточнить границы их экологических ниш и повысить точность прогнозов изменений ареалов на арктическом шельфе.
Изменения в арктических экосистемах важно отслеживать не только для понимания сокращения ареалов местных видов, но и для наблюдения за появлением новых, ранее нехарактерных для этих вод видов. Потепление и уменьшение ледового покрова создают условия для проникновения в Баренцево море видов из более южных районов. Это может изменить пищевые цепочки и привести к конкуренции между видами. Чтобы прогнозировать такие изменения, полезно использовать модели распределения видов (SDM), которые помогают оценить, где могут появиться новые обитатели и как это повлияет на экосистемы. Регулярный сбор данных и их интеграция с прогнозными моделями позволят лучше подготовиться к последствиям климатических сдвигов.
Библиография
Баканев С. В. Расселение и оценка возможного ареала краба-стригуна (Chionoecetes opilio) в Баренцевом море // Принципы экологии. 2015. Т. 4, № 3. С. 27–39.
Зимина О. Л. Десятиногие ракообразные Карского моря по результатам траловых съемок 2012 и 2016 гг.: фауна и распределение // Труды Зоологического института РАН. 2021. Т. 325, № 3. С. 364–372.
Иоганзен Б. Г., Файзова Л. В. Об определении показателей встречаемости, обилия, биомассы и их соотношения у некоторых гидробионтов // Элементы водных экосистем. М.: Наука, 1978. С. 215–225.
Киктев Д. Б., Муравьев А. В., Бундель А. Ю. Методические рекомендации по верификации метеорологических прогнозов . М.: Типография АМА ПРЕСС, 2021. 94 с.
Кузнецов В. В. Биология массовых и наиболее обычных видов ракообразных Баренцева и Белого моря . М.; Л.: Наука, 1964. 242 с.
Мастицкий С. Э., Шитиков В. К. Статистический анализ и визуализация данных с помощью R . 2014. URL: http://r-analytics.blogspot.com (дата обращения: 12.01.2025).
Петряшев В. В. Фауна ракообразных Leptostraca, Mysidacea, Isopoda и Decapoda (Anomura) Чукотского моря и сопредельных вод: биогеография и история формирования // Биология моря. 2002а. Т. 28, № 3. С. 161–169.
Петряшев В. В. Фауна ракообразных Leptostraca, Mysidacea, Isopoda и Decapoda (Anomura) Чукотского моря и сопредельных вод: условия существования и видовой состав // Биология моря. 2002б. Т. 28, № 2. С. 85–92.
Соколов В. И. Фауна десятиногих ракообразных (Crustacea, Decapoda) Баренцева моря // Труды ВНИРО. 2003. Т. 142. С. 25–76.
Allouche O., Tsoar A., Kadmon R. Assessing the accuracy of species distribution models: Prevalence, kappa and the true skill statistic (TSS) // Journal of Applied Ecology. 2006. Vol. 43. P. 1223–1232.
Assis J., Fernández Bejarano S. J., Salazar V. W., Schepers L., Gouvêa L., Fragkopoulou E., Leclercq F., Vanhoorne B., Tyberghein L., Serrão E. A., Verbruggen H., De Clerck O. Bio-ORACLE v3.0. Pushing marine data layers to the CMIP6 Earth system models of climate change research // Global Ecology and Biogeography. 2024. DOI: 10.1111/geb.13813
Berge J., Renaud P. E., Eiane K., Gulliksen B., Cottier F. R., Varpe O., Brattegard T. Changes in the decapod fauna of an Arctic fjord during the last 100 years (1908–2007) // Polar Biology. 2009. Vol. 32, No 7. P. 953–961.
Blum H. Atlantification: Facing the Atlantic from the Arctic – a provocation // Atlantic Studies. 2024. Vol. 21 (1). P. 192–194.
Breheny P., Burchett W. Visualization of Regression Models Using visreg // The R Journal. 2017. Vol. 9/2. P. 56–71.
Eriksen E., Gjøsæter H., Prozorkevich D., Shamray E., Dolgov A., Skern-Mauritzen M., Stiansen J. E., Kovalev Yu., Sunnanå K. From single species surveys towards ecosystem monitoring in the Barents Sea // Progress in Oceanography. 2018. Vol. 166. P. 4–14.
Eyring V., Bony S., Meehl G. A., Senior C. A. Overview of the Coupled Model Intercomparison Project Phase 6 (CMIP6) experimental design and organization // Geoscientific Model Development. 2016. Vol. 9. P. 1937–1958.
Fielding A. H., Bell J. F. A review of methods for the assessment of prediction errors in conservation presence/absence models // Environmental Conservation. 1997. Vol. 24, № 1. P. 38–49.
Fisher R. A. The design of experiments. London: Oliver and Boyd, 1935. 252 p.
Frame B., Lawrence J., Ausseil A. G., Reisinger A., Daigneault A. Adapting global shared socio-economic pathways for national and local scenarios // Clim. Risk Manage. 2018. Vol. 21. P. 39–51.
Goulet P., Mullowney D., Ratsimandresy A., Kingsbury M., Hamoutene D. Species Distribution Modelling for snow crab (Chionoecetes opilio) potential habitat in Connaigre Bay Newfoundland // Can. Tech. Rep. Fish. Aquat. Sci. 2022. Vol. 3517. vii + 36 p.
Guisan A., Thuiller W., Zimmermann N. Habitat Suitability and Distribution Models. With Applications in R. Cambridge University Press, 2017. 462 p.
Hosmer D. W., Lemeshow S. Applied logistic regression (2nd ed.). Wiley, 2000. 397 p.
Jørgensen L. L., Lyubin P. A., Skjoldal H. R., Ingvaldsen R. B., Anisimova N. A., Manushin I. E. Distribution of benthic megafauna in the Barents Sea: baseline for an ecosystem approach to management // ICES Journal of Marine Science. 2015. Vol. 72, No 2. P. 595–613.
Lind S., Ingvaldsen R. B., Furevik T. Arctic warming hotspot in the northern Barents Sea linked to declining sea-ice import // Nature Climate Change. 2018. Vol. 8. P. 634–639.
Liu X., Han X., Han Z. Effects of climate change on the potential habitat distribution of swimming crab Portunus trituberculatus under the species distribution model // J. Ocean. Limnol. 2022. Vol. 40. P. 1556–1565.
Mielke P. W., Berry K. J. Permutation Methods: A Distance Function Approach. N. Y.: Springer, 2001. 446 p.
Nephin J., Thompson P. L., Anderson S. C et al. Integrating disparate survey data in species distribution models demonstrate the need for robust model evaluation // Canadian Journal of Fisheries and Aquatic Sciences. 2023. Vol. 80 (12). P. 1869–1889.
Notz D. Arctic Sea Ice in CMIP6 // Geophysical Research Letters. 2020. Vol. 47. 11 p.
Pearson R. G. Species’ distribution modeling for conservation educators and practitioners // American Museum of Natural History. Lessons in Conservation. 2007. Vol. 3. P. 54–89.
Siders Z., Ducharme-Barth N., Carvalho F. et al. Ensemble Random Forests as a tool for modeling rare occurrences // Endangered Species Research. 2020. Vol. 43.
Smedsrud L. H., Esau I., Ingvaldsen R. B. et al. The role of the Barents Sea in the Arctic climate system // Reviews of Geophysics. 2013. Vol. 51 (3). P. 415–449.
Thorson G. Reproductive and larval ecology of marine bottom invertebrates // Biological Reviews. 1950. Vol. 25, No 1. P. 1–45.
Thuiller W. BIOMOD – optimizing predictions of species distributions and projecting potential future shifts under global change // Global Change Biology. 2003. Vol. 9. P. 1353–1362.
Weslawski J. M. Distribution of Decapoda (Crustacea) in South Spitsbergen coastal waters with remarks on their ecology and breeding biology // Polish Polar Research. 1987. Vol. 8 (2). P. 121–134.
Zimina O. L., Lyubin P. A., Jørgensen L. L., Zakharov D. V., Lyubina O. S. Decapod Crustaceans of the Barents Sea and adjacent waters: species composition and peculiarities of distribution // Arthropoda Selecta. 2015. Vol. 24 (4). P. 417–428. DOI: 10.15298/ARTHSEL.24.4.04
Благодарности
Автор выражает благодарность коллегам и сотрудникам ПИНРО (Россия, Мурманск) и БИМИ (Норвегия, Тромсё) за добросовестный сбор материала, ведение и редактирования базы данных. Также автор персонально выражает благодарность руководителю лаборатории гидробиологии ПИНРО И. Е. Манушину за предоставление исходных данных.






 © 2011 - 2026
© 2011 - 2026