Введение
Микроводоросль хлорелла – удобный объект биологического мониторинга состояния природных экологических систем, поскольку имеет широкий ареал распространения и присутствует как в водоемах, так и на почвах. Благодаря этому она стала объектом массового культивирования для применения в самых разных направлениях. С использованием хлореллы была получена информация о мутагенных и летальных эффектах высоких доз внешнего облучения, продуктов ядерного деления 235U разного возраста, 232Th, неорганических и органических соединений в модельных растворах, компонентов природных и промышленных вод (Шевченко и др., 1969; Векшина и др., 1970; Wong, 1980; Шевченко и др., 1996; Евсеева и др., 2008)
Первые теоретические и экспериментальные исследования биорегенеративных систем были проведены на водорослях рода Chlorella. Подробное изучение этой водоросли позволило выявить и решить ряд проблем, связанных со специфическими требованиями биологических систем жизнеобеспечения человека.
В данном исследовании использовался штамм микроводоросли Chlorella kessleri ВКПМ АI-11 ARW (РФ, НПО «Алгобиотехнология»). 15 января 2022 г. вступил в силу ГОСТ Р 59977-2022, содержащий технологию биологической реабилитации водных объектов данным штаммом хлореллы.
Применение эталонной питательной среды для выращивания данного штамма, представленной в патенте № RU2585523C1, приводит к высоким результатам роста водорослей, однако ее приготовление в малых объемах требует значительных усилий и точных дозировок, что увеличивает время и сложность процесса (Богданов, 2016). По сравнению с оригинальным составом, среда Тамия характеризуется более простой методикой приготовления, что делает ее более удобной для лабораторного применения. Сама по себе среда Тамия – это стандартная культуральная среда для выращивания протококковых водорослей, таких как хлорелла. Эта среда была разработана для стабильного и эффективного культивирования водорослей в лабораторных условиях. Она используется для различных исследований в области микробиологии и биотехнологии, обеспечивая оптимальные условия для роста и развития водорослей (Зайцев и др., 2022; Полынов и др., 2024; Tulegenova et al., 2020). Среда Тамия отличается простой методикой приготовления, что способствует снижению экономических затрат и ускорению получения воспроизводимых результатов. Данная среда широко используется в научных исследованиях, что обеспечивает возможность сравнения результатов, полученных на данном штамме, с данными других работ без учета влияния различий в составе питательных сред. Это упрощает задачу стандартизации экспериментов и способствует более объективному сопоставлению данных.
Таким образом, цель данного исследования – оценить эффективность применения среды Тамия для выращивания штамма микроводоросли C. kessleri ВКПМ АI-11 ARW в лабораторных условиях с целью упрощения процесса культивирования и обеспечения стандартизации экспериментов.
Материалы
C. kessleri ВКПМ АI-11 ARW – штамм микроводоросли, способный активно продуцировать биомассу, получен в результате селекции штамма водорослей Parachlorella nurekis 1904 KIEG и Chlorella vulgaris BIN (Богданов, 2014, 2016). Штамм обладает планктонными свойствами, т. е. находится во взвешенном состоянии и свободно парит в водной толще, а также равномерно распределяется в культуральной среде благодаря тому, что клетки несут на себе отрицательный заряд (Богданов, 2016).
Антагонистические свойства штамма проявляются при наборе культурой оптической плотности 0.85 ед., при этом наступает лизис прочей альгофлоры, гибель бактерий, грибов и дрожжей. Штамм строго соблюдает условия монокультуры по отношению к прочим водорослям и обладает невосприимчивостью к фагам (Богданов, 2016).
«Предшественник» данного штамма водорослей, P. nurekis 1904 KIEG, неоднократно использовался для альголизации водоема-охладителя – Белоярского водохранилища (4200 га) Белоярской атомной станцией. Другие предприятия также часто пользовались данным штаммом, например, ОАО «ЕВРАЗ Нижнетагильский металлургический комбинат» в период с 2013 по 2019 г. ежегодно альголизировало хлореллой Нижнетагильский городской пруд (780 га), пруд на реке Вязовка (3.5 га) и Леневское водохранилище (2300 га). По данным компании-производителя, в 2011 г. было предотвращено цветение водоемов общей площадью 22344.5 га (Список предприятий…, 2025).
Штамм C. kessleri, согласно патентной информации, в лабораторных условиях растет на комплексной питательной среде, состоящей из растворов четырех составов химических реактивов на один литр водопроводной воды и фугата послеспиртовой барды, причем последний вводится в питательную среду до получения уровня pH не ниже 7.0. Штамм не требует подачи углекислого газа и барботирования культуры воздухом (Богданов, 2016).
Составы питательной среды, согласно патенту:
- состав № 1: азотно-фосфорный – 0.30 мл;
- состав № 2: железисто-натриевый – 0.15 мл;
- состав № 3: медно-кобальтовый – 0.15 мл;
- состав № 4: сернокислого калия – 0.33 мл.
Методы
В ходе работы были приготовлены различные варианты среды, в т. ч. стандартная для протококковых водорослей среда Тамия, и были опробованы различные комбинации сред для поиска наиболее оптимального варианта.
Состав среды Тамия с концентрацией 100 % указан в табл. 1 (Ляпунова, 2015).
Таблица 1. Состав среды Тамия
| Компоненты среды | Масса, г/л |
| KNO3 | 5 |
| MgSO4 | 2.5 |
| KH2PO4 x 3H2O | 1.25 |
| FeC6H5O7 | 0.003 |
Для возможности параллельного культивирования сразу на нескольких средах был использован многокюветный культиватор водорослей КВМ-05. Данный культиватор способен поддерживать температуру культивирования водоросли в диапазоне от 25 до 40 °С, точность поддержания температуры при этом составляет ±1 °С. Постоянная температура поддерживается автоматическим включением и выключением встроенного вентилятора по команде блока термостабилизации прибора. Исходя из патентной информации и технических возможностей культиватора, температура культивирования составляла 28 ± 1 °С.
Углекислотное насыщение фотосинтеза наблюдается при концентрации его в растворах в пределах 0.01–0.027 %. Следовательно, 0.03%-ное количество углекислоты в воздухе вполне достаточно для обеспечения питания водорослей (Музафаров и др., 1972).
В процессе культивирования суспензия водоросли облучается светом лампы накаливания 40 Вт, 220 В. Режим освещенности составлял 12 часов в сутки, что обеспечивалось с помощью реле, автоматически срабатывающего по времени, с погрешностью отсчета не более 2 с/сут.
Для исследования были приготовлены:
- Среда Тамия в различных концентрациях (15, 30, 50, 65 и 80 %) без добавления дополнительных растворов микроэлементов;
- Среда Тамия в различных концентрациях (15, 30, 50, 65 и 80 %) с добавлением дополнительных растворов микроэлементов;
- Культуральная среда, указанная в патенте;
- Комбинации патентной культуральной среды и среды Тамия (1:1, 2:1, 3:1).
Дополнительные растворы микроэлементов состоят из двух частей, состав которых приведен в табл. 2.
Таблица 2. Состав дополнительных растворов микроэлементов
| Компоненты среды | Масса, мг/л |
| Раствор 1 | |
| H3BO3 | 2.86 |
| MnCl2 х 4H2O | 1.81 |
| ZnSO4 х 7H2O | 0.222 |
| Раствор 2 | |
| MoO3 | 17.64 |
| NH4VO | 22.96 |
Различные концентрации питательной среды получены путем разбавления исходного 100 % раствора питательной среды Тамия дистиллированной водой. В вариантах питательной среды с добавлением микроэлементов их внесение осуществлялось из расчета 0.5 мл каждого раствора на 1 л среды (Ляпунова, 2015).
Засев водоросли производился с начальной плотностью 0.20 единицы оптической плотности. После засева на среду проводилось ежедневное наблюдение динамики нарастания культуры. Наращивание культуры проводилось в течение 14 дней. Значение оптической плотности ежедневно регистрировалось в процессе культивирования измерителем плотности суспензии ИПС-03 в течение двух недель.
Согласно основному закону светопоглощения, существует прямопропорциональная зависимость между оптической плотностью и концентрацией растворенного вещества в растворе. Подобная связь наблюдается и между оптической плотностью и числом клеток в водорослевой суспензии. Таким образом, величина оптической плотности позволяет оперативно и с высокой точностью оценивать изменения в численности клеток на протяжении роста водорослевой культуры.
В работе были исследованы:
- динамика нарастания культуры;
- удельная скорость роста;
- время достижения максимальной оптической плотности (ОП), принятой за 1.45 ед., при первоначальном внесении культуры в среду;
- время выхода на экспоненциальную фазу роста;
- время достижения максимальной оптической плотности (ОП) при пересеве культуры в фазу экспоненциального роста.
Определение удельной скорости роста (1) позволяет оценить, насколько эффективно культура микроорганизмов, в частности водорослей, использует ресурсы среды. При измерении удельной скорости роста с использованием оптической плотности в водных культурах водорослей удельная скорость роста будет характеризовать, как быстро меняется оптическая плотность (косвенно, количество клеток) в единицу времени. Наиболее эффективно рассчитывать удельную скорость роста в экспоненциальной фазе, когда организм активно делится и скорость роста зависит от доступных ресурсов. Для расчета достаточно любых двух экспериментальных точек:
μ = (ln(D2) - ln(D1)) / (t2 - t1) (1),
где μ – удельная скорость роста (сут-1); ln (D1) – натуральный логарифм оптической плотности в момент времени t1; ln (D2) – натуральный логарифм оптической плотности в момент времени t2; t1 и t2 – моменты времени, на которых проводятся замеры.
Обработка полученной информации осуществлялась с использованием пакета приложений Microsoft Excel 2016. Оценки средних и доверительных интервалов проводили стандартными методами математической статистики. На диаграммах представлены средние значения и стандартные ошибки.
Результаты
Согласно полученным результатам по динамике роста микроводоросли C. kessleri на питательной среде Тамия различных концентраций без внесения дополнительных микроэлементов (рис. 1), наилучший вариант для культивирования водоросли – концентрация среды Тамия в 30 %. При концентрации в 15 % переходная фаза занимает на одни сутки больше, что может быть вызвано недостатком питательных веществ, из-за чего клетки водоросли имеют более низкую активность и им необходимо больше времени для усвоения ресурсов и активации ферментов для повышения метаболических процессов и начала активного деления. Низкая концентрация таких питательных веществ, как азот и углерод, необходимые для синтеза белков и углеводов, а также фосфор, необходимый для синтеза нуклеотидов, не дает клеткам возможности быстро начать деление с высокой скоростью. Таким образом, переход из лаг-фазы в фазу экспоненциального роста замедляется.
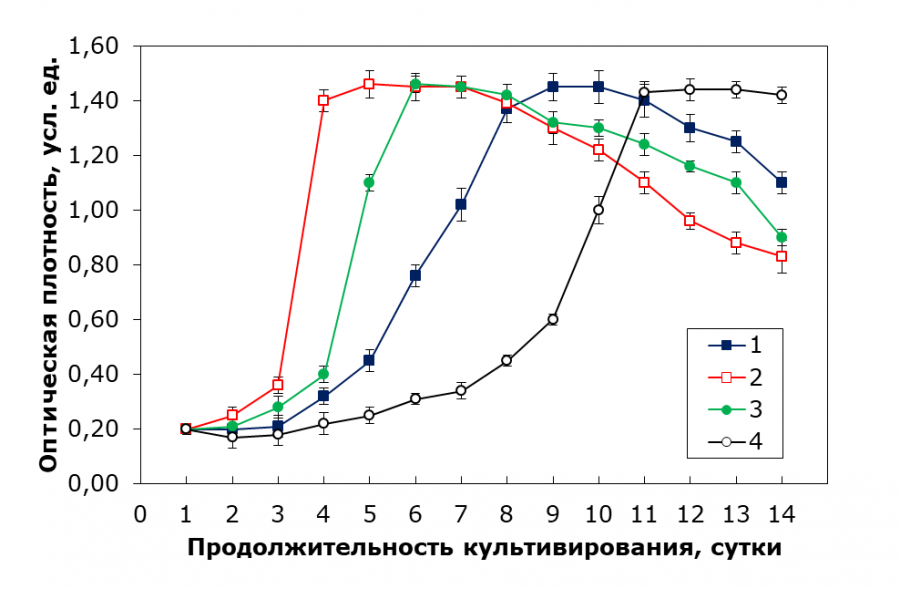
Рис. 1. Кривые роста C. kessleri в зависимости от используемой концентрации среды Тамия (без внесения дополнительных микроэлементов): 1 – среда Тамия с концентрацией 15 %, 2 – среда Тамия с концентрацией 30 %, 3 – среда Тамия с концентрацией 50 %, 4 – среда Тамия с концентрацией 65 %
Fig. 1. Growth curves of C. kessleri depending on the concentration of Tamya medium used (without additional trace elements): 1 – Tamiya medium with a concentration of 15 %, 2 – Tamiya medium with a concentration of 30 %, 3 – Tamiya medium with a concentration of 50 %, 4 – Tamiya medium with a concentration of 65 %
При больших концентрациях увеличивается непосредственно лаг-фаза, что особенно хорошо заметно при концентрации среды Тамия в 65 %. Это может быть связано с несколькими факторами, такими как токсичность продуктов метаболизма, осмотический стресс и нарушение осморегуляции из-за избыточных концентраций некоторых ионов (например, фосфор и/или магний).
Обобщенные результаты по выходу на фазу экспоненциального роста и достижения оптической плотности в 1.45 ед. приведены в табл. 3.
Таблица 3. Рост водорослей при различных концентрациях среды Тамия без внесения в среду дополнительных микроэлементов
| Среда Тамия без микроэлементов | |||||
| 0.15 | 0.3 | 0.5 | 0.65 | 0.8 | |
| Время достижения ОП 1.45 ед. при полном жизненном цикле, сут | 9 | 5 | 6 | 11 | - |
| Время, необходимое для выхода на фазу экспоненциального роста, сут | 5 | 3 | 4 | 8 | - |
| Время достижения ОП 1.45 ед. при пересеве в экспоненциальную фазу, сут | 4 | 3 | 4 | 6 | - |
При 15 % концентрации время достижения оптимальной оптической плотности составило 9 суток, а выход на экспоненциальную фазу занял 5 суток, что указывает на замедленный рост культуры. Наилучшие результаты были получены при 30 % концентрации среды, где время до достижения ОП уменьшилось до 5 суток, а время выхода на экспоненциальную фазу составило 3 суток. При повышении концентрации до 50 % рост микроводоросли также улучшался, однако наблюдалось замедление роста в фазах выхода на экспоненциальную фазу и пересева. Высокие концентрации (65 % и 80 %) привели к значительному ухудшению результатов, при 80 % концентрации среды Тамия клетки водорослей практически не выживали. Таким образом, оптимальными для культивации являются концентрации среды Тамия в пределах 30–50 %. Удельная скорость в фазе экспоненциального роста составила 0.86 сут-1 для концентрации 30 % и 0.65 сут-1 для концентрации 50 %.
При использовании питательной среды Тамия с внесением дополнительных микроэлементов (рис. 2) можно увидеть более продолжительное нахождение культуры в стационарной фазе для всех концентраций среды, однако общая зависимость остается схожей.
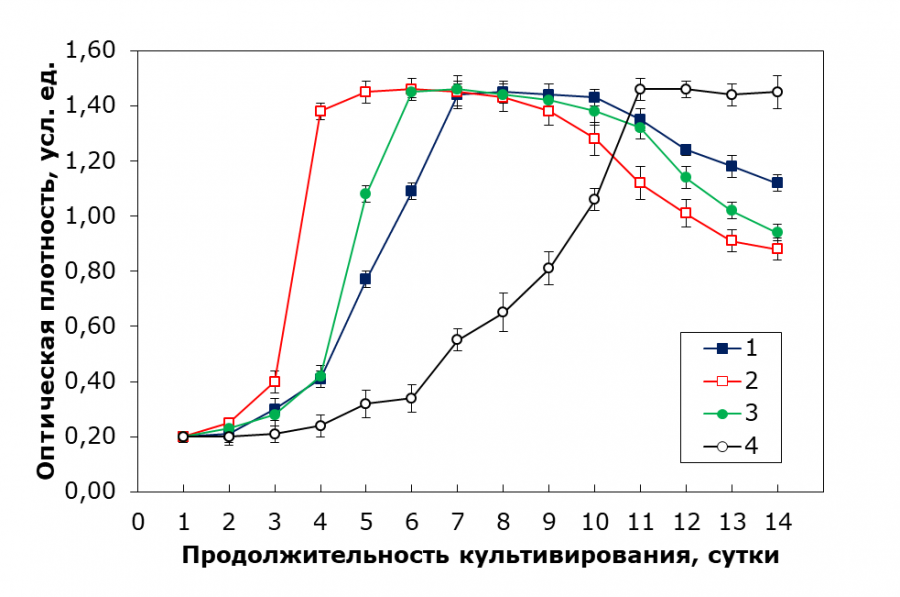
Рис. 2. Кривые роста C. kessleri в зависимости от используемой концентрации среды Тамия (с внесением дополнительных микроэлементов): 1 – среда Тамия с концентрацией 15 %, 2 – среда Тамия с концентрацией 30 %, 3 – среда Тамия с концентрацией 50 %, 4 – среда Тамия с концентрацией 65 %
Fig. 1. Growth curves of C. kessleri depending on the concentration of Tamiya medium used (with additional trace elements): 1 – Tamiya medium with a concentration of 15 %, 2 – Tamiya medium with a concentration of 30 %, 3 – Tamiya medium with a concentration of 50 %, 4 – Tamiya medium with a concentration of 65 %
Из приведенных в табл. 4 данных, где к среде Тамия в тех же концентрациях дополнительно добавляли растворы микроэлементов, видно, что время достижения оптимальной оптической плотности при концентрации среды 15 % составило 7 суток, время выхода на экспоненциальную фазу – 4 суток, а при пересеве – 3 суток. При 30 % концентрации результаты улучшились (5, 3 и 3 суток соответственно). При 50 % концентрации время до ОП увеличилось до 6 суток, но остальные параметры остались на уровне 4 суток. При 65 % наблюдается замедление роста (11 суток для достижения ОП и 7 суток для выхода на экспоненциальную фазу). При 80 % концентрации среды клетки водорослей не выжили. Таким образом, добавление микроэлементов улучшает рост при всех изученных концентрациях, но при слишком высоких концентрациях (80 %) происходит гибель клеток. Оптимальными вариантами вновь оказались концентрации среды Тамия 30–50 %. Удельная скорость роста для концентрации среды Тамия 30 % составила 0.85 сут-1, для 50 % – 0.62 сут-1.
Таблица 4. Рост водорослей при различных концентрациях среды Тамия с внесением в среду дополнительных микроэлементов
| Среда Тамия с микроэлементами (%) | |||||
| 15 | 30 | 50 | 65 | 80 | |
| Время достижения ОП 1.45 ед. при полном жизненном цикле, сут | 7 | 5 | 6 | 11 | - |
| Время, необходимое для выхода на фазу экспоненциального роста, сут | 4 | 3 | 4 | 7 | - |
| Время достижения ОП 1.45 ед. при пересеве в экспоненциальную фазу, сут | 3 | 3 | 4 | 6 | - |
В результате сравнения применения культуральной среды из патента и ее комбинаций со средой Тамия были получены следующие результаты (рис. 3).
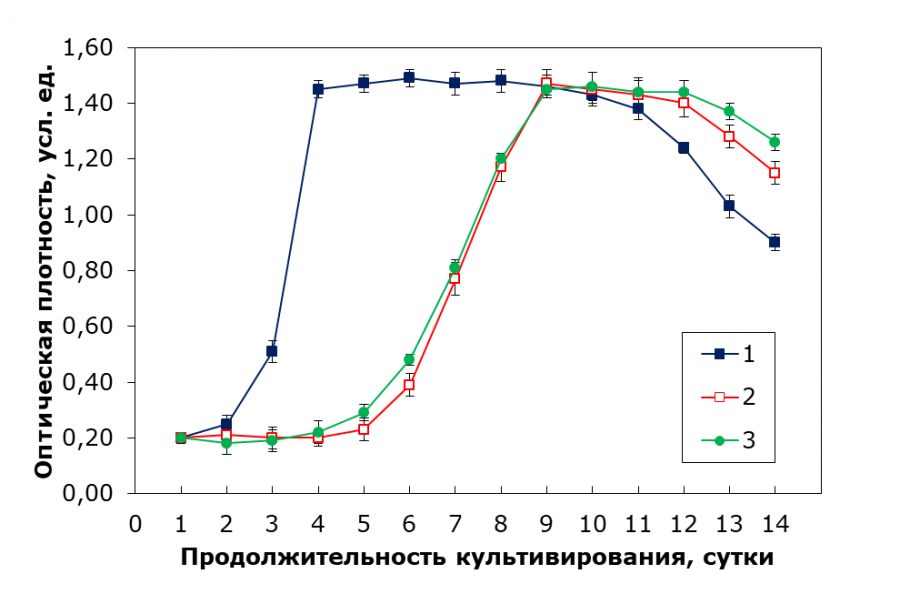
Рис. 3. Кривые роста C. kessleri при культивировании на эталонной питательной среде и ее комбинациях со средой Тамия в различных соотношениях: 1 – питательная среда из патента, 2 – комбинация среды Тамия и патентной среды в соотношении 2:1, 3 – комбинация среды Тамия и патентной среды в соотношении 3:1
Fig. 3. Growth curves of C. kessleri when cultivated on a reference nutrient medium and its combinations with Tamiya medium in various ratios: 1 – the nutrient medium from the patent, 2 – a combination of Tamiya medium and patent medium in a ratio of 2:1, 3 – a combination of Tamiya medium and patent medium in a ratio of 3:1
При использовании питательной среды, указанной в патенте, кривая роста ожидаемо показывает хорошие результаты по выходу из лаг-фазы, росту культуры и времени нахождения в стационарной фазе, а удельная скорость роста в экспоненциальной фазе равна 0.88 сут-1. Комбинация питательной среды Тамия и патентной питательной среды в соотношении 1:1 привела к гибели культуры, а в соотношениях 2:1 и 3:1 можно было увидеть продолжительную лаг-фазу и довольно короткую стационарную фазу. Данные эффекты можно объяснить измененным соотношением макроэлементов, например азота, фосфора и калия, из-за чего клеткам необходимо переключаться на другой механизм потребления транспортных веществ, также избыток отдельных элементов, таких как фосфаты, может быть токсичными. Комбинирование двух сред увеличивает концентрацию солей в растворе, что может вызывать осмотический стресс и/или дегидратацию, и клеткам необходимо длительное время для адаптации. Токсичные метаболиты, например аммиак, органические кислоты, кислородные радикалы и др., которые токсичны сами по себе, также могут взаимодействовать с различными компонентами питательной среды, создавая тем самым дополнительные стрессовые условия.
В табл. 5 приведены обобщенные результаты по культивированию хлореллы на культуральной среде, указанной в патенте, и различных ее комбинациях со средой Тамия.
Таблица 5. Рост водорослей при культивировании на культуральной среде, указанной в патенте, и различных ее комбинациях со средой Тамия
| Культуральная среда, указанная в патенте | Комбинация сред | |||
| 1:1 | 2:1 | 3:1 | ||
| Время достижения ОП 1.45 ед. при полном жизненном цикле, сут | 5 | - | 9 | 9 |
| Время, необходимое для выхода на фазу экспоненциального роста, сут | 3 | - | 7 | 6 |
| Время достижения ОП 1.45 ед. при пересеве в экспоненциальную фазу, сут | 3 | - | 6 | 5 |
Для среды из патента время достижения оптимальной оптической плотности составило 5 суток, выход на экспоненциальную фазу – 3 суток, а при пересеве – 3 суток. Для комбинации 1:1 результаты не были получены, т. к. культура погибла. При комбинациях 2:1 и 3:1 время до ОП составило 9 суток, что свидетельствует о замедлении роста по сравнению с эталонной средой, но остальные параметры (выход на экспоненциальную фазу и пересев) оставались в пределах 6–7 суток. Таким образом, комбинации среды из патента со средой Тамия показали ухудшение роста, особенно при соотношении 1:1. На рис. 4 отображены кривые роста, показавшие лучшие результаты при культивировании.
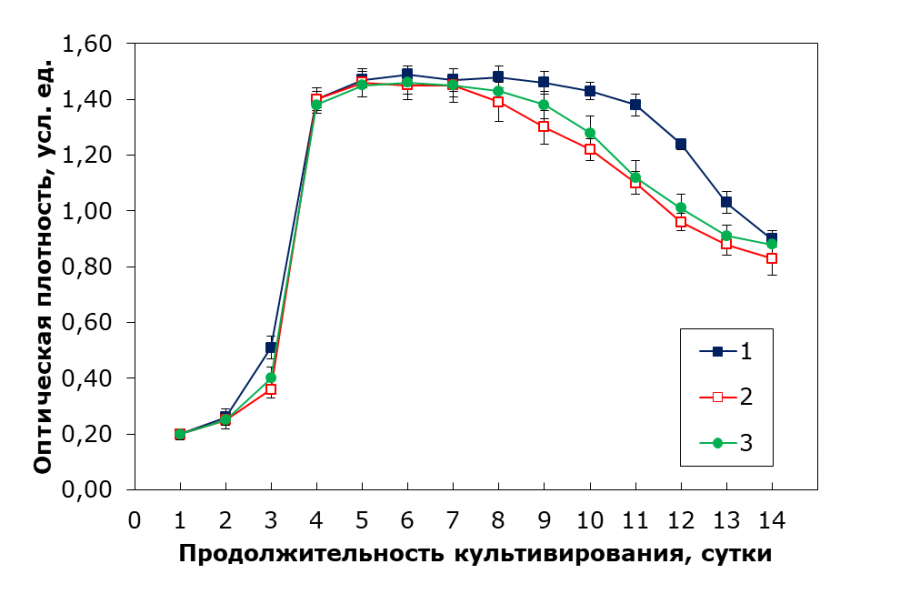
Рис. 4. Наилучшие кривые роста C. kessleri при культивировании на различных вариантах среды: 1 – питательная среда из патента, 2 – среда Тамия с концентрацией 30 % (без внесения дополнительных микроэлементов), 3 – среда Тамия с концентрацией 30 % (с внесением дополнительных микроэлементов)
Fig. 4. The best growth curves of C. kessleri when cultivated on various media variants: 1 – nutrient medium from the patent, 2 – Tamiya medium with a concentration of 30 % (without additional trace elements), 3 – Tamiya medium with a concentration of 30 % (with additional trace elements)
Кривая 1 на рис. 4 представляет эталонный вариант, который демонстрирует наилучшие результаты среди исследованных условий. На ней наблюдается более выраженный переход от лаг-фазы к фазе роста, что свидетельствует о быстром приспособлении культуры к новой среде и эффективном начале роста. Кроме того, эта среда обеспечивает более длительное нахождение культуры в стационарной фазе, что является индикатором стабильности метаболической активности клеток в условиях насыщения питательными веществами.
Кривые 2 и 3, хотя и имеют некоторые показатели, уступающие эталонному варианту, в целом не демонстрируют существенных отличий по сравнению с ним. Удельные скорости роста не имеют явно выраженных различий: 0.88 сут-1 для кривой 1, 0.86 сут-1 для кривой 2 и 0.85 сут-1 для кривой 3. Основными отличиями являются замедленный преход от лаг-фазы к фазе роста, а также сокращенная продолжительность стационарной фазы. Однако эти различия не оказывают значительного влияния на общую динамику при регулярном пересеивании культуры в фазе роста.
Заключение
В ходе данного исследования была проведена оценка различных вариантов культуральных сред для культивирования C. kessleri в лабораторных условиях. Результаты культивирования микроводоросли на среде из патента продемонстрировали хорошие показатели роста водорослей с минимальными сроками для достижения оптимальной оптической плотности и выхода на экспоненциальную фазу. Исходя из полученных данных, наиболее подходящими для культивирования в лаборатории являются среды на основе использования среды Тамия при концентрации 30 %, как с добавлением микроэлементов, так и без. Однако с учетом практических аспектов, таких как простота и стоимость, оптимальным выбором будет среда Тамия в концентрации 30 % без дополнительного внесения в нее микроэлементов. Это сочетание обеспечивает хороший баланс между эффективностью роста и затратами.
Библиография
ГОСТ Р 59977-2022. Биологическая безопасность. Обезвреживание и утилизация биологических и органических материалов. Общие технические условия . М.: Российский институт стандартизации, 2022. 11 с.
Богданов Н. И. Планктонный штамм Chlorella kessleri для предотвращения «цветения» водоемов синезелеными водорослями : Патент № RU2585523C1. 2016. 6 с.
Богданов Н. И. Планктонный штамм водорослей Parachlorella nurekis и его применение для уничтожения цианобактерий : Патент № RU2527895C2. 2014. 10 с.
Векшина Л. И., Коган И. Г., Кудряшов Е. И., Маренный А. Н., Пятышев Д. Р., Сакович И. С., Шевченко В. А. Относительная биологическая эффективность многозарядных ионов при однократном облучении хлореллы // Космическая биология и медицина. 1970. Т. 5. С. 39–42.
Евсеева Т. И., Майстренко Т. А., Гераськин С. А., Белых Е. С. Механизмы действия 232Th и Ce(III) на Chlorella vulgaris Beijer. Оценка вклада радиационного воздействия 232Th в индуцируемый эффект // Радиационная биология. Радиоэкология. 2008. Т. 48. С. 370–377.
Зайцев В. В., Петряков В. В., Зайцева Л. М., Махимова Ж. Н. Влияние питательной среды на морфологические особенности и жизнеспособность клеток микроводоросли Chlorella vulgaris Beijer // Самарский научный вестник. 2022. Т. 11, № 2. С. 52–56.
Ляпунова Е. Р. Относительная биологическая эффективность альфа-облучения хлореллы при различных условиях культивирования клеток : Дис. ... канд. биол. наук. Обнинск, 2015. 103 с.
Музафаров A. M., Таубаев Т. Т., Якубов Х. Ф. Массовое культивирование протококовых водорослей в установках под открытым небом // Культивирование водорослей и высших водных растений в Узбекистане. Ташкент: ФАН УзССР, 1972. 133 с.
Список предприятий и организаций, водоемы которых альголизировало ООО НПО «Альгобиотехнология» . URL: http://www.algobiotehnologia.com/shop/?gid=5 (дата обращения: 24.03.2025).
Шевченко В. А., Визгин В. П., Алексеенок А. Я. О мутационном процессе в популяциях одноклеточных водорослей при остром и хроническом облучении ионизирующей радиацией // Генетика. 1969. № 9 (5). С. 61–73.
Шевченко В. А., Абрамов В. И., Кальченко В. А., Федотов И. С., Рубанович А. В. Генетические последствия для популяций растений радиоактивного загрязнения окружающей среды в связи с Чернобыльской аварией // Радиационная биология. Радиоэкология. 1996. Т. 36. С. 531–545.
Tulegenova S. E., Beisenova R. R., Auelbekova A. K. The sensitivity of algae to the effect of antifungal drugs // Bulletin of the Karaganda University. Series Biology. Medicine. Geography. 2020. Vol. 97, № 1. P. 90–95.
Wong M. H. Effects of cobalt and zinc to Chlorella pyrenoidosa in soft and hard water // Microbiosis. 1980. Vol. 28. P. 19–25.






 © 2011 - 2026
© 2011 - 2026