Введение
Одним из ключевых инструментов сохранения естественных экосистем и поддержания их стабильности является создание особо охраняемых природных территорий. Наиболее эффективным и доступным способом защиты природных объектов и сохранения биоразнообразия на долгосрочной основе является проведение регулярного биомониторинга водных экосистем и прогнозирование возможных изменений в них. Отечественные гидробиологи уделяют большое внимание методам и подходам, предлагаемым Европейской рамочной водной директивой, рекомендующей проводить биологический контроль состояния водных объектов (Головатюк, Зинченко, 2011; Семенченко, Разлуцкий, 2011; Андрианова, Шанько, 2022). Биологический метод оценки качества вод базируется на изучении индикаторных организмов, структурного и функционального состояния популяций и биоценозов. Методы биоиндикации, основанные на анализе состояния сообществ зообентоса, активно применяются в оценке экологического состояния естественных водоемов и водотоков.
Многие отечественные и зарубежные исследователи определяют зообентос как перспективный индикатор состояния речных экосистем, отмечая, что зообентосные сообщества чутко реагируют на любые изменения условий обитания, выступая тем самым репрезентативными биоиндикаторами (Безматерных, 2007; Яныгина, 2017; Андрианова, Шанько, 2022; Mehari et al., 2014). Для них характерна повсеместная встречаемость, достаточно высокая численность, относительно крупные размеры, удобство сбора и обработки, сочетание приуроченности к определенному биотопу с определенной подвижностью, достаточно продолжительный срок жизни, чтобы аккумулировать загрязняющие вещества за длительный период (Баканов, 2000). Ряд исследователей указывают на взаимосвязь между типом субстрата и значениями биоиндикационных индексов (Яныгина, 2017; Андрианова, Шанько, 2022; Damanik-Ambarita et al., 2016; Dickens, Graham, 2002). Отмечается также, что таксономический состав, количественные показатели и другие параметры сообществ зообентоса за продолжительный период отражают состояние гидроценоза в целом (Безматерных, 2007). Замедление течения и увеличение илистых отложений в реках, дополнительное поступление биогенов, эвтрофирование вызывают закономерную перестройку таксономической структуры зообентоса (Андрианова, Шанько, 2022).
Малые реки являются наиболее распространенными водными объектами в Костромской области. Через территорию кологривского участка заповедника «Кологривский лес» имени М. Г. Синицына протекают малые реки Понга, Кисть, Лондушка, Сеха, Вонюх, Ухта, Юрманга, Нелка, Ломенга, Чёрная, являющиеся правыми притоками разного порядка реки Унжи. Малые реки характеризуются повышенной чувствительностью к воздействиям, т. к. из-за меньшего объема, невысокой транспортирующей способности, неравномерного гидрологического режима их способность к самоочищению и саморегуляции ниже. В свою очередь, малые реки являются начальными звеньями крупных водотоков и существенно влияют на их гидробиологический и гидрохимический режимы. Поэтому изучение экосистемных процессов в бассейнах малых рек, оценка состояния их сообществ, в т. ч. зообентоса, путем комплексного анализа их биоиндикационных характеристик имеют большое значение (Пашков, Решетников, 2009).
Среди зообентосных организмов важной экологической группой является макрозообентос, представители которого имеют относительно крупные размеры, что облегчает задачу обнаружения и распознавания этих организмов. Кроме того, основу пресноводного макрозообентоса чаще всего составляют личинки насекомых, большинство из которых, по сравнению с другими гидробионтами, отличаются повышенной чувствительностью к изменениям среды. Численность организмов макрозообентоса определяется такими факторами, как тип донных отложений, гидрологические характеристики водотока, поступление аллохтонного органического вещества, температура, наличие высшей водной растительности, характеристики водосбора (Петров, Якушева, 2022).
Следует отметить также влияние зоогенных факторов на бентосные сообщества. На некоторых водотоках в пределах Государственного природного заповедника «Кологривский лес» имени М. Г. Синицына наблюдается влияние зоогенного фактора на гидробиоценозы, что связано с деятельностью обыкновенного бобра (Castor fiber L., 1758) (Зайцев и др., 2018). Деятельность бобра оказывает комплексное влияние на бентос, т. к. приводит к изменению гидрологических, гидрохимических и гидробиологических характеристик водотоков, определяя, в свою очередь, изменения и в структуре зообентосных сообществ. Так, в условиях зоогенной трансформации наблюдается замедление течения, что приводит к накоплению органических веществ в воде, повышая уровень трофии водоема, заилению дна и увеличению кормовой базы детритоядных животных, снижению количества растворенного в воде кислорода. Зарегулирование бобрами водотока приводит к структурным изменениям в макрозообентосных сообществах, а именно меняется видовой состав и численное соотношение таксономических групп, возрастает число видов-индикаторов органического загрязнения, повышается индекс сапробности, снижается индекс Шеннона за счет элиминации реофильных форм (Хицова и др., 2010).
Целью исследования является оценка фонового экологического состояния малых рек на территории заповедника «Кологривский лес» имени М. Г. Синицына по таксономическому составу и количественным показателям сообществ макрозообентоса.
Материалы
Объекты исследования – некоторые водотоки на территории заповедника «Кологривский лес» имени М. Г. Синицына. Кологривский заповедник, созданный в 2006 г., площадь охранной зоны 58939.6 га, находится на территории Кологривского, Чухломского, Парфеньевского, Нейского, Мантуровского районов Костромской области. Включает в себя два участка, расположенные в подзоне европейской южной тайги. Территория Кологривского заповедника имеет обширную сеть водотоков, мелких водоемов и заболоченных участков.
По показателям макрозообентоса изучено экологическое состояние рек: Понга, Сеха, Ломенга, Лондушка, Чёрная. Все реки кологривского участка заповедника являются малыми, но имеют свои гидрологические особенности. По классификации Рохмистрова и Наумова (Рохмистров, Наумов, 1984), река Понга относится к средне-малым, реки Сеха и Лондушка – к самым малым, реки Ломенга и Чёрная – к незначительным водотокам (Сиротин, Сиротина, 2022).
Река Понга является самой широкой и глубокой рекой, имеет длину 73 км, ширину русла 10.8 м. Глубина реки составляет от 0.14 м на перекатах до 2 м на участках, подпруженных бобровыми плотинами. Скорость течения невысокая – 0.37 м/с, прозрачность – 0.72 м, песчаное дно с песчано-илистыми участками обильно зарастает макрофитами. Количество растворенного в воде кислорода на разных участках в период исследования колебалось в диапазоне 6.7‒8.1 мг/дм3, рН – 7.5‒7.8.
Река Сеха впадает в реку Понгу, имеет длину 34 км, ширину 5.27 м, глубину 0.36 м на разных уровнях ее протяженности. Скорость течения составляет 0.14 м/с, прозрачность 0.62 м. Изученные участки сочетают перекаты с каменисто-песчаным грунтом и глубокие участки с небольшим течением, илисто-песчаным и илистым грунтом, поросшие макрофитами. Количество растворенного в воде кислорода на разных участках в период исследования колебалось в диапазоне 8.7‒14.0 мг/ дм3, рН – 7.5‒8.3.
Река Чёрная является левым притоком реки Сехи, имеет длину 7 км, среднюю ширину русла 2.23 м, глубину 0.28 м, среднюю скорость течения 0.33 м/с. Грунт в реке илистый, прозрачность воды на момент исследования высокая. Количество растворенного в воде кислорода на разных участках в период исследования колебалось в диапазоне 8.7‒13.8 мг/ дм3, рН ‒ 8.
Река Лондушка имеет длину 26 км, среднюю ширину 3.84 м, глубину 0.55 м, прозрачность 0.53 м. Средняя скорость течения составляла 0.04 м/с, на некоторых участках достигала 0.57 м/с. В среднем и нижнем течениях отмечается высокая степень зарастания реки макрофитами (Сиротин, Сиротина, 2022). Грунт на большинстве участков представлен иловыми или песчано-иловыми отложениями. Количество растворенного в воде кислорода на разных участках в период исследования колебалось в диапазоне 8.4‒11.1 мг/ дм3, рН ‒ 8‒8.5.
Река Ломенга является правым притоком реки Лондушки, имеет длину 14 км, среднюю ширину 4.7 м, прозрачность 0.25‒0.8 м. Течение слабое и составляет 0.03 м/с. Берега реки топкие, заболоченные, плотно поросшие высшей водной растительностью. Грунт песчано-илистый, вода в реке имеет темный оттенок (Летопись природы..., 2022). Количество растворенного в воде кислорода в период исследования составило 6.9‒7.4 мг/ мг/дм3, рН ‒ 7.4.
В целом исследованные реки характеризуются илистым и песчано-илистым характером дна, невысоким содержанием кислорода в пределах 6.7–14.0 мг/дм3. В бобровых прудах и на участках рек, перегороженных бобровыми плотинами, отмечается самое низкое содержание кислорода (Сиротин, Сиротина, 2022).
Исследование сообществ макрозообентоса с последующей оценкой экологического состояния некоторых малых рек на территории кологривского кластера заповедника проводились в летний период 2021‒2023 гг. Материалом работы послужили качественные и количественные пробы макрозообентоса, отобранные в нескольких мониторинговых станциях речных экосистем: р. Понга ‒ 6 станций, р. Сеха ‒ 5 станций, Лондушка ‒ 3 станции, р. Чёрная ‒ 2 станции, р. Ломенга ‒ 1 станция. На каждой станции отбирались одна качественная и две количественные пробы в каждый год исследования (рис. 1).
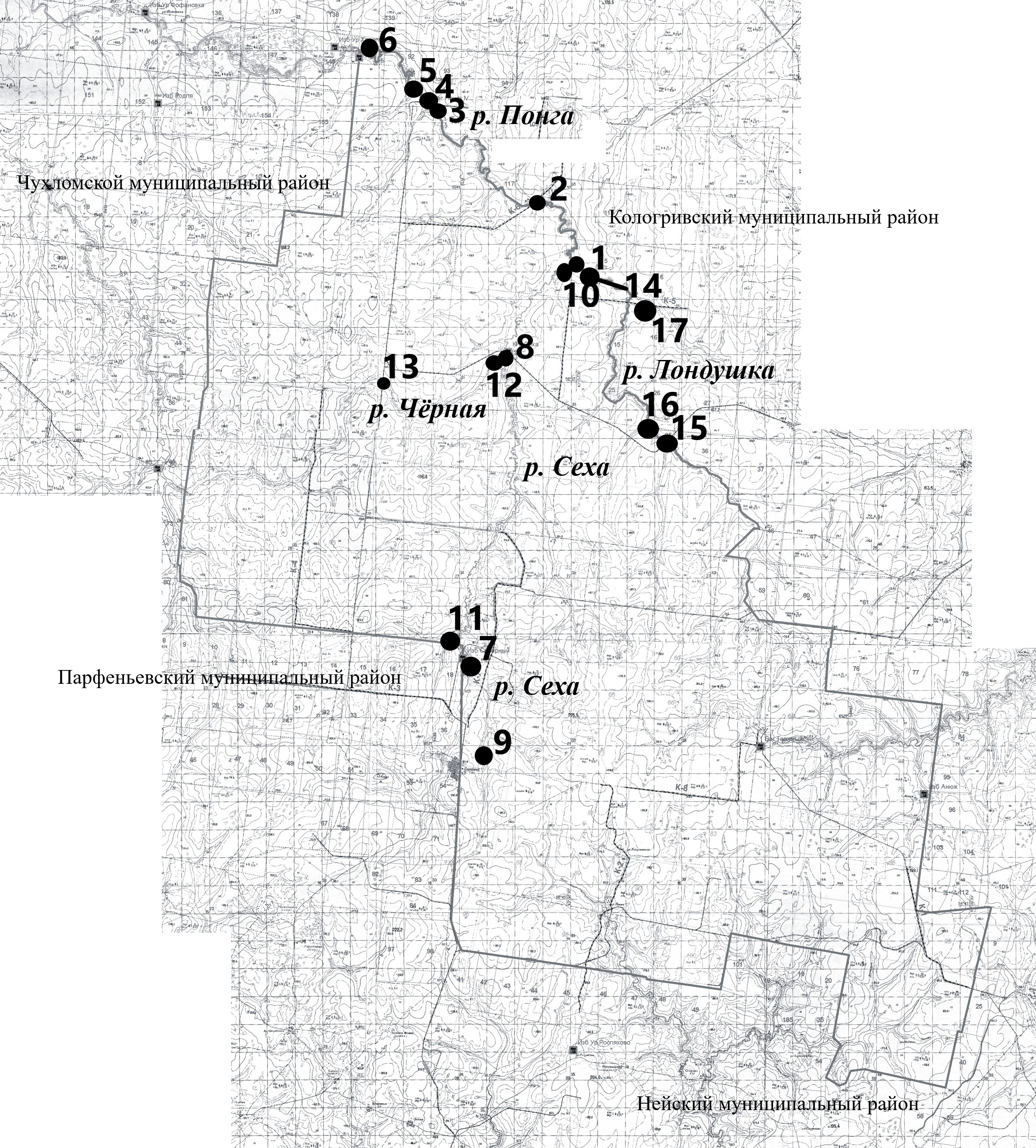
Рис. 1. Карта-схема расположения станций отбора проб зообентоса на территории кологривского кластера заповедника р. Понга: 1, 2 ‒ верхнее течение; 3 ‒ среднее течение, бобровый пруд; 4, 5, 6 ‒ среднее течение; р. Сеха: 7, 9 ‒ верхнее течение; 8 ‒ среднее течение; 10 ‒ нижнее течение; 11 ‒ бобровый пруд; р. Чёрная: 12 ‒ нижнее течение; 13 ‒ среднее течение; р. Лондушка ‒ 14 нижнее течение; 15 ‒ среднее течение; 16 ‒ бобровый пруд р. Ломенга ‒ 17.
Fig. 1. A map of the location of zoobenthos sampling stations on the territory of the Kologrivsky cluster of the reserve. Ponga river: 1, 2 ‒ upper current; 3 ‒ middle current, beaver pond; 4, 5, 6 ‒ middle current; Sekha river: 7, 9 ‒ upper current; 8 ‒ middle current; 10 ‒ lower current; 11 ‒ beaver pond; Chernaya River: 12 ‒ lower current; 13 ‒ middle current; Londushka river ‒ 14 lower current; 15 ‒ middle current; 16 ‒ beaver pond of Lomeng River ‒ 17
Методы
Сбор и обработка проб макрозообентоса проводились по общепринятым в гидробиологии методикам (Методические рекомендации..., 1984; Руководство..., 1992). Бентосные пробы отбирались при помощи гидробиологического скребка и дночерпателя Экмана – Берджа, промывались и разбирались в ситах в соответствии с рекомендациями. Донные беспозвоночные фиксировались формалином, концентрация которого доводилась до 4 %. Определение организмов проводилось с использованием микроскопа «Бимед» и бинокулярной лупы МБС-2. Для идентификации видов макрозообентоса использовались определители следующих авторов: Л. А. Кутиковой, Я. И. Старобогатова (Кутикова, 1977); В. Р. Цалолихина (Определитель пресноводных беспозвоночных..., 1994, 1997, 2000, 2001); С. Я. Цалолихина, В. Р. Алексеева (Определитель зоопланктона и зообентоса..., 2016). Для оценки качества воды исследованных водотоков по бентосу были рассчитаны показатели численности, биомассы, биотические индексы Вудивисса (Woodowiiss, 1964), Пантле – Букка в модификации Н. А. Дзюбан и С. П. Кузнецовой (Зуева, 2019), а также индекс BMWP (Biological Monitoring Working Party Index) и его производное ASPT (Average Score Per Taxon Index) (Семенченко, Разлуцкий, 2011). BMWP связан с балльной оценкой индикаторной значимости отдельных семейств макрозообентоса, ASPT уменьшает вклад случайных таксономических групп, обнаруженных в таксонах с высокой балльной оценкой (Головатюк, Зинченко, 2020). Численность организмов определялась прямым подсчетом особей в пробе, биомасса – взвешиванием объектов на электронных весах Scoutspu (Ohaus, Switzerland). Показатели численности и биомассы пересчитывались на м2. Для оценки биоразнообразия использованы индексы видового разнообразия Шеннона и выравненности Пиелу (Шитиков и др., 2003). С целью оценки видового сходства рассчитан индекс Сёренсена – Чекановского (Sørensen, 1948; Шитиков и др., 2003). При анализе трофической структуры сообществ макрозообентоса были выделены следующие группы организмов (Яковлев, 2005): соскребатели, собиратели-детритофаги, размельчители, фильтраторы, хищники, грунтозаглатыватели.
Результаты
В составе сообществ макрозообентоса исследованных рек обнаружено 70 низших определяемых таксонов (НОТ) беспозвоночных, которые представлены пятью таксономическими группами: Oligochaeta, Hirudinea, Bivalvia, Gastropoda и Insecta. Фаунистический состав макрозообентоса исследованных водотоков представлен в табл. 1.
Таблица 1. Фаунистический состав сообществ макрозообентоса исследованных водотоков на территории заповедника «Кологривский лес» имени М. Г. Синицына
| Таксон | Реки | ||||||
| Понга | Сеха | Лондушка | Ломенга | Чёрная | |||
| русло | бобровый пруд | русло | бобровый пруд | ||||
| Класс Oligochaeta | |||||||
| Oligochaeta incertae sedis | + | + | + | + | + | ||
| Lumbricus variegatus, Muller, 1774 | + | ||||||
| Класс Hirudinea | |||||||
| Herpobdella octoculata, Linnaeus, 1758 | + | + | + | + | + | ||
| Haemopis sanguisuga, Linnaeus, 1758 | + | + | + | ||||
| Glossiphonia complanata, Linnaeus, 1758 | + | + | |||||
| Класс Gastropoda | |||||||
| Lymnaea сf. оvata, Drapamaud, 1805 | + | ||||||
| Lymnaea cf. ampla, Hartmann, 1821 | + | ||||||
| Lymnaea stagnalis, Linnaeus, 1758 | + | + | |||||
| Lymnaea auricularia, Linnaeus, 1758 | + | ||||||
| Lymnaea glutinosa, Müller, 1774 | + | ||||||
| Viviparus contectus, Millet, 1813 | + | ||||||
| Valvata piscinalis O. F. Müller, 1774 | + | + | |||||
| Bathyomphalus contortus, Linnaeus, 1758 | + | + | + | ||||
| Choanomphalus rossmaessleri, Auerswald, 1852 | + | ||||||
| Choanomphalus riparius, Westerlund, 1865 | + | ||||||
| Planorbis sp. | + | ||||||
| Physa fontinalis, Linnaeus, 1758 | + | + | |||||
| Класс Bivalvia | |||||||
| Unio pictorum, Linnaeus,1758 | + | ||||||
| Anodonta cygnea, Linnaeus, 1758 | + | + | |||||
| Pisidium amnicum Müller, 1774 | + | + | + | + | + | + | + |
| Sphaerium sp. | + | + | + | + | + | + | |
| Класс Insecta | |||||||
| Отряд Megaloptera | |||||||
| Sialis sordida, Klingstedt, 1932 | + | + | + | ||||
| Отряд Plecoptera | |||||||
| Nemoura sp. | + | ||||||
| Отряд Ephemeroptera | |||||||
| Baetidae gen. sp. | + | ||||||
| Baetis rhodani, Pictet, 1843 | + | ||||||
| Cloeon dipterum, Linnaeus, 1761 | + | + | |||||
| Cloeon dipterum, Linnaeus, 1761 | + | + | |||||
| Baetis tricolor, Tshernova, 1928 | + | ||||||
| Potamanthus luteus, Linnaeus, 1767 | + | + | + | + | |||
| Ephemera vulgate, Linnaeus, 1758 | + | + | + | + | + | ||
| Еphemera danica, Мuller, 1764 | + | ||||||
| Habrophlebia lauta, McLachlan, 1884 | + | ||||||
| Отряд Diptera | |||||||
| Chironomus sp. | + | + | + | + | |||
| Tabanus sp. | + | + | + | ||||
| Отряд Trichoptera | |||||||
| Limnephilus flavicornis, Fabricius 1787 | + | + | + | ||||
| Limnephilus rhombicus, Linnaeus, 1758 | + | + | |||||
| Limnephilus vittatus, Fabricius, 1798 | + | + | + | ||||
| Limnophilus decipiens, Kolenati, 1848 | + | ||||||
| Limnephilus sp. | + | + | + | + | + | ||
| Anabolia soror, McLachlan, 1875 | + | + | |||||
| Potamophyax sp. | + | ||||||
| Halesus radiates, Curtis, 1834 | + | ||||||
| Halesus interpunctates, Zetterstedt, 1840 | + | ||||||
| Halesus sp. | + | + | |||||
| Goera pilosa, Fabricius, 1775 | + | ||||||
| Molanna angustata, Curtis, 1834 | + | + | + | ||||
| Molanna sp. | + | ||||||
| Athripsodes sp. | + | + | |||||
| Phryganea grandis, Linnaeus, 1758 | + | + | |||||
| Отряд Odonata | |||||||
| Libellula quadrimaculata, Linnaeus, 1758 | + | ||||||
| Coenagrion hastulatum, Charpentier, 1825 | + | ||||||
| Platycnemis pennipes, Pallas, 1771 | + | + | |||||
| Аeshna juncea, Linnaeus, 1758 | + | ||||||
| Aeschna grandis, Linnaeus, 1758 | + | ||||||
| Aeschna viridis, Eversmann, 1835 | + | ||||||
| Anax imperator, Leach, 1815 | + | ||||||
| Corduliidae gen. sp. | + | ||||||
| Cordulia aenea, Linnaeus, 1758 | + | + | |||||
| Cordulegaster boltonii, Donovan, 1807 | + | ||||||
| Somatochlora metalilica, Vander Linden, 1825 | + | ||||||
| Sympetrum flaveolum, Linnaeus, 1758 | + | ||||||
| Сalopteryx splendens, Harris, 1780 | + | ||||||
| Calopteryx virgo, Linnaeus, 1758 | + | ||||||
| Calopteryx sp. | + | ||||||
| Onychogomphus foricipatus, Linnaeus, 1758 | + | ||||||
| Отряд Coleoptera | |||||||
| Gyrinus sp. | + | ||||||
| Laccophilus sp. | + | ||||||
| Haliplus fluviatilis, Aube, 1836 | + | ||||||
| Noterus cf. crassicornis, O.F. Müller, 1776 | + | ||||||
| Нydaticus sp. | + | ||||||
| Dytiscus marginalis, Linnaeus, 1758 | + | + | |||||
| Всего НОТ | 48 | 27 | 11 | 14 | 6 | 9 | 18 |
Класс Insecta является доминирующим по количеству видов и составляет 70 % от числа всех обнаруженных НОТ зообентоса, что типично для пресных водотоков. Среди насекомых наибольшее число видов определено для отряда Ручейников (Trichoptera) и отряда Стрекоз (Odonata). Представители отряда Trichoptera составили 30.6 % от числа всех выявленных насекомых, Odonata ‒ 32.6 %. Субдоминантной группой выступают гастроподы (Gastropoda), которые составили 17.1 % от общего числа выявленных НОТ зообентоса. Остальные таксономические группы представлены меньшим количеством НОТ: Bivalvia – 5.7 %, Oligochaeta ‒ 2.9 % и Hirudinea ‒ 4.3 % от общего числа обнаруженных донных беспозвоночных. Наиболее распространенными, выявленными практически на всех станциях отбора исследованных рек, являются виды: Pisidium amnicum М. и Ephemera vulgata L., предпочитающие медленно текучие водотоки с иловатым или илистым дном. Так, в 2023 г. наибольшая количественная представленность P. amnicum отмечена в реке Лондушке, где численность данного вида составила в среднем 174.25 ± 0.94 экз./м2, причем большая часть моллюсков данного вида отмечена в пробах, отобранных в бобровом пруду. Поденки вида E. vulgata наиболее многочисленны в реке Понге, их численность составила 29.48 ± 0.46 экз./м2.
Соотношение таксономических групп по видовому разнообразию и количественным показателям варьирует в разных реках, что может быть связано с различными гидрологическими условиями, например характером дна, скоростью течения, наличием хорошо развитой прибрежной растительности и рядом других факторов (рис. 2).

А.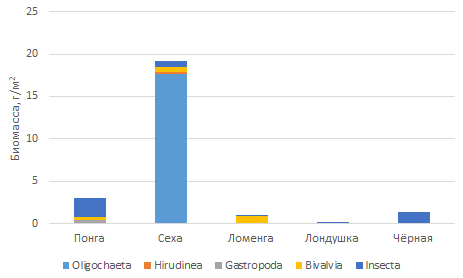
Б.
Рис. 2. Численность (А) и биомасса (Б) макрозообентоса исследованных речных экосистем заповедника
Fig. 2. The abundance (A) and biomass (Б) of the macrozoobenthos of the studied river ecosystems of the reserve
Во всех исследованных водотоках наиболее многочисленны представители класса Insecta. Насекомые представлены преимущественно личиночными формами. Наибольшее разнообразие данной группы зообентоса по количеству видов отмечено для рек Понга, где обнаружено 35 видов (численность ‒ 156.2 ± 0.068 экз./м2), и Сеха, где зарегистрировано 28 видов насекомых (численность ‒ 83.0 ± 0.008 экз./м2). Исключение составляет ситуация в реке Лондушке, где наибольшее видовое богатство отмечено у гастропод. Данная группа бентосных беспозвоночных в р. Лондушке представлена 4 семействами и составила 35.7 % от числа найденных представителей макрозообентоса. Наибольшему видовому разнообразию брюхоногих моллюсков способствует зарастаемость макрофитами и заболачивание берегов, что также приводит к заиливанию дна.
Среди брюхоногих моллюсков (Gastropoda) наибольшее количество таксономических групп и максимальные показатели численности отмечены в реке Лондушке, где гастроподы составили 35.7 % от общего числа выявленных видов донных беспозвоночных (численность ‒ 41 ± 0.001 экз./м2), и в реке Понге ‒ 10.4 % (численность ‒ 44.8 ± 0.046 экз./м2). За период исследования водотоков Кологривского заповедника зарегистрированы представители брюхоногих моллюсков следующих семейств: Lymnaeidae (5 видов), Planorbidae (3 вида), Viviparidae (1 вид), Valvatidae (1 вид), Physidae (1 вид). Представители гастропод данных семейств в основном предпочитают медленно текучие водотоки с заросшими высшей растительностью берегами и со слабо заиленным грунтом дна, что в целом соответствует экологическим условиям, сложившимся в исследованных реках заповедника.
Двустворчатые моллюски (Bivalvia) наиболее многочисленны в реке Лондушке, где данная группа представлена Sphaerium sр. Численность этой зообентосной группы составила 287 ± 0.83 экз./м2. Более крупные виды двустворок ‒ Unio pictorum L. и Anodonta cygnea L. обнаружены только на станциях отбора реки Понги. A. cygnea занесена в Красную книгу Костромской области как восстанавливаемый и восстанавливающийся вид (Красная книга..., 2019).
Во всех исследованных реках выявлены типичные представители бентосных сообществ ‒ олигохеты и пиявки, достаточно устойчивые к органическому загрязнению. Показатели численности и биомассы олигохет и пиявок в исследованных реках заповедника варьируют от 20.5 ± 0.026 до 210.2 ± 0.013 экз./м2 и от 0.0002 ± 0.006 до 0.32 ± 0.01 г/м2 соответственно. Наибольшая их численность за период исследования отмечена в реке Понге, для которой индекс разнообразия Шеннона ‒ Уивера наибольший среди исследованных рек ‒ 1.22, индекс выровненности Пиелу ‒ 0.35, что говорит о большем видовом разнообразии и более равномерном распределении видов в сообществе. Индекс видового разнообразия меньше в реках Черная – 0.74 и Лондушка – 0.63, индекс выровненности составил 0.26 и 0.24 соответственно.
Для определения таксономического сходства исследованных рек рассчитан индекс Сёренсена ‒ Чекановского (табл. 2). Наибольшие значения меры сходства Сёренсена ‒ Чекановского отмечены для рек Понга и Чёрная, Понга и Сеха, Сеха и Лондушка.
Таблица 2. Оценка видового сходства различных гидробиоценозов
| Водотоки | р. Сеха | р. Ломенга | р. Лондушка | р. Чёрная |
| р. Понга | 0.35 | 0.11 | 0.23 | 0.43 |
| р. Сеха | 0.25 | 0.33 | 0.28 | |
| р. Ломенга | 0.09 | 0.12 | ||
| р. Лондушка | 0.29 |
На период исследования в реках Сеха и Лондушка наблюдалось влияние зоогенного фактора на водные экосистемы. В бобровых прудах обнаружены представители четырех таксономических групп ‒ Hirudinea, Bivalvia, Gastropoda и Insecta. Всего за период исследования в прудах выявлено 14 НОТ макрозообентоса (см. табл. 1). В условиях запруживания речных экосистем в результате деятельности бобра также доминируют насекомые, среди которых встречаются поденки, ручейники и двукрылые. Субдоминантной группой по числу видов являются брюхоногие моллюски, представленные такими видами, как Lymnaea stagnalis L., Valvata piscinalis M., Bathyomphalus contortus L. Среди двустворчатых моллюсков выявлены представители родов Sphaerium sp. и Pisidium sp., численность которых по данным 2023 г. исследования в реке Лондушке в условиях запруживания составила 164 ± 0.32 экз.⁄м2 для Sphaerium sp. и 338.25 ± 0.76 экз.⁄м2 для Pisidium sp. Оценка качества вод в бобровых прудах с использованием индексов BMWP и ASPT показала по р. Лондушке низкие показатели качества (BMWP – 22 «плохое», ASPT – 3.6 «посредственное»), по р. Сехе – более высокие показатели (BMWP – 55 «хорошее», ASPT ‒ 5 «прекрасное»).
Одним из биоиндикационных показателей является оценка трофической структуры сообществ макрозообентоса, которая определяется по способу потребления пищи донными беспозвоночными. По типу питания выявленные в ходе исследования представители макрозообентоса относились к различным экологическим группам: соскребателям, собирателям-детритофагам, размельчителям, фильтраторам, хищникам и другим трофическим группам. Однако следует учитывать, что некоторые виды имеют смешанное питание – соскребатели-детритофаги и облигатные собиратели-фильтраторы, или соскребатели и размельчители. Соотношение трофических групп донных беспозвоночных исследованных водотоков заповедника по видовому составу представлено на рис. 3.
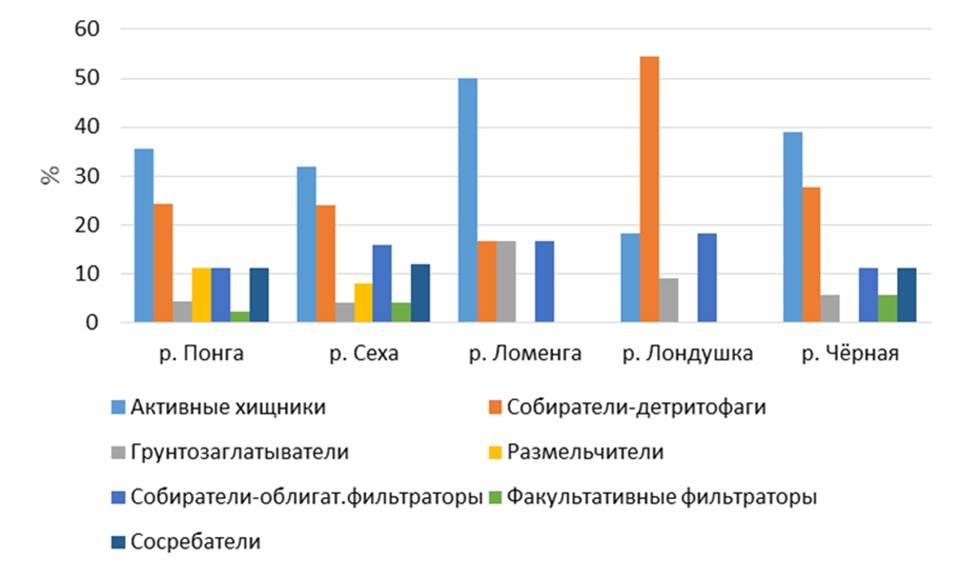
Рис. 3. Соотношение трофических групп макрозообентоса в исследованных реках
Fig. 3. The ratio of macrozoobenthos trophic groups in the studied rivers
За период исследования в большинстве рек наибольшее таксономическое разнообразие характерно для хищников, которые составили от 32 до 38.9 % от общего числа выявленных представителей макрозообентоса. Следующей по количеству НОТ явилась группа собирателей-детритофагов, которые составили от 16.7 до 27.8 %. Исключением является трофическая структура сообществ макрозообентоса реки Лондушки, где собиратели-детритофаги имели наибольшее видовое разнообразие, их доля в сообществе составила 54.5 % от общего числа групп на станциях отбора проб, эта же трофическая группа была преобладающей в структуре макрозообентоса в данной реке и по биомассе. Активные хищники преобладали по биомассе в реках Понга и Сеха (рис. 4). В составе макрозообенотоса р. Сехи наибольшие показатели биомассы также отмечены для таких групп, как грунтозаглатыватели и собиратели ‒ облигатные фильтраторы, в р. Понге ‒ собиратели-детритофаги и собиратели ‒ облигатные фильтраторы.
jpg.jpg) Рис. 4. Процентное соотношение таксономических групп макрозообентоса по биомассе (г/м2) в исследованных реках
Рис. 4. Процентное соотношение таксономических групп макрозообентоса по биомассе (г/м2) в исследованных реках
Fig. 4. Percentage of macrozoobenthos taxonomic groups by biomass (g/m2) in the studied rivers
Оценка экологического состояния исследованных рек по индексу Вудивисса показала, что реки Сеха, Понга и Чёрная относятся к 3-му классу (значение индекса 6‒7), что соответствует «умеренному загрязнению», реки Ломенга и Лондушка ‒ к 4-му классу качества ‒ «загрязненные». По результатам оценки качества вод малых рек заповедника по сапробиологической системе Пантле ‒ Букка в большинстве рек не выявлены различия между станциями отбора проб. Реки Понга, для которой значение индекса сапробности варьирует от 1.8 до 2.4, Сеха (2.1‒2.5, за исключением бобрового пруда), Лондушка (2.2‒2.5) и Чёрная (2.1‒2.5) относятся к β-мезосапробным (3-й класс – «умеренно загрязненные»). Река Ломенга, для которой индекс Пантле ‒ Букка составил 2.7, относится к α-мезасапробному типу ‒ 4-му классу «загрязненной». Индекс сапробности вод бобрового пруда реки Сехи составил 2.9, что также соответствует α-мезасапробному типу.
Расчеты индексов BMWP и ASPT, основанные на разной чувствительности макрозообентоса к органическому загрязнению, продемонстрировали в целом высокие показатели качества вод исследованных водотоков (рис. 5).
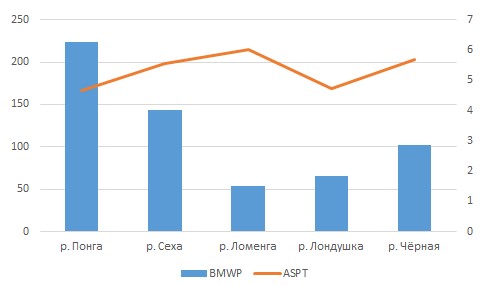
Рис. 5. Значение индексов BMWP и ASPT исследованных рек заповедника
Fig. 5. The value of the BMWP and ASPT indices of the studied rivers of the reserve
В различных реках значение индекса BMWP варьировало от 54 («хорошее» качество ‒ реки Ломенга и Лондушка) до 224 («исключительное» качество ‒ р. Понга), значение индекса ASPT ‒ от 4.7 («очень хорошее» ‒ реки Понга и Лондушка) до 6 («прекрасное» ‒ реки Чёрная и Сеха). Однако в реке Лондушке отмечены различия качества вод по станциям отбора проб (табл. 3). Так, низкие показатели биотических индексов в реке Лондушке определены на участке впадения в водоток р. Ломенги (станция 1), для которого характерен песчано-илистый грунт, а также на станции в условиях влияния бобровой деятельности на водоток, где отмечается накопление илистых донных отложений. Обнаруженные на станции 1 в р. Лондушке представители семейства Ephemeridae имеют наибольший балл согласно расчетам индекса BMWP.
Таблица 3. Значения биотических индексов исследованных водотоков по станциям отбора проб
| Станции отбора проб | Биотический индекс | |
| BMWP | ASPT | |
| р. Понга | ||
| Станция 1 | 138 (очень хорошее) | 6 (прекрасное) |
| Станция 2 | 57 (хорошее) | 6.3 (прекрасное) |
| Станция 3 | 78 (хорошее) | 5.6 (прекрасное) |
| Станция 4 | 62 (хорошее) | 5.2 (прекрасное) |
| Станция 5 | 37 (невысокое) | 5.3 (прекрасное) |
| Станция 6 | 18 (плохое) | 4.5 (хорошее) |
| р. Сеха | ||
| Станция 1 | 84 (хорошее) | 6.5 (прекрасное) |
| Станция 2 | 77 (хорошее) | 5.92 (прекрасное) |
| Станция 3 | 66 (хорошее) | 5.1 (прекрасное) |
| Станция 4 | 86 (хорошее) | 6.6 (прекрасное) |
| Станция 5 (бобровый пруд) | 55 (хорошее) | 5 (прекрасное) |
| р. Ломенга | 55 (хорошее) | 6 (прекрасное) |
| р. Лондушка | ||
| Станция 1 | 26 (невысокое) | 3.7 (посредственное) |
| Станция 2 | 46 (невысокое) | 5.1 (прекрасное) |
| Станция 3 (бобровый пруд) | 22 (плохое) | 3.6 (посредственное) |
| р. Чёрная | ||
| Станция 1 | 52 (хорошее) | 4.6 (очень хорошее) |
| Станция 2 | 90 (хорошее) | 5.6 (прекрасное) |
Обсуждение
Ввиду отсутствия влияния источников антропогенного загрязнения малые реки заповедника могут быть использованы в качестве фоновых (условно чистых) водотоков. Значения индексов BMWP и ASPT на основе видового состава сообществ макрозообентоса показали достаточно высокое качество вод исследованных речных экосистем. Наибольшая (10 баллов) оценка, согласно расчету индекса, была присвоена обитающим в реках видам из семейств Leptophlebidae, Potamanthidae, Molannidae, Ephemeridae (Ephemeroptera), Goeridae (Trichoptera). По сапробиологической системе Пантле ‒ Букка большинство исследованных рек относятся к β-мезосапробным (р. Понга, Сеха, Лондушка, Чёрная), что говорит о незначительном накоплении органических веществ и достаточно большом видовом разнообразии гидробионтов. Наибольшее значение индекса видового разнообразия Шеннона отмечено в реках Понга (1.21), Чёрная (0.73), Лондушка (0.63). Река Ломенга и бобровый пруд р. Сехи относятся к α-мезасапробному типу и характеризуются слабым течением, заболоченностью берегов (р. Ломенга), песчано-илистым и илистым грунтом.
Таксономический состав и количественные показатели сообществ макрозообентоса зависят от многих экологических факторов. На структуру макрозообентоса оказывают влияние такие факторы, как скорость течения, характер грунта, наличие признаков зарастаемости прибрежных участков речных экосистем макрофитами, что отмечают многие исследователи, в т. ч. исследователи зообентосных сообществ малых рек сопредельных районов (Фролова, Баянов, 2010; Ивичева, 2016). Все исследованные малые реки характеризуются зарастаемостью берегов прибрежной растительностью, в ряде случаев берега затоплены.
Значительных изменений соотношения основных таксономических и трофических групп, количественных показателей сообществ зообентоса на участках, находящихся под влиянием зоогенного фактора, за период исследования не отмечено. Во всех исследованных реках Кологривского заповедника, в т. ч. на участках, находящихся под зоогенным влиянием, наиболее представлены личинки насекомых. Высокие показатели численности насекомых характерны для рек Понга и Сеха, отличающихся песчаным характером дна. Численность насекомых уменьшалась в условиях песчано-илистого и илистого грунта, а также в условиях значительной зарастаемости прибрежной растительностью берегов рек Лондушка, Ломенга и Черная. Наибольшие показатели биомассы насекомых, за счет большой представленности личинок различных видов стрекоз (Odonata), ручейников (Trichoptera), поденок (Ephemeroptera), а также представителей семейства Dytiscidae, отмечены в реках Понга и Чёрная. В реке Сехе в условиях влияния зоогенного фактора выявлены виды таких семейств, как Potamanthidae и Ephemeridae, отмеченные наибольшим баллом по системе оценок BMWP. В бобровом пруде реки Лондушки такие биоиндикаторные виды не обнаружены.
В реках Сеха и Лондушка за период исследований отмечена высокая численность двустворчатых моллюсков (Bivalvia), представленных семействами Unionidae и Sphariidae. Набольшие показатели численности двустворок рода Pisidium sp. определены на участках влияния зоогенного фактора рек Лондушка и Сеха в условиях песчано-илистого грунта.
Наибольшие показатели численности Oligochaeta и Hirudinea зарегистрированы в реке Понге, где в районе бобровой плотины и ниже по течению были обнаружены Lumbricus variegatus и различные виды пиявок, предпочитающие водные экосистемы со стоячей или медленно текущей водой, обильно заросшие растительностью.
Соотношение экологических групп бентоса по типу питания в исследованных реках значительно отличается. В реках Понга и Сеха по количеству НОТ выявлено 7 экологических групп, в реке Чёрной ‒ 6, в реках Лондушка и Ломенга ‒ по 4 в каждой. В реках Сеха, Понга, Чёрная доминировали активные хищники и собиратели-детритофаги, в р. Лондушке значительна группа собирателей-детритофагов, которые составили 54.5 % от общего числа выявленных представителей макрозообентоса, в р. Ломенге ‒ активные хищники (50 %). Преобладание детритофагов в сообществе зообентоса реки Лондушки может свидетельствовать о накоплении органики, чему способствует зарастаемость макрофитами и заболоченность берегов водотока.
Таким образом, исследованные малые реки отличаются достаточно большим видовым разнообразием зообентоса. Наибольшее количество видов и количественная представленность характерны для насекомых, что типично для пресных водоемов. В условиях влияния зоогенного фактора за период исследования отмечено снижение видового разнообразия и количественных показателей сообществ макрозообентоса, что, вероятно, связано с сукцессионными процессами. Однако соотношение основных таксономических и трофических групп зообентоса малых рек Кологривского заповедника, а также показателей их численности и биомассы изменяется в целом незначительно.
Заключение
Исследованные водотоки на территории Кологривского заповедника отличаются песчано-илистым и илистым дном с разной степенью зарастания берегов прибрежной растительностью. В пределах некоторых рек наблюдается деятельность речного бобра. По сапробиологической системе Пантле ‒ Букка реки Понга, Сеха, Лондушка и Чёрная относятся к β-мезосапробным (3-й класс – «умеренно загрязненные»), река Ломенга ‒ к α-мезасапробному типу (4-й класс ‒ «загрязненная»). Значение индекса BMWP свидетельствует в целом о высоком качестве вод в реках заповедника и оценивается как «исключительное» ‒ в р. Понге, «очень хорошее» ‒ в реках Сеха и Чёрная, «хорошее» ‒ в реках Ломенга и Лондушка. Индекс ASPT показал «прекрасное» качество вод в реках Сеха, Ломенга и Чёрная; «очень хорошее» ‒ в реках Понга и Лондушка. В большинстве исследованных рек не выявлены различия в качестве вод по станциям отбора проб. Различия в качестве вод по станциям определены только для реки Лондушки, где выявлено по ряду станций снижение значений биотических индексов, что может быть обусловлено изменением в характере грунта в связи с накоплением илистых отложений. Также наблюдается различие значения индекса сапробности вод бобрового пруда реки Сехи в отличие от других станций отбора проб (α-мезасапробный тип).
В ходе исследования сообществ макрозообентоса некоторых малых рек Кологривского заповедника выявлено 70 низших определяемых таксонов (НОТ) беспозвоночных, которые представлены пятью таксономическими группами: Oligochaeta, Hirudinea, Bivalvia, Gastropoda и Insecta. Во всех исследованных малых реках наблюдалось доминирование насекомых, что типично для пресных водоемов и водотоков. Однако в условиях высокой зарастаемости берегов макрофитами в структуре сообществ макрозообентоса возрастает доля брюхоногих моллюсков, которые являются детритофагами, что может быть признаком накопления органических веществ. В период исследований немногочисленны чувствительные к изменению условий веснянки. Среди данной группы выявлены только представители рода Nemoura в реке Понге, которые обычны для мезотрофных водоемов. В условиях зоогенного влияния снижение разнообразия зообентоса не наблюдалось, по-прежнему доминировали насекомые, субдоминантной группой являлись брюхоногие моллюски, что связано с хорошей кормовой базой для них вследствие зарастаемости прибрежных участков, замедлением скорости водотока и накоплением органических веществ. В трофической структуре сообществ макрозообентоса во всех исследованных реках доминировала группа активных хищников, за исключением реки Лондушки, где по количеству видов и биомассе доминировали собиратели-детритофаги, и реки Чёрной, в зообентосных сообществах которой по биомассе доминировали собиратели ‒ облигатные фильтраторы.
Библиография
Андрианова А. В., Шанько Ю. В. Биотические индексы и метрики зообентоса в оценке экологического состояния крупной реки смешанного типа // Экология. 2022. № 2. С. 145–152.
Баканов А. И. Использование зообентоса для мониторинга пресноводных водоемов (обзор) // Биология внутренних вод. 2000. № 1. С. 68–82.
Безматерных Д. М. Зообентос как индикатор экологического состояния водных экосистем Западной Сибири: Аналитический обзор / Под ред. Д. М. Безматерных. Новосибирск: ГПНТБ СО РАН, 2007. Вып. 85. 86 с.
Головатюк Л. В., Зинченко Т. Д. Биотические идентификаторы в оценке качества воды эталонной реки: сравнительный анализ биоиндикационных индексов реки Байтуган (Высокое Заволжье) // Ученые записки Казанского университета. Серия: Естественные науки. 2020. Т. 162, кн. 1. С. 134–150.
Головатюк Л. В., Зинченко Т. Д. Биотические индексы и метрики в оценке качества воды малых рек Нижнего Поволжья (на примере рек Байтуган, Камышла, Сосновка) // Особенности пресноводных экосистем малых рек Волжского бассейна / Под ред. Г. С. Розенберга, Т. Д. Зинченко. Тольятти: Кассандра, 2011. С. 160–169.
Зайцев В. А., Сиротина М. В., Мурадова Л. В., Ситникова О. Н. Бобры заповедника «Кологривский лес» // Бобры в заповедниках европейской части России / Под ред. Н. А. Завьялова, Л. А. Хляп. Великие Луки: ООО «Великолукская типография», 2018. С. 125–180.
Зуева Н. В., Алексеев Д. К., Куличенко А. Ю. Биоиндикация и биотестирование в пресноводных экосистемах: Учебное пособие для высших учебных заведений . СПб.: Российский государственный гидрометеорологический университет, 2019. 140 с.
Ивичева К. Н. Зообентос малых рек-притоков Верхней Сухоны // Вода: химия и экология. 2016. № 8 (98). С. 53–59.
Красная книга Костромской области / В. И. Бондаренко, А. С. Дюкова, Д. Н. Зонтиков ; Науч. ред. М. В. Сиротина ; Администрация Костромской области, Департамент природных ресурсов и охраны окружающей среды Костромской области, Костромской государственный университет. 2-е изд., перераб. и доп. Кострома: Костромской гос. ун-т, 2019. 431 с.
Кутикова Л. А. Определитель пресноводных беспозвоночных Европейской части СССР: ] / Отв. ред. д-ра биол. наук Л. А. Кутикова, Я. И. Старобогатов; Гл. упр. гидрометеорол. службы при Совете Министров СССР, Зоол. ин-т АН СССР. Л.: Гидрометеоиздат, 1977. 511 с.
Летопись природы государственного природного заповедника «Кологривский лес» имени М. Г. Синицына ⁄ Сост. С. А. Чистяков. Кологрив: ООО «Костромской печатный дом», 2022. 138 с.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах: Зообентос и его продукция / Сост. А. А. Салазкин, А. Ф. Алимов, Н. П. Финогенова. Л.: ГосНИОРХ, 1984. 52 с.
Определитель пресноводных беспозвоночных России и сопредельных территорий. Т. 1. Низшие беспозвоночные . СПб.: Наука, 1994. 400 с.
Определитель пресноводных беспозвоночных России и сопредельных территорий. Т. 3. Паукообразные. Низшие насекомые ⁄ Под ред. С. Я. Цалолихина. СПб.: Наука, 1997. 439 с.
Определитель пресноводных беспозвоночных России и сопредельных территорий. Т. 4. Двукрылые насекомые ⁄ Под ред. С. Я. Цалолихина. СПб.: Наука, 2000. 997 с.
Определитель пресноводных беспозвоночных России и сопредельных территорий. Т. 5. Высшие насекомые ⁄ Под ред. С. Я. Цалолихина. СПб.: Наука, 2001. 825 с.
Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 2. Зообентос ⁄ Под ред. В. Р. Алексеева, С. Я. Цалолихина. М.; СПб.: Товарищество научных изданий КМК, 2016. 457 с.
Пашков А. Н., Решетников С. И. Сравнительная оценка состояния зообентосных и рыбных сообществ малых рек Черноморского побережья северо-западного Кавказа // Известия Самарского научного центра Российской академии наук. 2009. Т. 11, № 1 (2). С. 119‒122.
Петров Д. С., Якушева А. М. Оценка экологического состояния малых водотоков Санкт-Петербурга по показателям зообентоса в 2019–2021 гг. // Вестник Санкт-Петербургского университета. Науки о Земле. 2022. Т. 67 (3). С. 529–544.
Рохмистров В. Л., Наумов С. С. Физико-географические закономерности распределения речной сети Ярославского Нечерноземья ⁄ Под ред. А. Б. Дитмар // Географические аспекты рационального природопользования в Верхневолжском Нечерноземье: Межвузовский сборник научных трудов. Ярославль: ЯГПИ им. К. Д. Ушинского, 1984. С. 53–64.
Руководство по гидробиологическому мониторингу пресноводных экосистем / Ин-т глобал. климата и экологии; Под ред. В. А. Абакумова. СПб.: Гидрометеоиздат, 1992. 317 с.
Семенченко В. П., Разлуцкий В. И. Экологическое качество пресных вод . 2-е изд., испр. Минск: Беларуская навука, 2011. 328 с.
Сиротин А. Л., Сиротина М. В. Структура зоопланктона разных биотопов малых рек Кологривского кластера заповедника «Кологривский лес» // Трансформация экосистем. 2022. № 5 (4). С. 112–125.
Хицова Л. Н., Силина А. Е., Мелашенко М. В. Доминантно-информационная структура донных зооценозов пойменных водоемов в местах обитания бобра в Усманском Бору // Вестник ВГУ. Серия: Химия. Биология. Фармация. 2010. № 1. С. 127‒132.
Шитиков В. К., Розенберг Г. С., Зинченко Т. Д. Количественная гидроэкология: методы современной идентификации. . Тольятти: ИЭВБ РАН, 2003. 463 с.
Фролова Е. А., Баянов Н. Г. Обзор фауны водных беспозвоночных (бентоса, мейобентоса и нейстона) Нижегородской области и сопредельных регионов // Вестник Мордовского госуниверситета. 2010. № 1. С. 33‒41.
Яковлев В. А. Пресноводный зообентос северной Фенноскандии (разнообразие, структура и антропогенная динамика). Ч. 2 . Апатиты: Изд. Кольского НЦ РАН, 2005. 145 с.
Яныгина Л. В. Донные сообщества в оценке экологического состояния малой реки Издревой // Известия Алтайского отделения Русского географического общества. 2017. Т. 47, № 4. С. 93–100.
Damanik-Ambarita M. N., Lock K., Boets P. et al. Ecological water quality analysis of the Guayas river basin (Ecuador) based on macroinvertebrates indices // Limnologica. Vol. 57. P. 27–59. DOI: 10.1016/j.limno.2016.01.001
Dickens C. W. S., Graham P. M. The South African Scoring System (SASS) version 5 rapid bioassessment method for rivers // African Journal of Aquatic Science. 2002. Vol. 27. P. 1–10. DOI: 10.2989/16085914.2002.9626569
Mehari A. K., Wondie A., Mingist M., Vijverberg J. Spatial and seasonal variation in the macro-invertebrates and physico-chemical parameters of the Enfranz River, Lake Tana sub-basin (Ethiopia) // Ecohydrology & Hydrobiology. 2014. Vol. 14. P. 304–312. DOI: 10.1016/j.ecohyd.2014.07.004
Sørensen T. Method of establishing groups of equal amplitude in plant sociology based on similarity of species content // Biologiske skrifter. 1948. No 5 (4). Р. 1–34.
Woodowiiss F. S. The biological system of stream classification used by the Trent Board // Chem. And Ind. 1964. Vol. 11. P. 443–447.






 © 2011 - 2026
© 2011 - 2026