Введение
Существуют различные классификации антропогенных факторов: по видам загрязнителей, по пространственной локализации и пр. Одна из классификаций глобальных угроз на биоразнообразие рек предложена Vörösmarty et al. (2010) и включает в себя четыре группы фаторов: прямое загрязнение вод (сбросы сточных вод), изменение гидрологического режима (создание водохранилищ, системы мелиорации и пр.), биологическое загрязнение (инвазии) и преобразование водосборов (Vörösmarty et al., 2010). Любой водный объект необходимо рассматривать совместно с его водосбором. Деятельность человека на водосборах напрямую влияет на качество вод водных объектов (Flotemersch et al., 2015). Любое преобразование территории водосборов напрямую угрожает гидробионтам, обитающим в водных объектах (Vörösmarty et al., 2010). Биоразнообразие водных экосистем является одним из важнейших критериев оценки качества вод в водных объектах. Городские территории всегда являются источником прямых сбросов, причем абсолютно различного качественного состава. Именно городские территории благодаря большим площадям непроницаемых для стока покрытий являются самыми преобразованными водосборами. Вблизи городов также происходит вырубка лесов и использование территории для сельскохозяйственных угодий. Негативным фактором помимо усиления эррозии является внесение минеральных удобрений. Все эти процессы можно обозначить одним термином «урбанизация». Поэтому говорят о комплексном воздействии урбанизированных территорий (Grizzetti et al., 2017). С урбанизацией также тесно связан показатель плотности населения (Luck, 2007). Негативное влияние урбанизации водосбора на биоразнообразие различных групп гидробионтов и качество вод описано в многочисленных работах (Carle et al., 2005; Smith, Lamp, 2008; Kuzmanović et al., 2016; Kuzmanovic et al., 2017).
Водосборный подход к анализу качества вод широко применяется в мировой практике. Так, связь водных макробеспозвоночных со степенью урбанизации, распаханности и лесистости водосборов приведена в работах (Wang, Kanehl, 2003; Davies et al., 2010; Cuffney et al., 2010; Beixin et al., 2012; Gao et al., 2014; Lakew, Moog, 2015), фитопланктона – в работе (Kim et al., 2016). В то же время вопрос влияния водосборов на сообщества гидробионтов в нашей стране изучен слабо. Для таежной зоны, например, показано влияние вырубок на сообщества гидробионтов (Батурина и др., 2020). При этом именно таежная зона занимает существенную площадь нашей страны и благодаря избыточному увлажнению богата реками и озерами.
Оценка экологического состояния водных объектов осуществляется на основе данных о биоразнообразии и количественных показателей гидробионтов разных уровней: от бактерий до рыб. Широко используются такие экологические группы, как высшая водная растительность, фитопланктон, зоопланктон, зообентос, как по отдельности, так и совместно (Zueva, Bobrov, 2018; Springe et al., 2006; Paggi et al., 2006; Angeler, Goedkoop, 2010; Collier et al., 2013; Eikenberry et al., 2016; Wu et al., 2017; Chagas et al., 2017; Hoang et al., 2018; Зуева и др., 2021). Фито- и зоопланктон характеризуются короткими жизненными циклами и связаны главным образом с водной массой. Планктонные организмы характеризуют качество вод в конкретный момент времени. Макрофиты и зообентос обладают длительными жизненными циклами и связаны с субстратом. Они отражают хроническое воздействие и могут охарактеризовать общее экологическое состояние водоема. Для оценки экологического состояния рек чаще всего используют зообентос. Европейская рамочная директива закрепляет использование макрофитов и зообентоса для оценки экологического состояния рек на территории Евросоюза (Directive, 2000; Семенченко, 2004).
Вологодская область, как и вся таежная зона Европейской части России в целом, характеризуется низкой степенью урбанизации. Городская застройка незначительна, преобладают сельские населенные пункты. Сельскохозяйственные угодья также сосредоточены вокруг крупных населенных пунктов. Район бассейна Верхней Сухоны является наиболее населенной территорией в пределах Вологодской области (Природа…, 2007). Очистка сточных вод от индивидуальных хозяйств практически отсутствует. По данным мониторинговых служб, водотоки, протекающие по данной территории, по гидрохимическим показателям являются наиболее загрязненными реками Вологодской области. Ранее для территории региона авторами уже была проведена оценка хозяйственной деятельности на водосборе на сообщества зообентоса (Ивичева, Филоненко, 2012, 2019), химический состав вод (Ивичева, Филоненко, 2013, 2017), а также показано изменение биоразнообразия фитопланктона, зоопланктона, зообентоса и высшей водной растительности под действием различных антропогенных факторов (Ivicheva et al., 2018).
В настоящей работе рассмотрено влияние урбанизации водосборов на качество вод водотоков, оцененное по химическим и гидробиологическим показателям (высшая водная растительность, фитопланктон, зоопланктон, зообентос) на примере таежной зоны. В качестве модельной территории выбраны притоки р. Сухоны.
Материалы
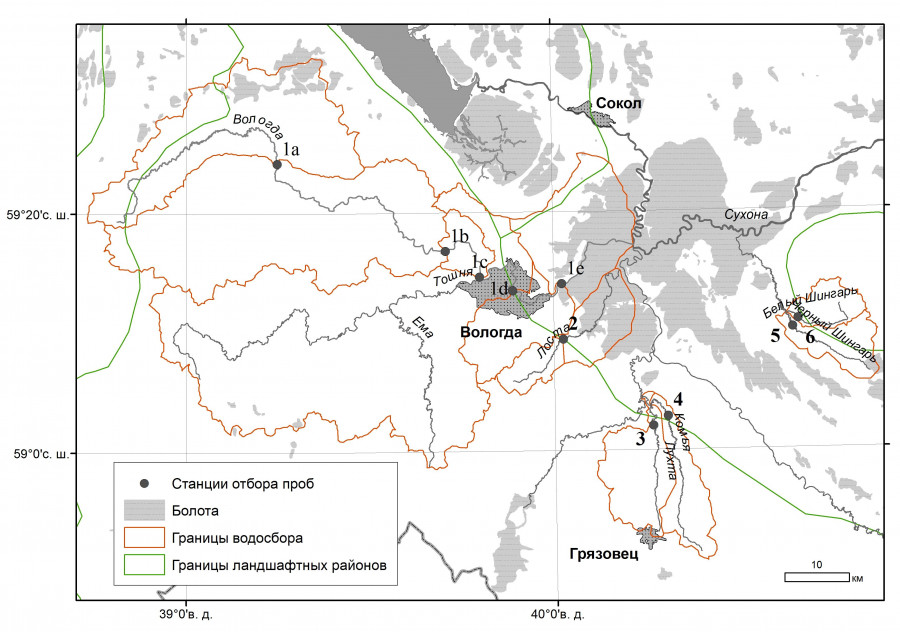
Территория исследований расположена на юге центральной части Вологодской области в подзоне южной тайги. Исследования проводились на реках – притоках р. Сухоны разного порядка (бассейн Белого моря). Равнинный рельеф и подпор от р. Сухоны влияют на гидрологические характеристики расположенных на данной территории водотоков: в меженный период течение отсутствует (Природа…, 2007). Исследования проводили на 10 станциях шести рек (рис. 1): пять станций в разных течениях р. Вологды, по одной станции на пяти малых реках. На каждой станции проводили измерение глубины и скорости течения (табл. 1).
 й
й
Рис. 1. Станции отбора проб: р. Вологда: 1a – верховья, 1b – водохранилище, 1c – ниже плотины, 1d – центр города, 1e – ниже города; 2 – Лоста; 3 – Лухта; 4 – Комья; 5 – Черный Шингарь; 6 – Белый Шингарь
Fig. 1. Sampling stations: Vologda River: 1a – upper stream, 1b – water resevoir, 1c - below the dam, 1d – city centre, 1e – below the city; 2 – Losta River; 3 – Luhta River; 4 – Komya River; 5 – Chyornyj Shingar' River, 6 – Bely Shingar' River
Построение водосборов и классификация их территории проводились в программе ArcGIS. Подробное описание методики и результатов классификации представлено авторами ранее (Ивичева, Филоненко, 2017). Водосборы исследованных рек характеризуются разной степенью антропогенной нагрузки (см. табл. 1): от практически неосвоенных (Черный Шингарь) до распаханных более чем на 60 % (р. Вологда в нижнем течении). Лесистость водосбора изменяется с 77 (Черный Шингарь) до 35 % (Лоста). Доля населенных пунктов – с 0.4 (Черный Шингарь) до 7.7 % (Вологда ниже города). Плотность населения увеличивается с 0.8 до 130 чел./км2. Бассейн Верхней Сухоны характеризуется заболоченностью 14.2 %. Из иссследованных рек наибольшая заболоченность характерна для водосбора р. Лоста (38 %) (Филоненко, Филиппов, 2013). Однако не все исследованные водосборы в створах имеют болота, поэтому данный показатель в дальнейшем не учитывается.
Таблица 1. Характеристики пунктов отбора проб
| № | Координаты | Р | H | V | Грунт | Л | Р | НП | ПН |
| 1a | 59°24′18″ с.ш., 39°14′54″ в.д. | 101.2 | 0.3–1 | 0.4 | крупный песок, гравий, валуны | 65.82 | 19.40 | 1.19 | 1.76 |
| 1b | 59°16′47″ с.ш., 39°42′21″ в.д. | 57.8 | 0.5–5 | 0.01 | заиленный песок | 64.42 | 24.13 | 2.52 | 11.04 |
| 1c | 59°14′25″ с.ш., 39°47′56″ в.д. | 46 | 0.5–3.5 | 0.01 | заиленный песок | 62.71 | 25.43 | 3.1 | 13.44 |
| 1d | 59°13′28″ с.ш., 39°53′23″ в.д. | 32.4 | 0.5–4 | 0.01 | песок, детрит | 60.41 | 25.91 | 5.46 | 78.18 |
| 1e | 59°13′59″ с.ш., 40°01′28″ в.д. | 16.3 | 0.5–3 | 0.01 | ил, детрит | 57.25 | 26.35 | 7.67 | 130.53 |
| 2 | 59°09′20″ с.ш., 40°01′25″ в.д. | 23.4 | 0.5–1.2 | 0.01 | ил, детрит | 35.02 | 57.40 | 5.96 | 29.91 |
| 3 | 59°01′56″ с.ш., 40°15′51″ в.д. | 10 | 0.2–1 | 0.01 | песок, детрит | 45.76 | 46.11 | 4.59 | 30.62 |
| 4 | 59°02′49″ с.ш., 40°18′28″ в.д. | 7.8 | 0.3–1 | 0.01 | песок, детрит | 59.34 | 35.33 | 0.97 | 0.98 |
| 5 | 59°10′13″ с.ш., 40°38′47″ в.д. | 3.8 | 1–1.5 | 0.01 | ил, детрит | 76.74 | 11.75 | 0.37 | 0.81 |
| 6 | 59°10′42″ с.ш., 40°39′53″ в.д. | 3.2 | 0.2–0.6 | 0.4 | песок | 57.49 | 29.94 | 2.96 | 5.36 |
Примечание: Здесь и далее номера станций соответствуют таковым на рис. 1. P – расстояние до устья, км; H – глубина, м; V – скорость течения в период межени, м/с; Л – доля лесов на водосборе, %; П – доля полей на водосборе, %; НП – доля населенных пунктов на водосборе, %; ПН – плотность населения на водосборе, чел./км2.
Методы
Отбор проб планктона и зообентоса проводили в 2013 г. в течение вегетационного периода. Всего было отобрано 32 пробы фитопланктона (май, июль, август), 42 – зоопланктона (май, июль, август, октябрь), 292 – зообентоса (ежемесячно с апреля по октябрь). Камеральная обработка проб выполнена авторами статьи. В августе проводили описание высшей водной растительности. В частности, выполнены флористические и геоботанические описания пробных площадей в естественных контурах, собран гербарный материал (~70 листов), который после идентификации передан в гербарий MIRE. Отбор и обработку проб осуществляли по стандартным методикам и программам (Садчиков, 2003; Лобуничева и др., 2013).
Для фитопланктона, зоопланктона и зообентоса в программе Past v.4.03 проводили расчет индексов Шеннона и Симпсона. Для всех групп гидробионтов рассчитывали также сапробность по индексу Пантле – Букка в модификации Сладечека (Шитиков и др., 2005). Для определения индикаторного значения отдельных видов макрофитов использовали работы (Marvan et al., 2005), фитопланктона – (Sládeček, 1973; Wegl, 1983; Баринова и др., 2006), зоопланктона – (Sládeček, 1973), зообентоса – (Sládeček, 1973; Wegl, 1983; Щербина, 2010). Для зообентоса также рассчитывали индексы Trent Biotic Index (TBI), Belgian Biotic Index (BBI) (Семенченко, 2004).
Параллельно с отбором гидробиологических проб на каждой станции измеряли pH и содержание кислорода, а также отбирали гидрохимические пробы для последующего лабораторного анализа, который проводили в Аккредитованной испытательной лаборатории Федерального государственного учреждения Государственного центра агрохимической службы «Вологодский» (аттестат аккредитации № РОСС RU.0001.21ПЧ08). Рассчитывали индекс загрязнения вод (ИЗВ) по шести показателям: сульфаты, фосфаты, нитрит-ион, азот аммонийный, БПК5, нефтепродукты.
Для каждой станции рассчитывались следующие показатели: ИЗВ – индекс загрязнения вод, N – численность, B – биомасса, n – количество видов, nI – количество водных видов макрофитов, nпр – среднее число видов в пробе, СN – сапробность по численности, CNI – сапробность по водным видам макрофитов, СB – сапробность по биомассе, HN – индекс Шеннона по численности, бит./экз., HB – индекс Шеннона по биомассе, бит./г, SN – индекс Симпсона по численности, SB – индекс Симпсона по биомассе, Г–У – индекс Гуднайта – Уитли, TBI – Trent Biotic Index, BBI – Belgian Biotic Index. Где возможно, значения приводятся в виде средней ± стандартная ошибка.
Ординацию данных проводили с помощью многомерного шкалирования (MDS). Матрицы по обилию макрофитов, численности фитопланктона, численности зоопланктона и численности и биомассе бентоса предварительно трансформировали через квадратный корень (Clarke, Warwick, 2001). В качестве меры сходства использовали коэффициент Чекановского – Съеренсена (Шитиков и др., 2005), что обусловлено высоким вниманием последнего как к массовым, так и к редким видам. Для нанесения факторных нагрузок значения факторов нормировали.
Достоверность различий между выделенными группами станций оценивали с помощью процедуры ANOSIM. Вклад отдельных видов в это различие между выделенными группами станций оценивался с помощью процедуры Simper. Для визуализации интенсивности влияния внешних абиотических факторов среды была проведена ординация матрицы факторов методом многомерного шкалирования. Для этого исходная матрица факторов была нормирована. Для анализа характера грунтов каждому типу грунта присвоено бальное значение: детрит – 0, ил – 1, заиленный песок – 1.5, песок – 2, крупный песок, гравий, валуны – 3. Полученная матрица была группирована в многомерном пространстве, мерой сходства для нее была выбрана Евклидова метрика.
Большинство вычислений и построение графиков выполняли в табличном редакторе Microsoft Excel. Расчет индексов видового разнообразия, ординацию, кластеризацию и сопутствующую обработку данных проводили в статистическом пакете Past v.4.03. Связь между показателями определяли с помощью коэффициента корреляции Пирсона, сила связи оценивалась по шкале Чеддока.
Результаты
Водосборы
Группировка станций методом многомерного шкалирования достоверно делит все водосборы по степени освоенности на три группы (рис. 2).
К первой группе относятся водосборы со слабой антропогенной нагрузкой: водосборы рек Вологда (в верховьях (1a), в водохранилище (1b), и ниже плотины (1c)), Комья (4), Белый Шингарь (6). Водосбор р. Черный Шингарь (5) является наименее освоенным и расположен отдельно. Плотность населения от 0.8 до 13.4 чел./км2, доля лесов от 57.5 до 76.7 %, доля сельхозугодий от 11.8 до 35.3 %.
Во вторую группу попали нарушенные водосборы с сельскохозяйственной нагрузкой: Лоста (2) и Лухта (3). Доля сельхозугодий 46–57 %.
Третья группа водосборов – нарушенные водосборы с высокой степенью урбанизации: р. Вологда в центре (1d) и ниже города (1e). Доля населенных пунктов 5.5–7.7 % (представлены преимущественно городской территорией), плотность населения 78.2–130.5 чел./км2.
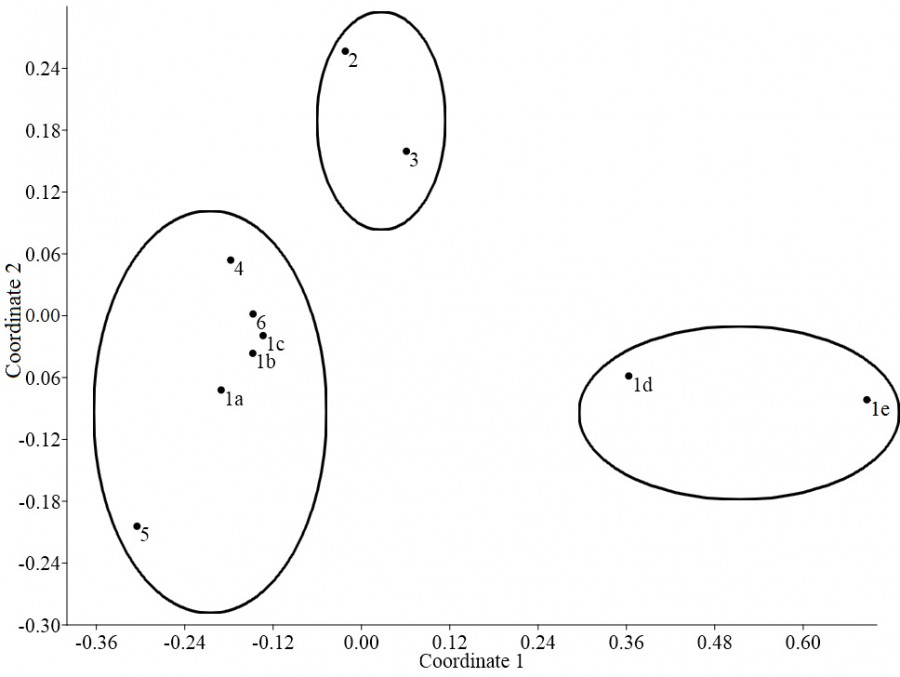
Рис. 2. Группировка станций методом многомерного шкалирования (MDS) на основании матрицы антропогенной нагрузки на водосборы (stress = 0.02). Здесь и далее номера станций соответствуют таковым на рис. 1
Fig. 2. Grouping of stations by multidimensional scaling (MDS) based on the matrix of anthropogenic load on catchments (stress = 0.02). Hereafter the station numbers correspond to those in Fig. 1
Гидрохимия
Подробная характеристика гидрохимических показателей представлена ранее (Ивичева, Филоненко, 2017). Все изученные водотоки характеризуются сезонными колебания состава воды (мутность, цветность, щелочность, жесткость). Природным генезисом территории определяется высокое содержание железа, меди и цинка. Влияние антропогенного загрязнения наиболее сильно проявляется в период зимней и летне-осенней межени, когда уровни в водотоках достигают минимальных значений (Воробьёв, 2007). Воды в исследованных реках относятся к гидрокарбонатному классу группы кальция сильной минерализации. В анионном комплексе преобладают гидрокарбонаты, что является характерной чертой таежной зоны. Отмечается тенденция увеличения концентрации следующих веществ в р. Вологде вниз по течению и в малых реках при приближении к областному центру: хлоридов, перманганатной окисляемости, ХПК, БПК5, фосфатов, нитрит-ионов, нитрат-ионов, нефтепродуктов, взвешенных веществ.
Значения ИЗВ в р. Вологде увеличиваются вниз по течению (табл. 2). Наиболее высокое качество отмечается в верховьях (1a), воды характеризуются как чистые. На станциях 1b и 1d воды характеризуются уже как умеренно загрязненные. На станции 1e отмечено самое плохое качество вод – загрязненные. В малых реках лучшее качество вод зафиксировано в р. Черный Шингарь, худшее – в р. Лухта. Во всех реках (кроме р. Лухта) воды характеризуются как чистые.
Таблица 2. ИЗВ, количественные характеристики, индексы видового разнообразия и экологические индексы разных групп гидробионтов в притоках Верхней Сухоны (начало)
| Показатель | 1a | 1b | 1c | 1d | 1e |
| ИЗВ | 0.66 | 1.26 | 0.90 | 1.91 | 2.89 |
| Макрофиты | |||||
| n/nI | 33/11 | 25/9 | 32/8 | 10/2 | 14/1 |
| СN | 1.75 | 1.76 | 1.89 | 1.56 | 1.29 |
| СNI | 1.78 | 2.09 | 2.05 | 1.80 | – |
| Фитопланктон | |||||
| N | 0.36±0.17 | 1.01±0.59 | 0.30±0.13 | 0.51±0.28 | 0.16±0.09 |
| B | 0.15±0.04 | 1.22±0.56 | 0.14±0.06 | 0.18±0.07 | 0.07±0.01 |
| n | 32 | 46 | 16 | 18 | 11 |
| СN | 1.46±0.17 | 1.71±0.14 | 1.72±0.01 | 1.82±0.18 | 2.05±0.05 |
| СB | 1.60±0.01 | 1.58±0.09 | 1.67±0.01 | 1.65±0.16 | 2.09±0.01 |
| HN | 1.06±0.32 | 1.80±0.36 | 1.23±0.51 | 1.70±0.33 | 1.56±0.41 |
| HB | 1.42±0.63 | 1.77±0.33 | 0.93±0.59 | 1.91±0.04 | 1.62±0.34 |
| SN | 0.52±0.09 | 0.27±0.09 | 0.44±0.17 | 0.33±0.12 | 0.29±0.10 |
| SB | 0.40±0.24 | 0.22±0.05 | 0.61±0.23 | 0.20±0.01 | 0.23±0.06 |
| Зоопланктон | |||||
| N | 1.66±0.49 | 30.00±11.20 | 8.32±3.44 | 37.25±34.72 | 76.82±48.77 |
| B | 54.61±47.82 | 227.41±76.12 | 23.13±10.21 | 190.01±181.40 | 808.91±667.62 |
| n | 19 | 33 | 27 | 28 | 25 |
| СN | 1.41±0.07 | 1.91±0.15 | 1.46±0.06 | 1.67±0.11 | 1.79±0.14 |
| СB | 1.59±0.12 | 1.78±0.1 | 1.51±0.06 | 1.60±0.09 | 1.76±0.08 |
| nпр | 5.60±1.29 | 12.00±3.94 | 9.75±2.87 | 8.80±2.35 | 10.00±2.63 |
| HN | 1.10±0.17 | 1.55±0.47 | 1.37±0.23 | 1.11±0.16 | 1.28±0.21 |
| HB | 1.10±0.20 | 1.16±0.19 | 1.43±0.30 | 1.20±0.29 | 1.07±0.21 |
| SN | 0.61±0.05 | 0.63±0.17 | 0.64±0.05 | 0.54±0.05 | 0.62±0.09 |
| SB | 0.61±0.07 | 0.54±0.09 | 0.65±0.11 | 0.45±0.16 | 0.51±0.11 |
| Зообентос | |||||
| N | 13.27±3.60 | 2.12±0.57 | 5.88±1.56 | 3.51±0.69 | 2.43±0.68 |
| B | 14.48±3.46 | 13.13±7.02 | 43.52±20.23 | 26.29±10.32 | 3.27±1.44 |
| n | 94 | 65 | 78 | 68 | 13 |
| Г-У | 6.87±1.10 | 22.11±2.61 | 38.5±6.51 | 61.59±4.54 | 91.83±6.28 |
| nпр | 14.90±1.40 | 8.10±1.00 | 9.80±1.30 | 8.80±2.00 | 1.90±0.30 |
| HN | 2.14±0.09 | 1.64±0.12 | 1.78±0.10 | 1.41±0.25 | 0.26±0.09 |
| SN | 0.82±0.02 | 0.73±0.03 | 0.78±0.02 | 0.63±0.07 | 0.14±0.05 |
| СN | 1.59±0.15 | 3.22±0.09 | 3.31±0.14 | 3.43±0.14 | 3.60±0.01 |
| TBI | 10 | 8 | 8 | 3 | 2 |
| BBI | 9 | 7 | 8 | 5 | 3 |
| Показатель | 2 | 3 | 4 | 5 | 6 |
| ИЗВ | 0.94 | 1.17 | 0.49 | 0.38 | 0.61 |
| Макрофиты | |||||
| n/nI | 10/2 | 10/2 | 9/6 | 11/5 | 12/5 |
| СN | 1.82 | 1.84 | 1.81 | 1.74 | 1.80 |
| СNI | 2.16 | 2.20 | 2.04 | 2.00 | 1.74 |
| Фитопланктон | |||||
| N | 0.03±0.01 | 0.06±0.02 | 0.70±0.43 | 0.12±0.08 | 0.12±0.03 |
| B | 0.03±0.01 | 0.08±0.04 | 0.12±0.05 | 0.08±0.03 | 0.44±0.15 |
| n | 8 | 9 | 15 | 25 | 19 |
| СN | 1.88±0.08 | 2.00±0.24 | 1.96±0.11 | 1.75±0.21 | 1.77±0.20 |
| СB | 1.74±0.08 | 1.82±0.29 | 2.05±0.09 | 1.85±0.20 | 1.70±0.06 |
| HN | 1.07±0.31 | 1.20±0.64 | 0.69±0.37 | 1.02±0.31 | 2.01±0.16 |
| HB | 0.61±0.32 | 0.80±0.68 | 0.82±0.42 | 1.33±0.23 | 1.72±0.58 |
| SN | 0.45±0.12 | 0.40±0.23 | 0.68±0.17 | 0.55±0.14 | 0.17±0.05 |
| SB | 0.72±0.15 | 0.61±0.33 | 0.63±0.18 | 0.36±0.07 | 0.30±0.18 |
| Зоопланктон | |||||
| N | 1.42±0.10 | 1.97±0.16 | 1.66±0.68 | 0.545±0.13 | 2.55±1.70 |
| B | 9.20±4.13 | 34.22±2.71 | 18.50±12.23 | 9.54±7.30 | 7.41±2.90 |
| n | 15 | 15 | 19 | 14 | 19 |
| СN | 1.46±0.13 | 1.44±0.09 | 1.37±0.07 | 1.33±0.03 | 1.48±0.04 |
| СB | 1.69±0.03 | 1.48±0.07 | 1.55±0.18 | 1.59±0.08 | 1.53±0.18 |
| nпр | 5.25±1.49 | 5.67±1.86 | 7.25±1.25 | 5.33±1.86 | 5.75±0.75 |
| HN | 1.04±0.16 | 0.90±0.37 | 1.30±0.26 | 0.96±0.32 | 0.88±0.25 |
| HB | 0.90±0.32 | 0.74±0.28 | 1.09±0.29 | 0.88±0.14 | 1.20±1.89 |
| SN | 0.56±0.04 | 0.46±0.19 | 0.61±0.12 | 0.35±0.16 | 0.52±0.13 |
| SB | 0.47±0.16 | 0.37±0.15 | 0.52±0.13 | 0.35±0.12 | 0.62±0.08 |
| Зообентос | |||||
| N | 5.34±0.98 | 7.47±0.86 | 5.60±1.11 | 3.13±0.51 | 8.06±2.41 |
| B | 24.39±7.63 | 36.90±6.77 | 43.95±10.38 | 19.51±3.20 | 10.98±3.90 |
| n | 44 | 78 | 59 | 65 | 89 |
| Г-У | 43.1±8.06 | 36.03±4.51 | 12.50±3.60 | 14.88±3.75 | 11.05±2.80 |
| nпр | 9.90±1.30 | 14.00±1.40 | 10.70±1.90 | 10.2±1.00 | 12.00±1.30 |
| HN | 1.62±0.12 | 1.91±0.16 | 1.52±0.17 | 1.85±0.13 | 1.80±0.22 |
| SN | 0.70±0.03 | 0.77±0.04 | 0.66±0.05 | 0.78±0.02 | 0.66±0.08 |
| СN | 3.33±0.09 | 2.95±0.15 | 2.92±0.11 | 2.29±0.05 | 2.12±0.11 |
| TBI | 6 | 8 | 8 | 9 | 10 |
| BBI | 5 | 7 | 8 | 7 | 9 |
Макрофиты и фитопланктон
При расчете индекса сапробности по относительному обилию макрофитов все водотоки относятся к β-мезосапробным. При этом на территории города (ст. 1e и 1d) индекс сапробности ниже, что связано с низкой плотностью зарослей и небольшим числом видов на данном участке.
По количественным показателям фитопланктона все станции делятся на две группы: р. Вологда, где численность и биомасса выше, и малые реки, где количественные показатели ниже (см. табл. 2). Наибольшие количественные показатели отмечены в р. Вологде в зоне подпора плотины (1b). В пределах участка водохранилища активно вегетируют диатомовые, криптофитовые и эвгленовые водоросли. Наименьшие количественные показатели в р. Вологде отмечены на станции ниже города (1e), где антропогенная нагрузка максимальная. Минимальные среднесезонные численность и биомасса отмечены в р. Лоста (2), где фитопланктон формируется сравнительно бедным диатомовым комплексом.
Значения индексов Шеннона и Симпсона по численности и биомассе демонстрируют высокую корреляционную связь между собой. В р. Вологде значения индекса Шеннона выше, чем в малых реках. Значение индекса Симпсона на разных станциях находится на одном уровне. Наибольшие значения индексов видового разнообразия зафиксированы в р. Вологде на станциях в водохранилище (1b) и в центре города (1d). На станции ниже города, где антропогенная нагрузка максимальна, значение индекса Шеннона выше, чем в верховьях. На видовое разнообразие фитопланктона р. Вологды влияет в первую очередь скорость течения, а не антропогенная нагрузка. Из числа малых реках, наоборот, наибольшее видовое разнообразие отмечено в р. Белый Шингарь, где течение сохраняется весь год (6). Практически все станции относятся к β-мезосапробной зоне. Исключение составляет р. Вологда в верховьях (олигосапробная). Увеличение индекса сапробности при увеличении антропогенной нагрузки незначительно.
Зоопланктон
По количественным показателям зоопланктона все станции можно разделить на две группы. К первую группе относятся малые реки и станция в верховьях р. Вологды. Они характеризуются низкими показателями численности и биомассы, меньшим количеством видов (см. табл. 2). На остальных станциях численность, биомасса и количество видов значительно выше. Наибольшие значения отмечены на станции в водохранилище (1b), что связано с гидрологическим режимом и большими концентрациями питательных веществ. Наименьшие значения – в р. Лухта (3). Доминирование в наибольшей степени выражено в р. Черный Шингарь (5). Река Вологда в верховьях (1а) и реки Лухта (3), Комья (4), Черный Шингарь (5) и Белый Шингарь (6) относятся к олигосапробной зоне, остальные станции – к β-мезосапробной. Наибольшие значения индекса сапробности отмечены в водохранилище, где зафиксированы также наибольшие количественные показатели.
Зообентос
Подробное описание сообществ зообентоса исследованных водотоков приведено в (Ивичева, 2016, 2017). Численность зообентоса, количество видов в целом и среднее число видов в пробе выше на станциях, где течение сохраняется на протяжении всего вегетационного периода (1a, 6) (см. табл. 2). Основу сообществ составляют реофильные виды насекомых (поденок, ручейников, двукрылых). Численность и число видов этих групп показывают высокую корреляционную связь между собой и со скоростью течения. Биомасса зообентоса на разных станциях различалась. Наибольшие значения биомассы были отмечены на станциях 1c (преобладали олигохеты) и 4 (преобладали двустворчатые моллюски), наименьшие – на станции 1e. Индексы Гуднайта – Уитли и сапробности увеличиваются в р. Вологде вниз по течению и в малых реках при приближении к городу. Это говорит об ухудшении экологического состояния водотоков в указанной последовательности. Наименьшие значения обоих индексов отмечены в верховьях р. Вологды (1a). В малых реках примерно одинаковые значения индексов отмечаются на станциях 4, 5 и 6 – наиболее удаленных от города. При этом на станциях 4 и 5 течение в меженный период отсутствует. Наибольшие значения индексов Гуднайта – Уитли и сапробности отмечены на станциях 1d и 1e, испытывающих наибольшую антропогенную нагрузку. Индексы TBI и BBI, наоборот, уменьшаются в обозначенном выше ряду. Наибольшие значения индексов отмечаются на станциях 1a и 6, наименьшие – 1d и 1e. Индексы видового разнообразия (Шеннона и Симпсона) уменьшаются в р. Вологде вниз по течению и в малых реках при приближении к г. Вологде. Наибольшие значения обоих индексов отмечены на станции 1a (верховья р. Вологды), наименьшие – на станции 1e (ниже города). Из малых рек наибольшие значения индексов отмечены на станциях 3 и 5. Индекс Шеннона имеет высокую корреляционную связь с четырьмя индексами экологического состояния. Таким образом, наилучшее экологическое состояние отмечается в р. Вологде в верховьях (1a). Из малых рек хорошее экологическое состояние зафиксировано в реках Комья (4), Черный Шингарь (5) и Белый Шингарь (6).
Влияние водосборов на ИЗВ
Связь антропогенной нагрузки на водосборе и ИЗВ приведена на рис. 3А. Качество вод на водосборе ухудшается как с увеличением плотности населения, так и с увеличением на водосборе доли населенных пунктов.
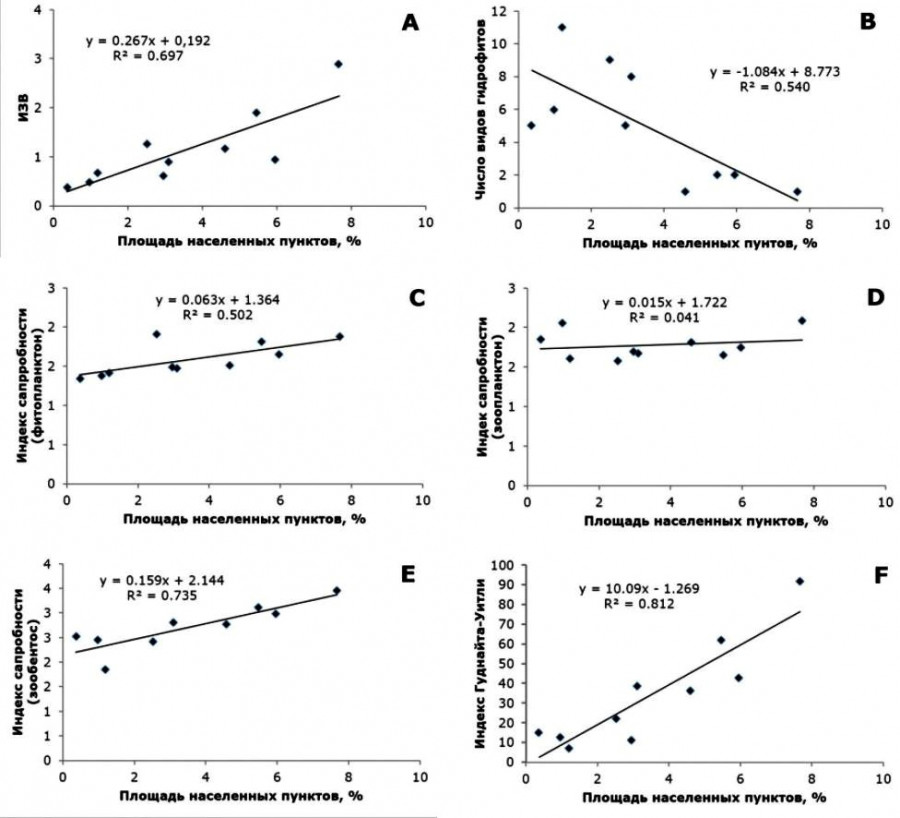
Рис. 3. Связь степени урбанизации водосбора с: ИЗВ (A), количеством видов гидрофитов (B), сапробностью по биомассе фитопланктона (C), сапробностью по численности зоопланктона (D), сапробностью по численности зообентоса (E), индексом Гуднайта – Уитли (F)
Fig. 3. The relationship of the degree of urbanization of the catchment area with: IZV (A), the number of hydrophyte species (B), saprobity in phytoplankton biomass (C), saprobity in zooplankton abundance (D), saprobity in zoobenthos abundance (E), Goodnight – Whitley index (F)
Влияние водосборов на макрофиты
Согласно группировке станций методом многомерного шкалирования на основании относительного обилия макрофитов, выделяются 3 группы: 1) станции на малых реках (2, 3, 4, 5, 6); 2) станции на р. Вологде в верховьях и водохранилище (1a, 1b); 3) станции на р. Вологде ниже плотины (1c, 1d) (рис. 4A). Различия достоверны для групп 1 и 2 (p = 0.05) и 2 и 3 (p = 0.02).
Для станций с сельскохозяйственными водосборами отмечается снижение числа гидрофитов по сравнению со станциями на малых реках, чьи водосборы нарушены слабо. Для станций с урбанизированными водосборами зафиксировано снижение количества видов всего (по сравнению с другими станциями на р. Вологде) и гидрофитов. Количество видов гидрофитов показывает заметную корелляционную связь со степенью урбанизации и плотностью населения (рис. 3B).
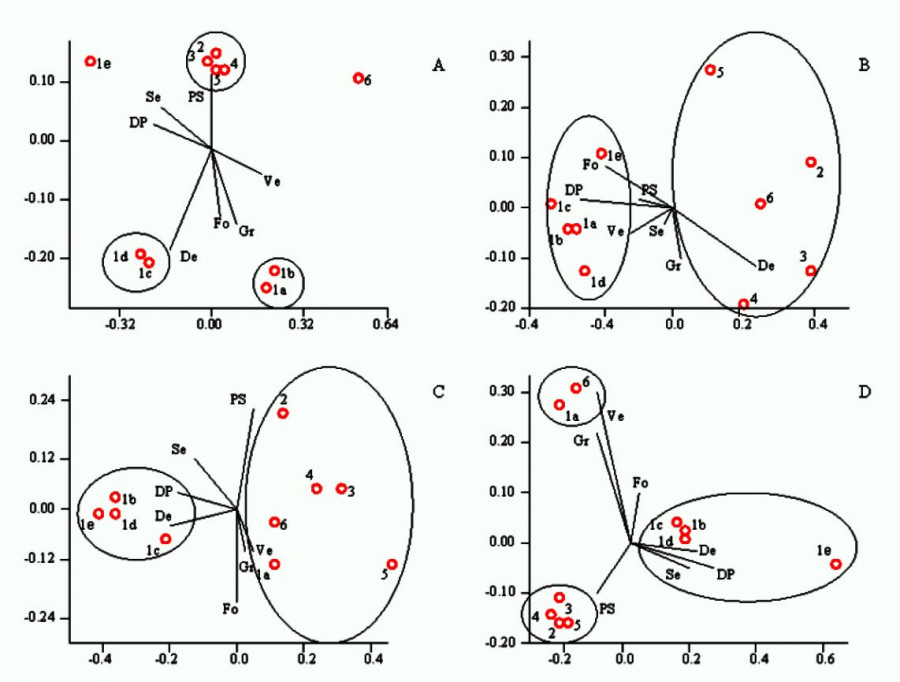
Рис. 4. Ординация станций методом многомерного шкалирования (MDS) на основании коэфициента Чекановского – Съеренсена для: обилия макрофитов (stress = 0.10) (A), численности фитопланктона (stress = 0.18) (B), численности зоопланктона (stress = 0.07) (C), численности зообентоса (stress = 0.05) (D). Подписанные оси показывают направление и интенсивность влияния выбранных факторов (длина оси). Обозначение факторов: PS – площадь сельхозугодий, %; Se – площадь населенных пунктов; DP – плотность населения, чел./км2; Ve – скорость течения в реке, м/сек; Fo – доля лесов; Gr – характеристика субстрата, баллы; De – глубина водотока, м. Овалами показаны выделенные группы станций
Fig. 4. Ordination of stations by multidimensional scaling (MDS) based on the Chekanovsky – Sorensen coefficient for: macrophyte abundance (stress = 0.10) (A), phytoplankton abundance (stress = 0.18) (B), zooplankton abundance (stress = 0.07) (C), zoobenthos abundance (stress = 0.05) (D). The signed axes show the direction and intensity of the influence of the selected factors (axis length). Designation of factors: PS is the area of farmland, %; Se is the area of settlements; DP is the population density per person/km2; Ve is the flow rate in the river, m/sec; Fo is the proportion of forests; Gr is the characteristic of the substrate, points; De is the depth of the watercourse, m. The selected groups of stations are shown in ovals
Влияние водосборов на фитопланктон
По результатам многомерного шкалирования на основании численности фитопланктона выделяются две группы (рис. 4B): 1) станции в р. Вологде (1a, 1b, 1c, 1d, 1e); 2) станции в малых реках (2, 3, 4, 5, 6). Выделенные группы достоверно различаются (p = 0.02), различие между ними составляет 93.4 %. Основной вклад в различие вносят виды Chroomonas acuta Butcher (12.9 %), Cryptomonas marssonii Skuja (11.2 %) и C. reflexa (Marsson) Skuja (10.3 %). Антропогенный фактор не оказывает значительного влияния на расхождение станций по группам. В поле факторов основные факторные нагрузки параллельны линии разделения двух групп.
Станции, вошедшие в первую группу (1a–1b), имеют несколько большие количественные характеристики фитопланктона в сравнении со станциями из второй группы (2–6). В среднем богатство видов и величины разнообразия в первой группе выше. Малые реки второй группы характеризуются большими максимальными значениями сапробности, чем участки р. Вологды. Средние показатели сапробности на большинстве станций р. Вологда также ниже таковых в водотоках второй группы. Заметное отличие составляет точка 1e, которая выделяется сравнительно высокими величинами сапробности. Указанные различия первой и второй групп объясняются размерами исследуемых водотоков. Наблюдается умеренная корреляционная связь степени урбанизации водосборов и сапробности (рис. 3C).
Зоопланктон и абиотические факторы
Согласно группировке станций методом многомерного шкалирования на основании численности зоопланктона, выделяются две достоверно различные (p = 0.004) группы (рис. 4C): 1) станции в р. Вологде кроме верховьев (1b, 1c, 1d, 1e), которые характеризуются отсутствием течения на протяжении большей части года; 2) станции в малых реках и в верховьях р. Вологды (1a, 2, 3, 4, 5, 6). Различие между группами составляет 83.7 %. Виды, вносящие наибольший вклад в различие: Asplanchna priodonta Gosse, 1850 (14.2 %), Brachionus calyciflorus Pallas, 1766 (8.4 %) и Synchaeta pectinata Ehrenberg, 1832 (6.9 %).
Влияние анализируемых внешних факторов в основном не оказывает значительного влияния на распределение станций. Наиболее ярко выраженный фактор – средняя глубина. Для первой группы отмечены глубины 0.3–1 м, для второй 1–5 м. Определенное значение на выделение групп станций также оказывает доля населенных пунктов на водосборе и плотность населения. В первую группу вошли станции с урбанизированными водосборами и с водосборами со слабой антропогенной нагрузкой. В целом картина очень сходна с разделением станций по фитопланктону за исключением попадания станции в верховьях р. Вологды (1a) к малым рекам.
Станции со слабонарушенными водосборами в большинстве своем относятся к олигосапробной зоне (за исключением станции в водохранилище). Станции с сельскохозяйственными и урбанизированными водосборами – к β-мезосапробной. Значения индексов Шеннона и Симпсона для станций с водосборами разной степени нарушенности существенно не отличаются. Для станций с урбанизированными водосборами характерны наибольшие количественные показатели – вследствие высокого содержания питательных веществ для зоопланктеров. Из всех параметров только индекс сапробности показывает умеренную корреляционную связь со степенью урбанизации водосбора (рис. 3E). Также индекс сапробности показывает достоверную положительную корреляционную связь с индексом загрязнения воды. Достоверной корреляционной связи параметров зоопланктона с лесистостью и распаханностью водосбора не выявлено.
Влияние водосборов на зообентос
Многомерное шкалирование на основании численности зообентоса позволяет выделить три группы станций (рис. 4D): 1) станции на малых реках без течения (2, 3, 4, 5); 2) станции, где течение сохраняется на протяжении большей части года (1а, 6); 3) станции на р. Вологде, где течение отсутствует (1b, 1c, 1d). В эту группу включается также ст. 1е, которая испытывает наибольшую антропогенную нагрузку.
Достоверные различия отмечены только между первой и третьей группами (p = 0.03). Различие между этими группами составляет 93 %. Наибольший вклад в различие вносят олигохеты Limnodrilus hoffmeisteri (38 %) и личинки комаров хирономид Cladotanytarsus gr. mancus (19 %). Таким образом, отдельно выделяются станции в средней реке (1b, 1c, 1d, 1e), станции в малых реках (2, 3, 4, 5) и станции с быстрым течением (1а, 6).
При рассмотрении экологического состояния водоема, оцененного по зообентосу, можно отметить, что для станций со слабонарушенными водосборами качество вод изменяется от «очень хорошие» до «умеренно загрязненные». Значение индекса Шеннона колеблется в диапазоне от 1.50 до 2.14. Зона сапробности – α- и β-мезосапробная. Наилучшее качество вод по индексам TBI и BBI наблюдается на станциях 1а и 6, благодаря тому что здесь отмечен реофильный комплекс донных макробеспозвоночных. Также эти станции расположены в наибольшей удаленности от г. Вологды. В малых реках (4, 5, 6), характеризующихся разными гидрологическими условиями, значения индексов Гуднайта – Уитли, Шеннона и Симпсона изменяются в незначительных пределах.
На станциях, чьи водосборы характеризуются высокой сельскохозяйственной нагрузкой (2 и 3), качество вод значительно отличается. Более удаленная от города станция – третья – характеризуется экологическим состоянием, как и станции из первой группы. На второй станции – более приближенной к городу – качество вод хуже. Воздействие сельского хозяйства на качество вод не выявлено.
На станциях с урбанизированными водосборами (третья группа) отмечено наиболее низкое качество вод: значение индекса Гуднайта – Уитли в 1.5–2 раза выше, чем на станциях с сельскохозяйственными водосборами, воды характеризуются как загрязненные и грязные. На этих станциях отмечаются наименьшие значения индексов Шеннона, Симпсона, TBI, BBI. Обе станции относятся к α-мезосапробной зоне.
Степень урбанизации водосбора и плотность населения показывают высокую корреляционную связь с индексами Гуднайта – Уитли (рис. 3E), Шеннона, сапробности (рис. 3F), TBI, BBI, числом видов.
Обсуждение
Количественные показатели, как и видовое богатство планктонных организмов, в средней реке (Вологда) значительно выше, чем в малых реках. Они не показывают зависимости от доли на водосборе населенных пунктов и плотности населения. Состав и структура фитопланктона и зоопланктона, в первую очередь состав групп, определяются средней глубиной водотоков. Глубина водотоков во многом определяет доступность света и питательных веществ. Вместе со скоростью течения эти факторы обуславливают развитие планктонных сообществ (Leland, 2003; Jäger et al., 2017). При использовании плакнтона в качестве индикатора необходимо учитывать гидрологию и местные условия среды (Collier et al., 2013). В то же время индексы видового разнообразия, рассчитанные по зоо- и фитопланктону, в малых реках и средней реке находятся на одном уровне. Наибольшее видовое разнообразие зафиксировано в р. Вологде в подпоре водохранилища, что также подтверждает решающую роль гидрологических фаткоров в развитии планктоных организмов. По индексу сапробности, рассчитанному по фитопланктону и высшей водной растительности, практически все станции относятся к β-мезосапробной зоне. При расчете индекса сапробности по зоопланктону многие станции находятся на границе олиго- и β-мезосапробной зон. Это объясняется тем, что большинство планктонных видов, отмеченных в наших пробах, относятся к β-мезосапробным, полисапробные практически не регистрируются (Sladecek, 1973; Wegl, 1983; Баринова и др., 2006).
По зообентосу отмечено снижение видового разнообразия и индексов, показывающих качество вод, при увеличении урбанизации (в р. Вологде вниз по течению, в малых реках при приближении к г. Вологде). Число видов-гидрофитов также снижается с увеличением урбанизации. Только для зообентоса значение индекса сапробности достоверно увеличивается при увеличении плотности населения и населенных пунктов на водосборе. Это подтвреждает прерогативу использования макрофитов и зообентоса для оценки экологичекого сотояния рек (Directive, 2000; Семенченко, 2004; Шитиков и др., 2005). В целом для зообентоса существует большой спектр индексов, позволяющих оценить качество вод водотока. Все из рассчитанных в данной работе индексов свидетельствуют об ухудшении качества вод при увеличении урбанизации водосборов. В целом сообщества зообентоса лучше демонстрируют увеличение антропогенной нагрузки на водосборе (Springe et al., 2006; Collier et al., 2013; Батурина и др., 2020). Зообентос по сравнению с планктоном меньше зависит от местных условий окружающей среды, таких как мутность и температура, а также гидрологические условия.
Размер водотоков влияет на устойчивость их экосистем. Малые реки быстрее, чем более крупные водотоки, реагируют на негативные воздействия (Dodds, 2006; Wu et al., 2010; Breuer et al., 2016). В отличие от рек, протекающих по высоко урбанизированной и сельскохозяйственно освоенной территории Китая (Kim et al., 2016), в нашем случае не установлено достоверного негативного влияния антропогенной нагрузки на водосборе на фитопланктон. В ряде исследований показано, что сельскохозяйственные угодья влияют на водотоки лишь в относительно узком прибрежном коридоре (Tanaka et al., 2016; Marzin et al., 2013). В наших исследованиях остутствие влияния водосборов на планктонные собщества связано с относительно низкой антропогенной нагрузкой, а также разными гидрологическими характеристиками изученных рек. По зообентосу качество вод зависит в первую очередь от близости к областному центру. В работе (Maloney et al., 2011) показано снижение видового богатства зообентоса и разнообразия при увеличении урбанизации водосбора. Достоверная корреляционная связь биотических индексов со степенью урбанизации отмечена также в работах (Beixin et al., 2012; Lakew and Moog, 2015). Для территории Вологодской области нами получены те же закономерности.
Заключение
Степень урбанизации водосбора негативно влияет на качество вод, оцененное по гидрохимическим показателям и зообентосу. Только для зообентоса все рассчитанные индексы показали достоверную корреляционную связь с долей на водосборе населенных пунктов и плотностью населения. Макрофиты также могут использоваться для оценки качества вод, однако опираться следует исключительно на гидрофиты. Зоопланктон и фитопланктон, в свою очередь, не показывают достоверной связи со степенью урбанизации водосборов. Для них как организмов, связанных в первую очередь с водной толщей, главным фактором является содержание в ней органических веществ. Поэтому наибольшие количественные показатели и видовое богатство отмечаются на приплотинном участке, для которого характерна высокая концентрация загрязняющих веществ и для центра города, где повышен поверхностный сток.
Библиография
Баринова С. С., Медведева Л. А., Анисимова О. В. Биоразнообразие водорослей-индикаторов окружающей среды . Тель-Авив: ПилиесСтудио, 2006. 498 с.
Батурина М. А., Кононова О. Н., Елсаков В. В. Гидробиологические характеристики рек Вычегодского бассейна в различных единицах ландшафтного деления // Принципы экологии. 2020. № 1. С. 4–26. DOI: 10.15393/j1.art.2020.9982
Зуева Н. В., Примак Е. А., Бабин А. В., Зуев Ю. А., Урусова Е. С. Интегральная оценка экологического благополучия малых рек Ленинградской области и Санкт-Петербурга // География и природные ресурсы. 2021. Т. 42, № 2. С. 32–40. DOI: 10.15372/GIPR20210204
Ивичева К. Н. Зообентос малых рек-притоков Верхней Сухоны // Вода: химия и экология. 2016. № 8 (98). С. 53–59.
Ивичева К. Н. Зообентос реки Вологды // Вода: химия и экология. 2017. № 1 (103). С. 80–86.
Ивичева К. Н., Филоненко И. В. Анализ влияния освоенности речных бассейнов на качество вод методами ГИС // Принципы экологии. 2012. № 2. С. 77–82. DOI: 10.15393/j1.art.2012.1061
Ивичева К. Н., Филоненко И. В. Анализ зависимости качества вод по гидрохимическим показателям от освоенности водосборов // Принципы экологии. 2013. Т. 2, № 3. С. 53–61. DOI: 10.15393/j1.art.2013.2421
Ивичева К. Н., Филоненко И. В. О влиянии освоенности водосбора реки Верхней Сухоны (Вологодская область) на химический состав вод ее притоков // Принципы экологии. 2019. Т. 8, № 1. С. 19–31. DOI: 10.15393/j1.art.2019.8422
Лобуничева Е. В., Борисов М. Я., Филоненко И. В., Филиппов Д. А. Оценка экологического состояния малых водоемов: Учебное пособие . Вологда: Коперник35, 2013. 218 с.
Природа Вологодской области . Вологда: Вологжанин, 2007. 440 с.
Садчиков А. П. Методы изучения пресноводного фитопланктона . М.: Университет и школа, 2003. 157 с.
Семенченко В. П. Принципы и системы биоиндикации текучих вод . Минск: Орех, 2004. 125 с.
Филоненко И. В., Филиппов Д. А. Оценка площади болот Вологодской области // Труды Инсторфа. 2013. № 7 (60). С. 3–11.
Шитиков В. К., Розенберг Г. С., Зинченко Т. Д. Количественная гидроэкология: методы, критерии, решения . Кн. 1. М.: Наука, 2005. 281 с.
Щербина Г. Х. Таксономический состав и сапробиологическая значимость донных макробеспозвоночных различных пресноводных экосистем Северо-Запада России // Экология и морфология беспозвоночных континентальных водоемов: Сб. науч. работ, посвящ. 100-летию со дня рождения Ф. Д. Мордухай-Болтовского. Махачкала: Наука ДНЦ, 2010. С. 426–466.
Angeler D. G., Goedkoop W. Biological responses to liming in boreal lakes: an assessment using plankton, macroinvertebrate and fish communities // Journal of Applied Ecology. 2010. Vol. 47, № 2. P. 478–486. DOI: 10.1111/j.1365-2664.2010.01794.x
Beixin W., Dongxiao L., Shuru L., Yong Z., Dongqi L., Lizhu W. Impacts of urbanization on stream habitats and macroinvertebrate communities in the tributaries of Qiangtang River, China // Hydrobiologia. 2012. Vol. 680, № 1. P. 39–51. DOI: 10.1007/s10750-011-0899-6
Breuer F., Janz P., Farrelly E., Ebke K.-P. Environmental and structural factors influencing algal communities in small streams and ditches in central Germany // Journal of Freshwater Ecology. 2016. Vol. 32, № 1. P. 65–83. DOI: 10.1080/02705060.2016.1241954
Carle M. V., Halpin P. N., Stow C. A. Patterns of watershed urbanization and impact on water quality // Journal of the American Water Resources Association. 2005. Vol. 41, № 3. P. 693–708. DOI: 10.1111/j.1752-1688.2005.tb03764.x
Chagas F. B., Rutkoski C. F., Bieniek G. B., Vargas G. D. L. P., Hartmann P. A., Hartmann M. A. Integrated analysis of water quality from two rivers used for public supply in southern Brazil // Acta Limnologica Brasiliensia. 2017. Vol. 29. Art. e14. DOI: 10.1590/s2179-975x6616
Clarke K. R., Warwick R. M. Changes in Marine Communities: An Approach to Statistical Analysis and Interpretation. 2nd Edition. PRIMER-E: Plymouth Marine Laboratory, UK, 2001. 176 p.
Collier K. J., Clapcott J. E., Duggan I. C., Hamilton D. P., Hamer M., Young R. G. Spatial variation of structural and functional indicators in a large New Zealand river // River Research and Applications. 2013. Vol. 29, № 10. P. 1277–1290. DOI: 10.1002/rra.2609
Cuffney T. F., Brightbill R. A., May J. T., Waite I. R. Response of benthic macroinvertebrates to environmental changes associated with urbanization in nine metropolitan areas // Ecological Applications. 2010. Vol. 20, № 5. P. 1384–1401. DOI: 10.1890/08-1311.1
Davies P. J., Wright I. A., Findlay S. J., Jonasson O. J., Burgin S. Impact of urban development on aquatic macroinvertebrates in south eastern Australia: degradation of in-stream habitats and comparison with non-urban streams // Aquatic Ecology. 2010. Vol. 44, № 4. P. 685–700. DOI: 10.1007/s10452-009-9307-y
Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy // Official Journal L. 22.12.2000. № 327. P. 1–73. URL: https://eur-lex.europa.eu/eli/dir/2000/60/oj
Dodds W. K. Eutrophication and trophic state in rivers and streams // Limnology and Oceanography. 2006. Vol. 51, № 1. P. 671–680. DOI: 10.4319/lo.2006.51.1_part_2.0671
Eikenberry B. C. S., Bell A. H., Templar H. A., Burns D. J. Comparison of benthos and plankton for selected areas of concern and non-areas of concern in western Lake Michigan Rivers and Harbors in 2012. U.S. Geological Survey Scientific Investigations Report 2016–5090. 2016. 28 p. DOI: 10.3133/sir20165090
Flotemersch J. E., Leibowitz S. G., Hill R. A., Stroddard J. L., Thoms M. C., Tharme R. E. A watershed integrity definition and assessment approach to support strategic management of watersheds // River Research and Applications. 2015. Vol. 32, № 7. P. 1654–1671. DOI: 10.1002/rra.2978
Gao X., Niu C., Chen Yu., Yin X. Spatial heterogeneity of stream environmental conditions and macroinvertebrates community in an agriculture dominated watershed and management implications for a large river (the Liao River, China) basin // Environmental Monitoring and Assessment. 2014. Vol. 186, № 4. P. 2375–2391. DOI: 10.1007/s10661-013-3545-0
Grizzetti B., Pistocchi A., Liquete C., Udias A., Bouraoui F., van de Bund W. Human pressures and ecological status of European rivers // Scientific Reports. 2017. Vol. 7. Art. 205. DOI: 10.1038/s41598-017-00324-3
Jäger C. G., Hagemann J., Borchardt D. Can nutrient pathways and biotic interactions control eutrophication in riverine ecosystems? Evidence from a model driven mesocosm experiment // Water Research. 2017. Vol. 115. P. 162–171. DOI: 10.1016/j.watres.2017.02.062
Hoang H. T. T., Duong T. T., Nguyen K. T., Le Q. T. P., Luu M. T. N., Trinh D. A., Le A. H., Ho C. T., Dang K. D., Némery J., Orange D., Klein J. Impact of anthropogenic activities on water quality and plankton communities in the Day River (Red River Delta, Vietnam) // Environmental Monitoring and Assessment. 2018. Vol. 190. Art. 67. DOI: 10.1007/s10661-017-6435-z
Ivicheva K. N., Makarenkova N. N., Zaytseva V. L., Philippov D. A. Influence of flow velocity, river size, a dam, and an urbanized area on biodiversity of lowland rivers // Biosystems Diversity. 2018. Vol. 26, № 4. P. 292–302. DOI: 10.15421/011844
Kim J.-A., Lee S.-W., Hwang G.-S., Hwang S.-J., Kim C., An K.-J. Effects of streamline complexity on the relationships between urban land use and ecological communities in streams // Paddy and Water Environment. 2016. Vol. 14, № 2. P. 299–312. DOI: 10.1007/s10333-015-0500-4
Kuzmanović M., López-Doval J. C., De Castro-Català N., Guasch H., Petrović M., Muñoz I., Ginebreda A., Barceló D. Ecotoxicological risk assessment of chemical pollution in four Iberian river basins and its relationship with the aquatic macroinvertebrate community status // Science of the Total Environment. 2016. Vol. 540. P. 324–333. DOI: 10.1016/j.scitotenv.2015.06.112
Kuzmanovic M., Dolédec S., de Castro-Catala N., Ginebreda A., Sabater S., Muñoz I., Barceló D. Environmental stressors as a driver of the trait composition of benthic macroinvertebrate assemblages in polluted Iberian rivers // Environmental Research. 2017. Vol. 156. P. 485–493. DOI: 10.1016/j.envres.2017.03.054
Lakew A., Moog O. A multimetric index based on benthic macroinvertebrates for assessing the ecological status of streams and rivers in central and southeast highlands of Ethiopia // Hydrobiologia. 2015. Vol. 751. № 1. P. 229–242. DOI: 10.1007/s10750-015-2189-1
Leland H. V. The influence of water depth and flow regime on phytoplankton biomass and community structure in a shallow, lowland river // Hydrobiologia. 2003. Vol. 506, № 1–3. P. 247–255. DOI: 10.1023/b:hydr.0000008596.00382.56
Luck G. W. A review of the relationships between human population density and biodiversity // Biological Reviews. 2007. Vol. 82, № 4. P. 607–645. DOI: 10.1111/j.1469-185X.2007.00028.x
Maloney K. O., Munguia P., Mitchell R. M. Anthropogenic disturbance and landscape patterns affect diversity patterns of aquatic benthic macroinvertebrates // Journal of the North American Benthological Society. 2011. Vol. 30, № 1. P. 284–295. DOI: 10.1899/09-112.1
Marvan P., Maršálek B., Heteša J., Sukačova K., Maršálková E., Geriš R., Kozáková M. Comments on the revised tables of algal (and other botanical) water quality indicators listed in CSN 75 7716 – discussion material for assessment of trophic status of water bodies. 2005. URL: http://www.sinice.cz/res/file/scientific/trophicstatus-comments.pdf
Marzin A., Verdonschot P. F., Pont D. The relative influence of catchment, riparian corridor, and reach-scale anthropogenic pressures on fish and macroinvertebrate assemblages in French rivers // Hydrobiologia. 2013. Vol. 704, № 1. P. 375–388. DOI: 10.1007/s10750-012-1254-2
Paggi A. C., Ocón C., Tangorra M., Capítulo A. R. Response of the zoobenthos community along the dispersion plume of a highly polluted stream in the receiving waters of a large river (Rio de la Plata, Argentina) // Hydrobiologia. 2006. Vol. 568, № 1. P. 1–14. DOI: 10.1007/s10750-005-0010-2
Sládeček V. System of water quality from the biological point of view // Achieves für Hydrobiologie – Beiheft Ergebnisse der Limnologie. 1973. Vol. 7, № 1. P. 1–218.
Smith R. F., Lamp W. O. Comparison of insect communities between adjacent headwater and main-stem streams in urban and rural watersheds // Journal of the North American Benthological Society. 2008. Vol. 27, № 1. P. 161–175. DOI: 10.1899/07-071.1
Springe G., Sandin L., Briede A., Skuja A. Biological quality metrics: their variability and appropriate scale for assessing streams // Hydrobiologia. 2006. Vol. 566, № 1. P. 153–172. DOI: 10.1007/s10750-006-0099-y
Tanaka M.,O., Souza A.,L.,T., Moschini L.,E., Oliveira A.,K. Influence of watershed land use and riparian characteristics on biological indicators of stream water quality in southeastern Brazil // Agriculture, ecosystems & environment. 2016. Vol. 216. P. 333–339. DOI: 10.1016/j.agee.2015.10.016
Vörösmarty C. J., McIntyre P. B., Gessner M. O., Dudgeon D., Prusevich A., Green P., Glidden S., Bunn S. E., Sullivan C. A., Reidy Liermann C., Davies P. M. Global threats to human water security and river biodiversity // Nature. 2010. Vol. 467. P. 555–561. DOI: 10.1038/nature09440
Wang L., Kanehl P. Influences of watershed urbanization and instream habitat on macroinvertebrates in cold water streams // Journal of the American Water Resources Association. 2003. Vol. 39, № 5. P. 1181–1196. DOI: 10.1111/j.1752-1688.2003.tb03701.x
Wegl R. Index für die Limnosaprobität // Wasser und Abwasser. 1983. Bd. 26. S. 1–175.
Wu N., Dong X., Liu Y., Wang C., Baattrup-Pedersen A., Riis T. Using river microalgae as indicators for freshwater biomonitoring: Review of published research and future directions // Ecological indicators. 2017. Vol. 81. P. 124–131. DOI: 10.1016/j.ecolind.2017.05.066
Wu N., Schmalz B., Fohrer N. Distribution of phytoplankton in a German lowland river in relation to environmental factors // Journal of Plankton Research. 2010. Vol. 33, № 5. P. 807–820. DOI: 10.1093/plankt/fbq139
Zueva N. V., Bobrov A. A. Use of macrophytes in assessing the ecological status of small river (by the example of the Okhta river, St. Petersburg) // Inland Water Biology. 2018. Vol. 11, № 1. P. 34–41. DOI: 10.1134/S1995082917040137
Благодарности
Исследование К. Н. Ивичевой, Н. Н. Макарёнковой, В. Л. Зайцевой, И. В. Филоненко, Ю. А. Зуева выполнено в рамках государственного задания ФГБНУ «ВНИРО» № 076-00004-23-01. Исследование Д. А. Филиппова выполнено в рамках государственного задания № 124032100076-2 Института биологии внутренних вод им. И. Д. Папанина РАН.






 © 2011 - 2026
© 2011 - 2026