Введение
Экологическая сукцессия есть развитие биологических сообществ с течением времени в результате естественных или антропогенных изменений. Сукцессии продолжают играть центральную роль в современной экологической теории (Chang, Turner, 2019). Сукцессионные изменения сообществ в разной степени связаны с внешними и внутренними по отношению к сообществу факторами (Уиттекер, 1980). Сезонная сукцессия планктона считается предсказуемым и направленным процессом и включает только ту смену видов, которая является результатом либо взаимодействий между самими организмами, либо влиянием хищничества и конкуренции (Sommer et al., 1986). Последовательность смены видов, понимаемая как сукцессионная смена популяций, вызывается ограничением ресурсов и межвидовой конкуренцией, а также хищничеством (Gliwicz, Pijanowska, 1989; Donet, Hoffman, 1995). Сезонная сукцессия зоопланктона в малых реках представляет собой циклическую сукцессию, пусковым механизмом которой служит весеннее половодье (Крылов, 2005). Сезонные воздействия окружающей среды являются основными драйверами наблюдаемых колебаний видов, изменяющими основные качественные характеристики циклической сукцессии (Benincà et al., 2015). Сезонная динамика сообществ зоопланктона зависит также от трофических взаимодействий (Romagnan et al., 2015; Kenitz et al., 2017) и характеристик среды обитания (например, состава и обилия макрофитов) (Fu et al., 2021).
В исследовании сукцессий водных экосистем часто отсутствуют критерии, по которым можно было бы определить сукцессионное состояние отдельных биоценозов. Биоценозы являются развивающимися системами, переходящими из одного качественного состояния в другое как под воздействием внешних факторов, так и под влиянием изменений взаимодействий между компонентами биоценоза. В водоемах и водотоках одним из ведущих внешних факторов, формирующих среду для зоопланктона, является высшая водная растительность (Зимбалевская и др., 1987). Последовательное уменьшение пространственной неоднородности макрофитов, а также абиотических переменных оказывает комбинированное влияние на структуру сообществ зоопланктона (Fu et al., 2021). Развитие зоопланктона в течение сезона тесно связано с развитием зарослей макрофитов (Kuczynska-Kippen, 2003; Jeong et al., 2014). Изучение сезонной сукцессии зарослевых сообществ зоопланктона чаще проводят на озерах и водохранилищах (Столбунова, 2005; Бурмистрова, 2007; Макарцева, 2008; Палаш, 2010). Малые реки до сих пор остаются мало затронутыми в подобных исследованиях.
Большинство отечественных исследований по сезонной динамике зоопланктона сводится к выделению планктонных комплексов, под которыми понимают специфический видовой состав, приуроченный к какому-либо сезону года (Столбунова, 2006; Лазарева, 2010; Попов, Мухортова, 2016). Сезонную сукцессию рассматривают также как динамику численности и биомассы за вегетационный сезон (Черевичко, 2007; Зарубина, Ермолаева, 2014; Литвинова, Федяева, 2016). При этом часто не учитываются изменения видовой структуры сообществ зоопланктона, связанные с влиянием макрофитов. В ходе сезонной сукцессии, представляющей собой ежегодно повторяющийся процесс сборки сообществ, можно изучить все основные внешние факторы и внутренние взаимодействия, формирующие сообщества (Sommer et al., 2012).
Целью работы была характеристика сезонной сукцессии как изменения во времени видовой структуры зоопланктоценозов разнотипных зарослей макрофитов малой реки Левинки и анализ влияния на нее факторов среды.
Материалы
Исследования зоопланктона были проведены в среднем течении р. Левинки, расположенной в г. Нижнем Новгороде. Отбор проб проводили с 26 мая по 10 октября 2018 г. с периодичностью две недели в пяти прибрежных биотопах с разнотипной растительностью и без нее, расположенных на однородном участке реки. Были выбраны заросли растений с плавающими на поверхности воды листьями (кубышка желтая Nuphar lutea (L.) Sm, рдест плавающий Potamogeton natans L.), гелофиты (манник большой Glyceria maxima (Hartm.) Holmb.), погруженные (пузырчатка обыкновенная Utricularia vulgaris L.), а также участок прибрежья, лишенный высшей водной растительности (чистая рипаль). В зарослях пузырчатки отбор проб начали проводить с 18 июня в связи с отсутствием или недостаточным развитием растений в предыдущие даты отбора проб. Обследованные биотопы располагались на расстоянии 20–500 м друг от друга. Скорость течения в зарослях макрофитов была крайне низкой и не превышала 0.05 м/с. Исследованный учаткок реки подвержен незначительной антропогенной нагрузке. В пределах акватории отсутствуют места точечных сбросов в воду. Отмечено превышение ПДК по железу и марганцу, что в целом является региональной особенностью водоемов и водотоков (Экологическое состояние..., 2005).
Методы
Пробы зоопланктона отбирали мерным ведром на глубине 0.5 м путем процеживания 50 литров воды через планктонную сеть (нейлоновое сито с ячеей 70 мкм) и фиксировали 40 % раствором формалина. Отбор проб проводили с 10:00 до 12:00 ч Московского времени. Обработку материала осуществляли общепринятыми методами (Методические рекомендации…, 1982). Идентификацию видов зоопланктона проводили с использованием определителей (Кутикова, 1970; Определитель…, 2010). Параллельно с отбором проб проводили измерения ряда абиотических параметров среды. Прозрачность воды определяли по белому диску Секки. Температуру, активную реакцию среды (рН) и электропроводность воды измеряли мультипараметрическим зондом YSI Pro 1030. Также оценивали процент проективного покрытия растениями биотопа.
Доминирующие виды зоопланктона выявляли согласно индексу Палия – Ковнацки (Шитиков и др., 2003). Пробы зоопланктона классифицировали с помощью кластерного анализа на основе сходства видовой структуры, в качестве меры сходства использовали косинус угла между векторами проб в многомерном пространстве численностей видов (Шурганова и др., 2004; Шурганова, 2007). Кластерный анализ проводили на основе расчетов расстояния между группами проб (кластерами) методом средней связи (Якимов и др., 2016). Ординацию данных проводили с применением анализа избыточности (RDA) (Шитиков, Розенберг, 2013; Legendre & Legendre, 2012). Все расчеты проводились в среде R (R Core Team, 2015).
Результаты
В период исследований наблюдалось изменение рН воды р. Левинки от слабокислой до щелочной (6.20–8.60). Электропроводность изменялась в пределах 262–427 мкСм/см. Температура воды варьировала от 9.0 до 24.6 °С.
В зоопланктоне было идентифицировано 128 видов, из них 65 принадлежало коловраткам (Rotifera), 41 – ветвистоусым ракообразным (Cladocera), 22 – веслоногим ракообразным (Copepoda). Среди обнаруженных видов был найден трансконтинентальный вид-вселенец – коловратка североамериканского происхождения Kellicottia bostoniensis (Rousselet, 1908).
Кластеризация проб с использованием многомерного векторного анализа позволила нам выделить в исследуемых биотопах планктонные комплексы. Под планктонным комплексом мы понимаем временной промежуток существования сообщества зоопланктона со сходной видовой структурой.
В зарослях кубышки желтой четко выделялось два зоопланктонных комплекса: раннелетний (конец мая – начало июня) и летне-осенний (середина августа – начало октября) (рис. 1). Высокая степень сходства видовой структуры в раннелетний период связана с доминированием в сообществе ветвистоусого рачка Chydorus cf. sphaericus (O. F. Müller, 1785) и науплиальных стадий веслоногих ракообразных. С середины июня до конца июля видовая структура сообщества зоопланктона претерпевала изменения. Однако во все даты отбора в число доминантов входил крупный фитофильный ветвистоусый рачок Sida crystallina (O. F. Müller, 1776). Высокая степень доминирования этого рачка обуславливала сходство видовой структуры зоопланктоценозов в середине июня и конце июля. С середины августа до начала октября в зоопланктоне преобладали науплиальные и копеподитные стадии веслоногих ракообразных. Также в число доминантов входили ветвистоусые ракообразные семейства Chydoridae, добывающие пищу с поверхности субстрата, – Acroperus harpae (Baird, 1834) и C. sphaericus. В начале октября в состав доминантов вошла чужеродная коловратка K. bostoniensis.
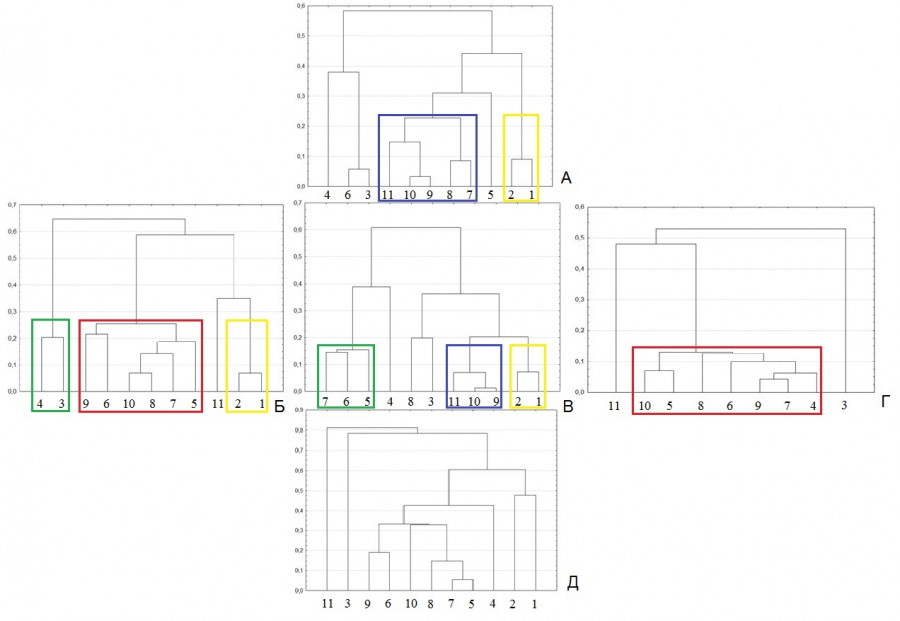
Рис. 1. Дендрограмма иерархической кластеризации проб зоопланктона биотопов р. Левинка на основе видовой структуры. По осям Y отложено расстояние объединения. По осям Х отложены даты отбора проб: 1 – 26.05, 2 – 5.06, 3 – 18.06, 4 – 3.07, 5 – 16.07, 6 – 31.07, 7 – 14.08, 8 – 28.08, 9 – 11.09, 10 – 21.09, 11 – 10.10. Буквами обозначены исследованные биотопы: А – кубышка желтая, Б – рдест плавающий, В – манник большой, Г – пузырчатка обыкновенная, Д – чистая рипаль. Цветными линиями обведены отдельные планктонные комплексы: желтыми – раннелетний, зелеными – летний, красными – летне-осенний, синими – осенний
Fig. 1. Dendrogram of hierarchical clustering of zooplankton samples from biotopes of the Levinka River based on species structure. Y axes show the distance of association. X-axes show sampling dates: 1 – 26.05, 2 – 5.06, 3 – 18.06, 4 – 3.07, 5 – 16.07, 6 – 31.07, 7 – 14.08, 8 – 28.08, 9 – 11.09, 10 – 21.09, 11 – 10.10. The letters indicate the biotopes studied: A – Nuphar lutea, Б – Potamogeton natans, В – Glyceria maxima, Г – Utricularia vulgaris, Д – clean riparian. Coloured lines encircle separate plankton complexes: yellow – early summer, green – summer, red – summer-autumn, blue – autumn
В зарослях рдеста плавающего на протяжении вегетационного сезона формировалось три зоопланктонных комплекса: раннелетний (конец мая – начало июня), летний (середина июня – начало июля) и летне-осенний (середина июля – середина сентября) (см. рис. 1). Раннелетний зоопланктонный комплекс характеризовался доминированием ветвистоусых ракообразных C. cf. sphaericus и A. harpae, а также копеподитных стадий веслоногих рачков. С середины июня до начала июля в зоопланктоне на первый план выходил ветвистоусый рачок S. crystallina, который обуславливал формирование отдельного комплекса в этот период. К середине июля S. crystallina вошла в число субдоминантов, а ее место занял ветвистоусый рачок Ceriodaphnia pulchella Sars, 1862. Вместе с науплиальными и копеподитными стадиями веслоногих ракообразных они формировали ядро доминирующих видов до середины сентября. В конце сезона произошли структурные перестройки в сообществе зоопланктона. Здесь на первое место вышли младшие возрастные стадии веслоногих рачков, C. cf. sphaericus, а также коловратка K. bostoniensis.
В зарослях манника большого в течение сезона четко формировалось три зоопланктонных комплекса: раннелетний (конец мая – начало июня), летний (середина июля – середина августа) и осенний (сентябрь – начало октября) (см. рис. 1). Перестройки видовой структуры наблюдались с середины июня до середины июля и в конце августа и были связаны со сменой доминантов в сообществе. Так, раннелетний комплекс формировали науплиальные и копеподитные стадии веслоногих ракообразных и ветвистоусый рачок C. cf. sphaericus. В середине июня в число доминантов вошел ветвистоусый рачок Simocephalus vetulus (O. F. Müller, 1776). Это обусловило обособление пробы на дендрограмме (см. рис. 1). В начале июля лидирующее место в числе доминантов занял ветвистоусый рачок C. pulchella. С середины июля до середины августа наблюдалось формирование зоопланктонного комплекса с преобладанием Ceriodaphnia megops Sars, 1862 и C. pulchella, а также науплиальных стадий Copepoda. Осенний комплекс характеризовался высоким сходством видовой структуры и преобладанием в зоопланктоне науплиальных и копеподитных стадий веслоногих ракообразных.
В зарослях пузырчатки обыкновенной был выявлен зоопланктонный комплекс, существующий наиболее продолжительное время, с начала июля до конца сентября (см. рис. 1). В этот период лидирующее положение среди доминантов занимал ветвистоусый рачок C. pulchella. Также в число доминантов входили науплиальные и копеподитные стадии веслоногих ракообразных и C. megops. В середине июня и начале октября видовая структура сообществ зоопланктона существенно отличалась от летнего комплекса. В июне доминантом в планктоне являлась колониальная коловратка Conochilus unicornis Rousselet, 1892. В октябре лидирующее положение в сообществе приобрела коловратка K. bostoniensis. Также доминантами выступали науплиальные и копеподитные стадии веслоногих ракообразных.
В отличие от зарослей макрофитов в открытом прибрежье видовая структура сообщества зоопланктона претерпевала существенные изменения в течение вегетационного сезона. Только в августе формировался зоопланктонный комплекс с доминированием науплиальных и копеподитных стадий веслоногих ракообразных и ветвистоусого рачка A. harpae (см. рис. 1). В начале сезона в сообществе преобладали коловратки Asplanchna priodonta Gosse, 1850, Keratella cochlearis (Gosse, 1851) и K. quadrata (O. F. Müller, 1786). В середине июня абсолютным доминантом стал ветвистоусый рачок C. pulchella. В начале июле в число доминантов вошла коловратка K. longispina, а в конце июля – Polyarthra major Burckhardt, 1900. Наиболее существенные перестройки видовой структуры произошли в начале октября, когда лидирующее место в числе доминантов заняла коловратка K. bostoniensis.
Для установления влияния факторов среды на сезонную сукцессию сообществ зоопланктона была построена модель на основе анализа избыточности. Статистический анализ вспомогательных моделей, которые были построены для каждого отдельного фактора, показал, что значимым влиянием p < 0.05 обладали все факторы (табл. 1). Полная модель RDA объясняла 23.42 % (р < 0.001) от общей дисперсии видовой структуры сообществ зоопланктона. Статистически значимыми в модели были пять осей (табл. 2).
Таблица 1. Статистический анализ значимости объяснения изменчивости видовой структуры для каждого отдельного фактора
| Фактор | Скорректированная доля объясняемой дисперсии, % | Значение критерия Фишера, F | p |
| Температура | 9.17 | 6.25 | 0.001 |
| Проективное покрытие растений | 8.13 | 5.60 | 0.001 |
| Прозрачность | 5.04 | 3.76 | 0.001 |
| Глубина | 4.89 | 3.67 | 0.001 |
| Электропроводность | 4.66 | 3.54 | 0.001 |
| рН | 1.85 | 1.98 | 0.032 |
Таблица 2. Статистический анализ данных модели на основе анализа избыточности
| Модель, ось | Скорректированная доля объясняемой дисперсии, % | Значение критерия Фишера, F | p |
| Полная модель | 23.42 | 3.65 | 0.001 |
| Ось I | 9.65 | 9.03 | 0.001 |
| Ось II | 5.28 | 4.94 | 0.001 |
| Ось III | 3.54 | 3.31 | 0.001 |
| Ось IV | 2.29 | 2.15 | 0.015 |
| Ось V | 2.08 | 1.95 | 0.038 |
По результатам анализа избыточности построена ординационная диаграмма (рис. 2). Положение проб вдоль горизонтальной и вертикальной осей связано с сезонными изменениями видовой структуры сообществ зоопланктона.
В начале вегетационного сезона наблюдалось высокое сходство видовой структуры зарослевых биотопов, что обуславливало близость расположения станций на диаграмме. В этот период растения характеризовались низкой степенью развития, а в планктоне преобладали представители семейства Chydoridae. Анализ диаграммы показывает, что пробы, собранные в июне и начале июля из зарослей кубышки и рдеста, тяготели к увеличению прозрачности воды. На эти даты приходился период «чистой воды», когда в планктоне развивался крупный фильтратор S. crystallina, тяготеющий к макрофитам с плавающими на поверхности воды листьями.
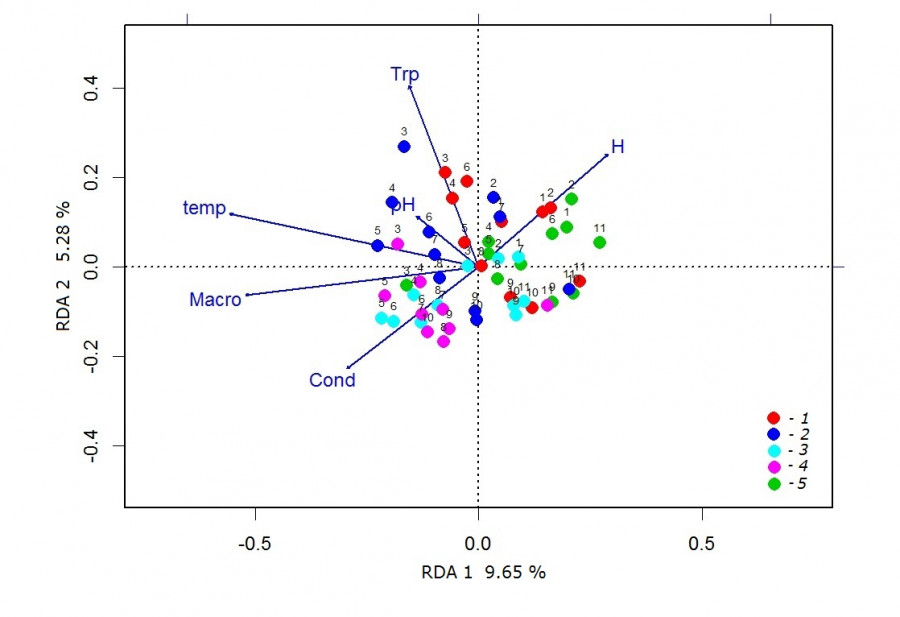
Рис. 2. Ординационная диаграмма, построенная по результатам анализа избыточности (RDA) для проб зоопланктона р. Левинка. H – глубина, temp – температура, Cond – электропроводность, Trp – прозрачность, pH – водородный показатель, Macro – проективное покрытие макрофитов. Цифрами обозначены даты отбора проб: 1 – 26.05, 2 – 5.06, 3 – 18.06, 4 – 3.07, 5 – 16.07, 6 – 31.07, 7 – 14.08, 8 – 28.08, 9 – 11.09, 10 – 21.09, 11 – 10.10. Цветными точками обозначены биотопы: 1 – кубышка желтая, 2 – рдест плавающий, 3 – манник большой, 4 – пузырчатка обыкновенная, 5 – чистая рипаль
Fig. 2. Ordination diagram based on the results of redundancy analysis (RDA) for zooplankton samples of the Levinka River. H – depth, temp – temperature, Cond – conductivity, Trp – transparency, pH – acidity, Macro – plant cover by biotope. Numbers indicate the dates of sampling: 1 – 26.05, 2 – 5.06, 3 – 18.06, 4 – 3.07, 5 – 16.07, 6 – 31.07, 7 – 14.08, 8 – 28.08, 9 – 11.09, 10 – 21.09, 11 – 10.10. The coloured dots indicate biotopes: 1 – Nuphar lutea, 2 – Potamogeton natans, 3 – Glyceria maxima, 4 – Utricularia vulgaris, 5 – clean riparian
В сторону векторов температуры воды и проективного покрытия макрофитов расположилось большинство летних проб рдеста, манника и пузырчатки. С летним ростом температуры воды связано отрастание и формирование большой биомассы макрофитов, обеспечивающее пространственную неоднородность биотопов. В дальнейшем происходило накопление перифитона и детрита в зарослевых биотопах, что провоцировало рост минерализации воды (электропроводности). С этим связано расположение августовских проб зарослей рдеста, манника и пузырчатки и сентябрьских проб зарослей рдеста и пузырчатки.
Большинство сентябрьских проб и все октябрьские расположились в относительной близости друг от друга. Это свидетельствует о сходстве видовой структуры сообществ зоопланктона в разных биотопах. К осени наблюдалось снижение температуры воды и отмирание высшей водной растительности в биотопах, где формировались сходные условия для зоопланктона. В этот период, как и в мае, в планктоне преобладали ракообразные семейства Chydoridae, добывающие пищу с поверхности субстрата.
Летние пробы из открытого прибрежья были расположены наиболее далеко от зарослевых проб, что обусловлено различиями в составе доминантов.
Обсуждение
Во всех зарослевых биотопах в течение сезона наблюдалась последовательная смена доминирующих видов в сообществах, что обуславливало формирование планктонных комплексов. Ход сезонной сукцессии зоопланктоценозов зарослей растений с плавающими листьями (кубышки и рдеста) имел сходные черты. В начале лета в обоих биотопах выделялись однородные по видовой структуре планктонные комплексы с доминированием ветвистоусого рачка S. crystallina. Его массовое развитие приурочено к периоду «чистой воды» и высокой плотности плавающих на поверхности воды листьев (Коровчинский, 1978; Столбунова, 2006; Кривенкова, 2018).
Зоопланктоценоз зарослей погруженного макрофита (пузырчатка) в летний период наиболее сильно отличался по видовой структуре от остальных зарослевых сообществ. Максимальное развитие пузырчатки приходилось на июль – август, что обуславливало долговременное существование планктонного комплекса. Большой объем погруженных растений в наибольшей степени формировал гетерогенность водного пространства и ограничивал зоопланктоценоз от влияния неблагоприятных факторов среды. Это позволяло сообществу зоопланктона длительное время сохранять консолидированную видовую структуру. Заполняя толщу воды плотной и сложной физической структурой, погруженные макрофиты обеспечивают среду для множества организмов и оказывают глубокое влияние на взаимодействие видов (Lauridsen et al., 1996; Jeppensen et al., 1998; Scheffer, 2004).
В октябре для зарослей кубышки, рдеста, пузырчатки и открытого прибрежья было характерно доминирование чужеродной коловратки K. bostoniensis. В зарослях пузырчатки ее численность была максимальной среди всех биотопов (табл. 3). Во всех этих биотопах к октябрю проективное покрытие растений снизилось до минимальных за сезон значений или растение полностью исчезло из биотопа (кубышка желтая). Отмирание погруженных и плавающих растений приводило к накоплению детрита, что провоцировало развитие бактерий и гетеротрофных жгутиконосцев, потребителем которых является чужеродная коловратка (Starkweather, Bogdan, 1980; Arndt, 1993; Oliveira et al., 2019). В ряде водных объектов также отмечено массовое развитие K. bostoniensis в октябре (Orcutt, Pace, 1984; Иванова, Телеш, 2004). В зарослях манника, где к октябрю большая часть растений оставалась в вегетирующем состоянии, количественное развитие K. bostoniensis было низким (табл. 3).
Таблица 3. Количественное развитие K. bostoniensis в исследованных биотопах
| Биотоп | Численность, тыс. экз./м3 | Доля от общей численности, % | ||
| 31.07.2018 | 10.10.2018 | 31.07.2018 | 10.10.2018 | |
| Кубышка желтая | 0.02 | 5.2 | 0.1 | 16.1 |
| Рдест плавающий | 0.02 | 3.0 | 0.006 | 11.7 |
| Манник большой | - | 0.14 | - | 0.37 |
| Пузырчатка обыкновенная | - | 12.8 | - | 25.3 |
| Чистая рипаль | 0.02 | 9.3 | 0.4 | 48.9 |
В гидроэкологии индекс видового разнообразия Шеннона стал общепринятым количественным критерием, позволяющим судить о стадиях развития сообществ (Зимбалевская, 1981; Алимов, 1982). В исследованиях зарослевого зоопланктона Днепровских водохранилищ (Зимбалевская, 1981) показано, что индекс Шеннона изменяется в течение сезона, нарастая до максимального уровня к осени. Высокие значения этого индекса используются как характеристики зрелости (климаксности) сообществ.
Анализ динамики индекса видового разнообразия Шеннона сообществ зоопланктона зарослей макрофитов показал, что наибольшие его колебания наблюдались в период перестройки видовой структуры и смены сезонных комплексов зоопланктона (рис. 3). Во всех зарослях макрофитов происходило снижение значения индекса при смене раннелетнего и летнего комплексов. В период начала существования планктонного комплекса происходит возрастание индекса Шеннона с дальнейшей стабилизацией при длительном существовании комплекса. В сентябре для всех зарослей характерно снижение индекса Шеннона, связанное с уменьшением числа видов в зоопланктоне. Однако к октябрю наблюдалось возрастание индекса, связанное с увеличением выравненности зоопланктона. В отличие от зарослей макрофитов, в зоопланктоне открытого прибрежья в осенний период наблюдалось снижение индекса видового разнообразия с минимальными значениями в октябре.
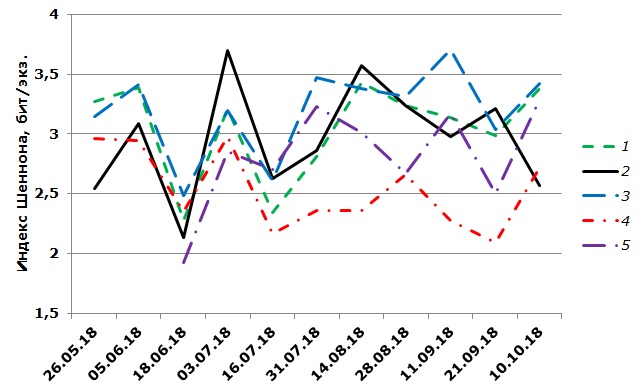
Рис. 3. Динамика индекса видового разнообразия Шеннона (бит/экз.), рассчитанного по численности зоопланктона зарослей макрофитов р. Левинки. Цветными линиями обозначены исследованные биотопы: 1 – кубышка желтая, 2 – чистая рипаль, 3 – рдест плавающий, 4 – манник большой, 5 – пузырчатка обыкновенная
Fig. 3. Dynamics of the Shannon species diversity index (bits/ind.) calculated from zooplankton abundance in macrophyte thickets of the Levinka River. The coloured lines indicate the studied biotopes: 1 – Nuphar lutea, 2 – pure riparian, 3 – Potamogeton natans, 4 – Glyceria maxima, 5 – Utricularia vulgaris
Таким образом, индекс видового разнообразия Шеннона отражает перестройки видовой структуры сообществ зоопланктона зарослей макрофитов. Высокие значения индекса наблюдаются в разные сезоны года, что свидетельствует о невозможности использования его как показателя зрелости зоопланктоценозов зарослей макрофитов малой реки при исследовании сезонной сукцессии.
Проведенный анализ показал, что ход сезонной сукцессии сообществ зоопланктона был обусловлен преимущественно изменениями температуры, прозрачности воды и проективного покрытия макрофитов. В начале и в конце вегетационного сезона в разнотипных зарослевых биотопах наблюдался сходный состав доминантов зоопланктоценозов. При этом в октябре в доминирующий комплекс большинства зарослей вошла коловратка K. bostoniensis. Накопление детрита при отмирании растений к осени обуславливало развитие в планктоне вторичных фильтраторов (C. cf. sphaericus) и собирателей (копеподиты). Преобладание этих таксонов в начале сезона связано с собиранием пищи с поверхности субстрата (неразложившихся остатков прошлогодних растений). Таким образом, смена зоопланктонных комплексов зарослей макрофитов в малой реке представляет собой циклическую сукцессию.
Заключение
Проведенные исследования показали, что изменение видовой структуры в ходе сезонной сукцессии сообществ зоопланктона зарослевых биотопов имеет цикличный характер. Наибольшая гетерогенность видовой структуры наблюдалась летом и была обусловлена различиями в экологических группах макрофитов и плотности зарастания биотопа. В зарослях растений с плавающими листьями (кубышка, рдест) в течение летнего сезона выделялись сходные по видовой структуре зоопланктонные комплексы с доминированием S. crystallina.
Наиболее значительные перестройки видовой структуры сообществ зоопланктона в зарослях происходили в июне и октябре. Июньские были связаны с повышением температуры воды и ростом проективного покрытия растений, а октябрьские – с понижением температуры воды и отмиранием высшей водной растительности.
Впервые показано, что чужеродная коловратка K. bostoniensis в зарослях макрофитов достигала массового развития в период отмирания растений. Вероятно, это связано с благоприятной для нее пищевой базой.
Значения индекса видового разнообразия Шеннона являются отражением перестроек видовой структуры сообществ зоопланктона зарослей макрофитов малой реки. Смена планктонных комплексов сопровождается снижением, а в период существования комплексов – возрастанием индекса Шеннона.
Библиография
Алимов А. Ф. Структурно-функциональный подход к изучению сообществ водных животных // Экология. 1982. № 3. C. 45–51.
Бурмистрова О. С. Зоопланктон зарослей макрофитов Телецкого озера // Озерные экосистемы: биологические процессы, антропогенная трансформация, качество воды: Материалы III Междунар. науч. конф. Минск – Нарочь. Минск: БГУ, 2007. С. 204–205.
Зарубина Е. Ю., Ермолаева Н. И. Сезонная динамика макрофитов и зоопланктона литоральной зоны Новосибирского водохранилища в 2013 г. // Международный журнал прикладных и фундаментальных исследований. 2014. № 11. С. 216–220.
Зимбалевская Л. Н. Фитофильные беспозвоночные равнинных рек и водохранилищ . Киев: Наукова думка, 1981. 216 с.
Зимбалевская Л. Н., Плигин Ю. В., Хороших Л. А., Долинский В. Л., Сидоренко В. М., Левина О. В., Георгиевская Л. М., Ревенко И. Г., Гошовская Г. А., Козина С. Я., Емельянов Л. В., Левитская Н. А. Структура и сукцессии литоральных биоценозов днепровских водохранилищ . Киев: Наукова думка, 1987. 204 с.
Иванова М. Б., Телеш И. В. Сезонная и межгодовая динамика планктонных коловраток и ракообразных // Закономерности гидробиологического режима водоемов разного типа / Под общ. ред. А. Ф. Алимова, М. Б. Ивановой. М.: Научный мир, 2004. С. 71–83.
Коровчинский Н. М. Изменчивость Sida crystallina и Diaphanosoma cf. brachyurum (Crustacea, Cladocera) озера Глубокого // Зоологический журнал. 1978. Т. 57, № 9. С. 1330–1342.
Кривенкова И. Ф. Значение фитофильного зоопланктона для экосистемы озера Кенон // Ученые записки Забайкальского государственного университета. 2018. Т. 13, № 1. С. 60–65.
Крылов А. В. Зоопланктон равнинных малых рек . М.: Наука, 2005. 263 с.
Кутикова Л. А. Коловратки фауны СССР . Л.: Наука, 1970. 742 с.
Лазарева В. И. Структура и динамика зоопланктона Рыбинского водохранилища / Под ред. А. И. Копылова. М.: Товарищество научных изданий КМК, 2010. 183 с.
Литвинова Н. В., Федяева Л. А. Влияние развития макрофитов в формировании структуры зоопланктона низовьев дельты р. Волги // Поволжский экологический журнал. 2018. № 4. С. 399–410.
Макарцева Е. С. Функционирование зоопланктона в условиях интенсивного зарастания (на примере оз. Свинечное) // Водные экосистемы: трофические уровни и проблемы поддержания биоразнообразия: Материалы Всероссийской конференции с международным участием «Водные и наземные экосистемы: проблемы и перспективы исследований». Вологда, 2008. С. 192–194.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах // Зоопланктон и его продукция. Л.: Гос. НИИ озер. и реч. рыб. хоз-ва, 1982. 33 с.
Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 1. Зоопланктон / Под ред. В. Р. Алексеева, С. Я. Цалолихина. М.: Товарищество научных изданий КМК, 2010. 495 с.
Палаш А. Л. Сезонная изменчивость придонного зоопланктона в растительных биотопах озер разного типа // Экология водных беспозвоночных: Сборник материалов Международной конференции, посвященной 100-летию со дня рождения Ф. Д. Мордухай-Болтовского. ИБВВ РАН, Борок. Ярославль: Принтхаус, 2010. С. 217–218.
Попов А. И., Мухортова О. В. Пелагический и литоральный зоопланктон Саратовского водохранилища: видовой состав, биологические инвазии, особенности формирования фауны / Отв. ред. Г. С. Розенберг. Тольятти: Кассандра, 2016. 158 с.
Столбунова В. Н. Зоопланктоценозы прибрежных мелководий водохранилищ Верхней Волги // Биологические ресурсы пресных вод: беспозвоночные. Рыбинск: Изд-во ОАО «Рыбинский дом печати», 2005. С. 357–373.
Столбунова В. Н. Зоопланктон озера Плещеево . М.: Наука, 2006. 152 с.
Уиттекер Р. Сообщества и экосистемы . М.: Прогресс, 1980. 328 с.
Черевичко А. В. Зоопланктон зарослей высшей водной растительности озера Полисто // Актуальные вопросы изучения микро-, мейозообентоса и фауны зарослей пресноводных водоемов: Тематические лекции и материалы I Международной школы-конференции. ИБВВ РАН, Борок. Н. Новгород: Вектор ТиС, 2007. С. 297–300.
Шитиков В. К., Розенберг Г. С., Зинченко Т. Д. Количественная гидроэкология: методы системной идентификации . Тольятти: ИЭВБ РАН, 2003. 463 с.
Шитиков В. К., Розенберг Г. С. Рандомизация и бутстреп: статистический анализ в биологии и экологии с использованием R . Тольятти: Кассандра, 2013. 314 с.
Шурганова Г. В., Черепенников В. В., Артельный Е. В. Динамика численности дискриминантных видов основных зоопланктоценозов Чебоксарского водохранилища // Поволжский экологический журнал. 2004. № 2. С. 200–209.
Шурганова Г. В. Динамика видовой структуры зоопланктоценозов в процессе их формирования и развития (на примере водохранилищ средней Волги: Горьковского и Чебоксарского) : Автореф. дис. … д-ра биол. наук. Н. Новгород, 2007. 48 с.
Экологическое состояние водных объектов Нижнего Новгорода . Н. Новгород: Изд-во ННГУ, 2005. 414 с.
Якимов В. Н., Шурганова Г. В., Черепенников В. В., Кудрин И. А., Ильин М. Ю. Методы сравнительной оценки результатов кластерного анализа структуры гидробиоценозов (на примере зоопланктона реки Линда Нижегородской области) // Биология внутренних вод. 2016. № 2. С. 94–103.
Arndt H. Rotifers as predators on components of the microbial web (bacteria, heterotrophic flagellates, ciliates)? A review // Hydrobiologia. 1993. Vol. 255–256. P. 231–246.
Benincà E., Ballantine B., Ellner S. P., Huisman J. Species fluctuations sustained by a cyclic succession at the edge of chaos // PNAS. 2015. Vol. 112, № 20. P. 6389–6394.
Chang C. C., Turner B. L. Ecological succession in a changing world // Journal of Ecology. 2019. Vol. 107. P. 503–509.
Donet A., Hoffman L. Seasonal succession and spatial distribution of the zooplankton community in the reservoir of Esch-Sur-Sûre (Luxembourg) // Belg. J. Zool. 1995. Vol. 125, iss. 1. P. 109–123.
Fu H., Özkan K., Yuan G., Johansson L.S., Søndergaard M., Lauridsen T. L., Jeppesen E. Abiotic and biotic drivers of temporal dynamics in the spatial heterogeneity of zooplankton communities across lakes in recovery from eutrophication // Science of the Total Environment. 2021. Vol. 778. P. 146368.
Gliwicz Z. M., Pijanowska J. The role of predation in zooplankton succession // Sommer U. (ed.). Plankton ecology: Succession in Plankton Communities. Brockj Springer series in contemporary bioscience. Springer-Verlag. Berlin, 1989. P. 253–296.
Jeong K. S., Choi J. Y., Jeong Kw. S. Influence of aquatic macrophytes on the interactions among aquatic organisms in shallow wetlands (Upo Wetland, South Korea) // J. Ecol. Environ. 2014. Vol. 37 (4). P. 185–194.
Jeppesen E., Lauridsen T. L., Kairesalo T., Perrow M. R. Impact of submerged macrophytes on fish-zooplankton interactions in lakes // The structuring role of submerged macrophytes in lakes / E. Jeppesen, M. Søndergaard, M. Søndergaard, K. Christoffersen (eds.). 1998. Ecol. Stud. Ser. 131. P. 91–114.
Kenitz K. M., Visser A. W., Mariani P., Andersen K. H. Seasonal succession in zooplankton feeding traits reveals trophic trait
coupling // Limnology and Oceanography. 2017. Vol. 62. P. 1184–1197.
Kuczynska-Kippen N. The distribution of rotifers (Rotifera) within a single Myriophyllum bed // Hydrobiology. 2003. Vol. 506–509. P. 327–331.
Lauridsen T. L., Pedersen L. J., Jeppesen E., Søndergaard M. The importance of macrophyte bed size for cladoceran composition and horizontal migration in a shallow lake // Journal of Plankton Research. 1996. Vol. 18. P. 2283–2294.
Legendre P., Legendre L. Numerical ecology. Oxford: Elsevier, 2012. 990 p.
Oliveira F. R., Lansac-Tôha F. M., Meira B. R. et al. Effects of the exotic rotifer Kellicottia bostoniensis (Rousselet, 1908) on the microbial food web components // Aquatic Ecology. 2019. № 53. P. 581.
Orcutt J. D., Pace M. L. Seasonal dynamics of rotifer and crustacean zooplankton populations in a eutrophic, monomictic lake with a note on rotifer sampling techniques // Hydrobiologia. 1984. Vol. 119 (1). P. 73–80.
Romagnan J.-B, Legendre L., Guidi L., Jamet J.-L., Jamet D., Mousseau L. et al. Comprehensive Model of Annual Plankton Succession Based on the Whole-Plankton Time Series Approach // PLoS ONE. 2015. Vol. 10 (3). P. e0119219.
Scheffer M. Ecology of Shallow Lakes. New York: Springer Science & Business Media, 2004. 457 р.
Sommer U., Gliwicz Z. M., Lampert W., Duncan A. The PEG model of a seasonal succession of planktonic events in fresh waters // Arch. Hydrobiol. 1986. Vol. 106. P. 433.
Sommer U., Adrian R., De Senerpont Domis L. et al. Beyond the Plankton Ecology Group (PEG) Model: Mechanisms driving plankton succession // Annu. Rev. Ecol. Evo. Syst. 2012. Vol. 43. P. 429.
Starkweather P. L., Bogdan K. G. Detrital feeding in natural zooplankton communities: discrimination between live and dead algal foods // Hydrobiologia. 1980. Vol. 73. P. 83–85.
R Core Team. R: A language and environment for statistical computing. 2015. URL: http://www.R–project.org (дата обращения: 13.05.2024).






 © 2011 - 2026
© 2011 - 2026