Введение
Погруженные макрофиты являются важным компонентом водных экосистем и обычно играют жизненно важную роль в экологическом функционировании мелководных озер (Jeppesen et al., 2012; Hao et al., 2017). Современное понимание экологии водных экосистем пока не позволяет определить структуру сообществ макрофитов в средах, подверженных колебаниям уровня воды (Zohary, Ostrovsky, 2011; Moura Júnior et al., 2016). Исследования реакции биомассы водных макрофитов в условиях колебания уровня воды показывают разные результаты в отношении видов (Byun et al., 2017). Цель данной работы – анализ колебания биомассы и площади зарастания макрофитов оз. Кенон – водоема-охладителя Читинской теплоцентрали (ТЭЦ-1) с регулируемым уровнем воды. Результаты исследования послужат основой для оценки и прогноза состояния экосистемы озера в изменяющихся условиях среды.
Материалы
Озеро Кенон расположено в черте г. Читы – столицы Забайкальского края. С 1965 г. используется в качестве водоема-охладителя Читинской ТЭЦ-1. С 1979 г. для регулирования уровня воды в озере начата подкачка из р. Ингода (Bazarova et al., 2019). Площадь озера в период низкого уровня воды составляет 14.7 км2, при высоком уровне – 16.2 км2. В работе проанализированы материалы многолетних исследований макрофитов (1971 по 2015 гг.), включающие литературные данные за 1971 г. (Владимирова, 1972, 1979), 1986 и 1993 гг. (Золатарева, 1998) и результаты собственных исследований за летний период 2010–2015 гг. Данные по уровню воды в оз. Кенон предоставлены ПАО «ТГК-14». Всего обследовано 109 станций, проведено 139 укосов.
Методы
Гидроботанические работы в озере проведены согласно общепринятой методике (Катанская, 1981). Растительность изучалась методом экологических профилей и путем маршрутного обследования озера с использованием эхолота фирмы Lowrance модель HDS 5 Gen 2 с точностью определения глубины ±1 см, определения координат ±2 м. Визуализация треков, получаемых при батиметрической съемке, позволяет различать заросшие и незаросшие участки дна. Достаточно четко различаются ярусы, границы переходов погруженных растительных сообществ. Для верификации изображения на треках проводились гидроботанические работы, которые заключались в определении видового состава, отборе укосов, измерении глубины и прозрачности воды по диску Секки, фиксации характера грунта и географических координат. Для подъема растений из водоема использовали якорь-кошку с металлической сеткой. Сбор биомассы сосудистых растений (укосы) осуществляли прибором КУГ (Базарова, 2003) с площадью захвата 0.25 м2, харовые водоросли собраны дночерпателем Петерсона. Каждый укос промывали, разбирали по видам, высушивали до воздушно-сухого состояния и взвешивали на весах с точностью до сотых грамма. Для пересчета на абсолютно-сухой вес использовали коэффициент 0.93. Все значения фитомассы в работе приведены в абсолютно-сухом весе в пересчета на 1 м2. Таксономия сосудистых растений приведена по Catalogue of Life, харовых водорослей – по Algae base.
Результаты
Анализ колебаний уровня воды показывает, что в 1964, 1971, 1986 и 1993 гг. уровень воды был выше значения 654 м над ур. м. по БС, что можно охарактеризовать как «высокий» (табл. 1). В 1964 и 1971 гг. уровень воды был обусловлен только количеством атмосферных осадков предшествующих лет, в последующие годы он зависел от объема подкачиваемых вод. Максимальные значения уровня зарегистрированы в 1986 и 1993 гг., когда объем подкачиваемых вод был максимальным. В период наших исследований объемы подкачиваемых вод были низкими, как и увлажненность территории Забайкалья (Обязов, 2014). Это привело к снижению уровня воды ниже значения 653.5 м над ур. м. по БС, который можно охарактеризовать как «низкий». Колебания уровня воды определяют соотношение площади мелководий и глубоководных участков, прозрачность воды, концентрацию биогенных элементов (см. табл. 1). Например, концентрация нитритов (NO2-) в 2010–2015 гг. по сравнению с 1986 г. снизилась, а концентрация нитратов (NO3-) и аммония (NH4-) в 2011 и 2012 гг., напротив, возросла. В это же время содержание общего фосфора (Pобщ) колебалось от 0.01 до 0.09 мг/л (Бутенко, Цыбекмитова, 2017) с тенденцией постепенного снижения концентрации. Озеро характеризуется как мезотрофный водоем.
Таблица 1. Значения абиотических и некоторых биотических параметров в оз. Кенон за разные годы
| Показатели | Год | |||||||
| 1964 | 1971 | 1986 | 1993 | 2010 | 2011 | 2012 | 2015 | |
| Уровень воды, м над ур. м. по БС | 654.1 | 654.6 | 654.8 | 654.5 | 653.2 | 653.0 | 652.9 | 653.3 |
| Количество атмосферных осадков, мм | 286.6 | 406.8 | 232.8 | 309.0 | 336 | 290.3 | 491.5 | 301.6 |
| Объем подкачиваемых вод, млн м3/год | 0 | 0 | – | 23.1 | 6.17 | 6.71 | 4.39 | 7.68 |
| Максимальная глубина озера, м | – | 7.0 | 7.0 | 7.0 | 4.5 | 4.7 | 4.7 | 5.2 |
| Прозрачность воды, м | – | 2.0 | 3.1 | 3.0 | 3.7 | 3.8 | 4.5 | |
| Максимальная глубина роста растений, м | 5.5 | 2.0 | 4 | 4 | 4 | 5 | ||
| % зарастания озера | 100 | 68 | 44 | 25 | 32 | 50 | 64 | 92 |
| NO3- | – | 0.07 | 0.03 | 0.01 | 1.48 | 0.00 | 0.00 | |
| NO2- | – | 0.01 | 0.03 | 0.0 | 0.01 | 0.00 | 0.00 | |
| NH4+ | – | 0.18 | 0.013 | 0.08 | 0.11 | 0.043 | 0.00 | |
| Pобщ | – | – | 0.10 | 0.09 | 0.04 | 0.01 | 0.01 | |
Сопоставление площади зарастания озера с колебаниями уровня воды показывает, что в период до регулирования площадь зарастания озера изменялась от 68 до 100 %. После начала регулирования и повышения уровня воды до 655 м (был поднят в 1991 г.) площадь зарастания снизилась до 25 %. Постепенное снижение уровня воды к началу наших исследований сопровождалось ростом площади зарастания озера.
Корреляционный анализ взаимосвязи уровня воды и площади зарастания озера показал полиномиальную зависимость с величиной аппроксимации R2 = 0.7. Это подтверждает, что при росте уровня воды площадь зарастания снижается и, наоборот, при снижении уровня воды площадь зарастания увеличивается (рис. 1).
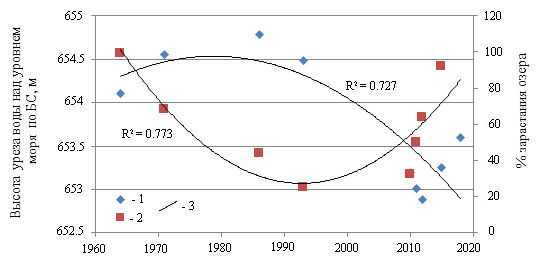
Рис. 1. Взаимосвязь уровня воды и степени зарастания (в % от площади) оз. Кенон: 1 – значения уровня воды, 2 – степень зарастания, 3 – полиномиальная зависимость
Fig. 1. Relationship between water level and the degree of overgrowth of lake Kenon: 1 – water level values, 2 – degree of overgrowth, 3 – polynomial trend
Анализ среднегодовых значений биомассы водных растений оз. Кенон (табл. 2) показывает, что в 1971 г. доля сосудистых растений в общей биомассе составляла 66.8 %, была выше доли харовых водорослей (34 %). Основную биомассу формировали фитоценозы погруженных растений Myriophyllum sibiricum, Ranunculus circinatus, Potamogeton crispus, Potamogeton perfoliatus, на которые приходилось 39.4 %. На долю воздушно-водных растений (гелофитов), представленных Schoenoplectus tabernaemontani, приходилось 14.5 % от общей биомассы. Доля погруженных укореняющихся растений с плавающими на поверхности воды листьями (нейстофиты) составляла менее 10 %. В 1986 г. произошло снижение площади зарастания озера и общей биомассы макрофитов, отмечена тенденция роста доли харовых водорослей. На этом фоне доля биомассы сосудистых погруженных в воду растений снизилась до 21.8 %, доля нейстофитов – до 2 %, а доля гелофитов возросла до 38.5 %. Рост доли гелофитов обусловлен сменой зарослей S. tabernaemontani на фитоценозы Phragmites australis.
Таблица 2. Значения биомассы (абсолютно-сухой вес ± стандартное отклонение) макрофитов оз. Кенон в разные годы
| Вид | Год | |||||||||||
| 1971 | 1986 | 2010 | 2011 | 2012 | 2015 | |||||||
| г/м2 | % | г/м2 | % | г/м2 | % | г/м2 | % | г/м2 | % | г/м2 | % | |
| Chara tomentosa L. | 157 | 11.9 | 225 | 14.1 | 312±453 | 22.65 | 925±782 | 32.3 | 119±130 | 4.5 | 773±664 | 24.1 |
| Chara aspera var. subinermis Kütz. | 83 | 6.38 | 67 | 4.2 | 50±29 | 3.57 | 42±0.1 | 1.5 | 596±537 | 22.0 | 339±275 | 10.6 |
| Chara globularis Thuill. | 126 | 9.5 | 178 | 11.2 | 311±241 | 22.04 | 628±541 | 21.9 | 355±229 | 13.1 | 158±31 | 4.9 |
| Nitella flexilis (L.) Ag. | 83 | 6.3 | 128 | 8.1 | 208 ±85 | 14.74 | 606±205 | 21.1 | 857±149 | 31.7 | 767±0.1 | 23.9 |
| Elodea canadensis Michx | 0 | 0 | 0 | 0 | 384±489 | 27.18 | 409±324 | 14.3 | 53±55 | 1.9 | 6.9 ±0.3 | 0.2 |
| Ceratophyllum demersum L. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 7±0.1 | 0.3 | 238±142 | 7.4 |
| Myriophyllum sibiricum Kom | 160 | 12.1 | 192 | 12.1 | 138±198 | 9.81 | 26±23 | 0.9 | 96±155 | 3.5 | 407±44 | 1.3 |
| Ranunculus circinatus Sibth | 126 | 9.5 | 154 | 9.7 | – | – | – | – | – | – | – | – |
| Potamogeton perfoliatus L. | 104 | 7.9 | 0.1 | 0.01 | – | – | 31±12 | 1.1 | 319±0.1 | 11.8 | 165±0.1 | 5.1 |
| Potamogeton crispus L. | 120 | 9.1 | 1.2 | 0.1 | – | – | 14±12 | 0.5 | 4±5 | 0.1 | ||
| Stuckenia pectinata (L.) Börner | 1.1 | 0.8 | 0.1 | 0.01 | – | – | 93±8 | 3.2 | 283±84 | 10.5 | 119±111 | 3.3 |
| Stuckenia vaginata (Magnin) Holub | 0.1 | – | – | – | – | – | 15±0.1 | 0.6 | – | – | ||
| Potamogeton octandrus Poir | 0 | 0 | 0 | 0 | 0 | 0 | 93±0.1 | 3.2 | 0 | 0 | 29±29.8 | 0.9 |
| Persicaria amphibia (L.) Gray | 75 | 5.7 | 0.1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nymphoides peltata (S. G. Gmel.) Kuntze | 96 | 7.3 | 32 | 2.0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phragmites australis (Cav.) Trin. ex Steud. | – | – | 613 | 38.5 | – | – | – | – | – | – | 570±0.01 | 17.8 |
| Schoenoplectus tabernaemontani (C. C. Gmel.) Palla | 191 | 14.5 | 0.1 | – | – | – | – | – | – | – | – | – |
Примечание. Прочерк – нет данных.
Снижение доли погруженных сосудистых растений связано с существенным сокращением зарослей P. crispus и P. perfoliatus. Лидирующая роль сохраняется за M. sibiricum и R. circinatus. В период исследований (2010–2015 гг.) доля харовых водорослей в сумме биомассы последовательно менялась следующим образом: 2010 г. – 63.0 %, 2011 г. – 76.8 %, 2012 г. – 71.3 %, 2015 г. – 63.5 %. Доля погруженных сосудистых растений изменялась следующим образом: 2010 г. – 37 %, 2011 г. – 23.7 %, 2012 г. – 28.7 %, 2015 г. – 18.7 %. При этом в 2010 г. основную биомассу сосудистых погруженных растений формировали локальные плотные заросли Elodea canadensis высотой до 2.0 м. В последующие годы роль E. canadensis и других видов погруженных растений снижалась. В 2015 г. регистрировались локальные скопления C. demersum, хотя до 2012 г. вид в озере не указывался. Возможно, он занесен в последние годы. Возросла доля площади S. pectinata, однако вклад вида в общую биомассу остается невысоким. В 2015 г. на термальном участке озера впервые выявлены группировки P. octandrus – представителя дальневосточной флоры (Базарова, Бобров, 2019). Из-за резкого снижения уровня воды в водоеме заросли воздушно-водных растений в 2010–2012 гг. развивались на осушенном побережье (рис. 2), поэтому их биомассу не учитывали. Подъем уровня воды в 2015 г. вследствие роста количества атмосферных осадков привел к затоплению прибрежий в местах произрастания Ph. australis.

Рис. 2. Северное прибрежье оз. Кенон в июне 2010 г.
Fig. 2. Northern shore of Lake Kenon in June 2010
Корреляционный анализ уровня воды и средней биомассы растений показал обратную линейную зависимость (достоверность аппроксимации R2 = 0.84) (рис. 3). Это свидетельствует о том, что снижение уровня воды способствует росту биомассы водных растений.
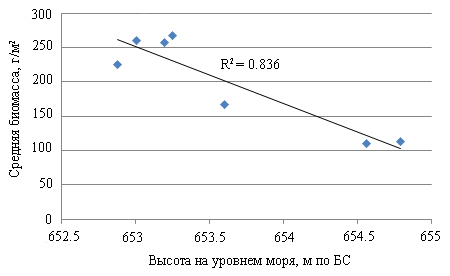
Рис. 3. Зависимость средней биомассы макрофитов от уровня воды
Fig. 3. Dependence of the average biomass of macrophytes on the water level
Обсуждение
Рассмотренные материалы показывают, что снижение уровня воды в оз. Кенон сопровождается ростом площади зарастания и среднегодовых значений биомассы макрофитов, особенно погруженных в воду растений, а рост уровня воды приводит к уменьшению площади и биомассы макрофитов. Аналогичная картина наблюдалась в мелководных разнотипных водных экосистемах мира (Squires et al., 2002; Havens, 2003; Turner et al., 2005; Ruies et al., 2010; Папченков, 2013; Zhang et al., 2016; Бабаназарова и др., 2018). В то же время существуют озера, в которых при низком уровне воды площадь зарослей растет, а биомасса сокращается (Zhao et al., 2021). Предполагаем, что в случае снижения уровня воды оз. Кенон ниже значения 652 м также произойдет сокращение площади зарастания и значений среднегодовой биомассы, что в целом негативно отразится на качестве воды озера. Согласно литературным данным, экстремальные колебания уровня воды (как повышение, так и понижение) ведут к снижению биомассы и площади зарастания озера (Покровская и др., 1983; Smith et al., 1987; Zohary, Ostrovsky, 2011), а умеренные колебания вносят позитивный вклад в развитие макрофитов озера (Pieczynska, 1990).
Несмотря на общую реакцию динамики площади и биомассы водных растений на колебания уровня воды, отклик экологических групп водных растений или конкретных видов на колебания уровня воды различается (Turner et al., 2005). В нашем случае площадь зарослей воздушно-водных растений в оз. Кенон при снижении уровня вод снижается, а при росте – возрастает. Хотя во многих публикациях отмечается, что при снижении уровня площадь зарослей гелофитов растет (Hellsten, 2009; Кочеткова и др., 2022; Zhao et al., 2021). В то же время есть публикации, в которых заросли гелофитов сокращаются (Yamamoto et al., 2006), так же как в нашем случае. Есть примеры гибели гелофитов при экстремально высоком уровне воды (Dienst et al., 2004). Мы считаем, что трапециевидная форма котловины оз. Кенон является причиной отмеченной реакции гелофитов. Кроме этого, форма котловины озера обуславливает и слабое развитие зарослей растений с плавающими на поверхности воды листьями. Они регистрировались в периоды высокого уровня до начала подкачки воды из р. Ингода.
Снижение уровня воды в оз. Кенон сопровождается ростом среднегодовых значений биомассы макрофитов. При этом выявлено, что доля харовых водорослей в общей биомассе растений растет, а доля сосудистых погруженных растений снижается. Аналогичная картина наблюдалась в оз. Окичоби (США) (Havens, 2003). Кроме этого, массовое развитие харовых водорослей в оз. Кенон, возможно, обусловлено совокупностью факторов, являющихся следствием снижения уровня воды: уменьшением концентрации Робщ и ростом прозрачности воды. Пример роста биомассы и площади харофитов при снижении концентрации Робщ показан для озер Ботшольского заповедника (Нидерланды) (Rip et al., 2006). Рост прозрачности воды повышает также доступность света, обеспечивая благоприятную среду для прорастания ооспор, ускоряя рост харофитов (de Winton et al., 2004).
На снижение роли погруженных сосудистых растений существенное влияние оказало антропогенное воздействие. Предполагаем, что на сокращение биомассы Potamogeton crispus в оз. Кенон значительное негативное влияние оказали сброс теплых вод с ТЭЦ-1 и вселение растительноядного белого амура Ctenopharyngodon idella (Valenciennes, 1844). P. crispus является евроазиатским видом с осенне-весенним циклом развития (Wu et al., 2021). Сдерживающее воздействие высоких температур воды на развитие P. crispus было показано в ряде работ (Hao et al., 2018; Lee et al., 2007; Zhang et al., 2016 ). В 2010–2015 гг. наблюдался рост биомассы Stuckenia pectinata, Ceratophyllum demersum, способности данных видов приспосабливаться к колебаниям уровня воды отмечены в исследованиях (Zhao et al., 2021).
Анализ среднегодовых значений биомассы макрофитов показывает, что биомасса харовых водорослей может достигать 925 г/м2. По данным В. П. Папченкова (2001), средние значения погруженных растений могут достигать 1031 ± 160 г/м2. В то же время максимальная биомасса сообществ Ch. tomentosa в оз. Кенон может составлять 1945 г/м2. Среди сосудистых погруженных растений максимум средних значений биомассы выявлен для Elodea canadensis, довольно высокие значения в разные годы были отмечены для Potamogeton perfoliatus, Ceratophyllum demersum, Myriophyllum sibiricum. В целом полученные среднегодовые значения биомассы основных видов водных растений оз. Кенон согласуются с результатами исследований, полученных в ходе выполнения работ по Международной биологической программе (The functioning..., 1980). Согласно полученным по программе результатам, максимальная фитомасса макрофитов в водоемах умеренной зоны не превышает 700 грамм сухой массы на 1 м2 и лишь в редких случаях для харовых составляет 1000 г сухой массы на 1 м2 площади зарослей (Алимов и др., 2013).
Заключение
Динамика площади зарастания и среднегодовых значений биомассы макрофитов оз. Кенон, уровенный режим которого по годам непостоянен, зависит как от количества атмосферных осадков, так и объема подкачиваемых вод и имеет циклический характер.
В годы с низким уровнем воды площадь зарастания озера и значения среднегодовой биомассы увеличиваются за счет роста погруженной растительности. В это же время сокращается площадь зарослей воздушно-водных растений из-за обсыхания прибрежных мелководий. Среди гелофитов отмечена смена доминанта Schoenoplectus tabernaemontani на Phragmites australis. Сокращаются также заросли слабо развитых сообществ погруженных укореняющихся растений с плавающими листьями из-за малой площади мелководий в трапециевидной по форме котловине озера. Среди погруженных водных растений растет доля харовых водорослей, а доля сосудистых погруженных растений снижается. Среди сосудистых растений увеличилась доля Myriophyllum sibiricum, а доля Potamogeton crispus снизилась. В период 2010–2015 гг. в озере получили развитие сообщества Stuckenia pectinata.
В целом результаты наших исследований показывают, что, несмотря на значительную антропогенную нагрузку, оз. Кенон сохраняет статус макрофитного водоема с доминированием харовых водорослей, S. pectinata и M. sibiricum. При этом, несмотря на общую тенденцию обратной зависимости площади зарослей и значений среднегодовой биомассы макрофитов от уровня воды, отклик экологических групп растений или конкретных видов отличается.
Библиография
Алимов А. Ф., Богатов В. В., Голубков С. М. Продукционная гидробиология . СПб.: Наука, 2013. 342 р.
Бабаназарова О. В., Сиделев С. И., Жданова С. М., Литвинов А. С., Овсеенко А. С., Коровкина К. П. Уровень воды в мелководном высокоэвтрофном озере – фактор развития по макрофитовому или фитопланктонному типу (оз. Неро, Ярославская область) // Водные ресурсы. 2018. Т. 45, № 6. С. 645–655.
Базарова Б. Б. Структура и продуктивность растительности водных экосистем Восточного Забайкалья (на примере озер бассейна реки Хилок) : Автореф. дис. … канд. биол. наук. Улан-Удэ, 2003. 18 с.
Базарова Б. Б., Бобров А. А. Potamogeton octandrus (Potamogetonaceae) – новый вид для флоры Сибири // Ботанический журнал. 2018. № 103 (11). С. 1489–1496.
Бутенко М. Н., Цыбекмитова Г. Ц. Динамика биогенных элементов (азота и фосфора) в воде озера Кенон // Экология водоемов-охладителей энергетических станций. Чита: ЗабГУ, 2017. C. 29–32.
Владимирова З. Ф. Водная растительность и ее регулирование в водоеме – охладителе Читинской ГРЭС (оз. Кенон) // Охрана природы и воспроизводство природных ресурсов. Чита, 1979. С. 113–114.
Владимирова З. Ф. Гидрофиты оз. Кенон // Отчет за 1971 год по теме ГК СМ СССР по науке и технике «Изучение влияния сбросов воды электростанция на водоем-охладитель в условиях Сибири». Иркутск: ЛИН СО РАН, 1972. С. 55–64.
Золотарева Л. Н. Водная растительность озера Кенон и ее динамика (Восточное Забайкалье) : Автореф. дис. … канд. биол. наук. Улан-Удэ, 1998. 19 с.
Катанская В. М. Высшая водная растительность континентальных водоемов СССР: Методы изучения . Л.: Наука, 1981. 187 с.
Кочеткова А. И., Брызгалина Е. С., Филиппов О. В., Баранова М. С. Динамика зарастания Волгоградского водохранилища (1972–2018 гг.) // Принципы экологии. 2022. Т. 12, № 1. С. 58–73.
Обязов В. А. Изменения современного климата и оценка их последствий для природных и природно-антропогенных систем Забайкалья : Автореф. дис. … д-ра геогр. наук. Казань, 2014. 38 с.
Папченков В. Г. Растительный покров водоемов и водотоков Среднего Поволжья . Ярославль: ЦМП МУБиНТ, 2001. 200 с.
Папченков В. Г. Степень зарастания Рыбинского водохранилища и продуктивность его растительного покрова // Биология внутренних вод. 2013. № 1. С. 24–31.
Покровская Т. Н., Миронова Н. Я., Шилькрот Г. С. Макрофитные озера и их евтрофирование . М.: Наука, 1983. 153 с.
Algae Base. URL: https://www.algaebase.org/ (дата обращения 20.04.2023).
Bazarova B. B., Kuklin A. P., Matafonov P. V., Tsybekmitova G. Ts., Gorlacheva E. P., Afonina E. Yu., Tashlykova N. A. Long-term dynamics of hydrobiont communities in Kenon Lake // IOP Conference Series: Earth Environ. 2019. № 321: 012056. DOI: 10.1088/1755-1315/321/1/012056.
Byun C., Nam J. M., Kim J. G. Effects of flooding regime on wetland plant growth and species dominance in a mesocosm experiment // Plant Ecology. 2017. Vol. 218, № 5. Р. 517–527. DOI: 10.1007/s11258-017-0707-0.
Catalogue of Life. URL: https://www.catalogueoflife.org/col (дата обращения: 20.04.2023).
de Winton M. D., Casanova M. T., Clayton J. S. Charophyte germination and establishment under low irradiance // Aquatic Botany. 2004. Vol. 79, № 2. P. 175–187. DOI: 10.1016/j.aquabot.2004.01.013.
Dienst M., Schmieder K., Ostendorp W. Effects of water level variations on the dynamics of the reed belts of Lake Constance // Limnologica. 2004. Vol. 34. P. 29–36.
Hao B., Roejkjaer A. F., Wu H., Cao Y., Jeppesen E., and Li W. Responses of primary producers in shallow lakes to elevated temperature: a mesocosm experiment during the growing season of Potamogeton crispus // Aquatic Sci. 2018. Vol. 80:34. DOI: 10.1007/s00027-018-0585-0.
Havens K. E. Submerged aquatic vegetation correlations with depth and light attenuating materials in a shallow subtropical lake // Hydrobiologia. 2003. Vol. 493, № 1/3. P. 173–186. DOI: 10.1023/A:1025497621547.
Hellsten S., Mjelde M. Macrophyte responses to water level fluctuation in Fennoscandinavian lakes-applying a common index // Internationale Vereinigung für theoretische und angewandte Limnologie: Verhandlungen. 2009. Vol. 30, № 5. P. 765–769.
Jeppesen E., Søndergaard M., Søndergaard M., Christoffersen K. The Structuring Role of Submerged Macrophytes in Lakes. Berlin/Heidelberg: Springer Science & Business Media, 2012. Vol. 131.
Lee K. S., Park S. R., and Kim Y. K. Effects of irradiance, temperature, and nutrients on growth dynamics of seagrasses: a review. J. // Journal of Experimental Marine Biology and Ecology. 2007. Vol. 350. P. 140–175. DOI: 10.1016/j.jembe.2007.06.016.
Moura Júnior E. G., Pott A., Severi W., Zickel C. S. Water Level Rise Induced Limnological Changes Indirectly Influencing the Structure of Aquatic Macrophyte Communities in a Tropical Reservoir // Journal of Plant Sciences. 2016. Vol. 4, № 6. Р. 195–201. DOI: 10.11648/j.jps.20160406.18.
Pieczyńska E. Lentic aquatic-terrestrial ecotones: their structure, functions, and importance // The Ecology and management of aquatic-terrestrial ecotones, UNESCO. Paris, 1990. P. 103–140.
Rip W., Rawee N., de Jong A. Alternation between clear, high-vegetation-and turbid, low-vegetation states in a shallow lake: The role of birds // Aquatic Botany. 2006. Vol. 85. P. 184–190. DOI: 10.1016/j.aquabot.2006.03.003.
Ruiz C., Martinez G., Toro M., Camacho A. A Review: macrophytes in the Assessment of Spanish Lakes Ecological Status Under the Water Framework Directive (WFD) // Ambientalia. 2011. P. 1–25.
Smith B. D., Maitland P. S., Pennock S. M. A comparative-study of water level regimes and littoral benthic communities in Scottish lochs // Biol Conserv. 1987. Vol. 39, № 4. P. 291–316.
Squires M. M., Lesack L. F. W., Huebert D. The influence of water transparency on the distribution and abundance of macrophytes among lakes of the Mackenzie Delta, western Canadian Arctic // Freshwater Biology. 2002. Vol. 47, № 11. Р. 2123–2135. DOI: 10.1046/j.1365-2427.2002.00959.x.
The functioning of freshwater ecosystems / Eds. E. D. Le Cren, R. H. Lowe-McCon-nell. International biological programme 22. Cambridge: Cambridge University Press, 1980. 588 p.
Turner M. A., Huebert D. B., Findlay D. L., Hendzel L. L., Jansen W. A., Bodaly R. A., Armstrong L. M., Kasian E. M. Divergent impacts of experimental lake-level drawdown on planktonic and benthic plant communities in a boreal forest lake // Canadian Journal of Fisheries and Aquatic Sciences. 2005. Vol. 62. P. 991–1003. DOI: 10.1139/f05-003.
Wu H., Hao B., Jo. H., Cai Y. Seasonality and Species Specificity of Submerged Macrophyte Biomass in Shallow Lakes Under the Influence of Climate Warming and Eutrophication // Front. Plant Sci. 2021. № 12:678259. DOI: 10.3389/fpls.2021.678259.
Yamamoto T., Kohmatsu Y., Yuma M. Effects of summer drawdown on cyprinid fish larvae in Lake Biwa, Japan // Limnology. 2006. Vol. 7. P. 75–82. DOI: 10.1007/s10201-006-0172-2.
Zhang Y., Liu X., Qin B., Shi K., Deng J., Zhou Y. Aquatic vegetation in response to increased eutrophication and degraded light climate in eastern Lake Taihu implications for lake ecological restoration // Scientific Reports. 2016. Vol. 6 (1). DOI: 10.1038/srep23867.
Zhao F., Fang X., Zhao Z., Chai X. Effects of Water Level Fluctuations on the Growth Characteristics and Community Succession of Submerged Macrophytes: A Case Study of Yilong Lake, China // Water. 2021. Vol. 13, № 20: 2900. DOI: 10.3390/w13202900.
Zonary T., Ostovsky I. Ecological impacts of excessive water level fluctuations in stratified freshwater lakes // Inland Waters. 2011. Vol. 1, № 1. P. 47–59. DOI: 10.5268/IW-1.1.406.
Благодарности
Работа выполнена в рамках государственного задания по теме № FUFR-2021-0006.






 © 2011 - 2025
© 2011 - 2025