Введение
В естественных условиях обитания на популяции животных одновременно действует комплекс факторов, которые вызывают разные биологические эффекты. Обнаружение четких закономерностей формирования таких эффектов – весьма сложная задача не только в связи с многообразием действующих в природе факторов, но и из-за возможных модифицирующих влияний раздражителей друг на друга, в результате которых изменяется зависимость «доза – эффект» для животных, населяющих техногенно загрязненные территории. На степень проявления радиационных воздействий могут влиять и такие экологические факторы, как популяционные циклы животных (Раскоша, Ермакова, 2013). В этой связи представляется необходимым помимо исследований, проводимых на животных из природных популяций, важность которых очевидна, выявить закономерности формирования ответной реакции органов и тканей при одновременном многокомпонентном действии факторов в контролируемых условиях эксперимента на линейных мышах (генетическая однородность, отсутствие скрытых возбудителей инфекционных и паразитарных заболеваний), содержащихся в стандартизированных условиях вивария, с возможностью точной дозировки и времени экспозиции загрязнителей.
В осуществлении адаптации животных к постоянно изменяющимся условиям окружающей среды одно из приоритетных мест принадлежит щитовидной железе, гормоны которой влияют практически на все органы и ткани организма. Тиреоидная ткань, являясь чрезвычайно лабильной, отвечает на антропогенную трансформацию среды изменением структурно-функциональных характеристик составляющих ее компонентов. Обнаружена чувствительность щитовидной железы мелких млекопитающих к радиационному воздействию (Надольник и др., 2004; Fujimoto et al., 2020). Исследования, проведенные нами на полевках-экономках из природных популяций, показали, что обитание животных в течение многих поколений в условиях повышенного уровня естественной радиоактивности вызывает существенные отклонения от контроля в морфологическом (Раскоша и др., 2015) и цитогенетическом (Раскоша, 2018; Raskosha et al., 2022) состоянии щитовидной железы. Растет частота заболеваний этого органа среди ликвидаторов радиационных аварий и населения, проживающего на техногенно загрязненных территориях (Drozdovitch, 2021). При радиационных воздействиях сопутствующим химическим фактором могут быть нитраты, которые в результате интенсивного использования азотистых удобрений в сельском хозяйстве и промышленности накапливаются в растениях, почве и грунтовых водах и впоследствии способны оказывать пагубное воздействие на млекопитающих (ATSDR, 2001; Pearce, Braverman, 2017). Способность токсикантов перемещаться на значительные расстояния от источника загрязнения и непредсказуемость их совместного действия требуют более детального исследования формирования эффектов в организме млекопитающих, поэтому необходимо продолжить исследования в этом направлении с применением морфологических и морфометрических методов исследования, которые обладают широкой информативностью и позволяют выявлять одновременно как деструктивные, так и компенсаторно-приспособительные перестройки в органах и тканях животных.
В работе мы хотели проверить гипотезу о высокой чувствительности щитовидной железы животных к хроническому низкоинтенсивному γ-облучению и нитрату натрия в дозах и концентрациях, встречающихся в окружающей среде. Мы предполагаем, что раздельное действие факторов радиационной и химической природы не в полной мере отражает морфологическое состояние щитовидной железы, формирующееся после их совместного действия. Цель исследования – изучить особенности раздельного и совместного действия факторов радиационной и химической природы на щитовидную железу мышей и определить морфологические критерии тиреоидной ткани, по которым можно оценить характер таких воздействий у млекопитающих, обитающих на техногенно загрязненных территориях.
Материалы
В качестве объектов исследования использовали самцов мышей линии СВА (n = 38, возраст 3–4 месяца, масса тела – 21.4 ± 0.4 г.), полученных из УНУ «Научная коллекция экспериментальных животных» ФГБНУ ИБ ФИЦ Коми НЦ УрО РАН (http://www.ckp-rf.ru/usu/471933/). Работа проводилась в соответствии с Руководством по содержанию и использованию лабораторных животных (Руководство…, 2017) и требованиями директивы 2010/63/ЕU Европейского парламента о защите животных, используемых в научных целях (Directive 2010/63/EU, 2022).
Методы
Необходимым этапом выявления особенностей многофакторного действия было изучение каждого фактора в отдельности, а затем оценка их совместного действия. Мыши путем случайной выборки были разделены на контрольную и пять опытных групп по 5–8 особей в каждой: I группа – γ-облучение в дозе 1.6 сГр, II группа – нитрат натрия в концентрации 10 мг/л, III группа – нитрат натрия в концентрации 45 мг/л, IV группа – γ-облучение в дозе 1.6 сГр + нитрат натрия в концентрации 10 мг/л, V группа – γ-облучение в дозе 1.6 сГр + нитрат натрия в концентрации 45 мг/л.
Радиационная нагрузка на организм животных определялась мощностью экспозиционной дозы и сроком их содержания под воздействием ионизирующего излучения. Мышей облучали в течение 30 суток от двух источников 226Ra с активностью 0.474 * 106 и 0.451 * 106 кБк, разнесенных на расстояние 2.5 м. Геометрия расположения источников обеспечивала сравнительно однородное γ-облучение животных (неравномерность облучения не превышала 6 %). Мощность экспозиционной дозы γ-излучения составляла 2000–2500 мкР/ч. Данный уровень излучения имитировал условия внешнего γ-фона на участках с повышенной естественной радиоактивностью в Республике Коми. Суммарную поглощенную дозу (1.6 сГр) определяли термолюминесцентными дозиметрами с детекторами ДТГ-4 (LiF) с последующей регистрацией на термолюминесцентной установке ДВГ–02ТМ (НПП «Доза», Россия) в лаборатории миграции радионуклидов и радиохимии ИБ ФИЦ Коми НЦ УрО РАН. Водные растворы нитрата натрия мыши получали перорально в течение 30 суток в концентрациях 10 и 45 мг/л. Выбор концентраций базировался на уровне ПДК для питьевой воды – 45 мг/л в соответствие с СанПиН 1.2.3685-21. Накопленные дозы нитрата за месяц составили соответственно 0.1 и 0.3 г/кг массы тела (рассчитаны по NO3-). Следует отметить, что нитрат-ион не токсичен, но из-за действия анаэробных бактерий (в желудочно-кишечном тракте) от 5 до 20 % нитратов превращаются в нитриты, которые обладают выраженной токсичностью (Habermeyer et al., 2015). Контролем служили мыши такого же возраста и пола, содержавшиеся при нормальном радиационном фоне (8–10 мкР/ч) в аналогичных с опытными животными условиях вивария (температура – 20–22 °С, влажности воздуха 50 ± 5 %) со свободным доступом к воде и пище.
Декапитацию мышей одновременно опытных и контрольной групп осуществляли через 30 суток после окончания воздействий в утренние часы, чтобы избежать влияния суточных колебаний на исследуемые показатели. Щитовидные железы сразу после извлечения фиксировали в 10 % нейтральном забуференном формалине (рН 7.2–7.4) с максимальной стандартизацией сроков фиксации и условий дальнейшей обработки материала. Парафиновые срезы тиреоидной ткани толщиной 5–6 мкм готовили на ротационном микротоме Finesse 325 (Thermo Scientific, USA). Полученные гистологические препараты окрашивали реактивом Шиффа с докраской ядер гематоксилином Карачи и анализировали под микроскопом NU2 (Karl Zeis, Германия) при увеличении от ×250 до ×1250. При морфометрическом исследовании тиреоидной паренхимы использовали точечный метод определения относительных объемов тканевых компонентов органа. Для этого использовали окулярную планиметрическую сетку Автандилова (на одно животное подсчитывали не менее 1000 точек). На основании полученных показателей вычисляли индекс активности щитовидной железы (соотношение относительных объемов эпителия и коллоида), который напрямую отражает функциональную активность органа. C использованием окулярной линейки измеряли высоту фолликулярного эпителия, диаметры ядер, а также длинный (L) и короткий (В) поперечники фолликулов (от 50 до 100 замеров). Средний диаметр фолликулов вычисляли по формуле D = (L + B) / 2. По отношению среднего диаметра фолликула к высоте тиреоидного эпителия определяли индекс функции железы, который обратно пропорционален ее функциональной активности. Подсчитывали среднее число тироцитов в фолликуле и общее число фолликулов на поле зрения микроскопа (10 полей зрения на особь). Измерение морфологических параметров тиреоидной ткани осуществляли в соответствии с методическими рекомендациями (Быков, 1979; Автандилов, 1990; Хмельницкий, 2002). Гистологические препараты фотографировали на микроскопе БИОЛАМ-Л (Россия) с использованием цифровой камеры МС-12 (ООО «ЛОМО-МА») при увеличении окуляра ×12.5, объектива ×20, 40 и 100.
Полученные результаты анализировали общепринятыми методами вариационной статистики с использованием пакета программ: Microsoft Office Excel 2017 (Microsoft, США) и Statistica 6.0 (StatSoft, lnc, США). Нормальность распределения цифровых массивов проверяли, используя критерий Пирсона. Достоверность различий между контрольной и опытными группами определяли с использованием t-критерия Стьюдента. Для количественной характеристики результатов совместного действия факторов использовали коэффициент взаимодействия (Кw), который вычисляется как отношение инкремента ответной реакции системы на совместное действие факторов к сумме инкрементов эффектов при их раздельном действии (Geras'kin et al., 2005). Результат взаимодействия факторов оценивали как аддитивный, если Кw = 1, эффект классифицировали как антагонистический или синергический соответственно при Кw ≤ 1 или Кw ≥ 1.
Результаты
Раздельное действие факторов. Анализ гистологических препаратов щитовидной железы у животных, подвергнутых хроническому γ-облучению (I группа), показал статистически значимое изменение большинства изучаемых морфометрических параметров тиреоидной ткани по сравнению с контрольной группой, в целом свидетельствующее об активации гормонопоэза (табл. 1). Так, высота фолликулярного эпителия была выше контроля (р ≤ 0.001), тироциты как в мелких, так и в крупных фолликулах выглядели гипертрофированными и имели кубическую или цилиндрическую форму (рис. 1А). У этой опытной группы животных отмечено увеличение числа клеток в среднем на один фолликул (р ≤ 0.05), а также изменение в процентном соотношении эпителия и коллоида и возрастание объемной доли экстрафолликулярного эпителия по сравнению с контрольными значениями (рис. 2). Индекс активности и индекс функции щитовидной железы подтверждали повышение функциональной активности исследуемой ткани у облученных животных (рис. 3). Об активности гормонообразовательных процессов в тиреоидной ткани мышей в ответ на радиационное воздействие свидетельствовали также резорбционные вакуоли в коллоиде некоторых фолликулов. Размер ядер тироцитов варьировал в широких пределах, число фолликулов на одно поле зрения соответствовало контролю. Кроме того, в щитовидной железе облученных животных иногда наблюдали расширение кровеносных сосудов, в некоторых случаях со стазом эритроцитов (рис. 1B).
Таблица 1. Mорфометрические изменения в щитовидной железе животных после действие γ-облучения и нитрата натрия
| Исследуемые параметры | Контроль | I группа | II группа | III группа | IV группа | V группа |
| Высота фолликулярного эпителия, мкм | 5.6 ± 0.2 | 9.9 ± 0.3*** | 8.9 ± 0.4*** | 8.2 ± 0.3** | 9.5 ± 0.2*** | 9.0 ± 0.2*** |
| Диаметр ядер, мкм | 4.4 ± 0.2 | 5.3 ± 0.5 | 5.4 ± 0.1*** | 4.9 ± 0.1* | 5.6 ± 0.1*** | 5.6 ± 0.1*** |
| Диаметр фолликулов, мкм | 63.6 ± 2.8 | 72.1 ± 1.6* | 67.6 ± 2.9 | 63.4 ± 2.1 | 57.4 ± 1.6* | 68.9 ± 1.4 |
| Число тироцитов в фолликуле | 16.3 ± 1.1 | 20.6 ± 0.7* | 19.6 ± 0.7* | 13.8 ± 1.0 | 15.7 ± 0.6 | 19.0 ± 0.6 |
| Число фолликулов, на поле зрения | 108.0 ± 12.5 | 95.2 ± 2.1 | 80.6 ± 1.8* | 77.7 ± 2.8* | 98.3 ± 9.7 | 71.2 ± 1.9* |
Примечание. Здесь и далее – статистически значимые отличия от контроля при *р ≤ 0.05, **р ≤ 0.01 и ***р ≤ 0.001.
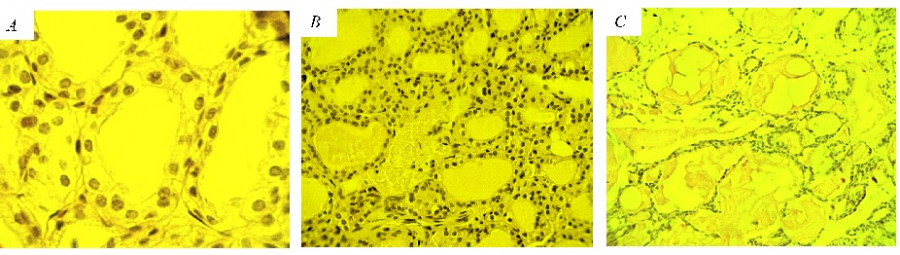
Рис. 1. Микрофотографии гистологических срезов щитовидной железы животных: А – гипертрофия клеток фолликулярного эпителия у мыши I группы (увеличение – 1250 раз); B – расширенные кровеносные сосуды у мыши I группы (увеличение – 500 раз); С – крупные фолликулы с атрофичной эпителиальной выстилкой, заполненные плотным темноокрашенным коллоидом у мыши III группы (увеличение – 250 раз). Препараты окрашены реактивом Шиффа с докраской ядер гематоксилином
Fig. 1. Micrographs of histological sections of the thyroid gland of animals: А – hypertrophy of follicular epithelial cells in mice from group I (magnification by 1250 times); B – wide blood vessels in mice from group I (magnification by 500 times); С – dilated follicles with atrophic epithelial lining filled with dense dark-colored colloid in mice from group III (magnification by 250 times). The preparations were stained with Schiff's reagent with additional staining of the nuclei with hematoxylin
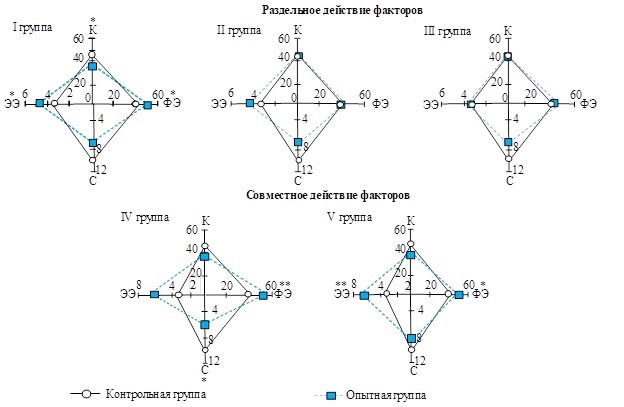 Рис. 2. Соотношение структурных компонентов (%) в щитовидной железе животных после раздельного и совместного действия факторов. Условные обозначения: К – коллоид, ФЭ – фолликулярный эпителий, С – строма и сосуды, ЭЭ – экстрафолликулярный эпителий
Рис. 2. Соотношение структурных компонентов (%) в щитовидной железе животных после раздельного и совместного действия факторов. Условные обозначения: К – коллоид, ФЭ – фолликулярный эпителий, С – строма и сосуды, ЭЭ – экстрафолликулярный эпителий
Fig. 2. Ratio of structural components (%) in the thyroid gland in animals after separate and combined action of factors. Legend: К – colloid, ФЭ – follicular epithelium, C – stroma and vessels, ЭЭ – extrafollicular epithelium
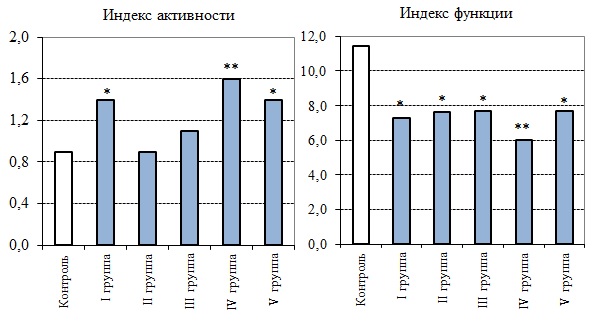
Рис. 3. Индексы щитовидной железы (усл. ед.; по оси ординат) у животных после раздельного и совместного действия факторов
Fig. 3. Indices of the thyroid gland (conditional units; along the y-axis) in animals after separate and combined action of factors
После введения нитрата натрия в щитовидной железе мышей (II и III группы) статистически значимо по сравнению с контролем увеличивалась высота фолликулярного эпителия и диаметр ядер тироцитов (р ≤ 0.001). О повышении функциональной активности тиреоидной ткани у животных этих опытных групп свидетельствовал индекс функции (рис. 3), а также выраженная тенденция к снижению процентного вклада стромы и сосудов в общую площадь паренхимы (см. рис. 2). Наряду с этим объемные плотности структурных компонентов исследуемой ткани и значения индекса активности не выходили за пределы нормы. Несмотря на то что средний диаметр фолликулов был в пределах контрольных значений, на гистологических срезах щитовидной железы в обеих опытных группах были обнаружены крупные фолликулы с атрофичной эпителиальной выстилкой, заполненные плотным темноокрашенным коллоидом (рис. 1C). Это повлияло на общее число фолликулов (на поле зрения), которое статистически значимо уменьшалось по сравнению с контролем (р ≤ 0.05). Вклад экстрафолликулярного эпителия в общую площадь паренхимы у животных этих опытных групп, в отличие от облученных мышей, сохранялся в пределах нормы.
Совместное действие факторов. У животных, подвергнутых одновременно действию ионизирующего излучения и нитрата натрия (IV и V группы), перераспределение структурных компонентов тиреоидной паренхимы выражалось в статистически значимом повышении доли фолликулярного и экстрафолликулярного эпителиев, в снижении объемной плотности коллоида (см. рис. 2), а также в увеличении высоты тироцитов и диаметра их ядер по сравнению с контрольной группой (см. табл. 1). Значения обоих индексов свидетельствовали о напряжении функции щитовидной железы у животных этих опытных групп, более выраженное в IV группе (см. рис. 3). Кроме того, в последнем случае отмечали статистически значимое по сравнению с контролем понижение объемной плотности сосудов и стромальных элементов, а также среднего диаметра фолликулов (р ≤ 0.05). У животных V группы на гистологических срезах исследуемой ткани выявлено, наоборот, разрастание фолликулов, что способствовало уменьшению по сравнению с контролем числа фолликулов на поле зрения. Наряду с этим в щитовидной железе мышей обеих опытных групп наблюдали дистрофические изменения, полиморфизм в размерах и форме ядер и тироцитов, а также застой крови в сосудах. Результаты расчетов Кw показали, что после хронического совместного действия ионизирующего излучения и нитрата натрия были отмечены нелинейные эффекты взаимодействия факторов на морфологические показатели щитовидной железы как антагонистической, так и синергической направленности (табл. 2).
Таблица 2. Значения Кw морфометрических параметров щитовидной железы животных после совместного действия факторов
| Группа | Объемная плотность, % | Высота ФЭ, мкм | Диаметр, мкм | Число | |||||
| Коллоид | Фолликулярный эпителий | Строма и сосуды | Экстрафол- ликулярный эпителий | Ядро | Фолликул | Тироциты в фолликуле | Фолликулы на поле зрения | ||
| IV группа | 1.57** | 1.25 | 1.05 | 0.97 | 0.51 | 0.63 | -0.50** | -0.08 | 0.24 |
| V группа | 0.74*** | 0.69 | 0.19* | 2.15* | 0.49 | 0.86 | -0.60 | 1.5 | 2.3** |
Обсуждение
При изучении «здоровья» популяций остро стоит проблема выбора наиболее информативных характеристик организма, способных представить объективную информацию о структурно-функциональных процессах адаптации, дезадаптации и реабилитации органов и тканей животных. Оценка состояния гомеостаза организма выступает как система раннего контроля качества окружающей природной среды, позволяющая выявить даже незначительные изменения в функционировании живых существ (Захаров и др., 1996). Щитовидная железа принимает активное участие в поддержании гомеостаза и играет ведущую роль в неспецифических реакциях защиты организма, являясь подходящим тест-органом для биоиндикации, при этом использование морфометрических методов позволяет в количественном выражении определить характер структурных преобразований и степень морфофункциональной активности ткани (Хмельницкий, 2002). Результаты проведенного исследования показали чувствительность щитовидной железы мышей как к раздельному, так и совместному действию ионизирующей радиации и нитрата натрия в дозах и концентрациях, реально встречающихся в окружающей среде, что позволяет предложить показатели ее морфофункционального состояния для использования в качестве критерия оценки радиационно-химических воздействий для животных из природных популяций.
Существующие на сегодняшний день подходы к нормированию техногенной нагрузки на биологические объекты основаны на эффектах собственно ионизирующего излучения без учета возможной модификации радиобиологического эффекта при одновременном воздействии нерадиационных факторов (Petin et al., 2009; Проскурякова и др., 2021). Полученные данные подтвердили наше предположение о том, что раздельное действие факторов в полной мере не отражает эффекты, возникающие в результате их взаимодействий. Тем не менее некоторые особенности ответной реакции тиреоидной ткани после совместного воздействия факторов проявлялись и в случае их раздельного действия. Это касается увеличения фолликулярного эпителия, который традиционно считается достоверным критерием функциональной активности щитовидной железы (Автандилов, 1990; Хмельницкий, 2002; Калашникова, Полякова, 2018) и обладает высокой радиочувствительностью (Раскоша и др., 2015), а также объемной доли клеток экстрафолликулярного эпителия. Клетки этого типа являются одним из источников восстановления тиреоидной паренхимы путем формирования «дочерних» фолликулов (Lee et al., 2018). Направленность пролиферативных процессов во многом обусловливает способность щитовидной железы к развитию компенсаторных процессов и восстановлению ее функциональной активности, однако активная пролиферация тироцитов может приводить в дальнейшем к тканевой перестройке этого органа с формированием узловых образований и разбалансировкой гормонопоэза (Хмельницкий, 2002; Калашникова, Полякова, 2018).
В последнее время повышенный интерес вызывает изучение биологического действия нитратов, особенно в отношении органов эндокринной системы (Eskiocak et al., 2005; Chan et al., 2011; Pearce, Braverman, 2017; Rios-Sanchez et al., 2021). Всемирная организация здравоохранения определила безопасный верхний предел содержания нитратов в питьевой воде как 50 мг/л (WHO Guidelines…, 2017), в России ПДК нитратов не должна превышать 45 мг/л (СанПиН 1.2.3685-21). Эти пороговые значения были приняты в первую очередь для защиты от метгемоглобинемии детей, находящихся на искусственном вскармливании, а не из-за опасений по поводу состояния щитовидной железы (Chan et al., 2011; Pearce, Braverman, 2017). Однако в литературе имеются убедительные доказательства того, что избыточное потребление нитратов вызывает нарушения в работе щитовидной железы (Eskiocak et al., 2005; Rios-Sanchez et al., 2021). Установлено торможение развития животных после хронической нитратной интоксикации, авторы связывают это именно с измененным состоянием этого органа (Ogur et al., 2000). При пероральном поступлении в организм нитраты превращаются в нитриты, которые реагируют с гемоглобином, образуя метгемоглобин, что приводит к гипоксии различных органов и тканей (Eskiocak et al., 2005; Habermeyer et al., 2015; Lee et al., 2017). Результаты, полученные нами, показали, что после употребления мышами нитрата натрия в концентрациях, не превышающих установленные нормы, морфологические изменения щитовидной железы были наименее выражены по сравнению с радиационным воздействием или совместным действием факторов. Особенность действия нитрата натрия проявлялась в том, что на фоне некоторого повышения функциональной активности тиреоидной ткани отмечали крупные фолликулярные аденомеры, которые мы не наблюдали после γ-облучения мышей, но они были обнаружены в одном из вариантов совместного действия факторов. В таких фолликулах вследствие уплотнения коллоида и нарушения его резорбции гормоны не выводятся в кровь, а заполняют его просвет, поэтому, несмотря на избыточное содержание коллоида, в функциональном отношении эти фолликулы неактивны (Хмельницкий, 2002). Появление разрастающихся фолликулов можно связать с тем, что нитраты способны снижать выработку тиреоидных гормонов путем конкурентного ингибирования поглощения йодида (Eskiocak et al., 2005; Pearce, Braverman, 2017).
По данным литературы, открытие радикального характера взаимодействия нитратов с оксигемоглобином, канцерогенный эффект данного химического вещества (Chan, 2011; Bouaziz-Ketata, 2015; Habermeyer et al., 2015; Karwowska, Kononiuk, 2020), а также аддитивное и синергическое действие с ионизирующим излучением позволяют трактовать сочетание этих двух факторов как потенциально опасное для живых организмов (Malenchenko et al., 1984). Наши результаты показали, что вклад совместного действия факторов был наиболее существенным по сравнению с их раздельным действием и в целом приводил к напряжению морфофункционального состояния исследуемого органа с проявлением как деструктивных, так и компенсаторно-приспособительных перестроек. На разных биологических объектах была установлена закономерность: чем меньше интенсивность одного из используемых в комбинации агентов, тем меньше должна быть интенсивность другого фактора для их максимального синергического взаимодействия. Синергизм при взаимодействии факторов может быть обусловлен формированием дополнительных эффективных повреждений в результате взаимодействия субповреждений, неэффективных при раздельном применении агентов (Petin et al., 2009). После совместного действия низкоинтенсивного гамма-облучения и нитрата натрия в концентрации, не превышающей ПДК, в щитовидной железе животных также проявлялись нелинейные эффекты взаимодействий, в т. ч. и синергического характера. Это было отмечено для таких морфометрических параметров, как объемные плотности фолликулярного и экстрафолликулярного эпителиев, коллоида, числа тироцитов в фолликуле и фолликулов на поле зрения, что необходимо учитывать при принятии решения о допустимых нагрузках на организм млекопитающих. В условиях радиационной нагрузки действие нитратов и нитритов на организм может усиливаться, исследователи объясняют это тем, что введение облученным животным нитрита натрия вызывает увеличение образования метгемоглобина в крови по сравнению с необлученными особями (Lee et al., 2017). Наряду с этим есть данные о том, что одним из механизмов токсичности нитратов, который характерен и для ионизирующей радиации, является их способность индуцировать окислительный стресс путем генерации свободных радикалов (Bouaziz-Ketata et al., 2015). Нарушение обмена нитратов в организме облученных животных происходит в т. ч. и за счет повышения скорости его поступления во внутрисосудистое пространство.
Заключение
Результаты проведенного исследования подтвердили гипотезу о высокой чувствительности щитовидной железы мышей к хроническому низкоинтенсивному ионизирующему излучению и нитрату натрия в дозах и концентрациях, встречающихся в окружающей среде, что позволяет предложить показатели морфофункционального состояния тиреоидной паренхимы для оценки биологического действия факторов радиационной и химической природы у млекопитающих, обитающих на техногенно загрязненных территориях. Обнаружено, что данные, полученные после раздельного действия факторов, в полной мере не отражали ответную реакцию щитовидной железы, формирующуюся после их совместного действия, в результате которого проявлялись нелинейные эффекты, в т. ч. и синергического характера. Полученные результаты могут быть полезными для развития системы оценки экологического риска в результате многофакторных антропогенных воздействий и при нормировании техногенной нагрузки на наземные экосистемы.
Библиография
Автандилов Г. Г. Медицинская морфометрия . М.: Медицина, 1990. 382 с.
Быков В. Л. Стереологический анализ щитовидной железы (обзор методов) // Архив анатомии, гистологии и эмбриологии. 1979. № 7. С. 124–132.
Захаров В. М., Крысанов Е. Ю., Пронин A. B. Методология оценки здоровья среды // Последствия Чернобыльской катастрофы: Здоровье среды. М., 1996. С. 22–32.
Калашникова С. А., Полякова Л. В. Особенности развития приспособительных и компенсаторных процессов в щитовидной железе на фоне экспериментального гепатофиброза // Журнал анатомии и гистопатологии. 2018. Т. 7, № 1. С. 40–46. DOI: 10.18499/2225-7357-2018-7-1-40-46.
Надольник Л. И., Нецецкая З. В., Кардаш Н. А. и др. Функционально-морфологическая характеристика щитовидной железы крыс в отдаленные сроки после однократного воздействия радиационного излучения в больших и малых дозах // Радиационная биология. Радиоэкология. 2004. Т. 44, № 5. С. 353–343.
Проскурякова Н. Л., Симаков А. В., Алферова Т. М. К вопросу сочетанного действия ионизирующей радиации и вредных факторов на организм человека // Медико-биологические проблемы жизнедеятельности. 2021. № 2 (26). С. 70–76.
Раскоша О. В. Оценка устойчивости клеток щитовидной железы полевок-экономок, обитающих в разных радиоэкологических условиях после дополнительных воздействий, методом ДНК-комет // Известия Уфимского научного центра РАН. 2018. № 3-5. С. 5–11. DOI: 10.31040/2222-8349-2018-5-3-5-11.
Раскоша О. В., Ермакова О. В. Морфологическое состояние щитовидной железы полевок-экономок, обитающих в условиях повышенного уровня естественной радиоактивности // Теоретическая и прикладная экология. 2013. № 2. С. 55–61.
Раскоша О. В., Ермакова О. В., Павлов А. В., Кораблева Т. В. Морфометрические и цитогенетические исследования фолликулярного эпителия щитовидной железы мелких млекопитающих при хроническом облучении в малых дозах // Радиационная биология. Радиоэкология. 2015. Т. 55, № 1. С. 63–70. DOI: 10.7868/S0869803115010130.
Руководство по содержанию и использованию лабораторных животных / Под ред. И. В. Белозерцевой. 8-е изд. М.: ИРБИС, 2017. 336 с.
СанПиН. 1.2.3685-21 Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания. Раздел III «Нормативы качества и безопасности воды» . URL: https://www.garant.ru/hotlaw/federal/1444090/ (дата обращения: 12.05.2022).
Хмельницкий О. К. Цитологическая и гистологическая диагностика заболеваний щитовидной железы: Руководство. . СПб.: Сотис, 2002. 288 с.
ATSDR (Agency for Toxic Substances and Disease Registry). Case Studies in Environmental Medicine: Nitrate / Nitrite Toxicity. Atlanta, GA: US Department of Health and Human Services, 2001. 22 p.
Bouaziz-Ketata H., Salah G. B., Mahjoubi A., Aidi Z., Kallel C., Kammoun H. et al. Hyparrhenia hirta: A potential protective agent against hematotoxicity and genotoxicity of sodium nitrate in adult rats // Environ Toxicology. 2015. Vol. 30, № 11. Р. 1275–1284. DOI: 10.1002/tox.21998.
Chan T. Y. Vegetable-borne nitrate and nitrite and the risk of methaemoglobinaemia // Toxicol Letters. 2011. Vol. 200 (1–2). Р. 107–108. DOI: 10.1016/j.toxlet.2010.11.002.
Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. URL: http://data.europa.eu/eli/dir/2010/63/oj (дата обращения: 12.05.2022).
Drozdovitch V. Radiation exposure to the thyroid after the Chernobyl accident // Frontiers in endocrinology. 2021. 11:569041. DOI: 10.3389/fendo.2020.569041.
Eskiocak S., Dundar C., Basoglu T., Altaner S. The effects of taking chronic nitrate by drinking water on thyroid functions and morphology // Journal of Clinical and Experimental Medicine. 2005. № 5. P. 66–71. DOI: 10.1007/s10238-005-0068-1.
Fujimoto N., Matsuu-Matsuyama M., Nakashima M. Morphological and functional changes in neonatally X-irradiated thyroid gland in rats // Endocrine Journal. 2020. Vol. 67, № 2. Р. 231–240. DOI: 10.1507/endocrj.EJ19-0245.
Geras' kin S. A., Kim J. K., Dikarev V. G., Udalova A. A., Dikareva N. S., SpirinY. V. Cytogenetic effects of combined radioactive (137Cs) and chemical (Cd, Pb, and 2,4-D herbicide) contamination on spring barley intercalar meristem cells // Mutation Research. 2005. Vol. 586, № 2. Р. 147–159. DOI: 10.1016/j.mrgentox.2005.06.004.
Habermeyer M., Roth A., Guth S., Diel P., Engel K. H., Epe B. et al. Nitrate and nitrite in the diet: how to assess their benefit and risk for human health // Molecular Nutrition & Food Research. 2015. Vol. 59, № 1. Р. 106–128. DOI: 10.1002/mnfr.201400286.
Karwowska M., Kononiuk A. Nitrates / Nitrites in Food-Risk for Nitrosative Stress and Benefits // Antioxidants (Basel). 2020. Vol. 9, № 3. Р. 241. DOI: 10.3390/antiox9030241.
Lee J., Yi S., Chang J. Y., Kang Y. E., Kim H. J., Park K. C. et al. Regeneration of thyroid follicles from primordial cells in a murine thyroidectomized model // Laboratory Investigation. 2017. Vol. 97, № 4. Р. 478–489. DOI: 10.1038/labinvest.2016.158.
Malenchenko A. F., Kuchuk V. S., Asafova L. P. Dynamics of nitrite-induced methemoglobin formation after total gamma-ray irradiation of rats // Bulletin of Experimental Biology and Medicine. 1984. Vol. 98. Р. 1498–1500. DOI: 10.1007/BF00800013.
Ogur R., Korkmaz A., Hasde M. Effects of high nitrate intake in rats // Journal of Basic and Clinical Physiology and Pharmacology. 2000. Vol. 11, № 1. Р. 47–56. DOI: 10.1515/JBCPP.2000.11.1.47.
Pearce E. N., Braverman L. E. Environmental iodine uptake inhibitors // Iodine deficiency disorders and their elimination / Eds. E. Pearce. Springer, Cham. Switzerland, 2017. Р. 141–154. DOI: 10.1007/978-3-319-49505-7.
Petin V. G., Kim J. K., Zhurakovskaya G. P., Kim S. H. Some peculiarities of the sequential action of heat and ionizing radiation on yeast cells // International Journal of Hyperthermia. 2009. Vol. 25, № 1. Р. 72–78. DOI: 10.1080/02656730802348008.
Raskosha O., Bashlykova L., Starobor N. Assessment of DNA damage in somatic and germ cells of animals living with increased radiation background and their offspring // International Journal of Radiation Biology. 2022. August. DOI: 10.1080/09553002.2022.2110327.
Rios-Sanchez E., Gonzalez-Zamora A., Bonaparte M. E. G., Mata E. M., Gonzalez-Delgado M. F., Amaro A. Z. et al. Regulation of the Tpo, Tg, Duox2, Pds, and Mct8 genes involved in the synthesis of thyroid hormones after subchronic exposure to sodium nitrate in female Wistar rats // Environmental Toxicology and Chemistry. 2021. Vol. 36, № 12. Р. 2380–2391. DOI: 10.1002/tox.23351.
WHO Guidelines for drinking-water quality. WHO Nitrate and nitrite. 4th ed.: Incorporating 1st addendum. Geneva: WHO, 2017. 398–403 р.
Благодарности
Исследования выполнены в рамках ГЗ по теме «Действие ионизирующего излучения и факторов нерадиационной природы на биологические объекты и биогенная миграция тяжелых естественных радионуклидов» ИБ ФИЦ Коми НЦ УрО РАН (№ 122040600024-5).






 © 2011 - 2026
© 2011 - 2026