Введение
Полициклические ароматические углеводороды (ПАУ) относятся к высоко опасным для человека поллютантам (Ifegwu, Anyakora, 2015). Они образуются при сжигании и переработке нефтепродуктов, угля, древесины, бытовых отходов и др. Чаще всего показателем присутствия ПАУ в окружающей среде служит бенз[a]пирен (БП). Он является канцерогеном, мутагеном, токсикантом 1-го класса опасности. Предельно допустимая концентрация (ПДК) БП в почве составляет 20 нг/г (СанПин 1.2.3685-21), для растений ПДК БП и других ПАУ не установлены.
Растения способны поглощать, аккумулировать, синтезировать и участвовать в деградации ПАУ (Яковлева, Габов, 2019). При действии поллютантов у растений возникает неспецифическая ответная реакция ‒ окислительный стресс. Перекисное окисление липидов (ПОЛ) ‒ цепной процесс свободнорадикального окисления, в ходе которого изменяется структура биомолекул, происходит инактивация ферментов, образуются дефекты в липидном слое мембран. В результате ПОЛ образуется малоновый диальдегид (МДА).
Ранее (Абдухалилов, Скугорева, 2019) нами было показано, что БП в дозе 10 ПДК приводил к усилению процессов ПОЛ и снижению накопления фотосинтетических пигментов у 15-суточных растений ячменя при выращивании на гидропонике. В работе (Яковлева и др., 2015) выявлено, что загрязнение песчаного субстрата 0.5–2 ПДК БП приводило к уменьшению всхожести семян до 80 %, снижению высоты и биомассы 30-суточных растений ячменя до 3.6 раза. При внесении в почву 2 ПДК БП наблюдали ростстимулирующий эффект: усиление накопления биомассы проростками, увеличение длины корня, снижение интенсивности ПОЛ в побегах проростков полевого гороха (Скугорева и др., 2021а). В ризосфере растений отмечается высокая активность микроорганизмов, способных использовать ПАУ в качестве единственного источника углерода и энергии (Gałązka, Grządziel, 2016). Известно, что в результате загрязнения ПАУ значительно изменяется структура почвенных бактериальных сообществ (Ажогина и др., 2020). Повышенное содержание ПАУ в городских почвах, особенно вблизи автодорог, может приводить к изменению в структуре микробных комплексов (Скугорева и др., 2021б). В модельном опыте внесение 1 и 2 ПДК БП приводило к снижению численности почвенных микроорганизмов (Скугорева и др., 2021а).
Целью работы было оценить токсичность почвы, загрязненной бенз[a]пиреном, по влиянию на проростки кресс-салата, почвенную микробиоту, простейших Paramecium caudatum и бактериальную тест-систему «Эколюм».
Материалы
Модельный эксперимент выполняли с использованием почвы, отобранной с агроучастка на территории Кирово-Чепецкого района Кировской области, на которой преобладают дерново-подзолистые почвы. Отбор почвы проводили из верхнего слоя (0–15 см). Почва имела нейтральную (рНН2О 6.5 ± 0.1) или близкую к нейтральной реакцию (рНKCl 5.6 ± 0.1). Содержание органического вещества составило 1.20 ± 0.20 %, что характеризует почву как малогумусную. Обеспеченность почвы нитратным азотом для растений низкая (2.60 ± 0.30 мг NO3–/кг); фосфором (72.6 ± 3.5 мг P2O5/кг) и калием (81 ± 12 мг К2О/кг) – средняя. Концентрация БП в почве была ниже предела обнаружения метода высокоэффективной жидкостной хроматографии (МУК 4.1.1274-03..., 2003).
Методы
Предварительно почву подсушивали до воздушно-сухого состояния, измельчали и просеивали через сито с размером ячейки 1 мм. В чашки Петри насыпали почву массой 40.0 г. Бенз[a]пирен вносили в дозах 0.2 и 0.4 мкг/г почвы, что соответствовало 10 и 20 ПДК БП, в виде водного раствора, приготовленного из ГСО БП (7515-98 МСО 0184:2000). Контрольный вариант – без внесения БП. Повторность в опыте трехкратная. После внесения в почву БП проводили посев семян кресс-салата по 30 шт. на чашку Петри. Затем чашки помещали в климатическую камеру, где осуществляли контроль фотопериода: день (12 ч) / ночь (12 ч). Температура на протяжении всего опыта составляла 20 ± 2 °С. Полив растений осуществляли регулярно дистиллированной водой из расчета 60 % от полной влагоемкости почвы. Эксперимент длился 10 суток.
На 8-е сутки от момента посадки определяли всхожесть семян (ГОСТ 12038-84). После окончания опыта (на 11-е сутки) растения извлекали из почвы, измеряли высоту побега и длину корня, а также их сырую биомассу. Содержание МДА определяли в побегах проростков в трехкратной повторности. Накопление МДА – спектрофотометрическим методом (λ = 532 нм) по окраске вытяжки из свежих растительных тканей после 30 мин кипячения на водяной бане с 0.5 % раствором тиобарбитуровой кислоты в 20 % трихлоруксусной кислоте (Лукаткин, Голованова, 1988).
Численность микроорганизмов в почве высчитывали методом предельных разведений на селективных питательных средах в трехкратной повторности: аммонификаторы (ГРМ-агар), азотфиксаторы (среда Эшби) и грибы (среда Чапека).
Острую токсичность проб почв определяли с использованием бактериальной тест-системы «Эколюм» и простейших Paramecium caudatum. Первый метод основан на измерении интенсивности биолюминесценции препарата лиофилизированных бактерий Escherichia coli. Подготовку и тестирование проб почвы проводили в соответствии с методикой ПНД Ф Т 14.1:2:3:4.11-04, Т 16.1:2.3:3.8-04. Методика предполагает три пороговых уровня индекса токсичности (Т): 1) допустимая степень токсичности образца при Т < 20; 2) образец токсичен при 20 ≤ Т < 50; 3) образец сильно токсичен при Т ≥ 50. Второй метод основан на хемотаксической реакции инфузорий P. caudatum. Согласно ФР.1.39.2015.19243, количественная оценка токсичности выражается в виде индекса токсичности (Т), по величине которого анализируемые пробы делятся на три группы: I) допустимая степень токсичности (0.00 < Т ≤ 0.40); II) умеренная степень токсичности (0.41 < Т ≤ 0.70); III) высокая степень токсичности (Т > 0.71).
В таблицах приведены средние арифметические значения и ошибки средних. Достоверность расхождений средних арифметических значений с контролем устанавливали при помощи t-критерия Стьюдента.
Результаты
В ходе исследования установлено, что в присутствии БП в почве в дозах 10 и 20 ПДК всхожесть семян кресс-салата составила 94.4 и 93.3 %, что практически не отличалось от значения в контроле (94.4 %). Внесение БП в почву не оказывало влияния на ростовые параметры проростков кресс-салата: длину корня и высоту побега (рис. 1).

Рис. 1. Ростовые параметры проростков кресс-салата при внесении в почву различных доз бенз[a]пирена
Fig. 1. Growth parameters of garden cress seedlings when various doses of benz[a]pyrene are introduced into the soil
Кроме линейных параметров, у растений измеряли биомассу (рис. 2). Выявлено, что в варианте опыта с дозой 20 ПДК БП происходило достоверное снижение накопления сырой биомассы корнями. Значение сырой биомассы корней в данном варианте составило 10.0 ± 0.8 мг на одно растение, что в 1.47 раза ниже значения для растений в контроле (14.7 ± 0.7 мг / растение).
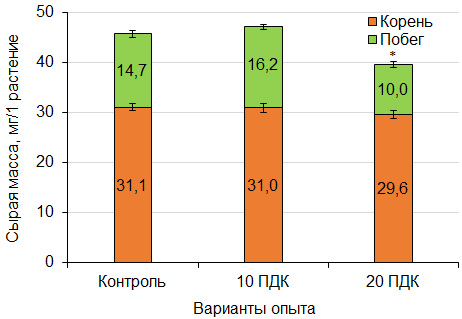
Рис. 2. Биомасса проростков кресс-салата при внесении в почву различных доз бенз[a]пирена. * – различия с контролем достоверны при р < 0.05
Fig. 2. Biomass of garden cress seedlings after application of various doses of benz[a]pyrene to the soil. * – differences with the controls are significant at p < 0.05
Наиболее чувствительным параметром к действию БП оказалось накопление МДА растениями кресс-салата. Внесение в почву данного ПАУ в дозах 10 и 20 ПДК приводило к увеличению содержания МДА в побегах растений в 1.69 и 1.60 раза по сравнению с контролем соответственно (рис. 3).
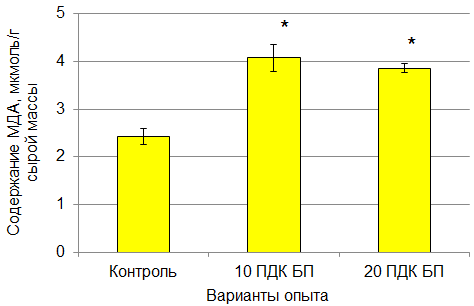
Рис. 3. Накопление МДА в побегах растений кресс-салата при внесении в почву различных доз бенз[a]пирена. * – различия с контролем достоверны при р < 0.01
Fig. 3. Accumulation of MDA in shoots of garden cress plants when various doses of benz[a]pyrene are introduced into the soil. * – differences with the controls are significant at p < 0.01
Результаты количественного учета микроорганизмов в почве приведены в табл. 1. Выявлено угнетающее действие БП на численность гнилостных бактерий (аммонификаторов): в 1.92 раза по сравнению с контролем при 10 ПДК и в 5.33 раза при 20 ПДК.
Таблица 1. Влияние бенз[а]пирена на численность почвенной микробиоты (·103 КОЕ / г сухой почвы)
| Вариант | Аммонификаторы | Азотфиксаторы | Грибы | Всего |
| Контроль | 160 ± 35 | 120 ± 13 | 4.3 ± 0.5 | 284 ± 48 |
| 10 ПДК БП | 83 ± 6 | 353 ± 17** | 19.5 ± 2.1** | 456 ± 24* |
| 20 ПДК БП | 30 ± 7* | 54 ± 8* | 4.7 ± 0.5 | 88 ± 16* |
Примечание. Различия с контролем достоверны при * р < 0.05, ** р < 0.01.
Для группы азотфиксаторов концентрация БП 10 ПДК оказала стимулирующее действие в 2.95 раза и угнетающее действие в 2.23 раза при концентрации 20 ПДК. Бенз[а]пирен в дозе 10 ПДК неожиданно приводил к активизации размножения микромицетов в 4.54 раза по сравнению с контролем, а при 20 ПДК угнетающее действие не проявилось.
Изучение структуры популяции (табл. 2) выявило доминирование аммонификаторов в контроле и азотфиксаторов – в вариантах с БП. Во всех вариантах минорным компонентом микробиоты являются грибы, чья доля в структуре популяции тем не менее увеличивается по мере возрастания концентрации БП с 1.6 (контроль) до 5.4 % (20 ПДК БП). Увеличение вклада аммонификаторов в структуру популяции микроорганизмов с 18.3 (10 ПДК) до 33.9 % (20 ПДК) связано не с возрастанием их численности, а с резким сокращением численности азотфиксаторов в этих вариантах.
Таблица 2. Структура популяции почвенной микробиоты, (%)
| Вариант | Аммонификаторы | Азотфиксаторы | Грибы |
| Контроль | 56.3 | 42.1 | 1.6 |
| 10 ПДК БП | 18.3 | 77.4 | 4.3 |
| 20 ПДК БП | 33.9 | 60.7 | 5.4 |
В табл. 3 представлены значения индексов токсичности (Т), определенные по реакции простейших P. caudatum и бактерий E. coli (тест-система «Эколюм») на почву без внесения и с внесением БП. Отмечено, что внесение БП в концентрации 10 ПДК не оказывает острого токсического действия на используемые биотесты. Значения Т для контрольного образца и образца 10 ПДК БП совпадают. Почва с содержанием 20 ПДК БП оказывает токсическое действие на тест-систему «Эколюм». Индекс токсичности, определенный по реакции P. caudatum, для варианта опыта при дозе 20 ПДК БП был в 1.8 раза выше, чем для контрольного варианта и 10 ПДК БП, но не превышал значений для допустимой степени токсичности (Т < 0.40).
Таблица 3. Результаты определения острой токсичности образцов почв, загрязненных бенз[а]пиреном, по реакции простейших Paramecium caudatum и бактериальной тест-системы «Эколюм»
| Вариант | Индекс токсичности (Т), степень токсичности | |
| Paramecium caudatum | Тест-система «Эколюм» | |
| Контроль | 0.19 ± 0.12, I группа, допустимая степень токсичности | 0, I группа, образец не токсичен |
| 10 ПДК БП | 0.19 ± 0.11, I группа, допустимая степень токсичности | 0, I группа, образец не токсичен |
| 20 ПДК БП | 0.34 ± 0.20, I группа, допустимая степень токсичности | 29 ± 9, II группа, образец токсичен |
Обсуждение
Рост является интегральным показателем состояния растений. При проведении модельного эксперимента установлено, что БП не оказывал влияния на всхожесть семян кресс-салата, что, вероятно, обусловлено низкой проницаемостью семенной кожуры для поллютанта. Кроме того, в период прорастания питание проростка происходит в большей степени благодаря семени, а не за счет питательных веществ почвы. Вероятно, по этой причине изменений ростовых параметров 10-суточных растений кресс-салата в присутствии БП в почве нами не выявлено (см. рис. 1). Тем не менее при высокой дозе БП в почве (20 ПДК) отмечали снижение накопления сырой биомассы корнями проростков (см. рис. 2).
В фазе проростка высшее растение достаточно чувствительно к действию стресс-факторов. Уровень окислительного стресса можно оценивать по накоплению МДА в тканях растений. При внесении БП в почву установлено повышенное относительно контроля содержание МДА в побегах кресс-салата (см. рис. 3), что может свидетельствовать об интенсификации процессов ПОЛ в клетках в условиях окислительного стресса, вызванного наличием БП в почве.
Известно, что БП обладает способностью усиливать рост и размножение ряда растений (Бигалиев и др., 2009). Впервые это было показано на водоросли Obelia geniculata (Шабад, 1973). С тех пор многочисленными исследованиями подтверждено, что в малых концентрациях БП обладает ростстимулирующим действием. В работе (Скугорева и др., 2021а) при внесении в почву небольшой дозы БП (2 ПДК) отмечали ростстимулирующий эффект БП. При более высоких концентрациях БП возможны процессы торможения роста и развития растений.
Микроорганизмы являются первой мишенью действия токсиканта на почвенную экосистему. В исследуемых концентрациях БП оказывал очень сильное воздействие, в первую очередь, на численность прокариотных микроорганизмов (см. табл. 1). Наиболее чувствительными к действию БП были аммонификаторы. При этом чем выше была доза БП, тем меньше в почве аммонификаторов: коэффициент корреляции между их численностью в почве и концентрацией БП составил -0.995. Подобный эффект был отмечен нами ранее (Скугорева и др., 2021а). Резкое отрицательное воздействие БП на численность почвенных аммонификаторов может приводить к снижению активности минерализационных процессов. Угнетение азотфиксаторов происходило только при высокой концентрации БП (20 ПДК), в то же время этот поллютант стимулировал размножение данной группы бактерий при концентрации 10 ПДК. Совершенно иная реакция наблюдается для грибов: отсутствие угнетения при самой высокой дозе БП и стимуляция их размножения при 10 ПДК. Полученные данные хорошо коррелируют с результатами, приведенными в работе (Опекунова, 2016), согласно которым при содержании 2 ПДК БП проявляется токсическое действие на сапрофитные микроорганизмы, количество которых значительно снижается, и на грибы, количество которых в почве резко возрастает.
При действии БП изменялась не только численность микроорганизмов, но структура популяций микробного сообщества почвы (см. табл. 2). Если для контрольного варианта характерно преобладание аммонификаторов, то для вариантов с БП – азотфиксаторов.
Согласно результатам биотестирования (см. табл. 3), внесение в почву 10 ПДК БП практически не оказывало токсического действия на P. caudatum и тест-систему «Эколюм». При более высокой концентрации БП (20 ПДК) отмечено токсическое действие на тест-систему «Эколюм», т. е. данная тест-система является более чувствительной к загрязнению почв БП, чем простейшие P. caudatum. Данный факт, вероятно, связан с тем, что кишечная палочка E. coli, входящая в основу тест-системы «Эколюм», относится к группе аммонификаторов, численность которых резко снижается при действии данного токсиканта. В то же время ранее нами было отмечено, что P. caudatum является чувствительным тест-организмом к загрязнению БП городских почв (Скугорева и др., 2021б).
Заключение
По результатам проведенного исследования можно сделать следующие выводы:
- Внесение БП в почву в дозах 10 и 20 ПДК не оказывало влияния на всхожесть семян и линейные параметры 10-суточных проростков кресс-салата.
- В варианте опыта с содержанием 20 ПДК БП происходило достоверное снижение накопления сырой биомассы корнями растений кресс-салата в 1.47 раза по сравнению с контролем.
- В дозах 10 и 20 ПДК БП в почве отмечали увеличение содержания МДА в побегах растений в 1.69 и 1.60 раза по сравнению с контролем, что может свидетельствовать об интенсификации процессов ПОЛ в клетках в условиях окислительного стресса, вызванного наличием БП в почве.
- Показана неоднозначность размножения почвенных микроорганизмов при внесении БП в дозах 10 и 20 ПДК. Самой чувствительной группой оказались аммонификаторы, которые можно считать индикаторной группой организмов на загрязнение почвы БП.
- Бактериальная тест-система «Эколюм» проявила себя более чувствительной по отношению к БП по сравнению с простейшими Paramecium caudatum. Острая токсичность для тест-системы «Эколюм» выявлена при загрязнении почвы 20 ПДК БП.
Таким образом, почва, загрязненная 20 ПДК БП, является токсичной для таких групп почвенных микроорганизмов, как аммонификаторы и азотфиксаторы, для проростков кресс-салата и для тест-системы «Эколюм». Первые рекогносцировочные данные о токсичности для различных групп живых организмов (бактерии, высшие растения) впоследствии можно включать в разработку систем мониторинга состояния почв, загрязненных данным поллютантом.
Библиография
Абдухалилов О. М., Скугорева С. Г. Токсическое действие полициклических ароматических углеводородов на растения ячменя // Трансформация экосистем под воздействием природных и антропогенных факторов: Материалы междунар. науч. конф. Киров: ВятГУ, 2019. С. 249–251.
Ажогина Т. Н., Скугорева С. Г., Аль-Раммахи А. А. К., Гненная Н. В., Сазыкина М. А., Сазыкин И. С. Влияние поллютантов на распространение генов устойчивости к антибиотикам в окружающей среде // Теорeтическая и прикладная экология. 2020. № 3. С. 6–14. DOI: 10.25750/1995-4301-2020-3-006-014
Бигалиев А. Б., Синтюрина А. В., Бияшева З. М. К вопросу о патогенном действии бензапирена, как загрязнителя окружающей среды (обзор) // Вестник КазНУ. 2009. URL: https://articlekz.com/article/7146 (дата обращения: 28.10.2021).
Лукаткин А. С., Голованова В. С. Интенсивность перекисного окисления липидов в охлажденных листьях теплолюбивых растений // Физиология растений. 1988. Т. 35. Вып. 4. С. 773–780.
МУК 4.1.1274-03. Измерение массовой доли бензпирена в пробах почв, грунтов, донных отложений и твердых отходов методом ВЭЖХ с использованием флуориметрического детектора pyrene in samples of soils, grounds, sediments and solid waste by HPLC using a fluorimetric detector]. М.: Минздрав России, 2003. 36 с.
Опекунова М. Г. Биоиндикация загрязнений: Учеб. пособие . 2-е изд. СПб.: СПбГУ, 2016. 299 с.
Скугорева С. Г., Домрачева Л. И., Абдухаллилов О. М. Влияние бензпирена на развитие почвенных микроорганизмов и рост проростков пелюшки pyrene on the development of soil microorganisms and the growth of field pea seedlings] // Биодиагностика состояния природных и природно-техногенных систем: Материалы ХIX Всероссийской научно-практической конференции c международным участием. Киров: Вятский государственный университет, 2021а. C. 103–108.
Скугорева С. Г., Домрачева Л. И., Абдухалилов О. М., Забубенина Ю. С., Фокина А. И., Кулаков В. Н. Особенности микробиологического и химического состава урбаноземов парков г. Кирова // Материалы XVI Всероссийской научно-практической с международным участием конференции «Экология родного края: проблемы и пути их решения». Киров: Вятский государственный университет, 2021б. Кн. 1. С. 277–282.
Шабад Л. М. О циркуляции канцерогенов в окружающей среде . М.: Медицина, 1973. 367 с.
Яковлева Е. В., Габов Д. Н. Полициклические ароматические углеводороды в растениях естественных бугристых болот // Принципы экологии. 2019. № 2. С. 119–128. DOI: 10.15393/j1.art.2019.8822.
Яковлева Е. В., Габов Д. Н., Безносиков В. А. Влияние бензпиренового загрязнения на ростовые процессы и состав полиаренов растений pyrene pollution on the growth processes and composition of polyarenes of plants] // Теоретическая и прикладная экология. 2015. № 4. С. 45–51. DOI: 10.25750/1995-4301-2015-4-045-051.
Gałązka А., Grządziel J. The molecular‐based methods used for studying bacterial diversity in soils contaminated with PAHs (the review) // Soil Contamination – Current Consequences and Further Solutions / Eds. M. L. Larramendy, S. Soloneski. IntechOpen. 2016. P. 85–104. DOI: 10.5772/64772.
Ifegwu O. C., Anyakora C. Chapter Six – Polycyclic Aromatic Hydrocarbons: Part I. Exposure // Advances in Clinical Chemistry. 2015. Vol. 72. P. 277–304. DOI: 10.1016/bs.acc.2015.08.001.
Благодарности
Работа выполнена в рамках государственного задания ИБ ФИЦ Коми НЦ УрО РАН по теме «Структура и состояние компонентов техногенных экосистем подзоны южной тайги», номер государственной регистрации в ЕГИСУ 1220401000325.






 © 2011 - 2026
© 2011 - 2026