Введение
Характер и динамика расселения по территории помогают оценить пространственно-временные изменения, происходящие внутри популяции (Pulliam, 2000; Mouquet, Loreau, 2003). Расселение может обуславливаться как естественными потребностями популяции, так и совокупностью внешних факторов среды. Воздействие последних может стать началом или оказаться продолжением уже идущих в экосистеме процессов (Ellison et al., 2020). Безусловно, на пространственную структуру популяции влияют и индивидуальные особенности поведения животных (Krause et al., 2010).
Формирование индивидуальных участков особей является достаточно распространенным явлением в животном мире. На примере млекопитающих (Burt, 1943) показано, что в основу становления индивидуального участка заложена возможность животного перемещаться в пределах определенного пространства согласно своим локомоторным возможностям. Сюда же следует отнести и отношение животного к корму и его использованию (Moorter et al., 2009), избегание конфликтов (Moorcroft, Lewis, 2006), хищников (Guillaume Bastille Rousseau et al., 2015) и др.
У ящериц показана связь особенностей пространственного распределения видов со многими сторонами их биологии (Pianka, Parker, 1975). Являясь одним из показателей состояния популяции в конкретных экологических условиях, изменение пространственной структуры служит подвижным механизмом приспособления видов к изменяющимся условиям окружающей среды.
Одним из наиболее удобных объектов исследования пространственной структуры среди представителей подотряда ящериц, несомненно, являются открыто живущие виды пустынных и полупустынных экосистем. Их изучение становится актуальной проблемой в условиях повсеместно происходящего зарастания песчаных массивов, которое ведет к сокращению характерных биотопов и снижению численности видов (Galán, 2004; Сараев, Пестов, 2010; Лотиев, Батхиев, 2019 и др.).
В процессе изучения динамики герпетокомплекса песчаных полупустынь Астраханской области объектом нашего исследования стала внутрипопуляционная группировка круглоголовки-вертихвостки Phrynocephalus guttatus guttatus (Gmelin, 1789) – фонового вида данной территории. Именно на уровне внутрипопуляционной группировки проходят начальные процессы авторегуляции в популяции.
Плотность населения круглоголовки-вертихвостки в южных регионах нашей страны колеблется в широких пределах от 1.2 до 27.8 ос./га (Tabachishin, 2010), но сейчас повсеместно снижается из-за зарастания незакрепленных и полузакрепленных песков – ее характерного биотопа.
Таким образом, целью исследования стало выяснение происходящих в пространственной структуре группировки круглоголовки-вертихвостки изменений и их связь с развивающимся процессом зарастания песчаных полупустынь.
Исследование проходило в разные периоды сезонной активности: в брачный сезон и в начале осени, после завершения процесса размножения.
Материалы
Данные по пространственной структуре популяции круглоголовки-вертихвостки собраны в течение следующих полевых сезонов: весной в первую (2010–2014 гг.) или две первых (2017–2019 гг.) декады мая; осенью в конце августа – начале сентября 2011, 2016–2019 гг. Место исследований – участок песчаной полупустыни вблизи поселка Досанг Красноярского района Астраханской области (46°54'08.7264"N, 47°54'52.5312"E).
Поселение вида для многолетних исследований мы выбрали на основе маршрутного рейда по окружающей поселок Досанг территории полупустынных экосистем (~7 км2). Данное поселение соответствовало уровню внутрипопуляционной группировки или элементарной популяции (Шилов, 1977) и располагалось на изолированном участке полузакрепленных песков площадью 0.4 га.
За период работы было встречено и помечено 682 особи, из которых 402 составляли оседлую часть группировки, а остальные 280 по отношению к поселению являлись мигрантами, передвигавшимися по его территории.
Методы
В процессе сбора материала использован набор стандартных методов зоологических исследований. У пойманных ящериц измеряли длину тела и хвоста с точностью до 1 мм и метили. С целью идентификации животным ставили временную метку с помощью спиртовых маркеров на спину, а постоянную – отрезанием кончиков фаланг пальцев по классической схеме (Mayhew, 1963; Tinkle, Woodward, 1967).
Для описания пространственной структуры использовали метод картирования встреч, перемещений и жилых нор. Данные картирования переводили в электронную форму в программах Adobe Illustrator и Конструктор карт Яндекса. Карты индивидуальных участков строилась по методу выпуклого многоугольника (Rose, 1982; Perry, Garland, 2002), обычно используемого в герпетологических исследованиях. Дополнительными подходами к описанию территориальной структуры служили методы тропления и осторожного преследования, а также визуальные наблюдения.
Предложенный нами и проверенный на многих видах ящериц метод осторожного преследования основан на том, что оседлым ящерицам присуще уверенное передвижение по своему участку и знание имеющихся здесь укрытий. При осторожном преследовании на расстоянии 3–5 или 5–10 м от животного (зависит от вида) оседлые особи спокойно передвигаются в пределах индивидуального участка, занимаясь обычной деятельностью, прячутся в известные им норы и кусты, а подойдя к границе своей территории, сворачивают назад. Поведение мигрирующих особей в случае осторожного преследования резко отличается. При малейшем намеке на преследование ящерицы сразу пугаются и убегают на далекое расстояние от места встречи с наблюдателем. Во время осторожного преследования наблюдатель, кроме того, получает материал о размерах и форме участка, а также информацию по поведению.
В результате использования описанного комплекса методов наблюдатель способен оценить численность близко к результатам метода абсолютного вылова с той лишь разницей, что участок не огорожен. Краевой эффект, возникающий в случае неогороженной площади из-за появления особей с внешней стороны, неизбежно приводит к завышению показателей плотности, особенно при долгосрочных наблюдениях. Чтобы избежать этой погрешности, мы включали в число оседлых только животных, проверенных всеми вышеописанными методами. Остальных особей считали мигрантами и оценивали их численность показателем числа особей на 1 га в сутки. Использование этого показателя позволяло оценить поток мигрантов и сравнивать его по сезонам.
Мы посчитали нецелесообразным подробно обсуждать материалы по размерам индивидуальных участков, поскольку эти параметры не являются точно измеряемыми величинами (Perry, Garland, 2002; Тертышников, 1970; Дебело, Чибилёв, 2013) и их статистическая обработка обычно не приводится.
Изменения пространственной структуры группировки круглоголовки-вертихвостки, очевидно, служили механизмом приспособления популяции к меняющимся условиям биоценоза, зарастанию песчаных массивов. Для оценки динамики фитоценоза мы использовали описание геоботанических площадок по адаптированно упрощенной схеме. Геоботанические исследования включили более 100 описаний геоботанических площадок. Методику и результаты этой части исследования мы подробно описывали в предыдущих публикациях (Полынова и др., 2019 и др.). Оценку достоверности различий полученных данных выполнили на основе непараметрического критерия Краскела – Уоллиса (H).
Результаты
Особенностью исследования явилось то, что в процессе многолетнего изучения поселения происходило зарастание его биотопа и окружающих песчаных массивов, за которым последовало изменение численности и половозрастной структуры вида, описанное нами в предыдущих публикациях (Полынова и др., 2014, 2019 и др.). Цифровая и статистическая характеристики зарастания приведены в упомянутых статьях. Кратко излагая данную составляющую работы, необходимо отметить, что проективное покрытие слабо закрепленных песков увеличилось c 2011 по 2018 г. в 4.1 раза (с 2.2 до 9.0 %), полузакрепленных – в 5.4 раза (с 9.0 до 48.5 %), закрепленных – в 2.3 раза (с 29.5 до 67.0 %). По расчету непараметрического критерия Манна – Уитни различия оказались достоверными, уровень значимости p ≤ 0.01. Для наглядности в данной статье мы демонстрируем фотографии основных изменений (рис. 1, 2).
a
b
Рис. 1. a – зарастание территории поселения эфемерами и эфемероидами, доминантный вид – костер кровельный, Anisantha tectorum L. Nevski; b – основной вид, способствующий закреплению песка – колосняк гигантский или волоснец кистистый, Leymus racemosus (Lam.) Tzvelev (фото Г. В. Полыновой)
Fig. 1. a – overgrowth of the settlement territory with ephemera and ephemeroids. Dominant species – Anisantha tectorum L. Nevski; b – the main species contributing to the consolidation of sand is Leymus racemosus (Lam.) Tzvelev (photo by G. V. Pоlynova)
a
b
Рис. 2. Стадии зарастания межбарханных понижений (фото Г. В. Полыновой)
Fig. 2. Stages of overgrowth of inter-arched depressions (photo by G. V. Polynova)
Зарастание характерного биотопа, незакрепленных и полузакрепленных песков, имеет для круглоголовки-вертихвостки ряд негативных последствий. Прежде всего ухудшаются условия передвижения, что отрицательно сказывается на успешности охоты. Кроме того, снижается необходимый уровень коммуникаций, основанный у данного вида на зрительной сигнализации. И наконец, продолжающийся процесс закрепления песков приводит к зарастанию экологических коридоров, по которым в популяции происходит не только распространение информации, но и обмен генофондом между отдельными поселениями.
Зарастание территории напрямую зависело от увеличения общей суммы осадков в данном регионе (Архив погоды в Досанге, 2020), о чем свидетельствуют наши статистические расчеты (Полынова, Мишустин, 2020).
Согласно опубликованным материалам, пространственное размещение популяции круглоголовки-вертихвостки имеет мозаичный характер, свойственный большинству видов подотряда Ящериц в пустынных и полупустынных экосистемах (Дебело, Чибилёв, 2013; Табачишин, 2006). В отношении предпочитаемого биотопа Ph. g. guttatus обладает относительной экологической пластичностью, используя все типы песчаных участков, но все-таки предпочитает слабо и полузакрепленные пески.
Поскольку в разные части сезона активности пространственная структура популяции выполняет различные функции и в связи с этим имеет определенные отличия, мы рассмотрим материалы, собранные весной в сезон размножения и данные, полученные в конце сезона активности, отдельно. Общим для обеих частей сезона служило взаимное расположение участков и привязанность группировки к одной и той же территории.
Динамика пространственной структуры в брачный сезон, первая и вторая декады мая. Собранные в брачный сезон материалы имели несколько общих черт. Первой общей характеристикой было то, что пространственная структура внутрипопуляционной группировки круглоголовки-вертихвостки, как правило, состояла из индивидуальных участков только половозрелых особей, самцов и самок (рис. 3, 4). В качестве примера предлагаем пространственную структуру группировки в 2010, 2013 и 2014 гг. (см. рис. 3, 4).
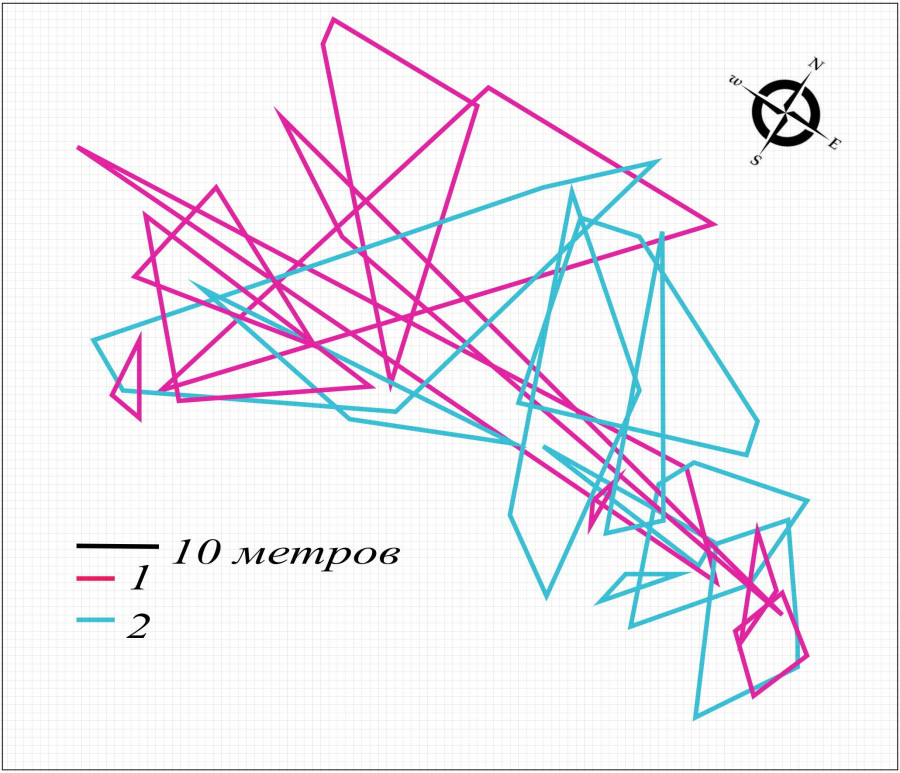
Рис. 3. Пространственная структура внутрипопуляционной группировки круглоголовки-вертихвостки Ph. g. guttatus, май 2010 г.: 1 – границы участков самок; 2 – границы участков самцов
Fig. 3. Spatial structure of the Ph. g. guttatus intra-population group, May 2010: 1 – females' territory borders; 2 – males' territory borders
a

b
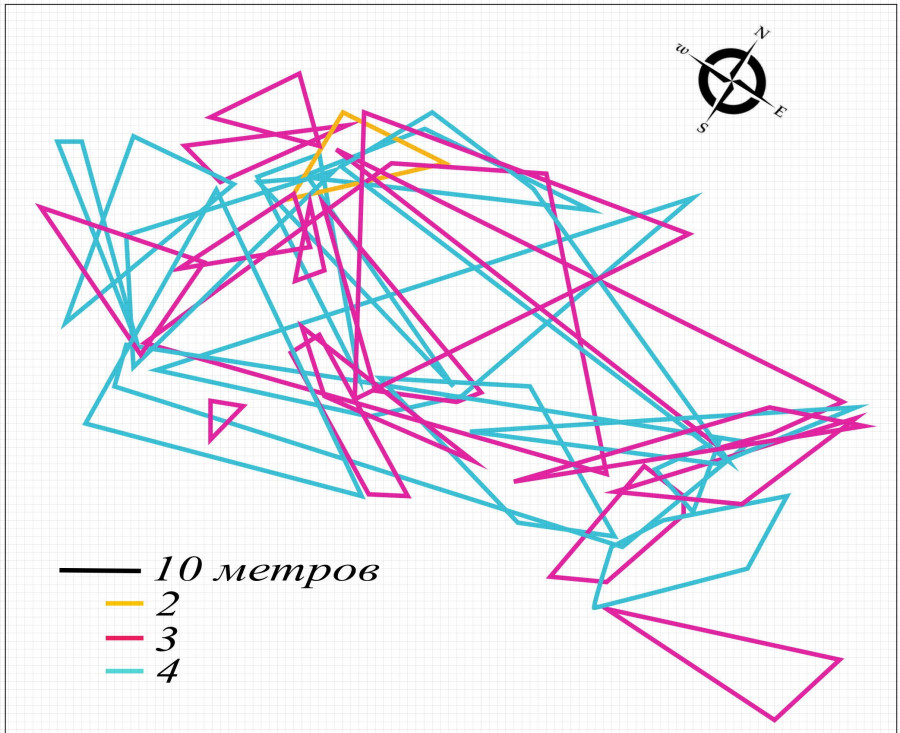
Рис. 4. Пространственная структура внутрипопуляционной группировки круглоголовки-вертихвостки Ph. g. guttatus, май 2013 (a), 2014 (b) гг.: 1 – масштаб; 2 – граница участка неполовозрелой особи; 3 – границы участков самок; 4 – границы участков самцов
Fig. 4. Spatial structure of the Ph. g. guttatus intra-population group, May 2013 (a), 2014 (b): 1 – scale; 2 – immature individuals' territory borders; 3 – females' territory borders; 4 – males' territory borders
Оседлых неполовозрелых круглоголовок мы в поселении не отмечали (2010, 2017–2019 гг.) или почти не отмечали (2012–2014 гг.) (рис. 5). Исключением оказался весенний сезон 2011 года, когда в группировку входило 16 неполовозрелых оседлых особей.
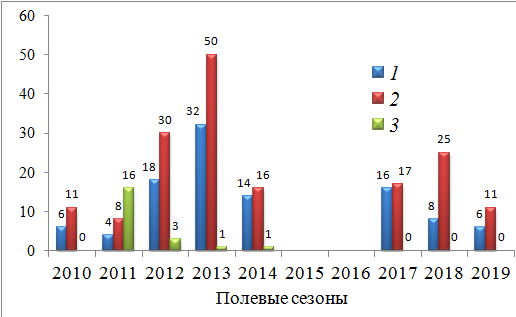
Рис. 5. Динамика численности (особи) оседлой части группировки круглоголовки-вертихвостки Ph. g. guttatus, май 2010–2014 и 2017–2019 гг.: 1 – самцы; 2 – самки; 3 – неполовозрелые особи
Fig. 5. Population dynamics (individuals) of the sedentary part of the Ph. g. guttatus intra-population group, May 2010–2014 and 2017–2019: 1 – males; 2 – females; 3 – immature individuals
Второй общей чертой весеннего поселения во все годы являлось то, что участки брачных партнеров широко перекрывались (см. рис. 3, 4). Это, несомненно, служило задачам сезона размножения. Хорошо известно, что главной функцией пространственной структуры позвоночных животных в сезон размножения является поддержание достаточного уровня брачных контактов (Шилов, 1977 и др.). Благоприятный участок заселился относительно равномерно за счет социальной структуры, основанной на соблюдении индивидуальной дистанции, равной 20–30 см. Широкое перекрывание индивидуальных участков описано у многих видов круглоголовок (Семенов, 2007).
Значительные отличия весенней пространственной структуры группировки по годам являлись результатом изменения численности круглоголовок за период исследований (см. рис. 5).
В первые четыре года сбора материала численность группировки росла. При этом размер занимаемой ею территории практически оставался неизменным. В результате возрастала локальная плотность оседлого населения от 55.5 в 2010 г. до 127.5 ос./га в 2013 г. (рис. 6). Подобные высокие показатели плотности не имеют аналогов в литературе. Диапазон, приводимый разными авторами, составляет от 1.2 до 35.4–38.5 ос./га (Tabachishin, 2010). Самая высокая плотность описана в Калмыкии – 99.9 ос./га (Бадмаева, 1983). Конечно, в нашем случае имеется в виду локальная плотность в пределах поселения, но все равно показатели 2012 и 2013 гг. очень велики и свидетельствуют о переуплотнении поселения.
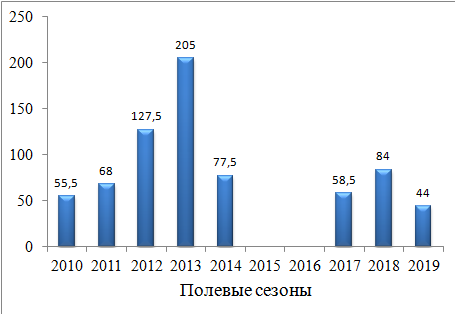
Рис. 6. Динамика локальной плотности (ос./га) оседлой части группировки Ph. g. guttatus, май 2010–2014
и 2017–2019 гг.
Fig. 6. Dynamics of the local density in the sedentary part of the Ph. g. guttatus grouping, May 2010–2014 and 2017–2019
В то время как в первый сезон 2010 г. (см. рис. 3) участки особей располагались относительно свободно, хотя и перекрывались между собой, в 2012 и 2013 гг. (см. рис. 4а, приведена карта только 2013 г., т. к. данные 2012 и 2013 гг. идентичны), пространственная структура группировки представляла плотную сеть взаимно перекрывающихся индивидуальных участков. Несомненно, при такой структуре правильнее считать ее единой территорией группы, поскольку поддержание относительной автономности собственного участка для ящериц стало невозможным. В переуплотненных группировках 2012 и 2013 гг. закономерно увеличилось число агрессивных столкновений.
Расчет критерия Краскела – Уоллиса показал статистически значимые изменения процента перекрывания участков с участками других особей как у самцов, так и у самок (таблица).
Достоверность различий % перекрывания участков круглоголовки-вертихвостки Ph. g. guttatus, май 2010, 2013 и 2019 гг.
| Вариант сравнения | Критерий Краскела – Уоллиса | Уровень значимости |
| Самцы 2010–2013 гг. | 40.4 | p ≤ 0.05 |
| Самки 2010–2013 гг. | 29.0 | p ≤ 0.05 |
| Самцы 2013–2014 гг. | 24.1 | p ≤ 0.05 |
| Самки 2013–2014 гг. | 22.4 | p ≤ 0.05 |
| Самцы 2013–2019 гг. | 47.3 | p ≤ 0.05 |
| Самки 2013–2019 гг. | 29.4 | p ≤ 0.05 |
Уплотнение группировки оседлых особей сначала происходило на фоне относительно высокой численности популяции вида на прилежащей территории. Показателем высокой численности являлся поток мигрантов, проходивших через поселение (рис. 7). Между отдельными группировками активный поток мигрантов шел преимущественно по разбитым участкам песчаных дорог.
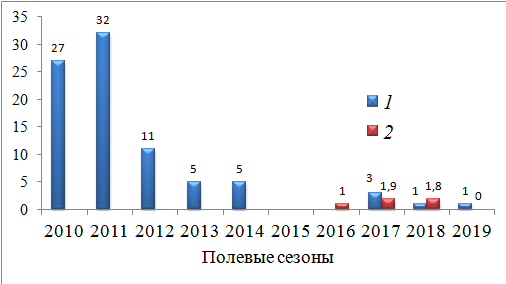
Рис. 7. Динамика потока мигрантов (ос./га сутки) через территорию группировки круглоголовки-вертихвостки Ph. g. guttatus, май 2010–2014, 2017–2019 гг. и конец августа – начало сентября 2016–2018 гг.: 1 – май; 2 – конец августа – начало сентября
Fig. 7. Population dynamics of the migrants (individuals / ha a day) through the Ph. g. guttatus group territory. May 2010–2014, 2017–2019 and late August – early September 2016–2018: 1 – May; 2 – late August – early September
Мы полагаем, что рост локальной плотности связан с началом зарастания окружающих песков, уменьшением площади характерного биотопа и концентрацией животных на пригодной территории. Снижение потока мигрантов, начавшееся в 2012 г., в равной степени могло свидетельствовать о падении численности популяции на прилежащей территории и о зарастании экологических коридоров, по которым происходило перемещение мигрирующих особей.
Возможность существования такой уплотненной пространственной структуры у круглоголовок в определенной степени связана со свойственной им мирмекофагией. Мирмекофагия определяет стабильность кормовой базы и особенности пищедобывательных стратегий (Ananjeva, Tuniyev, 1992; Arnold, 1984; Darevskij, Terentev, 1967; Shenbrot, Semenov, 1986). У молоди мирмекофагия предполагает избыточный пищевой ресурс и использование пищевой стратегии с минимумом энергетических затрат (Pianka, Parker, 1975).
Начиная с весеннего сезона 2014 г. перекрывание индивидуальных участков снизилось (см. таблицу) Соответственно снизилась и локальная плотность в пределах поселения от 77.5 до 82.5 ос./га (2014, 2017 и 2018 гг.) (см. рис. 4b, 6), но при этом поток мигрантов упал до минимальных показателей (см. рис. 7). Сочетание этих изменений подтвердило наше предположение об общем снижении численности популяции. Об этом говорили и наши наблюдения на окружающей территории.
В весенние периоды 2017–2019 гг. индивидуальная дистанция увеличилась и приблизилась к значению 1 м.
В брачный сезон 2019 г. плотность группировки снизилась до уровня 2010 г. (42.5 ос./га) и достоверно уменьшилось перекрывание индивидуальных участков (см. таблицу). При этом появились явные признаки деградации пространственной структуры. Нарушение проявилось в том, что у большей части самок не существовало перекрывания с участками брачных партнеров, группировка перестала быть единой и разделилась на две части: западную и восточную (рис. 8). Восточная часть оказалась малочисленной и включала в себя только одного самца. Мигранты почти пропали (см. рис. 7).
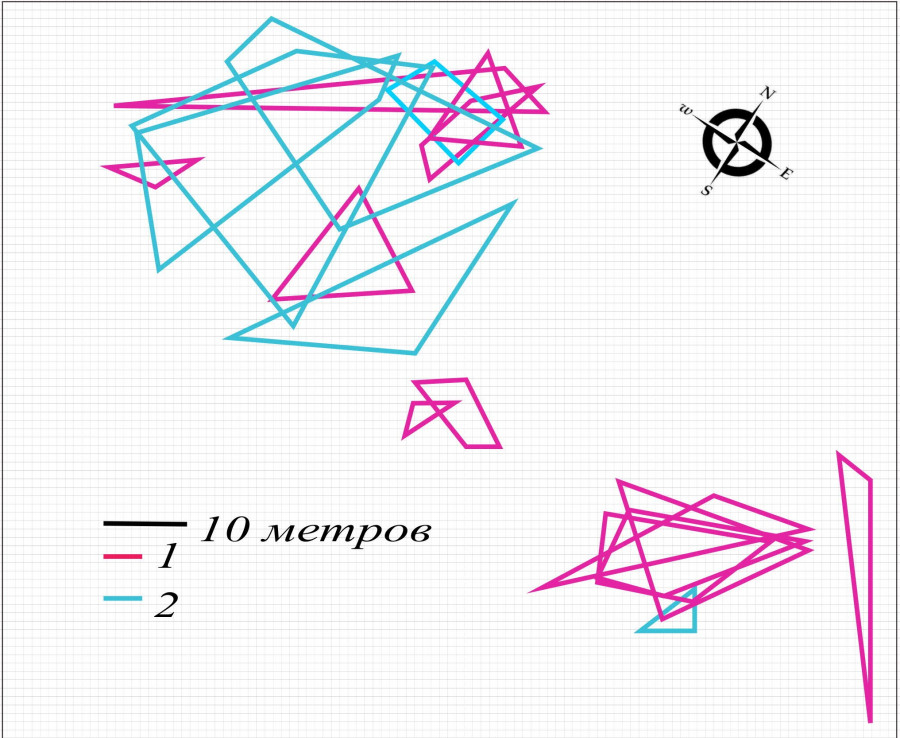
Рис. 8. Пространственная структура внутрипопуляционной группировки круглоголовки-вертихвостки Ph. g. guttatus, май 2019 г.: 1 – границы участков самок; 2 – границы участков самцов
Fig. 8. Spatial structure of the Ph. g. guttatus intra-population group, May 2019: 1 – females' territory borders; 2 – males' territory borders
Дополнил описанные изменения материал по половозрастному составу потока мигрантов (рис. 9).
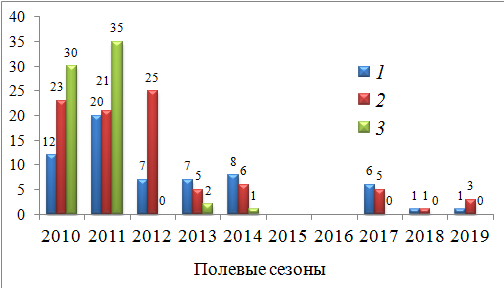
Рис. 9. Динамика половозрастного состава потока мигрантов (ос./га в сутки) через территорию группировки круглоголовки-вертихвостки Ph. g. guttatus, май 2010–2014 и 2017–2019 гг.: 1 – самцы; 2 – самки; 3 – неполовозрелые особи
Fig. 9. Population dynamics of the migrants (individuals/ha a day) through the Ph. g. guttatus group territory. May 2010–2014, 2017–2019: 1 – males; 2 – females; 3 – immature individuals
В первые два года (2010 и 2011) его основу составляли неполовозрелые ящерицы – обычное для позвоночных животных явление послегнездовой дисперсии молодняка (Шилов, 1977). В последующие годы поток мигрантов резко сократился и состоял практически только из взрослых ящериц. Почти полное отсутствие среди мигрантов молодняка свидетельствовало о снижении размножения популяции в целом.
Динамика пространственной структуры в конце сезона активности, конец августа – начало сентября. Пространственная структура группировки круглоголовки-вертихвостки после завершения брачного сезона, в конце сезона активности, имела некоторые отличия (рис. 10), связанные, очевидно, с изменением ее основной функции.
a
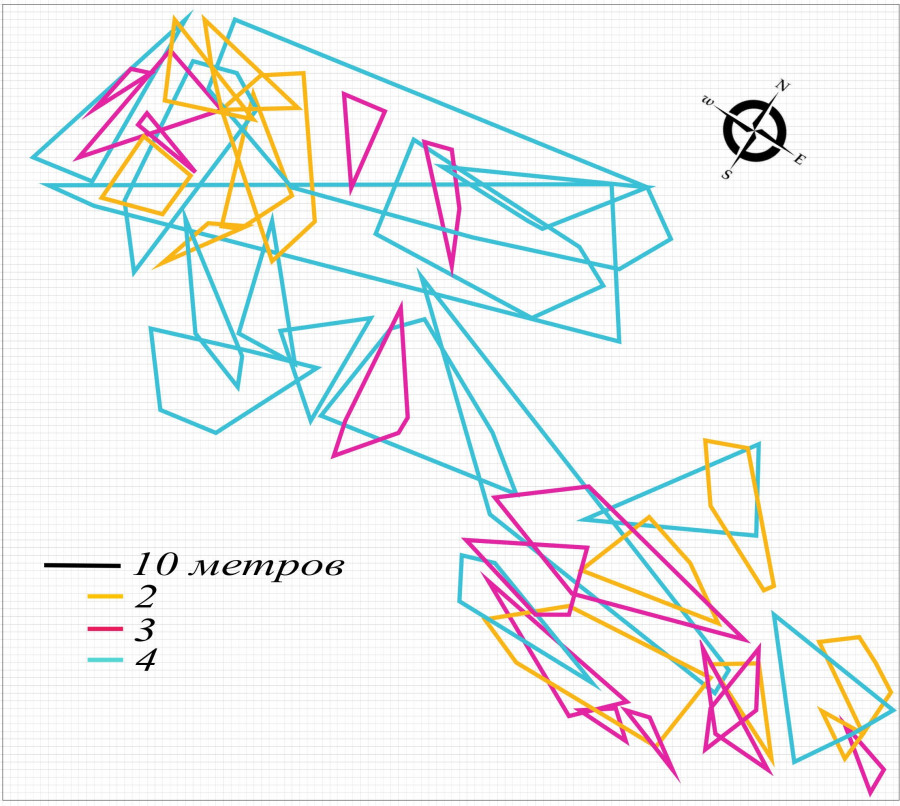
b
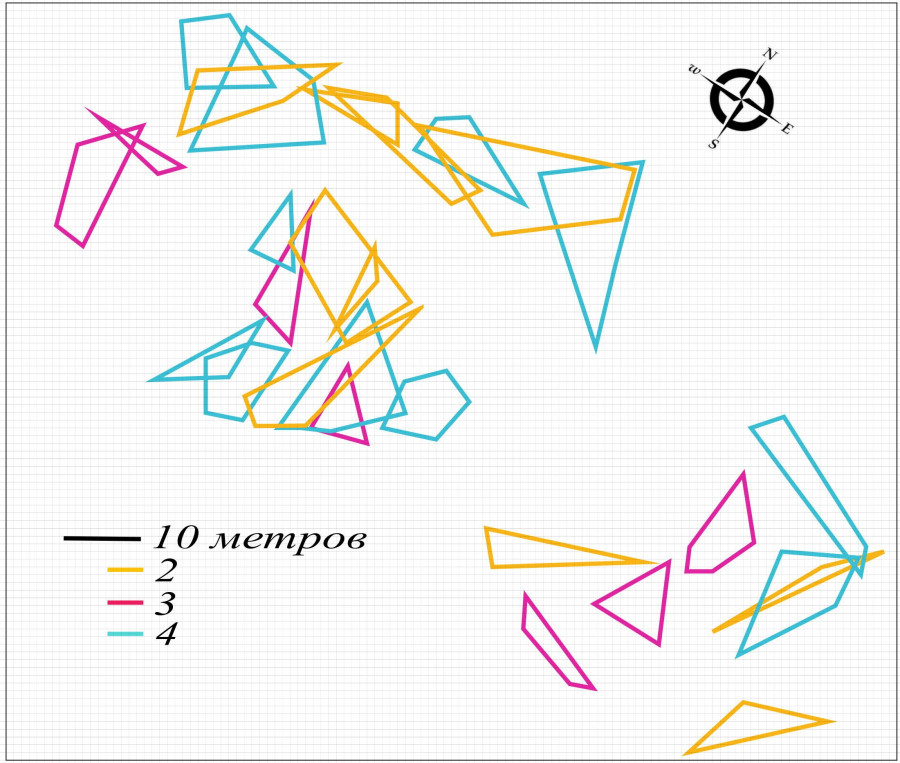
Рис. 10. Пространственная структура внутрипопуляционной группировки круглоголовки-вертихвостки Ph. g. guttatus, конец августа – начало сентября 2017 (a) и 2018 (b) гг.: 1 – масштаб; 2 – границы участков неполовозрелых особей; 3 – границы участков самок; 4 – границы участков самцов
Fig. 10. Spatial structure of the Ph. g. guttatus intra-population group, late August – early September 2017 (a) and 2018 (b): 1 – scale; 2 – immature individuals' territory borders; 3 – females' territory borders; 4 –males' territory borders
После сезона размножения эта структура в основном служит для подготовки к зимовке всех особей популяции и для активного роста сеголеток. В этом случае оседлость также адаптивна, поскольку предполагает определенную безопасность на знакомой территории и использование ее пищевых ресурсов.
Материал, собранный в течение трех лет (2016–2018), показал, что в отличие от весны в осенний сезон в группировке помимо оседлых взрослых самцов и самок существовали и оседлые неполовозрелые особи, сеголетки. Их участки перекрывались с участками половозрелых круглоголовок и в меньшей степени между собой (см. рис. 10). Последнюю особенность взаимного расположения участков молодняка подтверждают и другие исследователи (Бондаренко, 1982; Брушко, 1995). Известно, что пространственная структура молоди у ящериц разнообразна и изменчива (Stamps, 1977), а послегнездовая дисперсия молодняка происходит в короткий период и на относительно небольшое расстояние (Семенов, 2007). Плотность населения так же, как и весной, снижалась по годам: от 120 ос./га в 2016 г. до 70 ос./га в 2018 г.
В пространственной структуре сохранилась весенняя вытянутая форма поселения. В 2018 г. группировка не представляла собой единую структуру (см. рис. 10b). Такой же она оказалась и весной 2019 г. (см. рис. 8).
Подтверждением общего снижения численности популяции на прилежащей территории служила интенсивность потока мигрантов. Она оказалась такой же низкой, как в весенний период 2017–2019 гг.: 1–1.8 ос./га в сутки (см. рис. 7). Интересен тот факт, что в период послегнездовой дисперсии молоди в потоке мигрантов их почти не было, что также свидетельствовало о снижении темпов размножения на данной территории.
Обсуждение
На современном этапе обитатели песчаных пустынь и полупустынных биоценозов оказались в ситуации серьезных биоценотических изменений. Повсеместно идет процесс зарастания песков и связанное с этим сокращение площади характерных для большинства видов биотопов. Этим процессом затронуты многие регионы: Казахстан (Сараев, Пестов, 2010), Узбекистан (Бондаренко и др., 2010), Поволжье (Табачишин и др., 2006), Восточное Предкавказье (Лотиев, Батхиев, 2019) и др.
Как показали наши исследования в Нижнем Поволжье (Полынова, Мишустин, 2020), зарастание песков зависит от климатических условий и определяется увеличением общей суммы осадков на данной территории за последнее десятилетие. Закреплению песков также благоприятствует повсеместное сокращение поголовья скота и исчезновение диких копытных.
Что касается влияния на популяцию хищников, то исследования аутотомии хвоста разноцветной ящурки (Мишустин, Полынова, 2020), совместно обитающей на данной территории, достоверно показали незначительность пресса хищников на популяцию этого вида, что, вероятно, относится и к круглоголовке-вертихвостке, т. к. связано с низкой численностью основных врагов обоих видов.
Негативными последствиями зарастания биотопа для его обитателей является главным образом ухудшение условий передвижения и коммуникации. Эти изменения негативно влияют не только на типичных псаммофилов, но и на относительно эврибионтные виды (Лотиев, Батхиев, 2019; Табачишин, 2006).
Анализ полученных материалов по динамике пространственной структуры Ph. g. guttatus позволил понять механизмы переживания видом значительных изменений характерного биотопа. В этом отношении следует обратиться к моделям авторегуляции плотности популяции на основе территориальности и размещения по местообитаниям неодинаковой качественности (Brown, 1964; Fretwell, Lucas, 1969). Идея этих построений заключается в следующем: вначале заселяются оптимальные местообитания, затем субоптимальные, но с меньшей плотностью, остальные особи попадают в разряд неоседлых и являются популяционным резервом.
Экологическая ситуация в нашем случае отличалась от предложенной схемы тем, что происходило сокращение всех пригодных местообитаний на значительной территории. Еще на этапе поиска объекта для исследований мы с трудом нашли достаточно многочисленное поселение вида. Происходившее на глазах зарастание территории, и в том числе ее экологических коридоров, продолжило процесс уменьшения площади пригодных местообитаний и снижения уровня внутрипопуляционных контактов. В таких условиях достоверно показанное нами значительное увеличение плотности группировки оказалось закономерным. Есть многочисленные сведения, что в условиях повышенной плотности населения начинают работать хорошо известные у позвоночных животных механизмы авторегуляции численности (Шилов, 1977), которые в результате роста агрессивности между особями нарушают нормальное течение сезона размножения. Рост агрессивности отмечен и в наших наблюдениях. Работа механизмов авторегуляции на следующем этапе привела в рассматриваемой группировке к сокращению численности. При этом резерв популяции в виде неоседлых особей не возрастал, а сокращался, что давало аналогичные последствия.
К сожалению, нам не удалось найти в литературе материалов, аналогичных нашим многолетним исследованиям данного вопроса. В известной степени подтверждают описанную нами схему собственные опубликованные данные по разноцветной ящурке Eremias arguta deserti (Полынова, Мишустин, 2020). Для ящурки зарастание биотопа усугубилось усыханием кустов песчаной полыни (Artemisia arenaria, DC), служащих виду основным убежищем и местом охоты, что ускорило процесс снижения численности.
Заключение
Наши многолетние данные позволили предложить следующую схему переживания популяцией изменения экологических условий. На начальных стадиях зарастания песков животные начинают активно мигрировать по территории в поисках пригодных участков биотопа. Об этом свидетельствует очень высокий показатель потока мигрантов в первые два года наблюдений. Далее в результате активных миграций на участках оптимальных местообитаний концентрируется большая часть особей, что приводит к завышенной плотности населения группировок, начинают работать механизмы авторегуляции численности. В результате происходит сокращение численности оседлых группировок. Общее сокращение численности популяции проявляется и в уменьшении числа неоседлых особей, что усугубляется зарастанием экологических коридоров. В свою очередь мигранты не подпитывают малочисленную группировку, и процесс снижения численности продолжается. Это подтверждают материалы возобновленных через два года исследований. Снижение численности и плотности населения развивается дальше, и поселение перестает быть единым и распадается в последний десятый сезон исследований на части.
Предложенная схема получена на основе анализа наблюдений за динамикой численности отдельной внутрипопуляционной группировки круглоголовки-вертихвостки. Наблюдения за общим сокращением численности вида на окружающей территории позволяют предположить ее идентичность для всей популяции.
Библиография
Архив погоды в Досанге . URL: https://rp5.ru/Архив_погоды_в_Досанге (дата обращения: 23.01.2020).
Бадмаева В. И. Ящерицы Калмыкии : Автореф. дис. … канд. биол. наук. Киев, 1983. 24 с.
Бондаренко Д. А. Экология хентаунской круглоголовки в летне-осенний период // Вестник зоологии. 1982. № 5. С. 55–59.
Бондаренко Д. А., Перегонцев Е. А., Абдуназаров Б. Б., Сударев В. О. О современном состоянии герпетофауны песчаных массивов Ферганской долины (Узбекистан) // Герпетологические исследования в Казахстане и сопредельных странах: Сборник научных статей / Под ред. Т. Н. Дуйсебаевой. Алматы: АСБК СОПК, 2010. С. 246–248.
Брушко З. К. Ящерицы пустынь Казахстана . Алматы: Конжык, 1995. 231 с.
Дебело П. В., Чибилёв А. А. Амфибии и рептилии Урало-Каспийского региона. Екатеринбург: РИО УрО РАН, 2013. 400 с. (Серия: Природное разнообразие Урало-Каспийского региона. Т. III).
Лотиев К. Ю., Батхиев А. М. О деградации туранского герпетофаунистического комплекса в Терском песчаном массиве (Восточное Предкавказье) // Известия высших учебных заведений. Поволжский регион. Естественные науки. 2019. № 2 (26). С. 115–128.
Мишустин С. С., Полынова Г. В. Влияние хищничества на численность разноцветной ящурки в полупустынях юго-восточной части Нижнего Поволжья // Ученые записки Казанского университета. Серия: Естественные науки. 2020. Т. 162, № 3. С. 461–472. DOI: 10.26907/2542-064X.2020.3.461-472.
Полынова Г. В., Бажинова А. В., Полынова О. Е. Динамика половозрастной популяции круглоголовки-вертихвостки (Phrynocephalus guttatus guttatus Gmel.) в песчаных полупустынях Астраханской области // Вестник РУДН. Серия: Экология и безопасность жизнедеятельности. 2014. № 4. С. 11–24.
Полынова Г. В., Мишустин С. С., Полынова О. Е. Динамика герпетокомплекса песчаных пустынь Астраханской области // Известия высших учебных заведений. Поволжский регион. Естественные науки. 2019. № 2 (26). С. 150–163. DOI: 10.21685/2307-9150-2019-2-15.
Полынова Г. В., Мишустин С. С. Изменение пространственной структуры популяции разноцветной ящурки Eremias arguta deserti (Gmelin, 1789) в полупустынях Астраханской области // Принципы экологии. 2020. № 2 (36). С. 87–96.
Сараев Ф. А., Пестов М. В. К кадастру рептилий Северного и Северо-Восточного Прикаспия // Герпетологические исследования в Казахстане и сопредельных странах: Сборник научных статей / Под ред. Т. Н. Дуйсебаевой. Алматы: АСБК – СОПК, 2010. С. 172–191.
Семенов Д. В. Сравнительные аспекты пространственной экологии ящериц: на примере круглоголовок (Reptilia, Agamidae, Phrynocephalus) // Журнал общей биологии. 2007. Т. 68, № 5. С. 379–393.
Табачишин В. Г., Завьялов Е. В., Табачишина Е. И. Пространственное размещение разноцветной ящурки – Eremias arguta (Pallas, 1776) на севере ареала в Поволжье // Современная герпетология. 2006. Т. 5/6. С. 117–124.
Тертышников М. Ф. Индивидуальная территория прыткой ящерицы (Lacerta agilis) и разноцветной ящурки (Eremias arguta) и особенности ее использования // Зоологический журнал. 1970. Т. 49. Вып. 9. С. 1377–1385.
Шилов И. А. Эколого-физиологические основы популяционных отношений у животных . М.: Московский университет, 1977. 261 с.
Arnold E. N. Ecology of lowland lizard in the eastern United Arab Emirates // J. Zool. (Lond.). 1984. Vol. 204 (3). P. 329–354.
Ananjeva N. B., Tuniyev B. S. Historical biogeography of the Phrynocephalus species of the USSR // Asiatic Herpetol. Res. 1992. Vol. 4. P. 76–98.
Brown J. L. The evolution of diversity in avian territorial systems // Wilson Bull. 1964. Vol. 76. P. 160–169.
Burt W. H. Territoriality and home range concepts as applied to mammals // Journal of Mammalogy. 1943. Vol. 24 (3). P. 346–352. DOI: 10.2307/1374834.
Darevskij I. S., Terentev P. V. Estimation of energy flow through amphibian and reptile populations // Secondary Productivity in Terrestrial Ecosystems. 1967. Vol. 1. P. 181–197.
Ellison N., Hatchwell B. J., Biddiscombe S. J., Napper C. J., and Potts J. R. Mechanistic home range analysis reveals drivers of space use patterns for a non-territorial passerine // Journal of Animal Ecology. 2020. Vol. 89 (12). DOI: 10.1111/1365-2656.13292.
Fretwell S. D., Lucas H. L. On territorial behavior and other factors influencing habitat distribution in birds. 1. Theoretical development // Ibis. 1969. Vol. 19. P. 16–36.
Galán P. Structure of a population of the lizard Podarcis bocagei in northwest Spain: variations in age distribution, size distribution and sex ratio // Animal Biology. 2004. Vol. 54, № 1. P. 57–75.
Guillaume Bastille Rousseau, Jonathan R Potts, James A Schaefer, Mark A Lewis, E Hance Ellington, Nathaniel D Rayl, Shane P Mahoney, Dennis L Murray. Unveiling trade-offs in resource selection of migratory caribou using a mechanistic movement model of availability // Ecography. 2015. Vol. 38 (10). P. 1049–1059.
Krause J., James R. & Croft D. P. Personality in the context of social networks // Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 2010. Vol. 365 (1560). P. 4099–4106.
Mayhew W. W. Biology of the granite spring lizard, Sceloporus orcutti // Amer. Midl. Nat. 1963. Vol. 69, № 2. P. 310–327.
Moorcroft P. R., & Lewis M. A. Mechanistic home range analysis. Princeton, NJ: Princeton University Press, 2006. 192 p.
Moorter B. V., Visscher D., Benhamou S., Börger L., Boyce M. S., & Gaillard J.-M. Memory keeps you at home: A mechanistic model for home range emergence // Oikos. 2009. Vol. 118 (5). P. 641–652. DOI: 10.1111/j.1600-0706.2008.17003.x.
Mouquet N. and Loreau M. Community patterns in source-sink metacommunities // American Naturalist. 2003. Vol. 162 (5). P. 544–557.
Perry G., Garland T., Jr. Lizard home ranges revised: effects of sex, body size, diet, habitat, and phylogeny // Ecology. 2002. Vol. 83 (7). P. 1870–1885.
Pianka E. R., Parker W. S. Ecology of horned lizards: a review with special reference to Phrynosoma platyrhinos // Copeia. 1975. № 1. P. 141–162.
Pulliam H. R. On the relationship between niche and distribution // Ecology Letters. 2000. Vol. 3. P. 349–361.
Rose B. Lizard home range: methodology and functions // J. Herpetol. 1982. Vol. 16 (3). P. 253–269.
Shenbrot G. I., Semenov D. V. Some biological peculiarities of Phrynocephalus (Agamidae) // Studies in Herpetology / Ed. Z. Rocek. Prague, 1986. P. 579–582.
Stamps J. F. Social behavior and special pattern in lizards // Biology of the reptilian. Vol. 7: Ecology and behavior. New York: Akad. Press, 1977. P. 265–334.
Tabachishin V. G. Spatial distribution and abundance trends of spotted toad-headed agama, Phrynocephalus guttatus, in its northern habitat region // Современная герпетология. 2010. Т. 10. Вып. 3/4. С. 155–156.
Tinkle D. W., Woodward D. W. Relative movements of lizards in natural populations as determined from receptive radii // Ecology. 1967. Vol. 48, № 1. P. 166–168.
Благодарности
Публикация выполнена при поддержке Программы стратегического академического лидерства Российского университета дружбы народов (РУДН).
This paper has been supported by the Peoples’ Friendship University of Russia (RUDN University) Strategic Academic Leadership Program.










 © 2011 - 2026
© 2011 - 2026