Введение
Изучение закономерностей географической изменчивости размеров пойкилотермных позвоночных животных развивается в двух направлениях, которые до настоящего времени оставались слабо взаимосвязанными между собой. С одной стороны, это анализ литературных или собственных данных (полученных обычно на многочисленном музейном материале) по межпопуляционной изменчивости длины тела или каких-либо других характеристик общих размеров особей, принадлежащим к различным популяциям одного или нескольких видов, с целью выявления закономерностей, соответствующих известным зоогеографическим правилам Бергмана и Ренша (Adams, Church, 2008; Ashton, 2002; Ashton, Feldman, 2004; Blanckenhorn et al., 2006; Olalla-Tarraga, Rodriguez, 2007). Несмотря на то что первоначально правило Бергмана было сформулировано для гомойотермных животных (обзор см.: Watt et al., 2010), в последнее время становится все более популярным поиск закономерностей географической изменчивости у разнообразных групп пойкилотермных животных. В основе таких исследований положено представление о сильном влиянии климатической температуры на формирование размеров особей либо непосредственно в процессе онтогенеза, либо под влиянием отбора, влияющего на размеры или другие характеристики жизненного цикла, жестко связанные с размерами (Angilletta et al., 2004; 2004a; Liao, Lu, 2011; Olalla-Tarraga, Rodriguez, 2007). Второе направление в целом также основано на концепции тесной взаимосвязи характеристик жизненных циклов, в том числе и сложных, т. е. состоящих минимум из двух четко выраженных фаз – водной и наземной – таких как у многих видов амфибий. Исследования в рамках этого направления представляют собой детальный анализ географической (межпопуляционной) изменчивости, как правило – одного, реже – немногих близких видов, преимущественно широкоареальных, при этом основное внимание уделяется взаимосвязям размеров с возрастным составом, выживаемостью на различных стадиях жизненного цикла, темпами достижения половой зрелости и репродуктивными характеристиками. Каждое из двух этих направлений, будучи ограниченным своими целями, может быть не лишено ряда недостатков. Для первого, «экстенсивного», направления один из наиболее очевидных недостатков – возможная неточность или неполнота литературных данных, обусловленные, в том числе, и их субъективным выбором. Так, например, в обширном исследовании внутривидовых изменений в широтном и высотном направлениях максимальной продолжительности жизни амфибий (Zhang, Lu, 2012) для такого хорошо изученного вида, как травяная лягушка, этот максимальный возраст принимается равным 8 годам, что представляет собой явно заниженную оценку (обзор см.: Hjernquist et al., 2012), а данные по другому хорошо исследованному виду с еще более обширным ареалом – остромордой лягушке (Glandt, Jehle, 2008) – вообще не приводятся. При детальном анализе одного или немногих видов велик риск возвести частные результаты в ранг общих закономерностей. Очевидно, что объединение сильных сторон этих двух направлений позволило бы осуществить не только «экстенсивный», но и более углубленный анализ. В связи с этим основной целью нашей работы стал обзор данных по географической изменчивости возрастного состава и размеров одного широкоареального пойкилотермного вида и выявление онтогенетических и эволюционных механизмов формирования такой изменчивости. В качестве широко распространенного вида с большой протяженностью ареала в широтном направлении была выбрана травяная лягушка Rana temporaria Linnaeus, 1758. Крайняя западная и юго-западная части ее ареала включают Англию и Ирландию, часть Пиренейского п-ва, Франции и Италии (Glandt, 2009), в то время как на севере Европы граница ее распространения заходит за полярный круг и ограничена пределами материка (Кутенков, 2009). Необходимость анализа данных не только по длине тела, но и по возрасту объясняется тем, что различия в размерах взрослых амфибий являются не только следствием неодинаковой скорости роста, обусловленной климатическими условиями, но и различиями в возрастном составе (обзор см.: Morrison, Hero, 2003). Кроме того, необходимо учитывать размерные половые различия, которые у бесхвостых амфибий обычно считают следствием не только полового, но и других форм отбора (прежде всего, отбора на плодовитость), обусловливающих более крупные размеры самок (Shine, 1979, 1989). Из литературы известно, что у амфибий изменение средних размеров в пределах их ареалов в направлении с юга на север (или от равнин в горы) часто происходит ненаправленно (обзор см.: Adams, Church, 2008; Cvetkovic et al., 2008; Ficetola et al., 2010). Для травяной лягушки такое ненаправленное изменение длины тела с максимумом около 64° с. ш. было показано при исследовании 12 популяций, местообитания которых расположены на Скандинавском п-ве, вдоль 1600-километровой трансекты в направлении с юга на север (Laugen et al., 2005). Использование данных по возрастам тех же популяций показало, что в отличие от длины тела значения среднего возраста, а также возраста первого размножения и максимальной продолжительности жизни увеличиваются с юга на север направленно, достигая максимума в популяции с экстремально коротким сезоном активности, обитающей на 69° с. ш. (Hjernquist et al., 2012). Предлагаемое нами объяснение закономерностей межпопуляционной изменчивости размеров основано на рассмотрении изменений особенностей жизненного цикла, и прежде всего демографических характеристик. Согласно этому подходу, причина выявленного отсутствия однотипной направленности изменения средних размеров состоит в неоднозначности соотношения между сокращением величины годовых приростов длины тела и увеличением продолжительности жизни в направлении с юга на север. Средние значения возраста взрослых особей увеличиваются в этом направлении потому, что первое размножение происходит во все более позднем возрасте, вследствие ограничения продолжительностью сезона активности. По той же причине наблюдается замедление темпов роста, как по достижении половой зрелости, так и у взрослых лягушек (Ляпков и др., 2009). При переходе от южной части ареала к центральной следует ожидать увеличения средних размеров, поскольку в этом случае средний возраст увеличивается более быстрыми темпами, в сравнении с темпами замедления роста. При дальнейшем продвижении к северной границе ареала темпы замедления роста должны возрастать сильнее, поэтому следует ожидать уменьшения средних размеров. Ситуация усложняется тем, что даже в пределах одной популяции обычно существуют половые различия и по темпам роста, и по возрасту первого размножения (данные по бурым лягушкам см.: Ляпков и др., 2004, 2007, 2010a). Половые различия в темпах роста обусловлены неодинаковыми затратами самок и самцов на репродукцию (Jonsson et al., 2009), и, как правило, самцы достигают половой зрелости в несколько более раннем возрасте, чем самки (Ляпков и др., 2004). Кроме того, половые различия в возрастном составе могут быть обусловлены различной выживаемостью самок и самцов (обзор см.: Morrison, Hero, 2003; Ляпков и др., 2007). В пределах одной популяции различия между полами в соотношении двух рассмотренных выше тенденций изменений темпов роста и среднего возраста будут определять направленность и степень выраженности половых различий по размерам, а соответствующие межпопуляционные изменения будут определять географическую изменчивость направленности и выраженности половых различий. Задачи нашей работы: 1. На основании литературных и собственных данных по географической изменчивости возрастного состава и размеров половозрелых травяных лягушек выявить характер зависимости среднего возраста и средней длины тела от широты и от длительности сезона активности, а также выяснить, выполняются ли для этого широкоареального вида правило Бергмана (в его варианте, сформулированном Реншем для внутривидовой изменчивости, см:. Blackburn et al., 1999) и правило Ренша; 2. Сопоставить выявленные закономерности географической изменчивости с предложенным нами объяснением механизмов формирования и закономерностей проявления географической изменчивости длины тела.Аналитический обзор
В качестве источника данных для нашего анализа мы использовали публикации (табл. 1), в которых имеются данные по средней длине тела и среднему возрасту половозрелых травяных лягушек, относящихся к приблизительно 70 пространственно разделенным популяциям, а также по длительности сезона активности местообитаний этих популяций. В ряде случаев средние значения длины тела или возраста были рассчитаны нами по оригинальным данным, представляющиМ собой возрастные или размерные распределения в виде таблиц или рисунков.
Для количественной характеристики климатических различий, соответствующих изменению широты или высоты над уровнем моря (у. м.), мы использовали величину длительности сезона активности, связанной с климатической температурой местообитаний популяций (Hjernquist et al., 2012). У взрослых травяных лягушек сезон активности начинается весной выходом с зимовки, вскоре после которого происходит их размножение, и заканчивается осенью уходом в зимовку. Длительность сезона активности во многих публикациях не приводится, и тогда эту величину рассчитывали на основании данных по фенологии (сроков выхода с зимовки, начала размножения, ухода в зимовку) или по географическим координатам (или высоте над у. м.) местообитаний исследованных популяций. В последнем случае длительность сезона активности определяли по числу дней в году, среднесуточная температура которых превышала +5 ºС (Hjernquist et al., 2012). Величину половых различий по средним значениям длины тела и возраста оценивали с помощью отношения соответствующих средних значений у самок и самцов данной популяции, т. е. коэффициента Ловича – Гиббонса (LGc – Lovich, Gibbons, 1992), по формулам: age_LGc = fem_age/mal_age (где fem_age – средний возраст самок, mal_age – средний возраст самцов); SVL_LGc = fem_SVL/mal_SVL (где fem_SVL – средняя длина тела самок, mal_SVL – средняя длина тела самцов). Далее мы анализировали зависимость между широтой (latitude) или длительностью сезона активности (Т) местообитания данной популяции и средними значениями длины тела и возраста самцов и самок, а также зависимость от всех названных характеристик величины коэффициента Ловича – Гиббонса. Для количественной оценки и достоверности этих зависимостей мы вычисляли коэффициенты ранговой корреляции (Rs) между соответствующими характеристиками.
Кроме литературных данных, в анализе были использованы результаты наших опубликованных ранее исследований внутрипопуляционной и географической изменчивости травяной лягушки (Ляпков, 2008; Ляпков и др., 2002, 2002а, 2004, 2004а, 2009). Поскольку результаты этих наших работ будут рассмотрены подробно, следует дать краткую характеристику исследованных популяций и населяемых ими местообитаний. Половозрелых травяных лягушек собирали во время размножения в нерестовых водоемах в 3 различных регионах на территории России и в одном – в Беларуси: Россия, Кировская обл., 58º40′ N, 49º05′ E (далее для краткости Киров); Московская обл., Звенигородская биостанция МГУ, 55°44'N, 36°51'E (далее ЗБС); Брянская обл., окрестности заповедника Брянский лес, 52°27'N, 33°53'E (далее – Брянск); Беларусь, Минская обл., Копыльский р-н, окрестности села Конюхи, 53°09'N, 27°26'E (далее Минск). Длительность сезона активности местообитаний популяций Минска и Брянска составляет 7 мес., популяции ЗБС – 6 мес., Кирова – 5 мес. У всех собранных особей измеряли длину тела и определяли возраст с помощью изготовления окрашенных срезов из середины диафиза голени (Смирина, 1972). Далее измеряли диаметры каждой из линий склеивания, видимых на срезах (т. е. линий, соответствующих каждой из зимовок, пережитых данной особью) и на основании этих данных производили ретроспективную оценку длины тела, соответствующей времени ухода в каждую из зимовок (Смирина, 1983). Поскольку возраст лягушек характеризируется распределением, отличающимся от нормального, для сравнения популяций по этому признаку использовали критерий Манна – Уитни (Глотов и др., 1982).
Обработку данных проводили с помощью пакета статистических программ STATISTICA 6.0 (StatSoft Inc.).
Таблица 1. Источники литературных данных по географической изменчивости длины тела и возраста травяной лягушки
| Страна | Место сбора | Географические координаты | Источник |
| Франция | Восточная Франция, Servotte | 47°N, 05°W | Augert, Joly, 1993 |
| Франция | Восточная Франция, Thevenon | 47°N, 05°W | Augert, Joly, 1993 |
| Румыния | RetezatNational Park, горная популяция Taul Rades | 45°N | Bancila et al., 2009 |
| Румыния | RetezatNational Park, горная популяция Taul Judele | 45°N | Bancila et al., 2009 |
| Румыния | RetezatNational Park, горная популяцияIezilorLake | 45°N | Bancila et al., 2009 |
| Румыния | RetezatNational Park, горная популяцияSecatLake | 45°N | Bancila et al., 2009 |
| Англия | Северная Англия, Дурхам, 5 горных прудов | 54°46'N, 01°35'W | Beattie, 1987 |
| Англия | Северная Англия, Дурхам, 4 предгорных пруда | 54°46'N, 01°35'W | Beattie, 1987 |
| Англия | Линкольншир | 53°26'N | Cummins, 1986 |
| Англия | Линкольншир | 53°26'N | Cummins, 1986 |
| Англия | Норфолк | 52°42'N | Cummins, 1986 |
| Англия | Кембриджшир | 52°26'N | Cummins, 1986 |
| Англия | Кембриджшир | 52°26'N | Cummins, 1986 |
| Англия | Девон | 50°31'N | Cummins, 1986 |
| Швеция | Центральная Швеция, Umea | 63°30'N, 20°15'E | Elmberg, 1987 |
| Швеция | Центральная Швеция, Kraipe, 800 н. у. м. | 65°51'N, 16°22'E | Elmberg, 1991a |
| Швеция | Центральная Швеция, Ammarnas, 410 н. у. м. | 66°N, 16°E | Elmberg, 1991a |
| Швеция | Центральная Швеция, Umea | 63°30'N, 20°15'E | Elmberg, 1991a |
| Германия | Эссен | 51°50'N, 07°E | Geisselmann et al., 1971 |
| Ирландия | Клэр | 53°02'N, 09°04'W | Gibbons, McCarthy, 1984 |
| Ирландия | Клэр | 53°02'N, 09°04'W | Gibbons, McCarthy, 1986 |
| Испания | Сев. Испания, Страна Басков | 43°16'N | Gosa, 1998 |
| Италия, | Сев. Италия, Альпы Rocciavre Natural Park, 1250 н. у. м. | Guarino et al., 2008 | |
| Франция | Альпы, 2000 н. у. м.. | 45°20'N, 06°42'E | Guyetant et.al., 1988 |
| Франция | Альпы, 2300 н. у. м. | 45°20'N, 06°42'E | Guyetant et.al., 1995 |
| Швейцария | Цюрих, 655 м. н. у. м. | 47°N, 08°E | Heusser, 1970 |
| Швеция | Северная Швеция, Kiruna | 67°51'N, 21°20'E | Hjernquist et al., 2012 |
| Швеция | Центральная Швеция, Lindragen | 59°28'N, 13°31'E | Hjernquist et al., 2012 |
| Швеция | Южная Швеция, Tvedora | 55°42' N, 13°26' E | Hjernquist et al., 2012 |
| Россия | Ленинградская обл. | Ishchenko, 1996; Ищенко, 1968 | |
| Россия | Полярный Урал | Ishchenko, 1996; Ищенко, 1968 | |
| Беларусь, | Минская обл. | Ishchenko, 1996; Ищенко, 1968 | |
| Франция | Восточная Франция, Chardennet | 47°N, 05°W | Joly, 1991 |
| Франция | Восточная Франция, Neuf | 47°N, 05°W | Joly, 1991 |
| Франция | Восточная Франция, Roche | 47°N, 05°W | Joly, 1991 |
| Финляндия | Северная Финляндия, Kilpisjarvi, 485 н. у. м. | 69°04'N | Jonsson et al., 2009 |
| Швеция | Центральная Швеция, Umea | 64°27'N, 20°15'E | Jonsson et al., 2009 |
| Швеция | Центральная Швеция, Varmland | 59°50'N | Jonsson et al., 2009 |
| Швеция | Центральная Швеция, Uppland | 60°N | Jonsson et al., 2009 |
| Швеция | Центральная Швеция, Blekinge | 56°20'N, 14°34'E | Jonsson et al., 2009 |
| Швеция | Южная Швеция, Lund | 55°40'N, 13°30'E | Jonsson et al., 2009 |
| Швеция | Северная Швеция, Kiruna, 425 н. у. м. | 67°51'N, 21°20'E | Jonsson et al., 2009; Hjernquist et al., 2012 |
| Швеция | Центральная Швеция, Ammarnas, 410 н. у. м. | 65°54'N, 16°18'E | Jonsson etal, 2009; Hjernquist et al., 2012 |
| Польша | Краков | 50°05'N, 20°08'E | Juszczyk et al., 1984 |
| Словакия | Северо-восточная Словакия | 49°N, 20°E | Kminiak, 1971 |
| Финляндия | Haapavesi | 64°10'N, 25°10'E | Koskela, Pasanen, 1974 |
| Польша | Бржежини, 1000 м н. у. м. | 50°N | Kozlowska, 1971 |
| Польша | Чочоловска долина, 1000 м н. у. м. | 53°N | Kozlowska, 1971 |
| Польша | Завоя, 700 м н. у. м. | 50°N | Kozlowska, 1971 |
| Польша | Краков | 50°05'N, 20°08'E | Kozlowska, 1971 |
| Швеция | Центральная Швеция, Uppsala | 59°51'N, 17°14'E | Laugen et al., 2005; Hjernquist et al., 2012 |
| Франция | Альпы, 2300 н. у. м. | 45°20'N, 06°42'E | Miaud et al., 1999; Miaud, Guyetant, 1998 |
| Испания | Барселона | 42°N, 02°E | Montori, Pascual, 1987 |
| Англия | Ковентри и Варвикшир | 50°31'N | Navas, James, 2007 |
| Франция | Бретань, северо-запад Франции | 48°06'06''N, 01°47'47'W | Neveu, 2009; Neveu, pers.comm. |
| Финляндия | Хаапавеси | 64°10'N, 25°10'E | Pasanen, Koskela, 1974 |
| Финляндия | Сев. Финляндия, Kilpisjarvi | 69°04'N, 20°46'E | Patrelle et al., 2012 |
| Финляндия | Сев. Финляндия, Kilpisjarvi | 69°04'N, 20°46'E | Plaiasu et al., 2010 |
| Финляндия | Сев. Финляндия, Kolari | 67°02'N | Plaiasu et al., 2010 |
| Швейцария | Альпы, 1930 м н. у. м. | Ryser, 1996 | |
| Швейцария | Берн, 600 м н. у. м. | 47°N, 07°E | Ryser, 1988; Ryser, 1996 |
| Германия | Эссен | 51°50'N, 07°E | Schluepmann, 1981 |
| Австрия | Южная Австрия | 46°40'N, 14°26'E | Sztatecsny et al., 2010 |
| Швеция | Центральная Швеция, Ammarnas, 410 | 65°54'N, 16°E | ter Schure et al., 2002 |
| Швеция | Центральная Швеция, Umea | 64°27'N, 20°15'E | ter Schure et al., 2002 |
| Швеция | Центральная Швеция, Uppsala | 59°51'N, 17o14'E | ter Schure et al., 2002 |
| Швеция | Центральная Швеция, Blekinge | 56°20'N, 14°34'E | ter Schure et al., 2002 |
| Швеция | Южная Швеция, Lund | 55°40'N, 13°30'E | ter Schure et al., 2002 |
| Польша | Olsztyna (Ольштын) | 54°'N, 20°E | Tomasik, 1971 |
| Франция | юго-зап. Франция, Страна Басков | 43°18 N, 01°30 W | Vignes, 2010 |
| Россия | Северное Предуралье | Ануфриев, Бобрецов,1996 |
Наблюдения
Географическая изменчивость средних для популяций значений возраста и длины тела
Географическая изменчивость возраста
Средние для популяций значения возраста увеличиваются по мере уменьшения длительности сезона активности – и у самок, и у самцов (рис. 1) между этими величинами наблюдается сильная отрицательная корреляция (табл. 2). Изменение средних возрастов с увеличением широты происходило сходным образом, однако их корреляция была не такой сильной, хотя также достоверной (табл. 2). Это различие объясняется сравнительно невысокой (хотя и достоверной) корреляцией широты и длительности сезона активности, что связано с включением в анализ данных по горным популяциям, местообитания которых находятся в сравнительно низких широтах. Отметим также, что наши данные находятся в пределах выявленного диапазона изменений и в целом сходны с литературными (рис. 1).
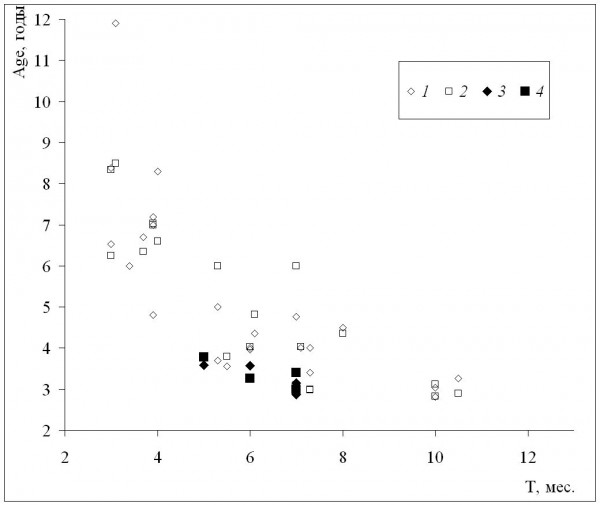
Рис. 1. Зависимость средних для популяций значений возраста (Age) от длительности сезона активности (Т) местообитания данной популяции. 1 – самки, литературные данные, 2 – самцы, литературные данные, 3 – самки, наши данные, 4 – самцы, наши данные
Fig. 1. The dependence of population means of age(Age) on activity season duration (Т) of population habitat. 1 – females, literature data, 2 – males, literature data, 3 – females, our data, 4 – males, our data
Таблица 2. Взаимосвязь характеристик местообитаний популяций травяной лягушки, средних для популяций значений возраста, длины тела и коэффициента Ловича-Гиббонса, согласно литературным и нашим данным. Достоверные различия (p < 0.05) отмечены полужирным шрифтом.
| Коррелирующие характеристики | N | Rs | p | |
| latitude | fem_age | 26 | 0.506 | 0.008 |
| latitude | mal_age | 23 | 0.508 | 0.013 |
| latitude | fem_SVL | 65 | -0.136 | 0.281 |
| latitude | mal_SVL | 51 | 0.045 | 0.755 |
| latitude | age_LGc | 13 | -0.246 | 0.419 |
| latitude | SVL_LGc | 51 | -0.341 | 0.014 |
| latitude | active_period | 73 | -0.560 | 0.000 |
| T | fem_age | 28 | -0.767 | 0.000 |
| T | mal_age | 25 | -0.810 | 0.000 |
| T | fem_SVL | 67 | -0.341 | 0.005 |
| T | mal_SVL | 53 | -0.411 | 0.002 |
| T | age_LGc | 14 | 0.026 | 0.929 |
| T | SVL_LGc | 53 | 0.010 | 0.943 |
| fem_age | mal_age | 25 | 0.935 | 0.000 |
| fem_SVL | mal_SVL | 53 | 0.872 | 0.000 |
| fem_SVL | SVL_LGc | 53 | 0.705 | 0.000 |
| mal_SVL | SVL_LGc | 53 | 0.337 | 0.014 |
| fem_age | fem_SVL | 20 | 0.744 | 0.000 |
| mal_age | mal_SVL | 17 | 0.618 | 0.008 |
Примечание. N – объем выборки, p – уровень значимости.
Географическая изменчивость длины тела
Средние для популяций значения длины тела в отличие от возраста не изменяются столь закономерно с изменением длительности сезона активности (рис. 2) или широты (табл. 2). По мере уменьшения длительности сезона активности наблюдается небольшое увеличение длины тела и у самок, и у самцов (рис. 2), однако при значениях этой длительности, близких к минимальным, размеры особей уменьшаются. Другое отличие от изменений средних возрастов состоит в сильных межпопуляционных различиях при сходных значениях длительности сезона активности, на что указывают также слабая отрицательная (хотя и достоверная) корреляция средней длины тела с длительностью сезона активности и отсутствие достоверной корреляции с географической широтой (табл. 2). Следует также отметить, что максимальные значения средних размеров наблюдали в горных популяциях при значениях длительности сезона активности, далеких от максимального и минимального. Наши данные по среднепопуляционным размерам также в целом сходны с литературными.
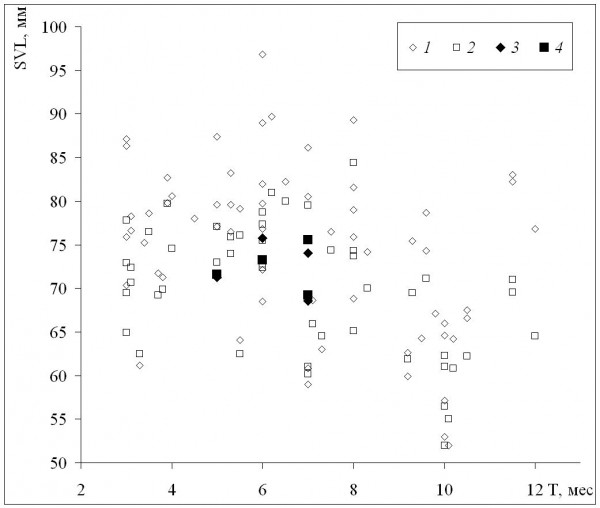
Рис. 2. Зависимость средних для популяций значений длины тела (SVL) от длительности сезона активности (Т). 1 – самки, литературные данные, 2 – самцы, литературные данные, 3 – самки, наши данные, 4 – самцы, наши данные
Fig. 2. The dependence of population means of body length (SVL) on activity season duration (Т). 1 – females, literature data, 2 – males, literature data, 3 – females, our data, 4 – males, our data
При сопоставлении средних значений длины тела и возраста может быть получена оценка масштабов географической изменчивости обеих этих характеристик. У самок (рис. 3) наблюдалось быстрое увеличение средних размеров в диапазоне средних возрастов приблизительно от 3 до 5 лет, а по мере дальнейшего «старения» средние размеры немного уменьшались. Сходная картина наблюдалась и у самцов (рис. 4), с той лишь разницей, что максимальные значения средних размеров соответствовали более старшему возрасту (6–7 лет). Выявленная форма зависимости подтверждает, что особи, относящиеся к популяциям из местообитаний со сравнительно низкими значениями длительности сезона активности и со средними возрастами, близкими к максимальным значениям, и особи со средними возрастами, близкими к максимальным значениям, не достигают максимально крупных размеров.
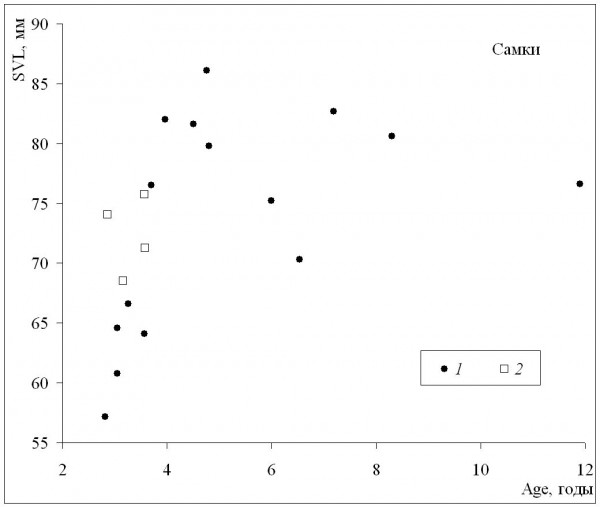
Рис. 3. Зависимость средних для популяций значений длины тела (SVL) от средних для популяций значений возраста (Age) у самок. 1 – литературные данные, 2 – наши данные
Fig. 3. The dependence of population means of body length (SVL) on population means of age(Age) in females. 1 – literature data, 2 – our data
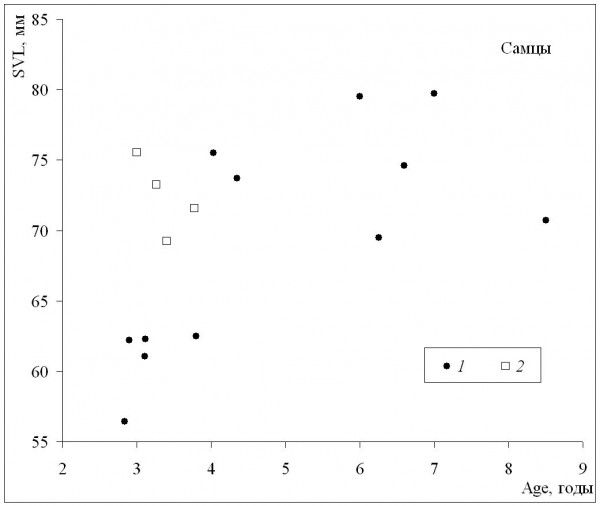
Рис. 4. Зависимость средних для популяций значений длины тела (SVL) от средних для популяций значений возраста (Age) у самцов. 1 – литературные данные, 2 – наши данные
Fig. 4. The dependence population means of body length (SVL) on population means of age(Age) in males. 1 – literature data, 2 – our data
Оценка темпов роста по достижении половой зрелости у особей из различных популяций возможна лишь при наличии данных по средним для каждого возраста значениям размеров. Такие данные встречаются в литературе сравнительно редко, и все результаты известных нам исследований, наряду с нашими данными, представлены в табл. 3. Согласно нашим данным, максимальными темпами роста характеризуются и самки, и самцы Брянска, хотя у другой южной популяции со сходной длительностью сезона активности (7 мес., Минск) темпы роста существенно ниже, и средние размеры в каждом из возрастов сходны с таковыми более северной популяции, у которой длительность сезона активности меньше на 2 мес. Сходные результаты наблюдались и при сравнении с литературными данными. Максимальными значениями средней длины тела в возрасте 2, 3 и 4 лет характеризовались особи из популяции итальянских Альп (Guarino et al., 2008) со сходной длительностью сезона активности (7 мес.), от которых лишь немного отставали особи из другой альпийской популяции (с длительностью сезона активности 8 мес.). Сравнительно низкие значения средней длины тела в каждом из возрастов (кроме возраста первого размножения) были у особей из более северных и высокогорных популяций (с длительностью сезона активности менее 7 мес.). Вместе с тем минимальными значениями средней длины тела в каждом из возрастов характеризовались особи южных популяций с наибольшими значениями длительности сезона активности (10–10.5 мес.). Следовательно, несмотря на максимальную длительность сезона активности, условия роста травяных лягушек в популяциях юго-западной части ареала далеки от оптимальных.
Таблица 3. Географическая изменчивость и возрастные различия длины тела (SVL, мм) половозрелых особей травяной лягушки.
| Популяция | Т, мес. | Возраст, годы | 2 | 3 | 4 | 5 | 6 | Все возраста | Источник |
| Западная Ирландия, | SVL♂ | 61 | 63 | 66 | 67 | 66 | 62.2 | Gibbons, McCarthy, 1984* | |
| Clare | 10.5 | SVL♀ | 58 | 66 | 68 | 71 | 73 | 66.6 | |
| Восточная Франция, | SVL♂ | 55.8 | 61.2 | 64.2 | 62,27 | Augert, Joly, 1993 | |||
| Servotte | 10 | SVL♀ | 59.7 | 66.5 | 69.6 | 64.57 | |||
| Восточная Франция, | SVL♂ | 51.8 | 59.9 | 61.0 | 57.16 | Augert, Joly, 1993 | |||
| Thevenon | 10 | SVL♀ | 53.4 | 59.9 | 63.0 | 56.45 | |||
| Швейцария, Берн, | SVL♂ | 66 | 70 | 73 | 78 | 79 | 73.7 | Ryser, 1996 | |
| 600 м н. у. м. | 8 | SVL♀ | 68 | 72 | 78 | 87 | 89 | 81.6 | |
| Северная Италия, RocciavreNatural | SVL♂ | 64.96 | 73.73 | 80.43 | 80.71 | 82.98 | 79.5 | Guarino et al., 2008 | |
| Park, 1250 м н. у. м. | 7 | SVL♀ | 67.90 | 79.86 | 81.83 | 77.10 | 96.80 | 86.1 | |
| Минск | 7 | SVL♂ | 62.25 | 68.96 | 72.58 | 70.67 | 69.23 | наши данные | |
| SVL♀ | 63.43 | 68.48 | 72.54 | 77.00 | 68.54 | ||||
| Брянск | 7 | SVL♂ | 68.15 | 76.17 | 81.85 | 74.05 | наши данные | ||
| SVL♀ | 66.29 | 76.86 | 81.22 | 75.56 | |||||
| ЗБС | 7 | SVL♂ | 69.05 | 73.44 | 77.17 | 80.28 | 80.41 | 73.27 | наши данные |
| SVL♀ | 69.52 | 73.78 | 79.58 | 83.66 | 85.59 | 75.74 | |||
| Центральная Швеция, Umea | 5.3 | SVL♀ | 78 | 79 | 85 | 82 | 76.5 | Elmberg, 1991 ** | |
| Киров | 5 | SVL♂ | 65.07 | 69.94 | 72.17 | 76.05 | 77.97 | 71.59 | наши данные |
| SVL♀ | 63.00 | 68.10 | 74.39 | 78.34 | 84.77 | 71.29 | |||
| Швейцария, Альпы, | SVL♂ | 68 | 72 | 75 | 74.6 | Ryser, 1996 | |||
| 1930 м н. у. м. | 4 | SVL♀ | 73 | 76 | 80.6 | ||||
| Центральная Швеция, Ammarnas | 3.9 | SVL♀ | 62 | 77 | 80 | 78 | 79.8 | Elmberg, 1991 ** | |
| Центральная Швеция, Kraipe | 3.4 | SVL♀ | 72 | 77 | 75.2 | Elmberg, 1991 ** | |||
| Северная Финляндия, | SVL♂ | 62 | 68 | 70 | 75 | 70.7 | Patrelle et al., 2012 | ||
| Kilpisjarvi | 3.1 | SVL♀ | 59 | 76 | 78 | 76.6 | |||
| Франция, Альпы, | SVL♂ | 70 | 72 | 74 | 77.8 | Miaud et al., 1999 | |||
| 2300 м н. у. м. | 3 | SVL♀ | 82 | 84 | 86.3 |
Примечания. Т – длительность сезона активности, * – в оригинальных публикациях данные в тексте или таблицах не приведены, для этой таблицы приблизительные значения взяты из рисунков, ** – данные по самцам не приводятся
Географическая изменчивость половых различий по возрасту и длине тела
Половые различия по возрасту и закономерности их географической изменчивости
Среднепопуляционные значения возраста самцов и самок (рис. 5) были, как правило, сходными во всем диапазоне значений возрастов. Сильные различия между полами наблюдались редко, также во всем диапазоне значений возрастов, и проявлялись чаще как преимущество самок. Величина коэффициента Ловича-Гиббонса не зависела ни от длительности сезона активности, ни от широты (табл. 2), что также указывает на более сильную зависимость направленности половых различий по возрасту от локальных условий, а не от направленных изменений в масштабах всего ареала. Согласно нашим данным, достоверных половых различий не выявлено в двух более южных популяциях, самки популяции ЗБС были достоверно старше самцов (по критерию Манна-Уитни: Z = 4.65; p < 0.00), а самцы Кирова – достоверно старше самок (Z = ‒2.20; p < 0.02).
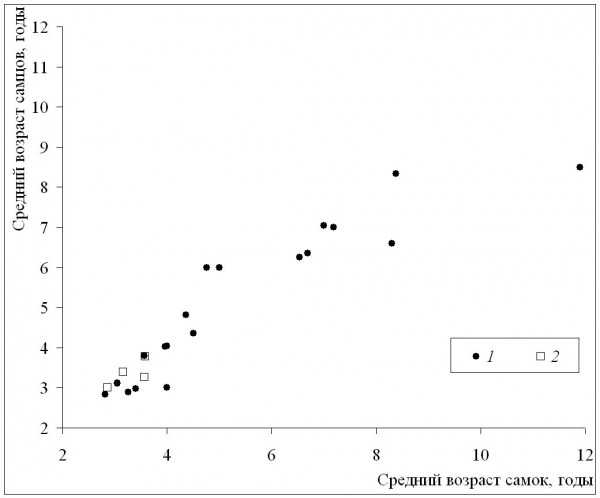
Рис. 5. Половые и межпопуляционные различия по среднему возрасту. 1 – литературные данные, 2 – наши данные
Fig. 5. Sexual and among-population differences in mean age. 1 – literature data, 2 – our data
Половые различия по длине тела и закономерности их географической изменчивости
Среднепопуляционные значения длины тела самок были сходными с таковыми самцов в диапазоне размеров самок от минимума до значения 72 мм, а у всех популяций с более крупными самками наблюдалось преимущество самок (рис. 6). Это означает, что при оптимальных условиях темпы роста самок выше, чем у самцов (при сходных значениях среднего возраста у обоих полов), что подтверждается также более сильной взаимосвязью коэффициента Ловича – Гиббонса (табл. 2) со средней длиной тела самок (рис. 7), в сравнении со средней длиной тела самцов (рис. 8). Однако, как уже отмечалось, эти оптимальные условия не соответствуют каким-либо определенным значениям в диапазоне изменений длительности сезона активности: высокие значения коэффициента Ловича – Гиббонса наблюдались как при низких, так и при высоких значениях длительности сезона активности (рис. 9), а корреляция двух этих характеристик была недостоверной (табл. 2). Не вполне понятным остается наличие достоверной отрицательной корреляции коэффициента Ловича – Гиббонса с широтой (табл. 2).
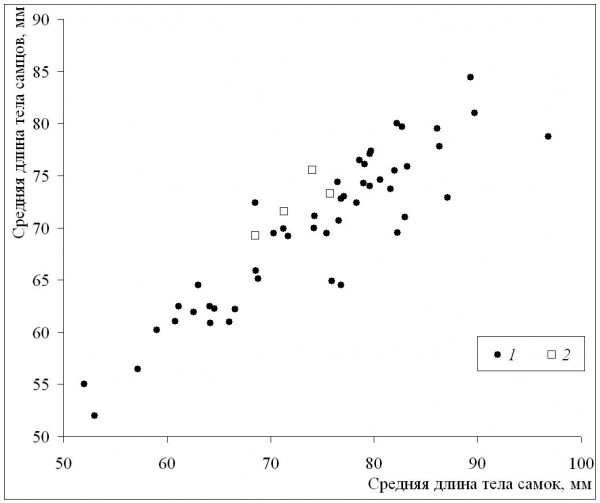
Рис. 6. Половые и межпопуляционные различия по средней длине тела. 1 – литературные данные, 2 – наши данные
Fig. 6. Sexual and among-population differences in mean body length. 1 – literature data, 2 – our data
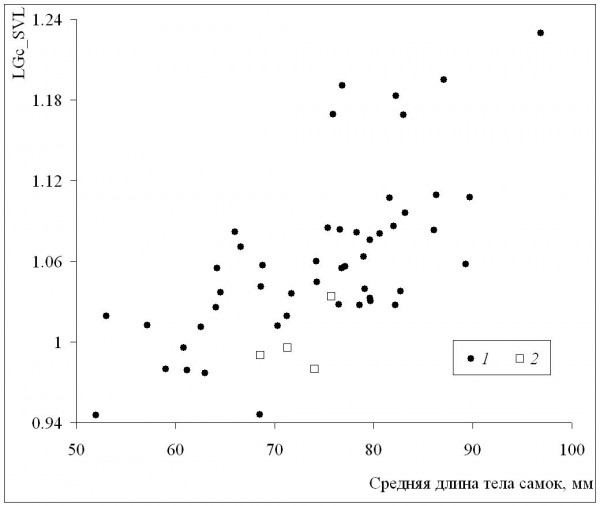
Рис. 7. Зависимость коэффициента Ловича-Гиббонса (LGc_SVL) от длины тела самок. 1 – литературные данные, 2 – наши данные
Fig. 7. The dependence of Lovich-Gibbons coefficient (LGc_SVL) on female body length. 1 – literature data, 2 – our data
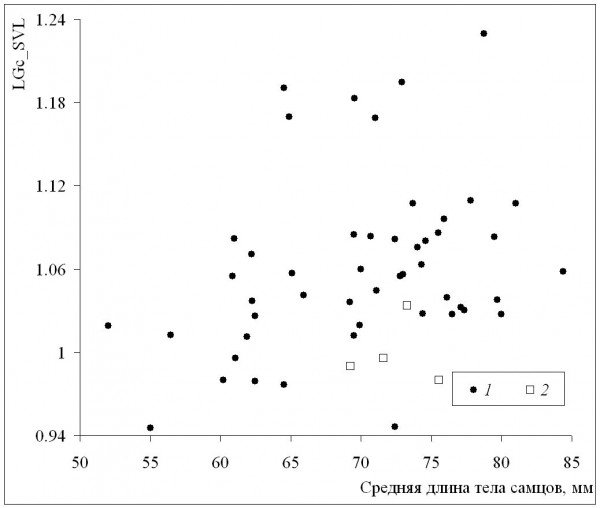
Рис. 8. Зависимость коэффициента Ловича – Гиббонса (LGc_SVL) от длины тела самцов. 1 – литературные данные, 2 – наши данные
Fig. 8. The dependence of Lovich-Gibbons coefficient (LGc_SVL) on male body length. 1 – literature data, 2 – our data
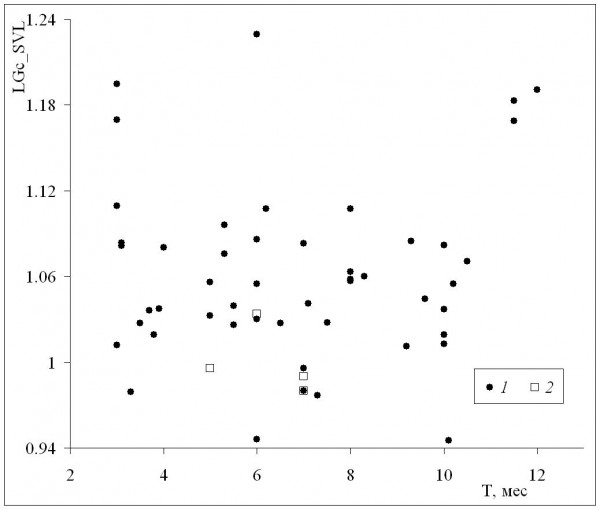
Рис. 9. Зависимость коэффициента Ловича – Гиббонса (LGc_SVL) от длительности сезона активности (Т). 1 – литературные данные, 2 – наши данные
Fig. 9. The dependence of Lovich-Gibbons coefficient (LGc_SVL) on activity season duration (Т). 1 – literature data, 2 – our data
Следует также отметить, что, согласно формальному определению (Blanckenhorn et al., 2006), более высокая межпопуляционная изменчивость длины тела выявлена у самок. В линейной модели lg(fem_SVL) =a + b × lg(mal_SVL) (где fem_SVL – средняя длина тела самок, mal_SVL – средняя длина тела самцов) значение b составило 1,161, другими словами, длина тела самок увеличивается быстрее, чем у самцов.
Закономерности
Географическая изменчивость возрастного состава и ее вклад в различия между популяциями по длине тела
Закономерности географической изменчивости возраста
И у самцов, и у самок средние для популяций значения возраста по мере уменьшения длительности сезона активности увеличиваются, т. е. изменяются направленно. Это означает, что при продвижении на север или с увеличением высоты местности происходит не только направленное увеличение возраста первого размножения, но и увеличение в возрастном составе доли старших возрастов, что было особенно четко показано при исследовании 11 скандинавских популяций травяной лягушки (Hjernquist et al., 2012). Авторы названного исследования также разделяют общепринятое мнение, согласно которому такое изменение возрастного состава возможно лишь при условии более высокой ежегодной выживаемости, не только до достижения половой зрелости, но и после каждого последующего размножения. Причины этой более высокой выживаемости не выявлены, но, предположительно, они связаны с меньшим прессом хищников в местообитаниях северных или горных популяций (Hjernquist et al., 2012; Patrelle et al., 2012). Следует также отметить, что более сильная корреляция средних возрастов с длительностью сезона активности, чем с широтой указывает на большее значение климатической температуры, а не других факторов среды (например, фотопериод), связанных с собственно широтой местности.
Кроме направленного увеличения среднего возраста с уменьшением длительности сезона активности происходит, как уже отмечалось, увеличение возраста первого размножения, а также максимальной продолжительности жизни, причем эта закономерность была выявлена не только для травяной (Miaud et al., 1999; Ляпков и др., 2009; Hjernquist et al., 2012), но и для остромордой лягушки (Ishchenko, 1996; Ляпков и др., 2010).
Закономерности географической изменчивости длины тела с учетом изменчивости возрастного состава
Выявленный ранее нелинейный характер зависимости среднепопуляционных размеров от широты травяных лягушек скандинавских популяций (Laugen et al., 2005; Hjernquist et al., 2012) проявляется, согласно нашему исследованию, и на большем протяжении ареала вида. Анализ различий по темпам роста северных и южных популяций позволяет считать главной причиной сравнительно мелких размеров особей из популяций с минимальной длительностью сезона активности сильное снижение темпов роста (по сравнению с особями из популяций с большей длительностью сезона активности), которое не компенсируется увеличением среднего возраста до максимальных значений. Вероятно, главной причиной такого сильного замедления роста является перераспределение ресурсов для запасания резервных веществ, необходимых для переживания длительной зимовки, длящейся до 9 мес. (Jonsson et al., 2009).
Менее понятны причины сильного замедления роста у особей из южных популяций с длительностью сезона активности, близкой к максимальной. Можно предположить, что в течение этого сезона благоприятные для роста условия непостоянны и чередуются с менее благоприятными, засушливыми, условиями. Известно, например, что в равнинных популяциях травяной лягушки северной Испании и прилегающей территории Франции нерест сильно растянут: его начало связано с сезоном дождей в октябре, наибольшая активность икрометания приходится на конец ноября – начало декабря, и нерест длится до конца февраля или начала марта (Gosa, 1998; Vignes, 2010). Отметим также, что такое сильное замедление роста присуще далеко не всем южным популяциям: высоким значениям длительности сезона активности могут соответствовать не только малые, но и большие значения средней длины тела (рис. 2), что, с учетом низких значений средних возрастов, указывает на наличие не только низких, но и высоких значений средних для популяций темпов роста. Тенденция к увеличению изменчивости темпов роста была выявлена нами в популяциях Минска и Брянска (Ляпков, 2008), местообитания которых находятся в сравнительно высоких широтах (T = 7 мес.).
Следует отметить, что одно из первых описаний случаев нелинейного изменения с широтой размеров бесхвостых амфибий и змей принадлежит П. В. Терентьеву, и он же предложил для таких случаев название «правило оптимума» (Терентьев, 1950).
В связи с выявлением соответствия изменчивости длины тела некоторых видов бесхвостых амфибий правилу Бергмана была предложена простая графическая модель, объясняющая условия выполнения и не выполнения этого правила. Эта модель (Liao, Lu, 2011) рассматривает соотношение возраста и длины тела при первом размножении и предсказывает, что при увеличении широты, в случае сравнительно слабого замедления роста, размеры при наступлении половой зрелости будут превышать таковые у особей более южных популяций, однако при сильном замедлении роста соотношение изменится на противоположное. Эту модель, во многом сходную с нашим объяснением, можно рассматривать как более общую, т. е. допустить, что первоначально с увеличением широты будет наблюдаться сравнительно слабое замедление роста, а затем – более сильное. Отметим, что в отличие от предложенного нами объяснения эта модель не учитывает возможное увеличение среднего возраста по мере увеличения широты, т. е. сокращения длительности сезона активности.
Географическая изменчивость направленности и выраженности половых различий
Половые различия по возрасту и закономерности их географической изменчивости
Выявленная нами общая тенденция сильного преобладания самок по средним возрастам в популяциях из местообитаний с самым низким значением длительности сезона активности подтверждается исследованиями скандинавских популяций. В трех из этих популяциях, местообитания которых расположены в самых высоких широтах, самки были старше самцов, в более южных – эта тенденция становилась менее выраженной (Hjernquist et al., 2012; Patrelle et al., 2012). На основании сравнительно несильной выраженности половых различий по среднему возрасту у особей из большинства популяций, кроме самых северных, можно заключить, что устойчивые и сильные половые различия, наблюдаемые при низких значениях Т, связаны с существенно более поздним возрастом первого размножения самок по сравнению с самцами (Hjernquist et al., 2012; Patrelle et al., 2012). Еще одним важным фактором, обусловливающим сильные половые различия, может быть более высокая смертность самцов из этих северных популяций, однако убедительных свидетельств в пользу такого предположения не существует. В исследованной нами популяции ЗБС выживаемость взрослых самок и самцов травяной лягушки была сходной (Ляпков и др., 2004), в популяциях других видов бурых лягушек сильных половых различий также не выявлено (обзор см.: Ляпков и др., 2004).
Половые различия по длине тела и закономерности их географической изменчивости
Согласно данным по скандинавским популяциям (Hjernquist et al., 2012), «темпы скелетного роста», т. е. оценки скорости роста, полученные на основании промеров линий склеивания на срезах фаланг пальцев задних конечностей, были достоверно выше у самцов. Предположив, что «скелетный рост» соответствует росту тела, авторы сделали вывод о более высоких темпах роста тела самцов и далее объяснили бóльшие средние значения длины тела самок из популяций высоких широт их сильным преобладанием по средним возрастам. Однако более быстрые темпы роста трубчатых костей у самцов, в сравнении с самками, не являются основанием для утверждения о более быстром росте тела. Причина в том, что отделы задних конечностей относительно длиннее и имеют относительно больший диаметр составляющих их трубчатых костей у самцов, несмотря на меньшую длину тела самцов, в сравнении с самками (Ляпков и др., 2004, 2004а).
Величина темпов роста самцов и самок может изменяться в зависимости от возраста даже в пределах одной популяции. Так, согласно результатам обратного расчисления длины тела (Ляпков, 2008; Ляпков и др., 2009), в возрасте одного года самцы всех четырех исследованных нами популяций были в среднем крупнее самок. По мере дальнейшего роста самки популяций ЗБС и Кирова постепенно обгоняли в размерах самцов и становились заметно крупнее в возрасте 3 или 4 лет, причем только в популяции ЗБС самки были достоверно крупнее самцов, поскольку в отличие от популяции Кирова самки популяции ЗБС были достоверно старше самцов. Самки двух южных популяций (Минска и Брянска) в возрасте 2 и 3 лет лишь догоняли, но не обгоняли самцов, и в итоге самцы были в среднем ненамного (и недостоверно) крупнее самок. Таким образом, как уже отмечалось, только у популяции ЗБС самки достоверно отличались от самцов более крупными размерами. В популяции Кирова половых размерных различий не было выявлено, а в двух южных популяциях самцы были ненамного (и недостоверно) крупнее самок.
Высокие темпы роста до достижения половой зрелости, вероятно, обеспечивают преимущество самцам уже при первом их размножении. Такой эффект полового отбора, несомненно, должен проявляться в той или иной степени в пределах всего ареала вида. В более старших возрастах самки, на которых влияет отбор на увеличение плодовитости, могут становиться крупнее самцов. Отсутствие общей закономерности географической изменчивости половых различий по темпам роста проявляется в том, что половые различия по длине тела в различных частях ареала ненаправленны или выражены слабо. В дополнение к материалам, приведенным на рисунках 6–9, следует упомянуть и другие литературные данные (которые не были проанализированы количественно из-за отсутствия информации о величине Т). Средние значения длины тела больше у самок, чем у самцов на Полярном Урале (Топоркова, Зубарева, 1965), в южной Швеции (Loman, 1978), в Мордовии (самки: 71.84 мм, самцы: 68.94 мм – М. К. Рыжов, личн. сообщ.), однако не различаются в Прикарпатье и Закарпатье (Щербак, Щербань, 1980).
Очевидно, что закономерное изменение выраженности половых различий представляет собой, скорее, исключение из правила. Нам известна только одна выполненная на бесхвостых амфибиях работа, в которой показано направленное увеличение с широтой половых различий по длине тела. У двух видов австралийских лягушек, Limnodynastes tasmaniensis и L. peronii, была выявлена различная направленность половых различий по длине тела: у первого из двух видов самки крупнее самцов, у второго – мельче. Однако у каждого из этих видов коэффициент Ловича – Гиббонса достоверно увеличивался с широтой, причем у вида L. tasmaniensis по мере увеличения широты наблюдался переход от приблизительно равных размеров полов к более крупным самкам (Schäuble, 2004). Отметим, что такое изменение выраженности полового диморфизма только в случае L. tasmaniensis соответствует объяснению на основе графической модели, предложенной в работе Бланкенхорна с соавт. (Fig. 1C – Blanckenhorn et al., 2006). На этом рисунке приводится 2 варианта: увеличение размеров с широтой, согласно правилу Бергмана, и их уменьшение, против правила Бергмана. По нашему мнению, в случае травяной лягушки следует использовать оба варианта, поскольку по мере увеличения широты сначала происходит увеличение размеров, а после достижения максимума – их уменьшение. Как уже отмечалось, с помощью анализа литературных данных нами было показано, что у травяной лягушки самки являются полом с более изменчивой длиной тела. Поэтому следует ожидать увеличения половых различий по мере увеличения размеров тела у особей обоих полов, а затем – уменьшения этих различий. Однако имеющиеся у нас литературные данные (рис. 9) указывают скорее на противоположный характер изменений: половые различия могут быть максимально выражены на юге и севере и менее выражены в центральной части ареала. Это также указывает на сравнительно редкое соответствие характера географической изменчивости половых различий правилу Ренша.
Заключение
В целом предложенное нами объяснение нелинейного изменения среднепопуляционных значений длины тела не противоречит предложенным ранее моделям, объясняющим соответствие и несоответствие такой изменчивости правилу Бергмана, а также соответствует выявленным особенностям географичекой изменчивости по темпам роста. Отсутствие направленной изменчивости и наличие максимума вблизи центральной части ареала травяной лягушки – следствие высоких темпов роста в сочетании со сравнительно высоким средним возрастом. Вместе с тем сравнительно небольшие размеры особей из популяций вблизи южной (юго-западной) границы ареала вида объясняются, кроме низких значений среднего возраста, также сравнительно низкими темпами их роста, несмотря на большую длительность сезона активности.
Кроме того, нами показано, что географическая изменчивость размеров для каждого из полов не зависит от направленности и выраженности половых различий у травяной лягушки. Географическая изменчивость половых различий по размерам обусловлена различиями не только в темпах роста, но и в возрастном составе, как между популяциями, так и внутри каждой из них. Поэтому направленность и выраженность половых различий не имеет четко выраженных закономерностей, а правило Ренша, в отличие от правила Бергмана, обычно не выполняется. Вероятно, выявленное разнообразие направленности половых различий является причиной того, что и у многих других видов эктотермных позвоночных правило Ренша выполняется сравнительно редко (обзор см.: Blanckenhorn et al., 2006).
Библиография
Ануфриев В. М., Бобрецов А. В. Амфибии и рептилии. Фауна европейского Северо-Востока России. Т. IV. СПб.: Наука, 1996. 130 с.
Глотов Н. В., Животовский Л. А., Хованов Н. В., Хромов-Борисов Н. Н. Биометрия. Л.: Изд-во ЛГУ, 1982. 264 с.
Ищенко В. Г. Динамический полиморфизм бурых лягушек фауны СССР. М.: Наука, 1978. 148 с.
Кутенков А. П. Экология травяной лягушки на Северо-Западе России. Петрозаводск: Изд-во ПетрГУ, 2009. 140 с.
Ляпков С. М. Географическая и возрастная изменчивость полового диморфизма по длине тела и темпам роста бурых лягушек // Вопросы герпетологии. Матер. 3-го Съезда герпетологического общества им. А. М. Никольского. Пущино; Москва, 2008. С. 262-267.
Ляпков С. М., Корнилова М. Б., Северцов А. С. Структура изменчивости репродуктивных характеристик травяной лягушки (Rana temporaria L.) и их взаимосвязь с размерами и возрастом // Зоол. журн. 2002. Т. 81. № 6. С. 719-733.
Ляпков С. М., Корнилова М. Б., Северцов А. С. Демографические характеристики и динамика численности популяции травяной лягушки (Rana temporaria L.) // Зоол. журн. 2002. Т. 81. № 10. С. 1251-1259.
Ляпков С. М., Корнилова М. Б., Северцов А. С. Факторы, влияющие на репродуктивный успех самцов травяной лягушки (Rana temporaria). 1. Демографические и морфометрические характеристики // Зоол. журн. 2004. Т. 83. № 11. С. 1375-1386.
Ляпков С. М., Корнилова М. Б., Северцов А. С. Факторы, влияющие на репродуктивный успех самцов травяной лягушки (Rana temporaria). 2. Связь морфометрических особенностей самцов с их репродуктивным успехом // Зоол. журн. 2004а. Т. 83. № 12. С. 1448-1462.
Ляпков С. М., Корнилова М. Б., Сербинова И. А., Корзун Е. В., Новицкий Р. В. Формирование направленной географической изменчивости особенностей жизненного цикла бурых лягушек // Современная герпетология. 2009. Т. 9. Вып. 3/4. С. 103–121.
Ляпков С. М., Корнилова М. Б., Марченковская А. А., Мисюра А. Н., Гассо В. Я. Особенности возрастного состава, размерных половых различий и репродуктивных характеристик у остромордой лягушки в южной части ареала // Герпетологические исследования в Казахстане и сопредельных странах: сб. ст. Алматы, 2010. С. 150–165.
Ляпков С. М., Черданцев В. Г., Черданцева Е. М. Половые различия темпов роста и выживаемости у остромордой лягушки (Rana arvalis) после завершения метаморфоза // Зоол. журн. 2007. Т. 86. № 4. С. 475-491.
Ляпков С. М., Черданцев В. Г., Черданцева Е. М. Географическая изменчивость полового диморфизма остромордой лягушки (Rana arvalis) как результат различия репродуктивных стратегий // Журн. общ. биол. 2010a. Т. 71. № 4. С. 337-358.
Смирина Э. М. Годовые слои в костях травяной лягушки // Зоол. журн. 1972. Т. 51. № 10. С. 1529-1534.
Смирина Э. М. Прижизненное определение возраста и ретроспективная оценка размеров тела серой жабы (Bufo bufo) // Зоол. журн. 1983 Т. 62. №. 3. С. 437 – 444.
Терентьев П. В. Влияние климатической температуры на размеры змей и бесхвостых земноводных // Бюлл. МОИП. Отд. биол. 1951. Т. 56. № 2. С. 14-23.
Топоркова Л. Я., Зубарева Э. Л. Материалы по экологии травяной лягушки на Полярном Урале // Тр. Ин-та биологии. УФ АН СССР. 1965. Вып. 38. С. 189-194.
Щербак Н. Н., Щербань М. И. Земноводные и пресмыкающиеся Украинских Карпат. Киев: Наукова думка, 1980. 268 с.
Adams D. C., Church J. O. Amphibians do not follow Bergmann’s rule // Evolution. 2008. Vol. 62 N 2. P. 413–420.
Angilletta, M. J., Niewiarowski P. H., Dunham A. E., Leache A. D., Porter W. D.. Bergmann’s clines in ectotherms: illustrating a life-history perspective with sceloporine lizards // Am. Nat. 2004. Vol. 164. P. E168–E183.
Angilletta M. J., Steury T. D., Sears M.W. Temperature, growth rate, and body size in ectotherms: Fitting pieces of a life-history puzzle // Integ. Comp. Biol. 2004a. Vol. 44. P. 498–509.
Ashton K. G. Do amphibians follow Bergmann’s rule? Can. J. Zool. 2002. Vol. 80. P. 708–716.
Ashton K. G., Feldman C. R. Bergmann’s rule in nonavian reptiles: turtles follow it, lizards and snakes reverse it // Evolution. 2003. Vol. 57. P. 1151-1163.
Augert D., Joly P. Plasticity of age at maturity between two neighbouring populations of the common frog (Rana temporaria L.) // Can. J. Zool. 1993. Vol. 71. N 1. P. 26-33.
Bancila R. I., Plaiasu R., Cogalniceanu D. Effect of latitude and altitude on body size in the common frog (Rana temporaria) populations // Studiisi Cercetari, Biologie. 2009. Vol. 17. P. 43-46.
Beattie R. C. The reproductive biology of common frog (Rana temporaria) populations from different altitudes in northern England // J. Zool. 1987. Vol. 211. P. 387-398.
Blackburn T. M., Gaston K. J., Loder N. Geographic gradients in body size: a clarification of Bergmann’s rule. Diversity and Distributions. 1999. Vol. 5. P. 165–174.
Blanckenhorn W. U., Stillwell R. C., Young K. A., Fox C. W., Ashton K. G. When Rensch meets Bergmann: does sexual size dimorphism change systematically with latitude? // Evolution. 2006. Vol. 60. N 10. P. 2004-2011.
Cummins C. P. Temporal and spatial variation in egg size and fecundity in Rana temporaria // J. Anim. Ecol. 1986. Vol. 55. P. 303-316.
Cvetkovic D., Tomasevic N., Ficetola G. F., Crnobrnja-Isailovic J., Miaud C. Bergmann’s rule in amphibians: combining demographic and ecological parameters to explain body size variation among populations in the common toad Bufo bufo // J. Zool. Syst. Evol. Res. 2008. Vol. 47. N 2. P. 171-180.
Elmberg J. Random mating in a boreal population of European common frogs Rana temporaria // Hol. Ecol. 1987. Vol. 10. P. 193-195.
Elmberg J. Ovarian cyclicity and fecundity in boreal common frogs Rana temporaria L. along a climatic gradient // Funct. Ecol. 1991. Vol. 5. P. 340-350.
Ficetola G. F., Scali S., Denoël M., Montinaro G., Vukov T. D., Zuffi M. A. L., Padoa-Schioppa E. Ecogeographical variation of body size in the newt Triturus carnifex: comparing the hypotheses using an information-theoretic approach // Global Ecology and Biogeography. 2010. Vol. 19. P. 485-495.
Geisselmann B., Flindt R., Hemmer, H. Studien zur Biologic, Okologie und Merkmalsvariabilitat der beiden Braunfroscharten Rana temporaria L. und Rana dalmatina Bonaparte // Zool. Jb. Syst. 1971. Vol. 98. P. 521-568.
Gibbons M. M., McCarthy T. K. Growth, maturation and survival of frogs Rana temporaria L. // Hol. Ecol. 1984. Vol. 7. N 4. P. 419-427.
Gibbons M. M., McCarthy T. K. The reproductive output of frogs Rana temporaria (L.) with particular reference to body size and age // J. Zool. 1986. Vol. A209. N 4. P. 579-593.
Glandt D., Jehle R. (Hrsg) Der Moorfrosch, Rana arvalis Nilsson 1842. Aktuelles aus Forschung und Schutzpraxis // Zeitschrift für Feldherpetologie. Supplement. 2008. Bd. 13. 496 S.
Glandt D. Taschenlexikon der Amphibien und Reptilien Europas. Wiebelsheim: Quelle & Meyer Verlag, 2009. 636 p.
Gosa A. El declive de una poblacion costera cantabricade Rana bermeja (Rana temporaria) // Munibe. 1998. N 59. P. 59-71.
Guarino F. M., Di Giа I. Sindaco R. Age structure in a declining population of Rana temporaria from northern Italy // Acta Zoologica Academiae Scientiarum Hungaricae. 2008. Vol. 54. N 1. P. 99-112.
Guyetant, R., Brosse, S., Herold, J.-P., Pinston, H. Etude de la croissance et du developpement de Grenouilles rousses Rana temporaria L. en altitude (Alpes du nord) // C.R. Seances Soc. Biol. 1988. Vol. 182. P.301-307.
Guyetant, R., Miaud, C., Battesti, Y., Nelva, A. Caracteristiques de la reproduction chez la Grenouille rousse Rana temporaria L. (Amphibia, Anura) en altitude (Massif de la Vanoise, Alpes du Nord, France) // Bull. Soc. Herpetol. Fr. 1995 Vol. 71-72. P. 13-21.
Heusser H. Ansiedlung, Ortstreue und Populationdynamik des Grasfrosches (Rana temporaria) an einem Gartenweiher // Salamandra/ 1970. Vol. 6. P. 80-87.
Hjernquist M. B., Soderman F, Jonsson K. I., Herczeg G., Laurila A., Merilä J. Seasonality determines patterns of growth and age structure over a geographic gradient in an ectothermic vertebrate // Oecologia. 2012 Vol. 169.
Ishchenko V.G. Problems of demography and declining populations of some euroasiatic brown frogs // Russian J. Herpetol. 1996. Vol. 3. N 2. P. 143–151.
Joly P. Variation in size and fecundity between neighbouring populations in the common frog, Rana temporaria // Alytes. 1991. Vol. 9. N 3. P. 79-88.
Jonsson K. I., Herczeg G., O’Hara R. B., Soederman F., ter Schure A. F. H., Larsson P., Merila J. Sexual patterns of prebreeding energy reserves in the common frog Rana temporaria along a latitudinal gradient // Ecography. 2009. Vol. 32. N 5. P. 831-839.
Juszczyk W., Krawczyk S., Zakrzewski M., Zamachowski W., Zysk A. Morphometric structure of population of Rana temporaria (L.), hibernating together with other amphibians in aquatic environment // Acta Biol. Cracov., Ser.Zool. 1984. Vol. 26. P. 39-50.
Kminiak M. Biometrische Untersuchungen der Populationen einiger Amphibienarten auf dem Gebiet Spisska Magura // Zool. Listy 1971. Vol. 20. P. 29-38.
Koskela P., Pasanen S. The wintering of the common frog, Rana temporaria L., in northern Finland // Aquilo. Ser. Zool. 1974. Vol. 15. P. 1-17.
Kozlowska M. Differences in the reproductive biology of mountain and lowland common frogs, Rana temporaria L // Acta Biol. Cracov., Ser.Zool. 1971. Vol. 14. N 1. P. 17-32.
Laugen A. T., Laurila A., Jönsson K. I., Fredrik F., Merilä J. Do common frogs (Rana temporaria) follow Bergmann’s rule? // Evolutionary Ecology Research. 2005. Vol. 7. P. 717-731.
Liao W., Lu X.. Adult body size = f (initial size + growth rate x age): explaining the proximate cause of Bergman’s cline in a toad along altitudinal gradients // Evol. Ecol. 2011. Vol. 25. P. 1-12.
Loman J. Growth of brown frogs Rana arvalis Nilsson and R. temporaria L. in South Sweden // Ekol. Pol. 1978. Vol. 26. N 2. P. 287-296.
Lovich J. E., Gibbons J. W. A review of techniques for quantifying sexual size dimorphism // Growth, development and aging. 1992. Vol. 56. N 4. P. 269-281.
Miaud C., Guyetant R. Plasticite et selection sur les traits de vie d'un organisme a cycle vital complexe, la grenouille rousse Rana temporaria (Amphibien: Anoure) // Bull. Soc. zool. Fr. 1998. Vol. 123, No 4. P. 325-344.
Miaud C., Guyetant R., Elmberg J. Variations in life-history traits in the common frog Rana temporaria (Amphibia: Anura): a literature review and new data from the French Alps // J. Zool. 1999. Vol. 249. P. 61-73.
Montori A., Pascual X. Contribucion al estudio de Rana temporaria L. (Amphibia, Ranidae) en Santa Fe Del Monsteny (Barcelona). II. Ciclo biologico // Misc. zool. 1987. Vol. 11. P. 299-307.
Morrison C., Hero J.-M. Geographic variation in life-history characteristics of amphibians: a review // Journal of Animal Ecology. 2003. V.72. P. 270–279.
Navas C. A., James R. S. Sexual dimorphism of extensor carpi radialis muscle size, isometric force, relaxation rate and stamina during the breeding season of the frog Rana temporaria Linnaeus 1758 // J. Exp. Biol. 2007. Vol. 210. P. 715-721.
Neveu A. Incidence of climate on common frog breeding: Long-term and short-term changes // Acta Oecologica. 2009. Vol. 35. P. 671–678.
Olalla-Tarraga, M. A., Rodriguez M. A.. Energy and interspecific body size patterns of amphibian faunas in Europe and North America: anurans follow Bergmann’s rule, urodeles its converse // Glob. Ecol. Biogeogr. 2007. V.16. P. 606–617.
Pasanen S., Koskela P. Seasonal and age variation in the metabolism of the common frog, Rana temporaria L., in northern Finland // Comp. Biochem. Physiol. 1974. Vol. 47A. P. 635-654.
Patrelle C., Hjernquist M.B., Laurila A., Soderman F., Merila J. Sex differences in age structure, growth rate and body size of common frogs Rana temporaria in the subarctic // Polar Biology. 2012. Vol. 35. (on-line first).
Plaiasu R., Bancila R. I., Cogalniceanu D. Body size variation in Rana temporaria populations inhabiting extreme environments // Ovidius University Annals of Natural Sciences. Biology – Ecology Series. 2010 Vol. 14. P. 121-126.
Ryser J. Determination of growth and maturation in the common frog, Rana temporaria, by skeletochronology // J. Zool. 1988. Vol. 216. P. 673-685.
Ryser J. Comparative life histories of a low- and high-elevation population of the common frog Rana temporaria // Amphibia-Reptilia. 1996. Vol. 17. P. 183-195.
Schäuble H. Variation in body size and sexual dimorphism across geographical and environmental space in the frogs Limnodynastes tasmaniensis and L. peronii // Biological Journal of the Linnean Society. 2004. Vol. 82. N 1. P. 39-56.
Schluepmann M. Grasfrosch // Abh. Landesmus. Nafurk. Muenster, 1981. Vol. 4. P. 103-112.
Shine R. Sexual selection and sexual dimorphism in the amphibian // Copeia. 1979. N 2. P. 297-306.
Shine R. Ecological causes for the evolution of sexual dimorphism: a review of the evidence // Quart. Rev. Biol. 1989. Vol. 64. N 4. P. 419-461.
Sztatecsny M., Strondl C., Baierl A., Ries C., Hoedl W. Chin up: are the bright throats of male common frogs a condition-independent visual cue? // Animal Behav. 2010. Vol. 79. N 4. P. 1-8.
ter Schure A. F. H., Larsson P., Merila J., Jonsson K. I. Latitudinal fractionation of polybrominated diphenyl ethers and polychlorinated biphenyls in frogs (Rana temporaria) // Environ. Sci. Technol. 2002. Vol. 36. P. 5057-5061.
Tomasik L. A comparative study on the morphological characters of adult specimens of the grass frog Rana temporaria temporaria Linnaeus, 1758 and moor frog Rana arvalis arvalis Nilsson, 1842 // Acta Zool. Cracov. 1971. Vol. 16. N 3. P. 217-280.
Vignes J.C. Caracteristiques biologiques de la reproduction de la Grenouille rousse (Rana temporaria) dans une population a l’extreme sud-ouest de la France // Munibe. 2010. N 58. P. 131-148
Watt C., Mitchell S., Salewski V. Bergmann’s rule; a concept cluster? // Oikos. 2010. Vol. 119. P. 89-100.
Zhang L., Lu X., 2012 Amphibians live longer at higher altitudes but not at higher latitudes // Biol. J. Linn. Soc. 2012. Vol. 106. N 3. P. 623-632.
Благодарности
Работа выполнена при поддержке грантов РФФИ – БРФФИ № 06-04-81027 и № 10-04- 90042. Автор благодарен М. К. Рыжову и Andre Neveu за любезно предоставленные неопубликованные данные по длине тела травяных лягушек.






 © 2011 - 2024
© 2011 - 2024