Введение
Полиморфные пресноводные виды рыб северного полушария, колонизировавшие водоемы дегляцированных районов в послеледниковый период, являются широко изучаемыми моделями аллопатрических и симпатрических дивергенций, как нишевых адаптаций (Schluter, 1996; Bernatchez, 2004; Østbye et al., 2005, 2006; Kahilainen et al., 2007). Сиг Coregonus lavaretus (L.), наиболее распространенный вид пресноводных рыб Северной Европы, образует множество как аллопатрических, так и симпатрических форм и популяций, различающихся морфологией, стратегиями жизненного цикла, экологическими нишами (Kahilainen et al., 2004, 2006, 2007, 2009, 2014; Østbye еt al., 2005; Kahilainen, Østbye, 2006; Siwertsson еt al., 2008, 2010; Harrod et al., 2010; Præbel et al., 2013 и др.). Корреляция фенотип – окружающая среда признана важным фактором адаптивной радиации (Schluter, 2000). В общем виде считается, что дивергенция у сига происходит как специализация использования ресурсов основных зон водоема пелагиаль (планктон) – литораль (бентос, планктон) – профундаль (бентос). Эти зоны резко различаются условиями: литораль – хорошая освещенность и прогреваемость, большое видовое разнообразие пищевых организмов; профундаль – низкая освещенность, сложный газовый и температурные режимы, ограниченные ресурсы бентоса; пелагиаль представляет собой отличную от предыдущих структурно однородную среду обитания с доступными ресурсами зоопланктона. Для более эффективного использования их конкретных пищевых ресурсов требуются морфологические адаптации, связанные, как правило, с конфигурациями головы, челюстей и жаберных тычинок (Schluter, 1996). При этом форма и численность жаберных тычинок, отвечающих за эффективность удержания добычи, являются определяющим адаптивным признаком (Решетников, 1980; Friedland et al., 2006). У сигов число жаберных тычинок является генетически обусловленной фенотипической чертой, используемой для разделения симпатрических морфов, форм или экотипов (Решетников, 1980). Изучение особенностей внутриводоемной структуры популяции сига различных озер, в том числе и испытывающих разноуровневые антропогенные нагрузки, позволяет понять механизмы адаптации популяции и направленность эволюционных процессов (Мина, 1986; Skúlason et al., 1999; Robinson, Parsons, 2002). В этом плане одна из крупнейших на севере Европы озерно-речная система Инари – Пасвик (бассейн Баренцева моря) является уникальным объектом, сочетающим многообразие природных и антропогенных условий, включая разнообразие растительных зон (тайга, лесо-тундра, тундра), сложную геологию водосборной территории (Melezhik et al., 1994), зарегулированный каскадом ГЭС сток, градиентный уровень промышленного загрязнения (Moiseenko et al., 1994), высокий уровень развития аквакультуры, обуславливающий инвазии новых видов и форм (Amundsen et al., 1999). Среди рыб наиболее многочисленным видом является сиг, для которого описаны две основные формы: малотычинковый – бентофаг, обитающий преимущественно в литоральной и профундальной зонах, и среднетычинковый – планктонофаг, обитающий в пелагиали (Лукин, Кашулин, 1991; Nøst et al., 1992; Amundsen et al., 1993, 2006; Moiseenko et al., 1994; Кашулин, Решетников, 1995). Ряд авторов также выделяют мелких малотычинковых и среднетычинковых сигов, обитающих совместно с крупными сигами этих форм (Kahilainen et al., 2004, 2006, 2007, 2009, 2014; Østbye еt al., 2005; Kahilainen, Østbye, 2006; Siwertsson еt al., 2008, 2010; Harrod et al., 2010; Præbel et al., 2013 и др.).
Оз. Куэтсъярви входит в придаточную систему р. Шуонийоки, впадающей в нижнее течении р. Пасвик, и является одним из наиболее техногенно загрязненных природных водоемов Евро-Арктического региона (Кашулин и др., 1999). В результате деятельности расположенных на его берегах плавильных цехов металлургического комбината «Печенганикель» в водах (Кашулин и др., 2013; Ylikörkkö et al., 2014) и донных отложениях (Dauvalter et al., 2010; Кашулин и др., 2013) озера отмечаются чрезвычайно высокие концентрации тяжелых металлов. Несмотря на специфические природные условия и антропогенное загрязнение озера, переход сига на короткоцикловую стратегию выживания позволяет ему поддерживать высокую численность популяции (Кашулин и др., 1999; Решетников и др., 1999). Здесь впервые была описана популяция самого мелкого сига, нерестящегося на первом-втором году жизни при достижение размеров 7–9 см при общей продолжительности жизни три-четыре года (Лукин, Кашулин, 1991; Решетников и др., 1997). В то же время в озере присутствуют сиги, отличающиеся морфологией, более высокими размерно-весовыми показателями, поздними сроками созревания и отсутствием типичных патологических трансформаций внутренних органов и тканей. Однако детального изучения морфологии и распределения симпатрических форм сига оз. Куэтсъярви ранее не проводилось.
Цель настоящей работы – провести анализ морфологических особенностей, популяционной структуры, параметров жизненного цикла и трофических связей выделяемых форм сига оз. Куэтсъярви для оценки их взаимоотношений внутри водоема.
Материалы
Характеристика водоема. Оз. Куэтсъярви (площадь озера 17.0 км2, максимальная глубина 37 м) является частью озерно-речной системы пограничной реки Пасвик, с которой соединяется небольшой протокой (рис. 1). Озеро ледникового происхождения, вытянутое в меридиальном направление длиной 11.6 км, наибольшей шириной 2.8 км, условный водообмен – 1.55. Берега озера высокие, поросшие сосновыми лесами и покрытые горными пустошами. По качеству вод озеро является одним из самых загрязненных в Мурманской области. Через р. Колос-йоки оно получает сточные воды комбината «Печенганикель». Основными загрязняющими элементами являются Ni, Cu и Co, а также сопутствующие халькофильные элементы – Pb, As, Cd и Hg. Большое влияние оказывают токсичные соединения (окислы серы, азота, тяжелые металлы), выбрасываемые в атмосферу и осаждающиеся на территории водосбора. Вода в озере является нейтральной и характеризуется значениями общей минерализации в среднем 69.0 мг/л и щелочности в среднем 286 мкэкв/л. Концентрации Ni составляют 106 (74–182) мкг/л, Cu – 8.6 (4.5–15.2) мкг/л. По содержанию биогенных элементов озеро характеризуется как эвтрофное. Наибольшая концентрация Робщ в озере (до 60 мкг/л) и Nобщ (до 390 мкг/л) отмечается в летний период. Величины коэффициента загрязнения донных отложений этими элементами находятся в пределах от 33.5 до 125.7, а степень общего загрязнения тяжелыми металлам, рассчитанная для этого озера, составляет 240.1 и относится, по классификации Л. Хокансона (1980), к высокой. Сообщества фитопланктона оз. Куэтсъярви насчитывают 54 вида, среди которых доминируют диатомовые, отличаются высокими показателями плотности (более 1700 г/м3) (Шаров, 2000). Зоопланктон озера весьма развит, плотность ветвистоусых и веслоногих рачков до 80000 экз./м3 (Яковлев и др., 1991; Noest et al., 1992). Количество видов зообентоса превышает 20, среди которых доминируют хирономиды (60–80 %). Состав ихтиофауны озера включает представителей девяти видов, относящихся к восьми семействам рыб: кумжа – Salmo trutta, сиг, ряпушка – Coregonus albula, хариус – Thumallus thumallus, щука – Esox lucius, окунь – Perca fluviatilis, налим – Lota lota, гольян – Phoxinus phoxinus, девятииглая колюшка – Pungitius pungitius.
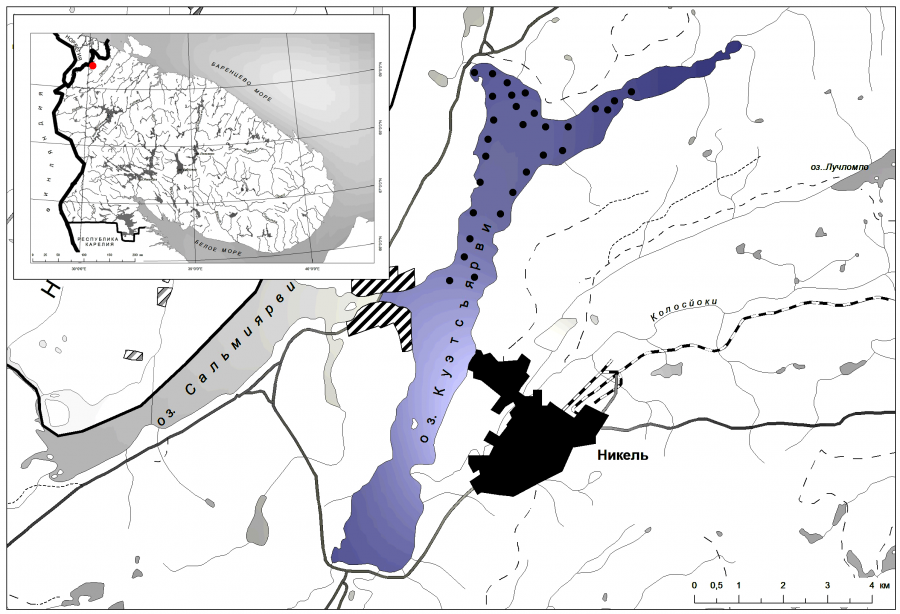
Рис. 1. Карта-схема оз. Куэтсъярви и места сбора ихтиологических проб (●) в 2015 г.
Fig. 1. Map-scheme of Kuetsyarvi lake and gathering sites of ichthyological samples (●) in 2015
Методы отлова рыбы и объем собранного материала. Рыбу отлавливали в сентябре 2015 г. стандартными наборами ставных жаберных сетей из монофиламента. Места отлова представлены на рис. 1. В литоральной зоне (на глубине 1.5–3 м) устанавливались сети длиной 25 м, высотой 1.5 м и размером ячеи 10–60 мм (что обеспечивало вылов рыбы длиной ≥ 5 см). Сети устанавливались порядками по 1–2 сети перпендикулярно берегу в местах с песчано-гравийными отмелями и крупными валунными отложениями. В профундальной зоне с глубинами более 18 м использовалось до 10 разноячеистых сетей в один порядок. В пелагической зоне водоема для отбора ихтиологического материала применялись плавные мультиразмерные сети высотой 3 м. Всего было выловлено 199 экземпляров сига.
Методы
Методы обработки рыбы. Каждая рыба была пронумерована и сфотографирована цифровым фотоаппаратом Nikon d610 c объективом 60mm f/2.8G ED AF-S Micro-Nikkor (Бочкарева, Зуйкова, 2007). Далее обработка материала проводилась по стандартной методике (Сидоров, Решетников, 2014). Для выделения внутривидовых группировок у исследуемых сигов подсчитывали тычинки на первой жаберной дуге. Измерения длины жаберной дуги и наибольшей жаберной тычинки проводились под бинокуляром с помощью окуляр-микрометра (Правдин, 1966). Расстояние между жаберными тычинками вычислялось по методике K. Kahilainen и K. Østbye (2006). По полученным изображениям проводились просчеты числа прободенных чешуй в боковой линии сигов и с помощью программы ImageJ измерения пластических признаков рыб. Количество и схема промеров – по K. Kahilainen и K. Østbye (2006) с небольшими изменениями. Сравнение выборок проводили с помощью t-критерия Стьюдента, а также с помощью метода главных компонент в программе Statistica. Перед использованием методов многомерной статистики абсолютные значения признаков были преобразованы (Darroch, Mosimann, 1985; Mosimann, 1970), использовалась ковариационная матрица. Исследование темпов линейного роста сига по чешуе проводилось согласно методике Е. М. Зубовой (2015). Содержимое желудков было исследовано только у 27 экземпляров сига, отловленных в 2015 г., и 48 сигов, собранных в 2012–2013 гг., по той же методике. Желудки сигов извлекались и фиксировались в 70 % растворе этилового спирта в течение 1–1.5 часа. Материал обрабатывался в лаборатории с использованием микроскопа (Методическое…, 1974). Объекты питания определялись до семейства или рода (Определитель…, 1977). Для оценки размерной изменчивости питания сига из озера были выделены 4 размерные группировки сига: 100–199 мм, 200–299 мм, 300–399 мм и 400–499 мм (Kahilainen, Østbye, 2006).
Результаты
Морфология. Сиг оз. Куэтсъярви представлен двумя основными бимодально распределенными формами – малотычинковой (далее SR – sparsely rakered) и среднетычинковой (DR – densely rakered), с числом тычинок на первой жаберной дуге соответственно от 17 до 27 (22.7 ± 0.29) и от 27 до 42 (32.4 ± 0.23) (рис. 2). DR был более многочисленным по сравнению с SR. Соотношение двух форм в пробах составило в среднем 2:1.
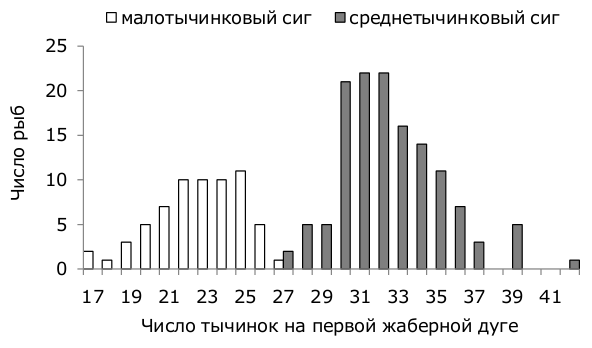
Рис. 2. Распределение сигов по числу тычинок на первой жаберной дуге в оз. Куэтсъярви, 2015 г.
Fig. 2. The distribution of whitefish according to the gill raker number on the first branchial arch in lake Kuetsjarvi, 2015
Анализ изображений сигов позволяет выделить дополнительные группировки сига, различающиеся строением головы. У SR встречались особи: 1) с большим глазом, выраженным нижним ртом, тупым рылом (рис. 3а) (далее SR1); 2) с небольшим глазом, полунижним или конечным ртом, острым рылом (рис. 3b) (SR2). У DR встречались особи: 1) с выраженным большим глазом, верхним ртом (рис. 3c) (DR1); 2) с небольшим глазом, полунижним или конечным ртом, острым рылом (рис. 3c) (DR2). При этом группировки SR2 и DR2 по морфологии частей головы практически не различались (рис. 3b, c) и их выделение основано только на строение жаберного аппарата. Соотношение численности четырех групп сига составляло SR1 29.1 % (58 экз.) : SR2 3.5 % (7 экз.) : DR1 34.7 % (69 экз.) : DR2 32.7 % (65 экз.). Большая часть SR1 (59 %) была выловлена в профундальной части озера (табл. 1), SR2 – в литоральной части (57 %); 64 % DR1 было выловлено в пелагиали, DR2 – в литоральной части озера (55 %) (см. табл. 1).
(a)

(b)

(c)

(d)

Рис. 3. Внешний вид малотычинкового (а – 184 мм, 5+ лет; b – 166 мм, 2+ лет) и среднетычинкового (c – 143 мм, 5+ лет; d – 179 мм, 2+ лет) сигов из оз. Куэтсъярви, 2015 г.
Fig. 3. The appearance of sparsely rakered (a – 184 mm, 5+ years; b – 166 mm, 2+ years) and densely rakered (c – 143 mm, 5+ years; d – 179 mm, 2+ years) whitefish from lake Kuetsjarvi , 2015
Таблица 1. Распределение внутривидовых группировок сига по экологическим зонам оз. Куэтсъярви, 2015 г.
| Место вылова | SR1 (58) | SR2 (7) | DR1 (69) | DR2 (65) |
| Литораль | 38 % | 57 % | 12 % | 55 % |
| Пелагиаль | 3 % | – | 64 % | 23 % |
| Профундаль | 59 % | 43 % | 24 % | 22 % |
Примечание. Здесь и в таблицах и рисунках, расположенных ниже: SR1 – малотычинковый сиг 1, SR2 – малотычинковый сиг 2, DR1 – среднетычинковый сиг 1, DR2 – среднетычинковый сиг 2; в скобках представлено число экземпляров.
В табл. 2 представлены 2 счетных и 18 пластических морфологических признака сигов оз. Куэтсъярви и их масса. Половые различия по этим признакам не обнаружены.
Таблица 2. Значения некоторых промеров тела внутривидовых группировок сига из оз. Куэтсъярви, 2015 г.
| Признаки | SR1 (58) | SR2 (7) | DR1 (69) | DR2 (65) |
| Длина (FL), мм | 169.6 ± 4.09 | 242.4 ± 22.38 | 114.9 ± 1.62 | 195.3 ± 4.40 |
| Масса, г | 54.9 ± 4.61 | 189.6 ± 52.57 | 14.6 ± 0.92 | 87.2 ± 7.32 |
| Число тычинок на первой жаберной дуге | 22.5 ± 0.30 | 24.9 ± 0.51 | 33.6 ± 0.37 | 31.9 ± 0.26 |
| Длина наибольшей жаберной тычинки, % от длины жаберной дуги | 11.1 ± 0.23 | 12.2 ± 0.60 | 20.1 ± 0.41 | 15.6 ± 0.33 |
| Расстояние между тычинками, мм | 0.9 ± 0.03 | 0.8 ± 0.11 | 0.4 ± 0.01 | 0.7 ± 0.02 |
| Число прободенных чешуй в боковой линии | 84.2 ± 0.52 | 91.0 ± 2.04 | 84.3 ± 0.47 | 90.0 ± 0.56 |
| % FL | ||||
| Длина жаберной дуги | 12.0 ± 0.16 | 11.1 ± 0.18 | 12.7 ± 0.14 | 11.2 ± 0.12 |
| Длина рыла | 4.5 ± 0.08 | 4.3 ± 0.28 | 4.8 ± 0.09 | 4.2 ± 0.09 |
| Горизонтальный диаметр глаза | 5.4 ± 0.08 | 4.3 ± 0.22 | 6.1 ± 0.06 | 4.6 ± 0.06 |
| Вертикальный диаметр глаза | 5.3 ± 0.16 | 4.5 ± 0.57 | 6.0 ± 0.09 | 4.7 ± 0.14 |
| Заглазничный отдел головы | 10.7 ± 0.14 | 9.7 ± 0.32 | 10.3 ± 0.15 | 9.6 ± 0.13 |
| Длина верхней челюсти | 5.9 ± 0.09 | 5.1 ± 0.28 | 7.2 ± 0.12 | 5.3 ± 0.09 |
| Длина нижней челюсти | 8.6 ± 0.13 | 7.9 ± 0.37 | 10.1 ± 0.14 | 8.1 ± 0.13 |
| Длина головы | 19.9 ± 0.24 | 17.8 ± 0.82 | 21.1 ± 0.30 | 17.7 ± 0.24 |
| Высота головы у затылка | 14.8 ± 0.12 | 13.3 ± 0.23 | 14.4 ± 0.09 | 13.4 ± 0.09 |
| Наибольшая высота тела | 21.3 ± 0.22 | 22.0 ± 0.85 | 19.0 ± 0.17 | 20.5 ± 0.22 |
| Наименьшая высота тела | 6.7 ± 0.04 | 7.3 ± 0.18 | 6.4 ± 0.03 | 6.8 ± 0.04 |
| Длина спинного плавника | 16.7 ± 0.25 | 16.5 ± 0.56 | 16.0 ± 0.28 | 15.6 ± 0.21 |
| Длина грудного плавника | 16.6 ± 0.30 | 14.6 ± 0.62 | 15.9 ± 0.27 | 13.9 ± 0.20 |
| Длина брюшного плавника | 14.0 ± 0.26 | 13.0 ± 0.64 | 13.4 ± 0.25 | 12.8 ± 0.20 |
| Длина анального плавника | 9.6 ± 0.18 | 8.9 ± 0.38 | 8.8 ± 0.17 | 8.6 ± 0.16 |
Примечание. Здесь и в табл. 3, 4, 6, 7 представлены средние значения признаков и их ошибки.
Выделенные группировки сига различались (p < 0.01) линейно-весовыми характеристиками, они уменьшались в ряду: SR2 > DR2 > SR1 > DR1 (см. табл. 2).
Строение жаберного аппарата (число тычинок на первой жаберной дуге, относительные длины наибольшей жаберной тычинки и жаберной дуги) четырех группировок сига различалось (p < 0.05): DR1 > DR2 > SR2 > SR1 (см. табл. 2). Расстояние между тычинками было значимо больше у SR1 и SR2. Диаграмма частотного распределения четырех группировок сига по числу тычинок представлена на рис. 4.
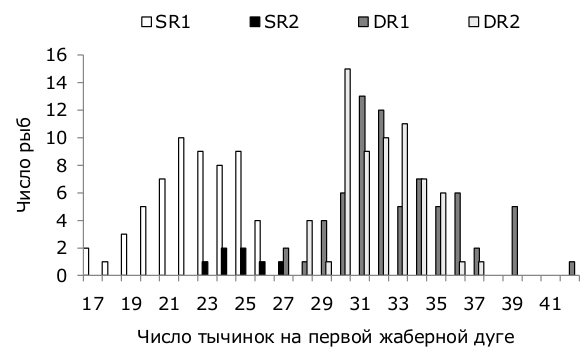
Рис. 4. Распределение внутривидовых группировок сига по числу тычинок на первой жаберной дуге в оз. Куэтсъярви, 2015 г.
Fig. 4. The distribution of intraspecific groups of whitefish according to the gill raker number on the first branchial arch from lake Kuetsjarvi, 2015
Относительные показатели морфологии головы у SR2 и DR2 значимо не различались, в то время как группировки сига SR1 и DR1 различались по строению головы друг от друга и от SR2-DR2 (см. табл. 2). Так, самый большой диаметр глаза (горизонтальный и вертикальный) имела группировка DR1 (p < 0.001), чуть меньший диаметр – SR1, SR2 и DR2 (см. табл. 2). То же самое можно сказать и о других показателях головы, кроме ее заглазничного отдела и высоты, которые были значимо больше у SR1, нежели у DR1. Наибольшие относительные показатели высоты тела были характерны для SR сигов, наименьшие – для DR1 (p < 0.05). Все группировки сига имели различные относительные длины грудного плавника (p < 0.05): SR1 > DR1 > SR2 > DR2. По числу прободенных чешуй в боковой линии выделились только две группировки сига (p < 0.001): в среднем 84 чешуи характерны для особей SR1 и DR1, большое число чешуй: 90–91 – для особей SR2 и DR2 (см. табл. 2).
Полученный анализ некоторых индексов пластических и меристических морфологических характеристик сигов подтверждает выводы, что на основе размерно-весовых показателей, строения первой жаберной дуги и длины грудного плавника можно выделить четыре внутривидовые группировки сига: SR1, SR2, DR1 и DR2, на основе морфологии головы – три: SR1, DR1 и SR2-DR2. Число чешуй в боковой линии определяет две группировки: SR1-DR1 и SR2-DR2.
По результатам анализа вклада пластических признаков в главные компоненты (ГК) рассматривать стоит только график ГК2 против ГК1, ГК3 и ГК4 имеют низкие факториальные нагрузки (табл. 3). На графике (рис. 5) четко выделяются три группировки сига: SR1, DR1 и DR2.
Таблица 3. Вклады пластических признаков в главные компоненты 1–4 у внутривидовых группировок сига из оз. Куэтсъярви, 2015 г.
| Признаки | ГК | |||
| 1 | 2 | 3 | 4 | |
| Длина рыла | 0.211 | -0.411 | -0.499 | -0.659 |
| Горизонтальный диаметр глаза | 0.735 | 0.177 | -0.138 | 0.505 |
| Вертикальный диаметр глаза | 0.835 | 0.384 | 0.361 | -0.149 |
| Заглазничная длина | -0.341 | -0.238 | 0.062 | -0.312 |
| Длина верхней челюсти | 0.705 | -0.364 | -0.411 | 0.170 |
| Длина нижней челюсти | 0.582 | -0.258 | -0.316 | 0.071 |
| Длина головы | 0.490 | -0.375 | -0.239 | -0.112 |
| Высота головы у затылка | -0.426 | 0.695 | -0.196 | 0.265 |
| Длина спинного плавника | -0.619 | -0.403 | 0.407 | 0.010 |
| Длина грудного плавника | -0.358 | -0.607 | 0.288 | 0.262 |
| Длина брюшного плавника | -0.565 | -0.516 | 0.372 | 0.078 |
| Длина анального плавника | -0.635 | -0.482 | 0.413 | -0.014 |
| Наибольшая высота тела | -0.745 | 0.599 | -0.158 | -0.030 |
| Наименьшая высота тела | -0.592 | 0.722 | -0.115 | -0.066 |
| Собственное значение, % | 43.96 | 22.74 | 10.34 | 6.49 |
Примечание. Жирным шрифтом выделены максимальные вклады признаков. Длина собственного вектора равна 1.
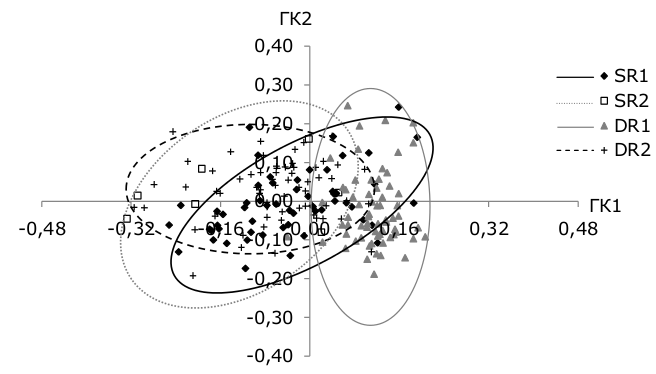
Рис. 5. Расположение особей сига в пространстве 1–2 главных компонент по пластическим признакам из оз. Куэтсъярви, 2015 г.
Fig. 5. The location of whitefish individuals in the space of 1–2 main components according to plastic features from lake Kuetsjarvi , 2015
Основной положительный вклад в первую главную компоненту внесли признаки формы головы (размеры глаза и верхней челюсти), а основной отрицательный вклад – признаки формы тела (длина анального плавника, наибольшая и наименьшая высоты тела) (см. табл. 3). Во вторую главную компоненту основной положительный вклад внесли признаки комплекса тела (наибольшая и наименьшая высоты тела) и головы (высота головы у затылка), основной отрицательный – длина грудного плавника (см. табл. 3). SR2-сиги на графике главных компонент не образуют отдельную группу (см. рис. 5) и больше принадлежат группе DR2, что подтверждает полученный анализ индексов морфологических признаков сигов оз. Куэтсъярви.
Темп роста и размерно-возрастная структура. Группировки SR1 и SR2 были представлены особями в возрасте соответственно от 1+ до 9+ и 2+...6+ лет (табл. 4). У первой преобладали рыбы в возрасте 4+...6+ (60 %), у второй – преобладание неизвестно из-за небольшого количества рыб. Фактические длина и масса сигов SR2 были значимо выше во всех возрастах по сравнению с SR1. DR1 и DR2 были представлены особями в возрасте соответственно от 2+ до 6+ и 1+...9+ (см. табл. 4). Как у первой, так и у второй преобладали рыбы в возрасте от 2+ до 4+ (75–96 %). Как и у SR-сигов, размерно-весовые показатели сигов DR2 были выше во всех возрастах по сравнению с DR1. Это послужило причиной более детального исследования размерных характеристик выделенных группировок сига оз. Куэтсъярви.
Для выявления особенностей темпов роста сигов строилась единая точечная диаграмма зависимости длина тела – длина радиуса чешуи, которая одинаково хорошо описывается как уравнениями линейной, так и степенной функции (рис. 6а, б). Для обратных расчислений использовались коэффициенты уравнения линейной функции, длины расчисляли по формуле Розы Ли (Брюзгин, 1969; Мина, 1973; Зубова, 2015).

Рис. 6. Сопоставление фактической длины тела (FL) и переднего диагонального радиуса чешуи (Rч) малотычинкового (а) и среднетычинкового (b) сигов из оз. Куэтсъярви, 2015 г.
Fig. 6. Comparison of the actual body length (FL) and the front diagonal radius of scales (Rч) of sparsely rakered (a) and densely rakered (b) whitefish from lake Kuetsjarvi, 2015
В результатах обратных расчислений длины по регрессионному методу «феномен» Ли не проявляется. Половые различия в темпе роста не обнаружены. При исследовании «индивидуальных» темпов линейного роста у SR- и DR-сигов начиная со второго-третьего года жизни явно определяются медленнорастущие (SR1 и DR1) и быстрорастущие (SR2 и DR2) группировки. Средние значения расчисленной длины сигов приведены в табл. 4. Как фактическая, так и расчисленная длина группировок сига в разных возрастах значимо различалась (p < 0.01), распределение рыб в ряду по фактической и расчисленной длине было аналогичным: SR2 > DR2 > SR1 > DR1. Начиная со второго года жизни оценки расчисленной длины, сделанные на основе относительных приростов, аналогичны оценкам, сделанным на основе абсолютных приростов (табл. 4).
Таблица 4. Фактическая длина (FL), мм, масса, г, значения расчисленной длины, мм, абсолютных годовых приростов, мм, и удельной скорости роста (Сl) внутривидовых группировок сига из оз. Куэтсъярви
| Внутривидовые группировки сига | Возраст, лет | ||||||||
| 1+ | 2+ | 3+ | 4+ | 5+ | 6+ | 7+ | 8+ | 9+ | |
| Длина Масса | |||||||||
| SR1 | 123 ± 14.0 18 ± 6.5 (2) | 137 ± 7.4 25 ± 4.6 (6) | 140 ± 4.8 25 ± 2.4 (7) | 159 ± 6.4 43 ± 6.5 (10) | 173 ± 4.4 51 ± 4.2 (15) | 193 ± 7.5 80 ± 9.4 (10) | 207 ± 6.6 107 ± 19.4 (4) | 215 115 (1) | 219 ± 6.0 119 ± 18.0 (2) |
| SR2 | - | 166 47 (1) | 198 ± 16.5 83 ± 20.1 (2) | 255 194 (1) | 291 ± 35.5 287 ± 118.5 (2) | 300 348 (1) | - | - | |
| DR1 | - | 114 ± 2.4 14 ± 1.3 (32) | 114 ± 3.2 14 ± 1.8 (19) | 116 ± 1.4 15 ± 0.5 (15) | 137 ± 6.0 25 ± 1.0 (2) | 164 45 (1) | - | - | |
| DR2 | 165 41 (1) | 171 ± 2.3 49 ± 2.1 (26) | 179 ± 4.9 60 ± 5.3 (19) | 219 ± 4.5 110 ± 8.4 (11) | 232 ± 6.5 138 ± 11.0 (8) | 246 ± 14.3 173 ± 36.7 (6) | - | - | 295 290 (1) |
| Расчисленная длина | |||||||||
| SR1 | 105 ± 0.7 (57) | 117 ± 0.9 (55) | 129 ± 1.3 (49) | 143 ± 1.9 (42) | 157 ± 2.2 (32) | 170 ± 5.3 (17) | 182 ± 4.0 (7) | 191 ± 5.3 (3) | 196 ± 0.3 (2) |
| SR2 | 115 ± 5.5 (7) | 138 ± 4.2 (7) | 169 ± 8.2 (6) | 212 ± 11.8 (4) | 239 ± 19.0 (3) | 257 (1) | - | - | - |
| DR1 | 87 ± 0.8 (69) | 98 ± 1.1 (69) | 104 ± 1.4 (37) | 113 ± 2.2 (18) | 133 ± 10.1 (3) | 160 (1) | - | - | - |
| DR2 | 95 ± 1.4 (65) | 123 ± 1.7 (64) | 142 ± 2.0 (38) | 170 ± 3.1 (26) | 195 ± 4.8 (15) | 207 ± 7.2 (17) | 228 (1) | 273 (1) | 288 (1) |
| Абсолютные годовые приросты / Удельная скорость роста | |||||||||
| SR1 | 105 / - | 12 / 0.11 | 12 / 0.10 | 14 / 0.10 | 14 / 0.09 | 13 / 0.08 | 12 / 0.07 | 9 / 0.05 | 5 / 0.03 |
| SR2 | 115 / - | 23 / 0.18 | 31 / 0.20 | 43 / 0.23 | 27 / 0.12 | 18 / 0.07 | - /- | - / - | - / - |
| DR1 | 87 / - | 11 / 0.12 | 6 / 0.06 | 9 / 0.08 | 20 / 0.16 | 27 / 0.18 | - / - | - / - | - / - |
| DR2 | 95 / - | 28 / 0.26 | 19 / 0.14 | 28 / 0.18 | 25 / 0.14 | 12 / 0.06 | 21 / 0.10 | 45 / 0.18 | 15 / 0.05 |
Питание. Анализ питания сигов показал, что у SR1 длиной < 200 мм основную долю пищевого комка (50 %) составляли представители профундального бентоса: личинки хирономид (Сhironomus sp., Micropsetra sp., Sergentia sp., Procladius sp., Prodiamesa sp., Strictochironomus sp.) и двустворчатые моллюски рода Euglesa sp. (табл. 5). Зоопланктонные организмы встречались в желудках у 46 % особей данной размерной группировки и были представлены придонными веслоногими ракообразными Acanthocyclops sp. (21 % от пищевого комка). У единичных экземпляров встречались водные клещи. С увеличением линейных характеристик сиги SR1 питались теми же группами беспозвоночных животных, но значение зоопланктонных организмов в питании снижалось, и личинки хирономид составляли уже 77 % от пищевого комка (см. табл. 5). Размеры пищевых компонентов с ростом SR1 увеличиваются, относительные размеры пищевого комка уменьшаются.
Таблица 5. Питание внутривидовых группировок сига в летне-осенний период из оз. Куэтсъярви, 2012–2015 гг.
| - | SR1 | SR2 | DR1 | DR2 | |||||
| Размерные группы (FL), мм | |||||||||
| 100–199 | 200–299 | 200–299 | 300–399 | 400–499 | 100–199 | 100–199 | 200–299 | 300–399 | |
| - | P, % / F, % | P, % / F, % | P, % / F, % | P, % / F, % | P, % / F, % | P, % / F, % | P, % / F, % | P, % / F, % | P, % / F, % |
| Зоопланктон | 20.9 / 46 | 3.0 / 33 | - | - | - | - | 37.8 / 40 | 16.6 / 7 | - |
| Бентос: | 50.3 / 65 | 82.3 / 100 | 100 / 100 | 94.0 / 100 | 100 / 100 | ||||
| ручейники (кук., лич.) | - | - | 63.4 / 100 | 83.7 / 100 | 99.0 / 100 | - | 22.2 / 60 | 27.2 / 27 | 100 / 100 |
| хирономиды (кук., лич.) | 43.9 / 65 | 76.7 / 100 | - | - | 0.8 / 100 | 26.3 / 100 | 39.7 / 60 | 35.2 / 60 | - |
| перепончатокрылые (имаго) | - | - | - | - | - | - | - | 0.03 / 7 | - |
| полужесткокрылые (имаго) | - | - | - | - | - | - | - | 0.03 / 7 | - |
| чешуекрылые (имаго) | - | - | - | - | - | - | - | 0.1 / 7 | - |
| жуки (имаго) | - | - | - | 0.2 / 7 | - | ||||
| водные клещи (имаго) | 0.1 / 4 | - | - | - | 0.2 / 100 | - | - | 0.04 / 27 | - |
| моллюски | 6.3 / 23 | 5.6 / 22 | 36.6 / 50 | 10.3 / 33 | - | - | 0.3 / 10 | 5.7 / 7 | - |
| Остатки насекомых | - | - | - | - | - | - | - | 3.3 / 7 | - |
| Рыба | - | - | - | - | - | - | - | 7.3 / 7 | - |
| Икра рыб | - | - | - | 6.0 / 33 | - | - | - | - | |
| Аморфная масса | 28.8 / 39 | 14.7 / 22 | - | - | - | 73.7 / 100 | - | 4.3 / 13 | - |
| Средний размер кормовых организмов, мм | 7.3 1.2– 16.0 | 8.6 1.0– 16.4 | 9.7 3.8 – 20.0 | 6.3 2.7– 12.0 | 6.3 1.0– 9.5 | - | 7.9 0.8– 22.0 | 9.5 0.6– 34.0 | 7.1 6.0– 8.1 |
| Средняя масса пищевого комка, мг | 235 | 404 | 1011 | 7749 | 1031 | 95 | 235 | 842 | 6169 |
| Средний Iн, 0/000 | 45.9 | 37.1 | 35.2 | 205.9 | 12.2 | 40.0 | 49.8 | 52.6 | 177.3 |
| Количество экз. | 26 | 9 | 2 | 3 | 1 | 1 | 10 | 15 | 1 |
Примечание. F, % – частота встречаемости каждого компонента пищи. P, % – доля каждого компонента пищи по массе. Iн, 0/000 – общий индекс наполнения желудка.
У быстрорастущего SR2 были просмотрены желудки особей 3 размерных групп: от 200 до 499 мм (см. табл. 5). В желудках этих сигов были обнаружены в основном представители литорального бентоса – личинки ручейников Agraylea sp., Athripsodes sp., Mystacides sp. и Molana sp. (> 1 тыс. экз. в одном желудке, от 63 до 99 % от массы пищевого комка) и брюхоногие моллюски Limnea sp. и Valvata sp. (от 10 до 37 % пищевого комка) (см. табл. 5). Также встречались в небольшом количестве личинки хирономид и двустворчатые моллюски, икра рыб. У быстрорастущего SR2 также наблюдается тенденция увеличения размеров пищевых компонентов и пищевого комка с ростом.
У быстрорастущего DR2 наблюдалось более высокое разнообразие в питании по сравнению с SR-сигами (см. табл. 5). У DR2 длиной < 200 мм основную долю пищевого комка составляли представители профундального бентоса (личинки хирономид, относящиеся к 8 родам) и зоопланктонные организмы (крупные придонные ракообразные родов Acanthocyclops sp. и Eurycercus sp.) (см. табл. 5). В желудках у 60 % DR2-сигов этой размерной группировки также были обнаружены представители литорального бентоса – личинки ручейников семейств Phryganeidae и Leptoceridae (22 % от массы пищевого комка) (см. табл. 5). С увеличением размеров (от 200 до 299 мм) данная группа сигов в основном питалась личинками хирономид (10 родов) и ручейников (3 семейства) (см. табл. 5). Зоопланктонные организмы были обнаружены только у 1 экземпляра сига (Eurycernus sp., Bosmina sp.), что можно отнести и к брюхоногим моллюскам рода Limnea sp. В желудках у единичных особей встречались имаго 5 отрядов насекомых (см. табл. 5). В пище данной размерной группировки DR2 обнаруживалась рыба (девятииглая колюшка). У особи DR2 длиной более 299 мм в желудке были обнаружены только личинки ручейников (Agraylea sp., Mystacides sp.). Абсолютная и относительная массы пищевого комка быстрорастущего DR2 близки к таковым быстрорастущего SR2-сига и увеличиваются с ростом рыб (см. табл. 5).
В желудке медленнорастущего DR1-сига длиной < 200 мм были определены личинки хирономид (Сhironomus sp.) (см. табл. 5).
Несмотря на высокую численность коловраток в составе зоопланктона оз. Куэтсъярви и олигохет в составе профундального бентоса (Environmental…, 2014), они редко или не встречались в желудках исследуемых рыб.
Созревание. Самые медленнорастущие сиги DR1 начинают созревать при наименьших размерах и массе по сравнению с остальными внутривидовыми группировками сига – при длине 100–104 мм, массе 7–8 г, в возрасте 2+, массово при средней длине 117 мм и массе 15 г в этом же возрасте. У быстрорастущих DR2 особи созревали при больших размерах: при длине 174–191 мм и массе 56–82 г в возрасте 2+...3+, массово при средней длине 220 мм и массе 117 г в возрасте мм 4+...5+. Особи медленнорастущих SR1 начинали созревать при длине и массе соответственно 116–135 мм и 13–22 г в возрасте 2+...3+, массово – при средней длине и массе 172 мм и 51 г в возрасте 4+...5+. Среди быстрорастущих SR2 не было половозрелых особей.
Обсуждение
Феномен высокой численности олиготоксобного вида Coregonus lavaretus в сильно загрязняемом оз. Куэтсъярви (69– 96 % от уловов за последние 20 лет) подробно рассматривался ранее (Кашулин и др., 1999), и в данной работе мы не затрагиваем влияние загрязнения на структурные показатели популяции. В то же время изучение морфофизиологических различий симпатрических форм расширяет наши представления об адаптационных возможностях сига к неблагоприятным условиям среды. Наши исследования позволяют выделить в оз. Куэтсъярви четыре группировки сига, различающихся совокупностью пластических и меристических признаков, размерно-весовыми показателями и, соответственно, темпами роста: SR1 – медленнорастущий малотычинковый сиг с большими глазами, выраженным нижним ртом, тупым рылом и быстрорастущий малотычинковый сиг с небольшими глазами, полунижним или конечным ртом, острым рылом; DR1 – медленнорастущий среднетычинковый сиг с выраженными большими глазами, верхним ртом; DR2 – быстрорастущий среднетычинковый сиг с небольшими глазами, полунижним или конечным ртом. Все выделенные группировки сига имели значимые различия в строении жаберного аппарата. Медленнорастущие сиги SR1 и DR1 образуют среднечешуйчатую группу сигов оз. Куэтсъярви, быстрорастущие группировки сига SR2 и DR2 – многочешуйчатую (Бочкарев, Зуйкова, 2010). SR1 преимущественно обитает в профундальной зоне озера, DR1 – в пелагиальной зоне; близкие по внешнему строению SR2 и DR2 – в литоральной части озера. Таким образом, отдельные группы признаков зачастую перекрываются у различных группировок сига оз. Куэтсъярви.
Считается, что такой признак, как количество прободенных чешуй в боковой линии, нельзя рассматривать как адаптивный к условиям среды, а сам признак можно использовать в качестве маркера при изучении расселения различных линий сигов (Бочкарев, Зуйкова, 2010). На данном этапе мы не можем рассуждать о филогенетических линиях сигов оз. Куэтсъярви, т. к. такие исследования в Мурманской области практически не проводились.
Если же учитывать в классификации сигов оз. Куэтсъярви такой стабильный признак, как число тычинок на первой жаберной дуге, и значения пластических признаков, то мы можем говорить о том, что в оз. Куэтсъярви обитают SR- и DR- сиги, а описанные выше различия во внешнем строении между SR1 и SR2, так же как между DR1 и DR2, есть следствие разной индивидуальной онтогенетической аллометрии внутри этих группировок, вызванной различиями в их темпе роста. Промеры частей головы у быстрорастущих групп сига SR2 и DR2 оз. Куэтсъярви имеют значимо меньшие величины, нежели у особей медленнорастущих сигов SR1 и DR1 в одних и тех же возрастных группах (рис. 7а, б). Зависимость экстерьера сигов и других видов рыб от их темпов роста была отмечена некоторыми авторами ранее (Мина, 1986; Решетников, 1980; Алексеев и др., 2014).
(а) (b)
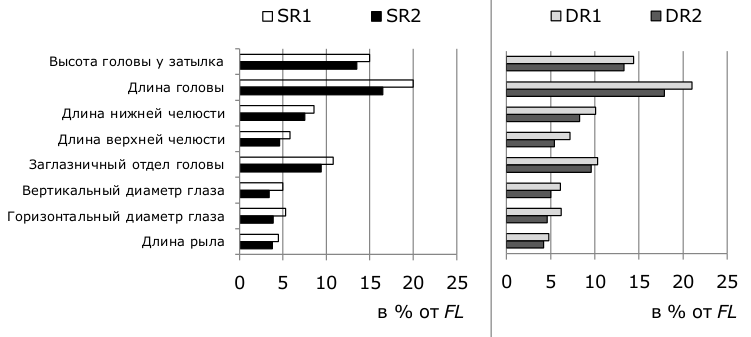
Рис. 7. Сравнение размеров головы (в % от FL) у медленнорастущего (SR1) и быстрорастущего (SR2) малотычинковых сигов в возрасте 4+...6+ (а) и у медленнорастущего (DR1) и быстрорастущего (DR2) среднетычинковых сигов в возрасте 2+...4+ (b) оз. Куэтсъярви, 2015 г.
Fig. 7.Comparison of head size (% FL) in slowly rowing (SR1) and fast-growing (SR2) sparsely rakered whitefish at the age of 4+...6+ (a) and in slowly growing (DR1) and fast-growing (DR2) densely rakered whitefish at the age of 2+...4+ (b) from lake Kuetsjarvi, 2015
Рядом исследователей было показано, что значимые различия в скорости роста у выделенных группировок сига системы р. Пасвик определяются качеством и количеством кормовых объектов в питании рыб, приуроченных к той или иной зоне водоема (Kahilainen et al., 2003, 2004; Kahilainen, Østbye, 2006). По нашим результатам, различия в темпах роста выделенных группировок сигов SR и DR оз. Куэтсъярви, особенно со 2–3-го годов жизни, являются результатом в первую очередь разнокачественного питания рыб и не связаны с количеством кормовых объектов. Так, относительные размеры пищевого комка у крупных сигов SR и DR (SR2, DR2) были больше, нежели у некрупных группировок сига (SR1, DR1), только у особей размерами > 299 мм (старше 5+ лет) (см. табл. 5). У SR1, обитающего в профундальной зоне Куэтсъярви, в желудках обнаруживались представители профундального макрозообентоса: личинки хирономид, которые составляют основу глубинного макрозообентоса оз. Куэтсъярви, двустворчатые моллюски и придонный крупный зоопланктон. В то время как у SR2, обитающего в литоральной зоне, в желудках встречались представители литорального бентоса: личинки ручейников и брюхоногие моллюски. Представители литорального бентоса, возможно, являются наиболее энергетически выгодным видом корма, чем профундального макрозообентоса. Несмотря на то, что 55 % DR2 было выловлено в литоральной зоне озера, содержимое их желудков включало представителей не только литорального (личинки ручейников), но профундального макрозообентоса, придонного и пелагического зоопланктона, рыбу. Это можно объяснить тем, что остальные 23 и 22 % рыб этой формы были выловлены в пелагической и профундальной зонах Куэтсъярви, т. е. сиг DR2 является выраженным эврифагом по сравнению с сигами SR. Что же касается DR1, то можно предположить, что данная группа сигов в основном питается пелагическим зоопланктоном, т. к. 64 % особей обитают в этой зоне озера. Пелагический зоопланктон Куэтсъярви более чем на 97 % представлен коловратками (Rotatoria), которые являются, возможно, малоценными кормовыми объектами, как и хирономиды, по сравнению с ракообразными (Cladocera и Сopepoda), что и определяет самый медленный темп роста у этих групп сигов. DR1 может питаться и профундальным макрозообентосом – 25 % сигов данной группы было выловлено в профундальной зоне озера. У единственного экземпляра сига этой группы, исследованного на питание, в желудке были обнаружены личинки хирономид. Причиной медленного роста DR1 оз. Куэтсъярви, как и в оз. Мудусъярви (Зубова, 2015; Kahilainen, Østbye, 2006), может быть и высокая его численность по сравнению с сигами SR, а также его конкуренция по питанию с интродуцированной ряпушкой Куэтсъярви, которая является выраженной пелагической рыбой и питается зоопланктоном.
Особенности в экстерьере четырех внутривидовых группировок сига оз. Куэтсъярви играют и функциональную роль в особенностях питания и движения рыб, приуроченных к определенным зонам озера. Так, наибольший диаметр глаза и «большой» верхний рот у сига DR1 являются типичными признаками планктофагов, обитающих в толще водоемов (Никольский, 1974), а наименьшая высота его тела является энергетически выгодной при поиске и добыче зоопланктонных организмов в пелагиали (Kahilainen, Østbye, 2006). В то же время относительно большой диаметр глаза у SR1, возможно, способствует нахождению пищи при слабой освещенности на глубинах озера, а нижнее расположение рта эффективно при питании профундальным макрозообентосом (Никольский, 1974). Полунижний и конечный рот крупных сигов оз. Куэтсъярви SR2–DR2, возможно, является наиболее универсальным, и представленные группировки сига могут питаться разным видом корма или же больше быть приспособленными для питания литоральным бентосом, что было нами показано выше и отмечено для крупных сигов других озер системы р. Пасвик (Kahilainen, Østbye, 2006).
Строение первой жаберной дуги должно играть большую роль при питании рыб (Решетников, 1980; Kahilainen, Østbye, 2006). У внутривидовых группировок сига SR (SR1 и SR2) и сига DR (DR1 и DR2) оз. Куэтсъярви среднее число тычинок на первой жаберной дуге имеет довольно близкое значение (см. табл. 2) и играет при их разделении второстепенную роль (см. выше). По нашим данным, сиги SR оз. Куэтсъярви в основном являются бентофагами, в то время как DR2 имеют смешанное питание, а в пище DR1, возможно, преобладают зоопланктонные организмы. В целом средние размеры организмов в желудках внутривидовых группировок сига SR Куэтсъярви имели близкие значения (см. табл. 5), минимальные размеры пищевых организмов превышали минимальное расстояние между тычинками (см. табл. 2, 5). Примерно такие же средние размеры беспозвоночных животных были обнаружены в желудках DR2 (см. табл. 2), хотя диапазон размеров был выше, в отличие от сигов SR. Минимальные размеры пищевых организмов у DR2 также превышали минимальное расстояние между тычинками (см. табл. 2, 5).
Наши исследования показали (Зубова, 2015), что наступление половой зрелости у сига как в различных водоемах, так и внутри одного водоема в Мурманской области может происходить при самой различной длине и в разном возрасте. Зависимость между созреванием и темпами роста внутривидовых группировок сига оз. Куэтсъярви является одной из форм связей между темпом роста и скоростью полового созревания рыб (Лапин, Юровицкий, 1959). Причиной тому может быть разнокачественность в еде у четырех внутривидовых группировок сига оз. Куэтсъярви (см. выше) (Лапин, Юровицкий, 1959; Кошелев, 1971). Возможно, низкая калорийность объектов питания у медленнорастущих сигов приводит к наступлению половой зрелости при меньших размерах, чем у быстрорастущих форм, что также наблюдалось и у других видов рыб (Кошелев, 1971). Размеры внутривидовых группировок сига, при которых наступало массовое созревание, близки к размерам массового нереста сигов таких же группировок из других водоемов системы р. Пасвик (Kahilainen et al., 2004; Зубова, 2015).
Полученные нами результаты по сигам оз. Куэтсъярви близки к результатам, выявленным по сигам верхнего и среднего течения системы р. Пасвик: медленнорастущий (SR1) и быстрорастущий (SR2) малотычинковые сиги озера Куэтсъярви соответствуют таковым SSR (small sparsely rakered) и LSR (large sparsely rakered); медленнорастущий среднетычинковый сиг (DR1) соответствует DR (densely rakered), быстрорастущий – LDR (large densely rakered) (Østbye еt al., 2005; Kahilainen, Østbye, 2006; Kahilainen et al., 2004, 2006, 2007, 2009, 2014; Harrod et al., 2010; Siwertsson еt al., 2008, 2010; Præbel et al., 2013). При этом среднее число тычинок у SSR (SR1) на первой жаберной дуге увеличивается от верхнего течения Пасвика к нижнему течению: от 17 (озеро Мудусъярви) до 22 тычинок (озеро Куэтсъярви). У остальных группировок сига из различных участков системы число тычинок на первой жаберной дуге колеблется незначительно: у SR2 (LSR) – в среднем от 23 до 25 тычинок, у DR1(DR) – от 34 до 36 тычинок, у DR2 (LDR) – от 32 до 34 тычинок. Это приводит к тому, что выделенные четыре группировки сига оз. Куэтсъярви по числу тычинок на первой жаберной дуге наиболее близки, чем в остальных участках Пасвика.
Заключение
В оз. Куэтсъярви (Мурманская область), являющемся одним из наиболее техногенно загрязненных природных водоемов Евро-Арктического региона, выделены четыре внутривидовые группировки сига: медленнорастущий малотычинковый сиг, быстрорастущий малотычинковый сиг, медленнорастущий среднетычинковый сиг и быстрорастущий среднетычинковый сиг. Специализация этих сигов на определенном виде ресурсов обусловливает их морфологические и поведенческие различия, пространственную дифференциацию и, в конечном итоге, различные экологические ниши.
Библиография
Алексеев С. С., Гордеева Н. В., Матвеев А. Н. и др. Три симпатрические формы арктического гольца Salvelinus alpinus complex (Salmoniformes, Salmonidae) из озера Камканда, Северное Забайкалье // Вопросы ихтиологии. 2014. Т. 54. № 4. С. 387–412.
Бочкарев Н. А., Зуйкова Е. И. Сравнительная характеристика сига-пыжьяна (Coregonus lavaretus pidschian, Coregonidae) из оз. Каракуль и р. Большой Абакан – к вопросу о вторичной интерградации сигов в бассейне верхнего и среднего течения р. Енисей // Труды ИСиЭЖ СO РАН. 2010. Вып. 46. С. 198–224.
Бочкарев Н. А., Зуйкова Е. И., Политов Д. В. Дополнительные возможности сбора и регистрации морфологических данных у рыб // Биология, биотехника разведения и состояние запасов сиговых рыб: Материалы междунар. конф. Тюмень: ФГУП «Госрыбцентр», 2013. С. 32–36.
Брюзгин В. Л. Методы изучения роста рыб по чешуе, костям и отолитам . Киев: Наукова думка, 1969. 188 с.
Зубова Е. М. Линейный рост европейского сига Coregonus lavaretus (L.) в антропогенно-модифицированных водоемах европейской субарктики (на примере Мурманской области) : Дис. … канд. биол. наук. Пермь: ПГНИУ, 2015. 28 с.
Кашулин Н. А., Решетников Ю. С. Накопление и распределение никеля, меди и цинка в органах и тканях рыб в субарктических водоемах // Вопросы ихтиологии. 1995. Т. 35. № 5. С. 687–697.
Кашулин Н. А., Лукин А. А., Амундсен П.-А. Рыбы пресноводных вод Субарктики как биоиндикаторы техногенного загрязнения . Апатиты: Изд-во КНЦ РАН, 1999. 142 с.
Кашулин Н. А., Даувальдар В. А., Денисов Д. Б. и др. Некоторые аспекты современного состояния пресноводных ресурсов Мурманской области // Вестник МГТУ. 2013. Т. 16. № 1. С. 98–107.
Кошелев Б. В. Некоторые закономерности роста и времени наступления первого икрометания у рыб // Закономерности роста и созревания рыб. М.: Наука, 1971. С. 186–218.
Лапин Ю. Е., Юровицкий Ю. Г. О внутривидовых закономерностях созревания и динамики плодовитости у рыб // Журнал общей биологии. 1959. Т. 20. № 6. С. 439–446.
Лукин А. А., Кашулин Н. А. Состояние ихтиофауны водоемов в приграничной зоне СССР и Норвегии . Апатиты: Изд-во КНЦ РАН, 1991. 50 с.
Методическое пособие по изучению питания и пищевых отношений рыб в естественных условиях . М.: Наука, 1974. 254 с.
Мина М. В. Рост рыб (методы исследования в природных популяциях) // Рост животных. Зоология позвоночных. М.: ВИНИТИ, 1973. Т. 4. С. 68–115.
Мина М. В. Микроэволюция рыб: эволюционные аспекты фенетического разнообразия . М.: Наука, 1986. 193 с.
Никольский Г. В. Теория динамики стада рыб . М.: Пищ. пром-сть, 1974. 447 с.
Правдин И. Ф. Руководство по изучению рыб . М.: Пищ. пром-сть, 1966. 376 с.
Определитель пресноводных беспозвоночных европейской части СССР (планктон и бентос) / Под ред. Л. А. Кутикова, Я. И. Старобогатова. Л.: Гидрометеоиздат, 1977. 511 с.
Решетников Ю. С. Экология и систематика сиговых рыб . М.: Наука, 1980. 301 с.
Решетников Ю. С., Попова О. А., Кашулин Н. А. и др. Оценка благополучия рыбной части водного сообщества по результатам морфологического анализа рыб // Успехи современной биологии. 1999. № 2. C. 165–177.
Решетников Ю. С., Кашулин Н. А., Лукин А. А. Самый мелкий сиг в Европе // Первый Конгресс ихтиологов России: Тез. докл. Астрахань; М.: ВНИРО, 1997. С. 50.
Сидоров Г. П., Решетников Ю. С. Лососеобразные рыбы водоемов европейского северо-востока . М.: Т-во науч. изд. КМК, 2014. 346 с.
Шаров А. Н. Структура фитопланктона водоемов Крайнего Севера в условиях техногенного загрязнения : Дис. … канд. биол. наук. Апатиты, 2000. 23 с.
Яковлев В. А. Гидробиологические исследования внутренних вод Кольского Севера (операт.-информ. материалы) . Апатиты: Изд-во КНЦ РАН, 1991. 53 с
Amundsen, P. A., Staldvik, F., Lukin, A. et al. Ecology and heavy metal contaminations in the fish communities of the Pasvik River System. Report. Norwegian College of Fishery Science. University of Tromsø, Norway, 1993. 29 p.
Amundsen P. A., Kashulin N. A., Koroleva I. M. et al. Environmental monitoring of fish in the Paz watercourse. NCFS, University of Tromse, Norway, 2006. 48 p.
Bernatchez L. Ecological theory of adaptive radiation: empirical assessment from Coregonine fishes (Salmoniformes) // Hendry AP, Stearns SC (eds.). Evolution illuminated: salmon and their relatives. Oxford: Oxford University press, 2004. P. 175–207.
Doroch J. N., Mosimann J. E. Canonical and principal components of shape // Biometrika. 1985. Vol. 72. No 2. P. 241–252.
Dauvalter V. A., Dauvalter M. V., Kashulin N. A. et al. Chemical composition of bottom sedimentary deposits in lakes in the zone impacted by atmospheric emissions from the Severonickel plant // Geochemistry International. 2010. Vol. 48. No 11. P. 1224–1229.
Friedland K. D., Ahrenholz D. W., Smith J. W. et al. Sieving functional morphology of the gill raker feeding apparatus of Atlantic menhaden // J. Exp. Zool. 2006. Vol. 305A. P. 974–985.
Harrod C., Mallela L., Kahilainen K. Phenotype-environment correlations in a putative whitefish adaptive radiation // J. of Animal Ecol. 2010. Vol. 79. P. 1057–1068.
Kahilainen K., Lehtonen H., Könönen K. Consequence of habitat segregation to growth rate of two sparsely rakered whitefish (Coregonus lavaretus (L.)) forms in a subarctic lake // Ecol. Freshw. Fish. 2003. Vol. 12. P. 275–285.
Kahilainen K., Malinen T., Tuamaala A. et al. Diel and seasonal habitat and food segregation of three sympatric Coregonus lavaretus forms in a subarctic lake // J. Fish Biol. 2004. Vol. 64. P. 418–434.
Kahilainen K., Alajärvi E., Lehtonen H. Planktivory and diet-overlap of densely rakered whitefish (Coregonus lavaretus(L.)) in a subarctic lake // Ecol. Freshw. Fish. 2005. Vol. 14. P. 50–58.
Kahilainen K., Østbye K. Morphological differentiation and resource polymorphism in three sympatric whitefish Coregonus lavaretus (L.) forms in a subarctic lake // J. Fish Biol. 2006. Vol. 68. P. 63–79.
Kahilainen K., Malinen T., Tuomaala A. et al. Empirical evaluation of phenotype–environment correlation and trait utility with allopatric and sympatric whitefish, Coregonus lavaretus (L.), populations in subarctic lakes // Biol. J. Linn. Soc. 2007. Vol. 92. No 3. P. 561–572.
Kahilainen K., Malinen T., Lentonen H. Polar light regime and piscivory govern diel vertical migrations of planktivorous fish and zooplankton in a subarctic lake // Ecol. Freshwater Fish. 2009. Vol. 18. P. 481–490.
Kahilainen K., Patterson W., Sonninen E. et al. Adaptive Radiation along a Thermal gradient: preliminary results of habitat use and respiration rate divergence among whitefish morphs // Plos One. 2014. Vol. 11. No 9. P. 1–12.
Klemetsen A., Elliott J. M., Knudsen R. et al. Evidence for genetic differences in the offspring of two sympatric morphs of Arctic charr // J. Fish. Biol. 2002. Vol. 60. P. 933–950.
Melezhik V. A. et al. Pechenga area, Russia. Part 1: geological setting and comparison with Pasvik, Norway // Trans. Instit. Min. Metall: Sect. B: Appl. Earth. Sci. 1994. Vol. 103. P. 129–165.
Moiseenko T., Mjelde M., Brandrud T. et al. Pasvik River Watercourse, Barents region: pollution impacts and ecological responses // Investigation in 1993 Institute of North Indusrial Ecology Problems (Russia), Norwegian Institute for Water Research (Norwey). NIVA-report OR-318. Oslo, 1994. P. 1–87.
Mosimann J. E. Size allometry: Size and shape variables with characterizations of the lognormal and generalized gamma distributions // J. Am. Stat. Ass. 1970. Vol. 65. P. 930–945.
Nøst T., Yakovlev V., Berger H. M. et al. Impacts of pollution on freshwater communities in the border region between Russia and Norway. NINA Scientific Report 26. Norwegian Institute for Nature Research. Trondheim, Norway, 1991. 41 p.
Præbel K., Knudsen R., Siwertsson A. et al. Ecological speciation in postglacial European whitefish: rapid adaptive radiations into the littoral, pelagic, and profundal lake habitats // Ecology and evolution Res. 2013. Vol. 3. No 15. P. 4970–4986.
Robinson B.W., Parsons K. J. Changing times, spaces, and faces: tests and implications of adaptive morphological plasticity in the fishes of northern postglacial lakes // Can. J. Fish. Aquat. Sci. 2002. Vol. 59. P. 1819–1833.
Schluter D., Rambaut A., Clarke B. C. et al. Ecological speciation in postglacial fishes // Philosophical Transactions of the Royal Society B: Biological Sciences. 1996. Vol. 351. P. 807–814.
Schluter D. The ecology of adaptive radiation. Oxsford: Oxford University Press, 2000. 288 p.
Skúlason S., Snorrason S., Jónsson B. Sympatric morphs, populations and speciation in freshwater fish with emphasis on arctic charr // Magurran AE, May RM (eds.). Evolution of biological diversity. Oxford: Oxford University Press, 1999. P. 70–92.
Siwertsson A., Knudsen R., Amundsen P.-A. Тemporal stability in gill raker numbers of subarctic European whitefish populations // Adv. Limnol. 2008. Vol. 63. P. 229–240.
Siwertsson A., Knudsen R., Kahilainen K. K. et al. Sympatric divercification as influenced by ecological opportunity and historical contingency in a young species lineage of whitefish // Evol. Ecol. Res. 2010. Vol. 12. P. 929–947.
Østbye K., Naesje T.-F., Bernatchez L. et al. Morphological divergence and origin of sympatric populations of European whitefish (Coregonus lavaretus (L.) in Lake Femud, Norway // J. Evol. Biol. 2005. Vol. 18. P. 683–702.
Østbye K, Amundsen P-A, Bernatchez L. et al. Parallel evolution of ecomorphological traits in the European whitefish Coregonus lavaretus (L.) species complex during postglacial times // Mol. Ecol. 2006. Vol. 15. P. 3983–4001.
Ylikörkkö J., Zueva M., Kashulin N. et al. Environmental Challenges in the Joint Border Area. Reports 41. Centre for Economic Development, Transport and the Environment for Lapland. Kokkola: Juvenes Print, 2015. 165 p.
Благодарности
Автор выражает благодарность сотрудникам лаборатории водных экосистем ИППЭС КНЦ РАН за помощь в проведении экспедиционных работ, за консультации при подготовке статьи. Особую благодарность автор выражает Н. А. Бочкареву (ИСиЭЖ СО РАН), М. В. Мине (ИБР РАН), Д. В. Политову (ИОГен РАН) за ценные замечания, высказанные при обсуждении результатов исследования.
Работа выполнена в рамках темы НИР № 0226-2019-0045 и частично поддержана из средств гранта РФФИ 18-05-60125 Арктика.






 © 2011 - 2024
© 2011 - 2024